2016.01.03.1
Files > Volume 1 > Vol 1 No 3 2016
EDITORIAL
Contexto actual de los estudios preclínicos
Current context of preclinical studies
Available from: http://dx.doi.org/10.21931/RB/2016.01.03.1
Thelvia I. Ramos
El desarrollo acelerado de la Industria Biofarmacéutica, y en particular de la producción de biológicos, ha permitido el incremento de la investigación clínica, teniendo en consideración la novedad de las sustancias que se desarrollan.
El éxito de un producto solo se logra a través de la realización de los estudios clínicos controlados, lo cual significa que este ha sido validado a través de un sistema de gestión de calidad, principal determinante para que la molécula en estudio, pueda ser autorizada y comercializada posterior a la demostración de su seguridad y eficacia. Previo a la presentación de una solicitud para un nuevo producto ante las autoridades regulatorias, es necesario pasar por la etapa de investigación preclínica.1
El desarrollo de un producto biotecnológico o una droga en específico, comienza cuando se decide por el patrocinador poner esta molécula en ensayos clínicos Fase I. Para llegar a esta etapa se requiere pasar por los ensayos no-clínicos, los cuales varían desde una prueba de concepto en animales y la demostración concomitante de un posible índice terapéutico (farmacología preclínica y la seguridad / toxicología).2
Los estudios preclínicos constituyen una etapa crucial en el desarrollo de nuevas moléculas y terapias. En la actualidad representan un punto álgido en el desarrollo de un producto farmacéutico, concretamente por la evidencia científica que se exige por parte las agencias reguladoras y que se requiere demostrar para el paso de la molécula a una fase clínica.
Refiriéndonos al entorno académico, podemos afirmar que estos estudios representan un elevado costo, y muchas veces existe el desconocimiento de los requisitos mínimos para llevar a cabo este tipo de ensayos, lo cual conlleva a un retraso importante en el desarrollo de terapias susceptibles que puedan pasar a investigación clínica.3
Los estudios preclínicos se realizan en animales y modelos fisiológicos en el laboratorio. Los llamados modelos in vivo, constituyen sistemas experimentales de gran utilidad en la investigación. Estos diseños en diversas especies de animal posibilitan la aplicación de técnicas de análisis que no pueden emplearse en el hombre por razones éticas. Prometen además investigaciones que no se obtienen mediante técnicas in vitro como los cultivos celulares, las cuales tiene la dificultad de que no pueden reproducir las interacciones propias de un sistema biológico completo, tejido u órgano como un todo.4 En las investigaciones farmacológicas los ensayos con animales de experimentación resultan indispensables para la búsqueda y aplicación de posibles dianas terapéuticas encaminadas tanto a la prevención como al tratamiento de una enfermedad.5
Estos ensayos, una vez realizados, permiten medir la eficacia y seguridad de determinado producto ya sea de origen sintético o natural.6 El propósito primario sigue siendo la evaluación de la actividad biológica. Durante estos estudios el producto diana, por lo general en dependencia del objeto que se persigue, es caracterizado en dos o más especies de animales, debido a que una droga puede afectarlos en forma diferente. Investigadores relacionados con el desarrollo de moléculas, utilizan modelos animales para conocer la fisiopatología y construir prototipos predecibles que emulen con la condición humana, pero no obstante todavía existen muchas limitaciones.7
Este tipo de investigación evalúa un gran rango de caracteristicas de la molécula, e incluyen estabilidad, determinaciones de diversos parámetros en plasma, y otros tipos de tejidos. Se establecen además las propiedades toxicológicas, farmacocinéticas y farmacodinámicas del compuesto. Dentro de estas se destacan los estudios de toxicidad aguda y crónica, toxicidad en dosis repetidas, tolerancia local, inmunogenicidad, carcinogenicidad y sobre el efecto en la reproducción y su progenie. En la última década se le ha dado un impulso importante a los estudios toxicogenómicos a través de estos modelos animales.
Los objetivos principales de la evaluación de la seguridad preclínica son: 1) seleccionar una dosis segura inicial y esquemas de escalado de dosis posteriores en los seres humanos; 2) identificar posibles órganos diana para la toxicidad y conocer si el estado de toxicidad presente ante el compuesto es reversible; y 3) identificar los parámetros de seguridad para monitorización clínica. Estos objetivos descritos para los estudios no-clínicos pretenden mejorar la calidad y consistencia de los datos, además de apoyar la seguridad y la eficacia del desarrollo de biofarmacéuticos.8
Los estudios preclínicos de seguridad son para definir efectos farmacológicos y toxicológicos no sólo antes de la iniciación de los estudios en humanos, sino en todo el desarrollo clínico. Estos deben tener en cuenta: 1) la selección de las especies animales en cuestión; 2) años de edad; 3) estado fisiológico; 4) la forma de la entrega, incluyendo dosis, vía de administración, y régimen de tratamiento; y 5) la estabilidad del material de ensayo en las condiciones de uso. Se espera que los estudios de toxicidad a realizar tengan cumplimiento de Buenas Prácticas de Laboratorio (BPL).9
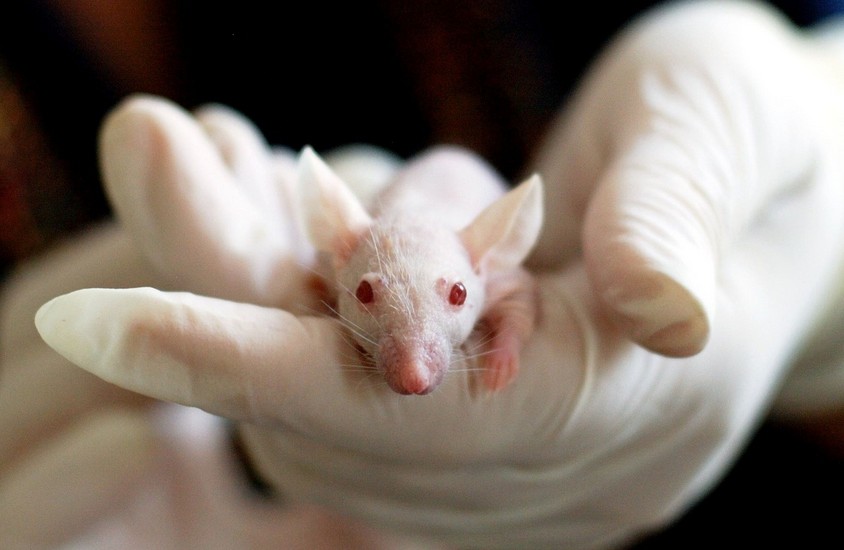
Existe un conocimiento científico que limita de alguna manera la extrapolación de los resultados de los estudios en animales, pues se tratan de sistemas biológicos diferentes aún para los ensayos en modelos de animales humanizados con diferencias de respuesta entre especies. El problema principal parece ser la traducción inter-especies para las reacciones adversas inesperadas y eficacia, lo que representa la mayoría de los retiros de drogas y fármacos ya en la fase de ensayo clínico, siendo esta molécula abandonada. De cada diez drogas que salen al mercado cada día, solo una o dos de ellas logran probada seguridad y eficacia, el resto son eliminadas por la presencia de eventos adversos, y los medicamentos que existen en el mercado constituyen opciones más seguras con efectos similares.10
Esta alta tasa de desgaste podría reducirse drásticamente mediante la mejora del proceso de pruebas preclínicas, sobre todo teniendo en cuenta las tecnologías recientes, aplicación de biomarcadores subrogados precisos, validados con dianas de toxicidad y eficacia; permitiendo mejorías en el diseño de los proyectos preclínicos para facilitar la recogida e interpretación de la información pertinente de este tipo de estudios, y su extrapolación a la clínica.
Los métodos convencionales para evaluar la toxicidad de los fármacos pueden no ser apropiados para los biofarmacéuticos debido a las propiedades estructurales, biológicas únicas que pueden influir en la especificidad de una especie, la inmunogenicidad y actividades pleiotrópicas imprevistas.11 Se reconoce además que algunos estudios que emplean sistemas de ensayo especializados necesarios para los productos biofarmacéuticos, puede que no tengan cumplimiento de BPL. Áreas de incumplimiento deben identificarse y evaluarse su importancia en relación con la estimación global de seguridad del producto propuesto. 12
Las preocupaciones de seguridad pueden derivarse de la presencia de impurezas o contaminantes de los Ingredientes Farmacéuticos Activos (IFA). Es preferible confiar en procesos de purificación para eliminar las impurezas y contaminantes en lugar de establecer un programa de pruebas preclínicas para su calificación. En todos los casos, el producto debe ser suficientemente caracterizado para permitir un diseño apropiado de los estudios preclínicos de seguridad.13
Existen riesgos potenciales asociados con contaminantes de la célula huésped derivadas de bacterias, levaduras, insectos, plantas y células de mamíferos. La presencia de contaminantes en el huésped celular puede dar lugar a reacciones alérgicas y otros efectos inmunopatológicos. Los efectos adversos asociados con contaminantes del ácido nucleico son teóricos, sino que incluyen la integración potencial en el genoma del huésped.13
Se recomienda en estos estudios cumplimiento de las normativas internacionales para poder establecer la seguridad preclínica y evaluación de productos farmacéuticos derivados de la biotecnología. Los principios activos incluyen proteínas y péptidos, sus derivados y productos de los que forman parte; podrían ser: células caracterizadas mediante el uso de una variedad de sistemas de expresión que incluyen bacterias, levaduras, insectos, plantas y células de mamíferos. También se incluyen variantes de moléculas biotecnológicas que se destacan en los últimos años como es el caso de enzimas, receptores, hormonas, citocinas, factores de crecimiento, activadores de plasminógeno, proteínas terapéuticas y de fusión, y los anticuerpos monoclonales categoría biotecnológica con mayor desarrollo durante los últimos cinco años. Los principios descritos también pueden ser aplicables a la proteína de ADN recombinante vacunas, péptidos sintetizados químicamente, los productos derivados del plasma, proteínas endógenas extraídas a partir de tejido humano, y fármacos de oligonucleótidos.14

Durante esta etapa de desarrollo preclínico de una molécula, su patrocinador evalúa los efectos farmacológicos y toxicológicos del producto en estudio a través de técnicas in vitro, e in vivo, como estas pruebas en animales. Esta etapa experimental Incluye la absorción, metabolismo y distribución del fármaco, excreción y su toxicidad, también la velocidad a la que el producto y sus metabolitos se eliminan del cuerpo.
En general, el producto que se utiliza en los estudios farmacológicos y toxicológicos debe ser comparable al producto propuesto para los estudios clínicos iniciales. Sin embargo, se aprecia que durante el transcurso de los programas de desarrollo es habitual que ocurran cambios en el proceso de fabricación con el fin de mejorar la calidad del producto y rendimientos. El impacto potencial de tales cambios para extrapolación de los resultados de los animales a los seres humanos debe ser considerado.
Los productos biofarmacéuticos que sean estructural y farmacológicamente comparable a un producto para el que existe una amplia experiencia en la práctica clínica puede necesitar menos extensas pruebas de toxicidad.
Si estos complejos estudios preliminares son prometedores, puede que el promotor previamente o a partir de estos resultados solicita su patente. Es solo en este momento que se puede considerar la solicitud de un permiso a las agencias reguladoras nacionales e internacionales para desarrollar la droga y comenzar con los estudios en seres humanos, solicitando toda la evidencia documentada sobre el desarrollo del producto (dossier). Una vez concluida esta etapa, se puede evaluar la posibilidad de contar con varias formulaciones incluso para diversas aplicaciones del mismo producto según sus propiedades biológicas, inmunológicas y farmacológicas entre otras. Cada formulación contará con una diversa valoración de sus resultados y permitirá estimaciones farmacológicas más extensas. Estos estudios duran un promedio de 3 a 5 años para un compuesto exitoso, pero sólo 1 de 1.000 compuestos avanza a la siguiente etapa, que comprende a los estudios clínicos en seres humanos. 15
En la fase preclínica es primordial el conocimiento del ámbito regulatorio y las guías que aplican. Hay que considerar que la investigación ha de ir unida a una simultánea toma de decisiones, que abarcan qué hacer, cuándo hacerlo, cómo y con qué especie animal o con cuantas. Cada droga de manera individual requiere un adecuado desarrollo preclínico que presente la mayor evidencia posible en cuanto a toxicidad y posible eficacia, considerándose el tipo de compuesto, mecanismo de acción para el que fue concebido y las posibles indicaciones clínicas.
Aunque es acertado afirmar que dicha regulación exige que un número importante de pruebas toxicológicas se realicen antes del primer ensayo en humanos, es importante destacar que algunos tipos de ensayos preclínicos no se exigen hasta avanzada las fases clínicas o incluso el registro.
En aras de lograr la armonización para este tipo de estudio a nivel mundial las agencias reguladoras nacionales e internacionales exigen la aplicación de las Guías y Normas de Buenas Prácticas Preclínicas (BPP) (del inglés ICH GUIDELINES ON SAFETY OF ANIMALS). Para el desarrollo y aplicación de los estudios preclínicos en todas las regiones, estas guías permiten adoptar un enfoque flexible, basado en la ciencia para la evaluación preclínica de seguridad. Son necesarias para apoyar el desarrollo clínico de un producto y su posterior autorización y comercialización, con estándares óptimos de calidad. Para los estudios preclínicos en productos biotecnológicos existe una guía específica la S6 (R1) Evaluación de la Seguridad Preclínica a partir de Productos Farmacéuticos obtenidos de la Biotecnología donde su última actualización fue en mayo de 2014. 16 En este número se destaca el auge investigativo tanto en la caracterización de modelos animales, como en la aplicación de estudios preclínicos para diversas especies, motivo por el cual se hace imprescindible que los investigadores conozcan al detalle el desarrollo de esta etapa dentro de la investigación de un producto así como las dificultades que presentan y la normativa y los estándares de calidad que se exigen en este tipo de investigación.
REFERENCIAS BIBLIOGRÁFICAS
1. Buenas Prácticas de Farmacovigilancia para las Américas. Red PARF Documento Técnico No. 5. Red Panamericana de Armonización de la Reglamentación Farmacéutica. Washington, DC Diciembre del 2010. OPS.
2.FDA. U.S. Food and Drug. Administraton. http://www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/How Drugs are Developed and Approved. Page Last Updated: 08/18/2015.
3. M. Berger, P. J. Kooyman, M. Makkee, J. S. van der Zee, P. J. Sterk1, J. van Dijk and E. M. Kemper. How to achieve safe, high-quality clinical studies with non-Medicinal Investigational Products? A practical guideline by using intra-bronchial carbon nanoparticles as case study. Respiratory Research (2016) 17:102.
4. Field HJ. Animal models in the evaluation of antiviral chemotherapy. Antiviral agents in the development and assessment of antiviral chemotheraphy. Boca Ratón: CRC Press, Inc. 1988: 67-84.
5. ICH S6 Guideline: Safety Studies for Biotechnological Products; July 1997.
6. Medicina. Universidad de Buenos Aires. Argentina. http://www.medicinabuenosaires.com/vol56-96/5/animalesdexp.htm.
7. Shultz LD, Ishikawa F, Greiner DL (2007) Humanized mice in translational biomedical research. Nat Rev Immunol 7(2):118-130.
8. Preclinical safety evaluation of biotechnology-derived pharmaceuticals. EMA/CHMP/ICH/731268/1998.
9. ICH M3 (R2) Guideline: Guidance on Nonclinical Safety Studies for the Conduct of Human Clinical Trials and Marketing Authorisation for Pharmaceuticals; June 2009.
10. Liao Y1, Zhang XL, Li L, Shen FM, Zhong MK. Stem cell therapy for bone repair: a systematic review and meta-analysis of preclinicalstudies with large animal models. Br J Clin Pharmacol. 2014 Oct; 78(4):718-26. doi: 10.1111/bcp.12382.
11. European Commission. Eudralex. The Rules Governing Medicinal Products in the European Union Volume 4 EU Guidelines to Good Manufacturing Practice, Berger et al. Respiratory Research (2016) 17:102.
12. Committee for Medicinal Products for Human Use (CHMP). ICH Guideline S6 (R1) - Preclinical Safety Evaluation of Biotechnology-derived Pharmaceuticals. Junio del 2011. Doc. Ref. EMA/CHMP/ICH/731268/1998.http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002828.pdf.
13. Scientific Considerations in Demonstrating Biosimilarity to a Reference Product. Guidance for Industry. U.S. Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Center for Biologics Evaluation and Research (CBER). Abril del 2015.
14. Assays and strategies for immunogenicity assessment of biological agents. Nencini F., Pratesi S., Petroni G., Matucci A., Maggi E., Vultaggio A. Drug Dev Res. Noviembre del 2014;75 Suppl 1:S4-6. doi: 10.1002/ddr.21184
15. DiMasi Joseph A. Risks in new drug development: Approval success rates for investigational drugs. Clinical Pharmacology & Therapeutics (2001) 69, 297-307; doi: 10.1067/mcp.2001.115446.
16. S6(R1) Preclinical Safety Evaluation of Biotechnology-Derived Pharmaceuticals June 2011. PSI Conference 12th May 2014.
Dra. Thelvia I. Ramos
MD. Especialista en Genética Clínica y Molecular. M.Sc. en Biotecnología Mención Ensayos Clínicos. Universidadde las Fuerzas Armadas-ESPE.Departamento de Ciencias de la Vida y la Agricultura.
