2017.02.01.4
Files > Volume 2 > Vol 2 No 1 2017 > Investigaciones
INVESTIGACIÓN
Evaluación de las condiciones de cultivo de Lactobacillus acidophilus y Lactobacillus casei a nivel de laboratorio, con inulina como fuente de carbono
Evaluation of culture conditions of Lactobacillus acidophilus y Lactobacillus casei on laboratory scale, with inulin as carbon source
James, M.1*, Velastegui, E1. Cruz, M.A1.
Available from: http://dx.doi.org/10.21931/RB/2017.02.01.4
_______________________________________________________________________________________________________________________
RESUMEN.
Lactobacillus acidophilus y Lactobacillus casei son bacterias ácido lácticas que funcionan como probioticos, generalmente son usadas para la formulación de alimentos funcionales y crecen en condiciones de cultivo similares. Ambas especies de Lactobacillus metabolizan azúcares específicos. La inulina es un fructooligosacárido cuya función prebiótica contribuye a la proliferación de la micro-flora intestinal y evita el crecimiento de microorganismos patógenos. En el presente trabajo se evaluó la concentración de inulina tanto de grado molecular como de grado reactivo, así como el pH del medio en sistemas fermentativos aerobios. Se obtuvo un medio óptimo para el crecimiento de Lactobacillus casei suplementado con 43,1g/L de inulina grado reactivo a un pH de 7,47; para Lactobacillus acidophilus se requiere de mayores estudios para determinar las condiciones óptimas tanto de concentración de inulina como de pH.
Palabras clave: Fermentación aeróbica, Lactobacillus acidophilus, Lactobacillus casei, inulina, pH.
_______________________________________________________________________________________________________________________
ABSTRACT.
Lactobacillus acidophilus and Lactobacillus casei are lactic acid bacteria that function as probiotics, are generally used for the formulation of functional foods and the bacteria growth happens under similar culture conditions. Both species of Lactobacillus metabolize specific sugars. Inulin is a fructooligosaccharide whose prebiotic function contributes to the proliferation of intestinal micro-flora and prevents the growth of pathogenic microorganisms. In the present work, the inulin concentration of both molecular grade and reactive grade was evaluated, as well as the pH of the medium in aerobic fermentative systems. An optimal growth medium for Lactobacillus casei supplemented with 43.1 g/L of reagent grade inulin was obtained at a pH of 7.47. For Lactobacillus, acidophilus further studies are required to determine the optimal conditions for both inulin concentrations and pH.
Key words: Aerobic fermentation, Lactobacillus acidophilus, Lactobacillus casei, inulin, pH.
_______________________________________________________________________________________________________________________
INTRODUCCIÓN.
Existe una problemática en torno a las enfermedades de tipo gastrointestinal que desencadenan cuadros patológicos importantes en humanos como: gastritis, colon irritable e incluso cáncer. Estudios han demostrado que una de las soluciones menos agresivas y más efectivas recae en el consumo de productos que contengan probióticos, esto se debe a que dichos microorganismos tienen la habilidad de reconstruir la flora intestinal mejorando así el proceso de digestión.1 Las enfermedades infecciosas bacterianas son tratadas generalmente con antibióticos, estos al ser de amplio espectro eliminan a los patógenos conjuntamente con la micro-flora intestinal benéfica; además de que los efectos de los antibióticos son agresivos, estos pueden generar resistencia por parte de los patógenos.2 Estos problemas han generado la necesidad de buscar nuevos métodos que beneficien de manera directa a la reconstrucción de la flora intestinal. Se ha propuesto al consumo de probióticos como la alternativa más eficaz para atacar los distintos problemas presentados.
Los probióticos son microorganismos, generalmente bacterias ácido lácticas (LBA), que poseen la habilidad de modificar la microbiota intestinal evitando la generación de microorganismos patógenos en el sistema digestivo.3 Los Lactobacillus spp. son bacterias acido lácticas Gram positivas anaerobias aero-tolerantes y homofermentativas; la mayoría de especies forman parte del consorcio microbiano del tracto intestinal. 4
Lactobacillus acidophilus y Lactobacillus casei tienen un efecto protector en el sistema gastrointestinal debido a su importante rol en el sistema inmune. Por ejemplo, L. acidophilus evita la adherencia de Candida albicans en el tracto digestivo impidiendo la producción de biofilms de la levadura ya que reducen su capacidad filamentosa, mediante la regulación inmunológica mediada por citoquininas.5 Otro ejemplo de respuesta inmunológica es dado por L. casei, este contribuye a la disminución de células cancerígenas en un 80 % debido a su actividad antitumoral, evidenciadas en con-cultivos con células epiteliales cancerosas.6
La inulina es un fructooligosacárido (FOS) compuesto por una cadena lineal de fructosas unida por enlaces β 1-2; en su extremo reductor se encuentra vinculada una molécula de glucosa por enlaces α 1-2. Dicho azúcar posee funciones prebióticas en bacterias LBA, generando efectos protectores inmunológicos; esto se da mediante el metabolismo de la molécula y su almacenamiento final en la célula.7
La importancia de esta investigación recae en la obtención de datos útiles para procesos de masificación. Esto permitirá formular alimentos funcionales donde exista una relación productiva entre el crecimiento de Lactobacillus y el consumo del prebiótico; además, los datos generados permitirán la mejora de condiciones de cultivo y disminución de tiempos de fermentación mediante la optimización de las condiciones de cultivo con el fin de generar las mayores concentraciones de biomasa de ambas cepas (L. acidophilus y L. casei). La importancia de la evaluación de propiedades físico-químicas en el crecimiento bacteriano recae en la influencia del pH en el metabolismo de la inulina por los probióticos en condiciones de fermentación aerobia. Los parámetros cinéticos (rendimientos, velocidades de crecimiento, tiempo de duplicación, consumo de sustrato, etc.) fueron analizados y relacionados entre sí para desarrollar un medio de cultivo óptimo que sea la base de la formulación de un producto alternativo y económico en el que se emplee a la inulina como prebiótico el Lactobacillus spp. (alimento funcional simbiótico).
MÉTODOS.
Cultivo de Lactobacillus.
Para la activación de Lactobacillus acidophilus ATCC ® 314 y Lactobacillus casei ATCC ® 334. Se cultivó en caldo MRS modificado y se incubo cada producto liofilizado en un periodo de 72 horas a 37°C y 127 rpm. Una vez activadas las cepas se preservó el cultivo madre a 4°C y se realizaron sub-cultivos cada 3 semanas.
Se modificó el medio MRS para el crecimiento de Lactobacillus spp. basándose en la composición del medio original.8 Obteniendo así la siguiente formulación: nitrato de amonio 2,85g/L (Merck ®); acetato de sodio trihidratado 5g/L (Fisher Chemicals); sulfato de manganeso hidratado 0,05g/L (Loba Chemie); fosfato de sodio2 g/L (AppliChem GmbH-an ITW Company); tween-80 1g/L; peptona 10g/L (Merck ®); dextrosa 20g/L (Becton, Dickinson & Company); extracto de levadura 5g/L (Becton, Dickinson & Company); caldo cerebro corazón 10g/L (Becton, Dickinson & Company).
Determinación de parámetros cinéticos
Cada ensayo realizado en este proyecto fue analizado con respecto a la obtención de los siguientes parámetros cinéticos: velocidad de crecimiento, velocidad máxima de crecimiento, tiempo de duplicación, productividad global, productividad máxima y rendimientos.
Ensayos de selección de pH.
Para este ensayo se realizó un medio basal MRS modificado (sin fuente de carbono), donde se agregó por separado 30g/L de inulina grado reactivo (BeneoTM GR) y 30g/L de inulina grado molecular (Inulin from chicory sigma ®). Para evitar que el pH de los medios de cultivo varié después de su esterilización e inoculación, se completó el volumen final del medio con tampones: para los medios que varían entre pH de 3,5 a 5,5 se usó tampón citrato 1M y para los medios que varían entre pH de 6 a 7,5 se completó con tampón Tris base HCl 0,01 M. Posteriormente, se inoculó ambas cepas por separado en los distintos tratamientos y se incubó los tubos de ensayo a 37°C, 127 rpm por 72 horas.
Ensayos de selección de inulina.
Se formuló el medio basal MRS caldo modificado a un pH constante de 6,5. Posteriormente se añadió inulina al medio en un rango de 10 a 50g/L de concentración en intervalos de 10g/L.9 Se inoculó ambas cepas por separado en los distintos tratamientos y se incubó los tubos de ensayo a condiciones constantes de 37 °C, 127 rpm por 72 horas.
Diseño experimental.
Se planteó un diseño central compuesto rotacional (DCCR) 2^k, para permitir el análisis del proceso de optimización de los medios, a partir de los datos obtenidos en los ensayos de selección de pH e inulina. Las variables de estudio fueron la variación de pH y la variación en la concentración de inulina; mientras que la variable de respuesta fue la concentración de biomasa (g/L); obteniendo una ecuación de segundo orden.
Optimización de concentración de inulina y pH.
Para la validación se utilizó medio MRS caldo basal modificado, empleando el medio optimizado resultante del diseño experimental. Se usó la fórmula cuadrática (ecuación 1) dada en el diseño de superficie de respuesta para obtener los valores ideales de las variables de estudio (pH y concentración de inulina).
Ecuación1. Fórmula cuadrática dada en el diseño de superficie de respuesta para obtener los valores ideales de las variables de estudio
Se inoculó 2,02 x 10-1 g/L de Lactobacillus casei y se midió la biomasa por densidad óptica para el crecimiento de biomasa como el consumo de sustrato a 600nm y 540nm respectivamente. Se añadió el análisis de rendimientos y su comparación con el crecimiento bacteriano.
Análisis de datos.
Se emplearon los softwares EXCEL 2010, STATISTICA versión 13.0 e IBM SPSS Statistics 24 para la obtención de datos de selección de las variables de pH y concentración de inulina tanto grado molecular como grado reactivo. También se empleó ambas herramientas para la formulación y recopilación de datos del diseño experimental. Todos los experimentes fueron analizados con un nivel de confianza del 95%. En los ensayos de selección tanto de pH como de inulina, se realizó un análisis de contraste de medias. Se analizó cada grupo de muestras de variable de respuesta (crecimiento de biomasa) con su respetiva variable independiente; además se contrasto la linealidad de las muestras. Obteniendo en todos los ensayos un error estándar menor a 0,05.
RESULTADOS Y DISCUSIÓN.
Ensayos de selección de pH.
Se obtuvo mayor crecimiento de L. acidophilus a pH 6,5 con inulina grado molecular y 7,5 con inulina grado reactivo comparado con los otros tratamientos (figura 1). Esto se debe a que en sistemas aerobios el crecimiento de biomasa se favorece a pH neutros; donde el potencial de reducción juega un papel importante en el metabolismo de las moléculas. Los crecimientos de las cepas no entran en los rangos estándares mencionados en fichas e investigaciones previamente realizadas (pH básicos). Un estudio previo, 10 demuestra que los parámetros de agitación y el uso del sustrato contribuyen a que la cepa se desarrolle en pH más básicos. Por lo tanto, se sugiere que el pH tiene influencia sobre el desarrollo de L. acidophilus interviniendo en rutas de producción de metabolitos o la inhibición de los mismos. Otra investigación demostró que el pH óptimo para la masificación de L. acidophilus se encuentra en un rango de 6 hasta 7,5.11
En esta investigación se comprobó que existió mayor crecimiento de biomasa de L. casei a pH 7 con inulina grado molecular y pH 7,5 con inulina grado reactivo (figura 1). Diferentes investigaciones demuestran que L. casei tiende a crecer a pH más básico en fermentaciones discontinuas, con un rango de variación generalmente entre 6,5 a 7.12
Se puede apreciar la factibilidad de masificación de las dos cepas a pH neutrales en un rango de 6,5 a 7,5, que coincide con el pH del medio de cultivo comercial MRS, disminuyendo el uso de soluciones reguladoras de pH.
Ensayos de selección de inulina.
Las concentraciones de biomasa obtenidas fueron 45.9mg/L y 68.4mg/L de L. acidophilus y L. casei respectivamente a una concentración inicial de 45g/L de inulina grado molecular (figura 2). Este resultado sugiere que este tipo de inulina, al ser pura y no contener trazas de otros carbohidratos, permite ser aprovechada por las bacterias generando mayor crecimiento en más de una especie de Lactobacillus. El mejor prebiótico para a masificación de especies de Lactobacillus es la inulina, una investigación previa permito observar un crecimiento a las 24 horas de L. casei (8,48 +/- 0,05 UFCmL-1) y L. acidophilus (8,08+/- 0,07 UFCmL-1) utilizando inulina grado molecular.13 Se sugiere que la inulina es metabolizada por algunas especies de la misma forma debido a su pureza; en dicho estudio no existe diferencia significativa en la biomasa final de ambas cepas, a diferencia de los resultados presentados en este ensayo en particular donde L. casei alcanza una mayor concentración de biomasa, demostrando una mejor capacidad en metabolizar este fructooligosacarido, debido a produce enzimas apropiadas.
La inulinasa es la enzima predilecta para cortar los enlaces b 1-2 de la inulina, convirtiendo al FOS en monómeros de glucosa y fructosa; esta es producida por muchas bacterias, en especial Lactobacillus spp. estudios demuestran que la producción de la enzima genera inhibición de producto.14 Investigaciones previas indican que la acción de la inulinasa sobre la inulina varía según el pH; la enzima degrada una molécula de inulina de manera completa a pH 5-7, mientras que a pH bajos la inulinasa degrada moléculas mediante el rompimiento de enlaces de manera aleatoria.15 Esto sugiere (según las condiciones de cultivo del presente estudio) que el método de acción de la inulinasa combinada con el pH, contribuyó en el crecimiento bacteriano, debido al rompimiento del fructooligosacárido en monómeros, facilitando procesos metabólicos.
Con inulina grado reactivo los resultados obtenidos fueron; 42.2mg/L de L. acidophilus a 50 g/L de FOS y 73.3mg/L de L. casei a 35g/L de FOS (figura 2). Los resultados demuestran que al usar inulina grado reactivo se obtiene mayo concentración de biomasa; esto se debe a que el reactivo no es 100% puro y contiene trazas de otros azúcares como glucosa, fructuosa y sacarosa. Lo cual sugiere que existe un mayor aprovechamiento de fuente de dichos azúcares más simples además de la inulina (especialmente por parte de L. casei), también se propone que las trazas activan de forman positiva la duplicación celular inicial.
Se ha propuesto mediante estudios que la inulina tiende a reducir tiempos de fermentación para la producción de metabolitos como el ácido láctico y promueve el crecimiento de probióticos como L. casei.16 En este ensayo la inulina grado reactivo combinada con la cepa L. casei presentaron la mayor concentración celular, lo que concuerda con la literatura citada. Beneficiando económicamente a la posible producción de un probiótico a escala industrial en el país.
Curvas de crecimiento previas a la optimización del proceso.
Para L. acidophilus la concentración de biomasa final fue de 4,31x10-1 g/L, obteniendo un crecimiento exponencial a partir de las seis horas de incubación hasta decima hora. Un estudio realizado determinó que a partir de la tercera hora existe un crecimiento exponencial de la bacteria hasta la hora doceava hora en un medio suplementado con suero de leche y 1% de inulina; 17 a diferencia de esta investigación donde la biomasa tiene un periodo de adaptación más prolongado y una fase exponencial más corta. La fase de adaptación fue más larga debido a que la degradación enzimática de inulina tarda a comparación de sustratos más simples, por consiguiente, la bacteria requiere de un gasto energético mayor. Sin embargo, otros estudios concuerdan con el presente trabajo concuerdan que la fase estacionaria de L. acidophilus se da a partir de la décima y onceava hora.
Se obtuvo una de 0,78 h-1 para L. acidophilus presentado un crecimiento exponencial a partir de las 4 horas de incubación hasta la doceava hora; los parámetros cinéticos se encuentran descritos en la tabla 1. Comparando con estudios propuestos, 18 donde se establece una de 1,0 h-1, se debe tomar en cuenta que el estudio con el que se compara utilizó otras fuentes de carbono como lactosa y por lo tanto la velocidad de crecimiento es mayor, y se sugiere que procesos energéticos influyen en el metabolismo de moléculas complejas como la inulina, es decir el microorganismo consume inicialmente las moléculas más simples para dar paso al consumo de azúcares más complejos como la inulina. La ruta metabólica presentada en estudios previos, indica que el sistema de degradación de inulina es complejo, inicia con la conversión del FOS en monómeros de fructosa y glucosa hasta obtener productos finales como succinato, acetato y etanol; 19 este gasto energético es representativo e influye en la producción de biomasa incluyendo su velocidad de crecimiento.
En L. casei la concentración de biomasa final fue de 5,58 x10-1 g/L, obteniendo un crecimiento exponencial a partir de las 4 horas de incubación hasta la doceava hora; además, se determinaron los parámetros cinéticos descritos en la tabla 1. Una investigación realizada, 20 determinó que la fase exponencial duró aproximadamente 10 horas, de manera similar a esta investigación. Adicionalmente, el estudio indica que la velocidad específica de crecimiento máxima para Lactobacillus utilizando glucosa como fuente de carbono es de 0,25 h-1; mientras que en el presente trabajo se obtuvo µmax de 0,307 h-1. Aunque la variación de velocidades no es grande, se sugiere que su diferencia se debe al uso de sustratos diferentes y la concentración inicial del inóculo.

Tabla 1. Parámetros cinéticos de L. acidophilus y L. casei.
Optimización de concentración de inulina y pH.
La superficie de respuesta generada para el DCCR de L. acidophilus con inulina grado molecular (ver figura 3), se ajustó en un 94,93% al modelo matemático propuesto y el mejor rendimiento (Yx/s) alcanzado en el ensayo fue de 0,59 (g/g) en el tratamiento de pH 6,5 y 31g/L de inulina grado molecular. Existió significancia estadística para las variables cuadráticas; al contrario de la interacción de las variables y su efecto lineal. Lo que sugiere un buen ajuste al modelo ya que los términos cuadráticos proveen la curvatura en la superficie; además estos analizan cada factor con los resultados promedios, obteniendo así una ecuación de segundo orden.21
La superficie de respuesta generada en el DCCR de L. acidophilus con inulina grado reactivo (ver figura 3), se ajustó al modelo matemático a un 70,78%; el rendimiento (Yx/s) más alto alcanzado en este ensayo es de 0,11 g/g en un medio de pH 8 y 40g/L de inulina grado reactivo. No existió significancia estadística en la combinación de variables ni en su expresión lineal o cuadrática, lo que implica que el modelo matemático propuesto no es el más adecuado, y a futuro se debe proponer más ajustes en los niveles de las variables del diseño experimental.
Se puede apreciar en las figuras de superficie de respuesta (figura 3) que los puntos extremos de las variables son posibles puntos óptimos para el crecimiento de L. acidophilus con inulina grado molecular. Mientras que el diseño de L. acidophilus con inulina grado reactivo demostró que el mejor crecimiento bacteriano se obtiene a menores porcentajes de inulina; el rango de pH es muy amplio por lo que no existió diferencia en el crecimiento con respecto a esta variable.

La superficie de respuesta L. casei con inulina grado molecular (ver figura 3), se ajustó en un 64,57% al modelo matemático. El mejor rendimiento (Yx/s) alcanzado en el ensayo fue de 0,26 g/g en el medio suplementado con 31g/L de inulina grado molecular y ajustado a un pH de 7. No existió significancia estadística tanto de los efectos cuadráticos como los efectos lineales de las variables, así en la combinación de las mismas. Esto da lugar a la interpretación de que el diseño no poseía valores significativos de ambas variables con respecto al crecimiento de L. casei.
La superficie de respuesta de L. casei con inulina grado reactivo (ver figura 3), se ajustó al modelo matemático en un 99,92%, lo cual sugiere la optimización del medio de cultivo a pH de 7,465 y a 43,1g/L de inulina para la masificación de la bacteria (datos obtenidos a partir de la ecuación dada por el modelo). También se obtuvo un mejor rendimiento (Yx/s) en cuanto al consumo de sustrato de 0,24 (g/g) en el tratamiento de pH 7 y 2,5g/L de inulina grado reactivo. Comparando con un estudio, 22 se determinó que la bacteria crece mejor en pH más neutrales (6,5 - 7); contrastando con los resultados obtenidos, concuerdan los valores de rendimientos y los puntos óptimos de pH que arroja el experimento.
Validación del medio de cultivo optimizado
Para los ensayos de validación del medio optimizado se determinaron las variables a partir de la formula dada por el modelo matemático (ecuación 1) de la siguiente manera:
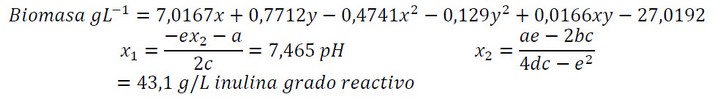
Los ensayos de validación del diseño experimental que implica la inoculación de L. casei en un medio regulado a pH 7,5 y a 43,1g/L de inulina grado reactivo; presentaron rendimientos (Yx/s) superiores a 0,55 (6,8 g/g), esto indica el aprovechamiento de inulina por parte de bacteria. Adicionalmente se alcanzó una concentración final de biomasa de 215 mg/L a las 72 horas de incubación en tubo de ensayo.
El medio ideal sugerido permitió obtener valores superiores tanto de velocidad específica de crecimiento (2,71 x10-3 h-1) como de rendimientos de consumo de sustrato y productividad global ( = 0,68 g/g y 7,75 x10-4 g/Lh), presentado mejores resultados que los obtenidos a lo largo de la investigación.
CONCLUSIONES
Se equilibró el nivel de pH del medio mediante el uso de tampones, esto contribuyó a disminuir errores entre réplicas y unidades experimentales. El rango de pH estudiado fue muy amplio, lo cual dificultó el proceso de optimización de este parámetro para cada cepa; sin embargo, se obtuvo un medio ideal para el crecimiento de L. casei, que existe una significancia estadística de pH tanto en su expresión cuadrática como lineal. Además los resultados obtenidos en la validación del medio se asemejan a los propuestos por el modelo matemático (concentraciones de biomasa mayores a 0,4 g/L).
Los porcentajes ideales propuestos para el medio masificante de ambos tipos de inulina varían. Esto se debe a que existe una diferencia en la pureza de los prebióticos, influenciando en el crecimiento de las cepas; los resultados de selección del FOS demuestran que el uso de inulina grado reactivo genera mayor concentración de biomasa a comparación de inulina grado molecular. Es por esto que el medio optimo propuesto utiliza dicha inulina, la cual contiene trazas de otras fuentes de carbono para el crecimiento de L. casei. Pese a que ambas cepas pertenecen al mismo género, se pudo visualizar diferencia significativa en el crecimiento y desarrollo de cada especie. Aunque los resultados se asemejen, su comportamiento es distinto.
AGRADECIMIENTOS
Los autores agradecen a la carrera de Ingeniería en Biotecnología, representada por la Coordinadora PhD. Vivian Morera, por el apoyo prestado a lo largo del proyecto de investigación desarrollado en las instalaciones del Laboratorio LQ3 de la Universidad De Las Américas. Adicionalmente se agradece el apoyo de los ayudantes de laboratorio: Javier Panchano, Cinthia Tovar y Alejandro Vega, estudiantes de la carrera.
REFERENCIAS BIBLIOGRÁFICAS
1. Chang, C., Ho-Keun, K., Ji-Sun, H., Jung-Eun, K., Sin, I. (2012). Prophylactic Effect of Probiotics on the Development of Experimental Autoimmune Myasthenia Gravis, Revista A Peer Reviewed, Open Access Journal, 7(12), 1-5.
2. Sanders, M., Akkermans, L., Haller, D., Hammerman, C., Heimbach, J., Hörmannsperger, G., Huys, G., Lutgendorff, F., Mack, D., Phothirath, P., Aguilar, G., Vaughan, E. (2010). Safety assessment of probiotics for human use, Revista gut microbes, 1(3), 164-179.
3. Papadimitriou., K, Zoumpopoulou.; G, Foligné., B, Alexandraki., V, Kazou., M, Pot., B, Tsakalidou., E, (2015). Discovering probiotic microorganisms: in vitro, in vivo, genetic and omics approaches, Revista Frontiers in Microbiology, 6(58), 1-4.
4. Vasiee, A., Yazdi, F., Mortazavi, A., Edalatian, M. (2014). Isolation, identification and characterization of probiotic Lactobacilli spp. from Tarkhineh, Revista International Food Research Journal, 21(6), 2487-2490.
5. Viela, S, Barbosa, J., Rossoni, R., Santos, J., Prata, M., Anbinder, A., Jorge, A., Junqueira, J. (2015). Lactobacillus acidophilus ATCC 4356 inhibits biofilm formation by C. albicans and attenuates the experimental candidiasis in Galleria mellonella, Revista Virulence, 6(1), 29-33.
6. Tiptiri-Kourpeti, A., Spyridopoilou, K., Santarmaki, V., Aindelis., G, Tompoulidou, E., Lamprianidou, E., Saxami, G., Ypsilantis, P., Lampri, E., Simopoulos, C., Kotsianidis, I., Galanis, A., Kourkoutas, Y., Dimitrellous, D., Chlichlia, K. (2016). Lactobacillus casei Exerts Anti-Proliferative Effects Accompanied by Apoptotic Cell Death and Up-Regulation of TRAIL in Colon Carcinoma Cells, Revista PLOS, 11(2), 3-7.
7. Vargas, C., Montañez, J. (2009). Obtención de insumos de interés industrial a partir de las fructanas de agave mezcalero potosino (Agave salmiana), (tesis de maestría en ciencias de producción agrícola sustentable), Instituto Politécnico Nacional de México.
8. ATCC, (s. f). ATCC Medium: 416 Lactobacillus MRS Agar/Caldo, recuperado el 20 de marzo del 2016, de http://www.atcc.org/~/media/39839AC0CB884212A57DBF6936371D91.ashx
9. Foye, O., Huang, I., Chiou, C., Walker, W., Ning, H. (2014). Early administration of probiotic Lactobacillus acidophilus and/or prebiotic inulin attenuates pathogen-mediated intestinal inflammation and Smad 7 cell signaling, Revista FEMS Immunology & Medical Microbiology, 65(3), 467-472.
10. Chramostová, J., Mošnová, R., Lisová, I., Pešek, E., Drbohlav, J., Němečková, I. (2014). Influence of Cultivation Conditions on the Growth of Lactobacillus acidophilus, Bifidobacterium sp., and Streptococcus thermophilus, and on the Production of Organic Acids in Fermented Milks, Revista Czech Journal of Food and Science, 32(5), 422-429.
11. Meena, G., Kumar, N., Majumdar, G., Banerjee, R., Meena, P., Yadav, V. (2014). Growth Characteristics Modeling of Lactobacillus acidophilus using RSM and ANN, Revista Braz. Arch. Biol. Technol, 57(1), 15-21.
12. Velásquez, J., Giraldo, G., Padillas, L. (2012). Viabilidad de Lactobacillus casei ssp casei ATCC 393 cultivado en suero de leche clarificado en un proceso de fermentación discontinuo, Revista Vitae, 19(1), 207-209.
13. Kunová, G., Rada, V., Lisová, I., Ročková, S., Vlková, E. (2011). In vitro Fermentability of Prebiotic Oligosaccharides by Lactobacilli, Revista Czech Journal of Food and Science, 29, 49-53.
14. Xian-Yang, G., Quian, H.,Zhang, W., (2010), Enhancement of L-Lactic Acid Production in Lactobacillus casei from Jerusalem Artichoke Tubers by Kinetic Optimization and Citrate Metabolism, Revista Journal of Microbiology and Biotechnology, 20 (1), 101-109.
15. Abdullah, N., Aly, M., Ibrahim, A., (2003), Studies On Possible Activation Of Microbial Inulinase Production Using Gamma Radiation Under Solid State Fermentation, (tesis en licenciatura en ciencias de farmacología), Universidad del Cairo-Egipto.
16. Rodríguez, D., Rocha-Santos, T., Pereira, C., Gomes, A., Malcata, X., Freitas, A. (2011). The potential effect of FOS and inulin upon probiotic bacterium performance in curdled milk matrices, Revista LWT-Food Science and Technology, 44(1), 100-107.
17. Olson, D., Aryana, K. (2012). Effect of Prebiotics on Lactobacillus acidophilus Growth and Resulting pH Changes in Skim Milk and a Model Peptone System, Revista Microbial & Biochemical Technology, 4(5), 121-124.
18. Ahn, Y., Lim, K., Ryu, J., Kang, D., Ham, J., Jang, Y., Kim, H. (2002).Characterization of Lactobacillus acidophilus Isolated from Piglets and Chicken, Revista Asian-Aust. J. Anim. Sci, 15(12), 1790-1796.
19. Sridhar, J., Eiteman, M., Wiegel, J. (2000). Elucidation of Enzymes in Fermentation Pathways Used by Clostridium thermosuccino genes Growing on Inulin, Revista Applied and Environmental Microbiology, 66(1), 246-250.
20. Pak, D., Muthaiyan, A., Story, R., O´Bryan, C., Lee, S., Crandall, P., Ricke, S. (2013). Fermentative Capacity of Three Strains of Lactobacillus Using Different Sources of Carbohydrates: In Vitro Evaluation of Synbiotic Effects, Resistance and Tolerance to Bile and Gastric Juices, Revista Journal of food research, 2(1), 158-163.
21. Zan, T., Ginebra, J. (2006). Principios de metodología de superficie de respuesta para modelos logísticos, (tesis Doctoral del departamento de estadística e investigación operativa), Universitat Politécnica de Catalunya Barcelona España.
22. Nezhard, M., Stenzel, D., Britz, M. (2010). Effect of growth at low pH on the cell surface properties of a typical strain of Lactobacillus casei group, Revista Iranian Journal of Microbiology, 2(3), 147-153.
Recibido: enero 2017
Aprrobado febrero 2017
James, M.1*, Velastegui, E1. Cruz, M.A1.
1 Universidad de Las Américas, Quito, Ecuador.
Autor de correspondencia: Mariuxy James. Facultad de Ingeniería y Ciencias Agropecuarias. Universidad de Las Américas. Sede Queri: calle José Queri s/n entre Av. Granados y Av. Eloy Alfaro, Quito, Ecuador. Teléf. (593) 0987808987 Correo electrónico: *[email protected]
1 Universidad de Las Américas, Quito, Ecuador.
Autor de correspondencia: Mariuxy James. Facultad de Ingeniería y Ciencias Agropecuarias. Universidad de Las Américas. Sede Queri: calle José Queri s/n entre Av. Granados y Av. Eloy Alfaro, Quito, Ecuador. Teléf. (593) 0987808987 Correo electrónico: *[email protected]
