2016.01.04.2
Files > Volume 1 > Vol 1 No 4 2016
CARTA AL EDITOR
Reparación de la lesión medular mediante trasplante de células aldainoglia e inhibición de la actividad RhoGTPasa.
Repair of spinal cord injury by aldainoglia cell transplantation and inhibition of RhoGTPase activity.
Available from: http://dx.doi.org/10.21931/RB/2016.01.04.2
Ernesto Doncel-Pérez 1
___________________________________________________________________________________________________________________________________________
Resumen
Una posible terapia para la reparación de una Lesión de la Médula Espinal (LME) está en la modulación eficaz de elementos moleculares y celulares implicados en el proceso de cicatrización glial. Las células de aldainoglia son precursores de células neurales con una alta capacidad para diferenciarse en neuronas, promueven el crecimiento, la envoltura y mielinización axonal de las neuronas residentes. Estas importantes características de la aldainoglia se pueden combinar con la inhibición específica de la actividad RhoGTPasa en astroglia y microglia que causan la reducción de la proliferación glial, la retracción de células astrogliales y la producción de mielina por los oligodendrocitos. Anteriormente hemos utilizado modelos de lesión experimental del sistema nervioso central, como la contusión de la médula espinal en ratas y el ictus lacunar estriatal en ratones; así observamos que la administración de glicolípido inhibidor para RhoGTPase o de células aldainoglia, respectivamente, produjo un aumento significativo de la recuperación funcional en los animales tratados. La estrategia de una terapia combinada con propiedades neuro-regenerativas es muy propicia en el tratamiento de LME por la potenciación funcional de neuronas y oligodendrocitos, que redundaría en la recuperación del ritmo locomotor. Aquí proponemos que el tratamiento de la lesión de la médula espinal con aldainoglia proveniente de neuroesferas, junto a la administración local de un inhibidor de RhoGTPasas tendría un efecto aditivo que facilitaría la recuperación después de la LME.
Palabras Clave: Aldainoglia, astrocito, cicatriz glial, CSPGs, médula espinal, mielinización, neurona, RhoGTPasa.
__________________________________________________________________________________________________________________________________________________________________________________________
Abstract
A possible therapy for repairing a spinal cord injury (SCI) is the effective modulation of cellular and molecular elements involved in the process of glial scarring. The aldainoglia cells are neural precursor cells with a high capacity to differentiate into neurons and promote growth, ensheathment and axonal myelination of resident neurons. These important features of the aldainoglia can be combined with the specific inhibition of RhoGTPase activity in astroglia and microglia that produces a reduction in glial proliferation, retraction of astroglial cells and production of myelin by oligodendrocytes. We have been working in experimental models of CNS injury, such as spinal cord contusion in rats and striatal lacunar infarction in mice; and we observed that administration of glycolipid inhibitor for RhoGTPase or aldainoglia cells, respectively, produced a significant increase in the functional recovery in treated animals. A therapy that combines both treatments with neuro-regenerative properties is quite desired in the treatment of SCI because a functional potentiation of neurons and oligodendrocytes, would result in a better recovery of locomotor rhythm. Here we propose that the treatment of spinal cord injuries with aldainoglia obtained from neurospheres, plus the local administration of an inhibitor of RhoGTPases have an additive effect that could be facilitate recovery after SCI.
Keywords: Aldaynoglia, astrocyte, CSPGs, glial scar, mielination, neuron, spinal cord, RhoGTPase.
__________________________________________________________________________________________________________________________________________________________________________________________
Introducción
Después de las enfermedades cardiovasculares y el cáncer, el trauma accidental es la causa principal de muerte en niños y adultos jóvenes en los países desarrollados. Las lesiones del Sistema Nervioso Central (SNC) causan incapacidad laboral, suelen conducir a una dependencia crónica y con frecuencia se producen en individuos menores de 45 años. La recuperación de una lesión en el cerebro o médula espinal depende de la zona dañada y la extensión de la lesión, sin embargo; las terapias disponibles en la actualidad se limitan a proporcionar alivio a los síntomas y realizar rehabilitación.
Tras una Lesión en la Médula Espinal (LME), se producen una serie de acontecimientos celulares y moleculares muy dinámicos en la zona afectada. Los macrófagos provenientes de la sangre eliminan el debris celular, comienza el proceso de muerte neuronal secundaria, células precursoras neurales migran cerca de la zona dañada, también proliferan y se diferencian astrocitos que agrandan sus procesos fibrosos, formando una barrera glial entre la zona lesionada y el SNC no lesionado. Los fibroblastos del tejido conectivo adyacente se dividen y se superponen sobre los astrocitos fibrosos, depositando colágeno, esto completa la formación de una frontera que le separa del SNC llamada cicatriz glial. Las células de esta cicatriz son principalmente astrocitos reactivos, microglia reactiva, pericitos y fibroblastos que junto a la matriz extracelular, conforman un ambiente hostil para el crecimiento axonal. Los astrocitos y la microglía son poblaciones de células del SNC altamente reactivas y tienen un papel fundamental en la formación de la cicatriz glial que está ampliamente documentado. 1,2
La respuesta de astrocitos a una lesión del SNC también se caracteriza por la producción de proteoglicanos tipo condroitin sulfato (Chondroitin Sulphate Proteoglicans, CSPGs), que presentan una potente barrera para la regeneración de axones. La acción inhibidora de CSPG se ha atribuido a la abundancia de las cadenas de glicosaminoglicanos (GAG) cargados negativamente que decoran el núcleo proteíco y constituyen un sustrato pobre que repele electrostáticamente los conos de crecimiento axonal. La protein tyrosine phosphatase sigma, PTPsigma, el leukocyte common antigen related phosphatase , LAR; así como el receptor de Nogo (NgR) han sido identificados como receptores neuronales que funcionalmente interactúan con los CSPGs y median la inhibición del crecimiento neuronal dependiente de CSPG. La chondroitinase ABC (chABC) es una enzima bacteriana que digiere las cadenas de GAG. La chABC suprime, in vitro, la inhibición de crecimiento de neuritas dependiente de CSPG; así como mejora el crecimiento de neuritas y la recuperación funcional después de LME. Por lo tanto, el “targeting” farmacológico de receptores para CSPGs es una estrategia que ha mostrado algún potencial para disminuir el secuestro de los conos de crecimiento neuronales dependiente de CSPG. Si bien estos estudios han identificado como posibles objetivos los receptores de CSPG, el trabajo futuro se inclina hacia el desarrollo de pequeñas moléculas inhibidoras que alcancen una mejor penetración y distribución en el SNC y se consiga llegar de manera más temprana y eficaz a la lesión. 3 En este sentido, hemos trabajado en el desarrollo de glucósidos inhibidores que consigan una inhibición específica y temporal de la astroglia. Esto, a su vez, permitiría una reducción significativa de la producción de CSPGs, promovería el crecimiento axonal y la recuperación funcional de las neuronas y células gliales. 1.4
Los derivados de la mielina del SNC constituyen una barrera para la regeneración de axones en los sitios de lesión. Los inhibidores asociados a la mielina (myelin-associated inhibitors, MAIS), incluyendo Nogo, la glicoproteína asociada a la mielina (myelin-associated glycoprotein, MAG) y la glicoproteína de mielina de los oligodendrocitos (oligodendrocyte myelin glycoprotein, OMgp) colapsan los conos de crecimiento axonal e inhiben el crecimiento de neuronas. El “targeting” de estos factores inhibidores externos ha producido alguna mejora en la plasticidad axonal y la recuperación funcional después de lesión del SNC. Adicionalmente, la estimulación del potencial de crecimiento intrínseco mediante silenciamiento de reguladores negativos del crecimiento de genes en neuronas, incluyendo la phosphatase and tensin homolog (PTEN) y el suppressor of cytokine signaling 3 (SOCS3), puede inducir de manera importante la regeneración axonal a larga distancia, después de una lesión del SNC. 5 También, el trasplante de células precusoras neurales en roedores con la médula espinal seccionada resulta en un crecimiento significativo a larga distancia de las células trasplantadas. 6 Estos estudios indican que una estimulación del crecimiento neuronal intrínseco es capaz de superar la naturaleza inhibitoria de la lesión en el CNS.
Una pequeña GTPasa, RhoA, que participa en la regulación de la actina; así como su efectora cadena abajo la Rho-kinasa (ROCK), se han estudiado de forma exhaustiva como mediadores de la inhibición del exo-crecimiento neurítico en el SNC. Se ha demostrado que MAIs aumentan los niveles de RhoA activa, unida a GTP. La inhibición de ROCK, estimula el exo-crecimiento de neuritas sobre la mielina; así también la infusión de inhibidores ROCK en la médula espinal lesionada de la rata (Ej: pequeñas moléculas como Y-27632 o fasudilo), mejora la recuperación de su sistema locomotor. 7 RhoA se puede inhibir específicamente con la exoenzima C3 transferasa (C3) de Clostridium botulinum, la cual ribosila el ADP e inactiva RhoA. El tratamiento de los animales con C3 mejora la recuperación locomotora en los modelos de LME por contusión y hemisección dorsal. 8 Los resultados positivos con C3 se han trasladado a fase I / II de ensayos clínicos con Cethrin (BA-210), una forma de C3 que es permeable a las células. Durante la cirugía de la médula espinal y usando fibrina como agente sellador, BA-210 se libera a nivel local sobre la duramadre. 9
Células precursoras neurales (neural stem cells, NSCs) trasplantadas tienen una elevada capacidad para sobrevivir e integrarse funcionalmente en la médula espinal lesionada de roedores. Lo anterior nos sugiere que la naturaleza inhibidora del SNC lesionado puede ser superada por neuronas con un crecimiento vigoroso. Se ha demostrado que las NSC trasplantadas en una médula espinal seccionada extienden largos axones a través de la materia gris y blanca, estableciendo un puente electrofisiológico a través de la lesión. 6 Las NSC injertadas tuvieron la capacidad de integrarse en la médula espinal de su huésped; no obstante, en la mitad de los animales se observó la presencia de colonias ectópicas de células del donante a lo largo de la médula espinal y el tronco cerebral. 10 Esto nos indica la precaución que debe mantenerse en el desarrollo de terapias con NSC, ya que estas células implantadas pueden generar tumores y/o conexiones sinápticas exuberantes que podrían dar lugar a efectos secundarios desfavorables ya sea conductuales o sensoriales, incluyendo el dolor neuropático. En general, en los trabajos revisados queda probado que las neuronas provenientes de NSCs poseen alta potencialidad de crecimiento; siendo capaces de crecer y diferenciarse extensamente en el CNS lesionado, a pesar de la presencia de factores inhibidores.
Un enfoque novedoso en la terapia para LME es la modulación de procesos celulares y moleculares implicados en la cicatrización glial. Este enfoque se sustenta en dos elementos fundamentales: i) apoyar, preservar y promover el crecimiento axonal de neuronas residentes o “de novo” y ii) la inhibición de la activación glial y por consecuencia la inhibición de la cicatriz glial (Figura 1).
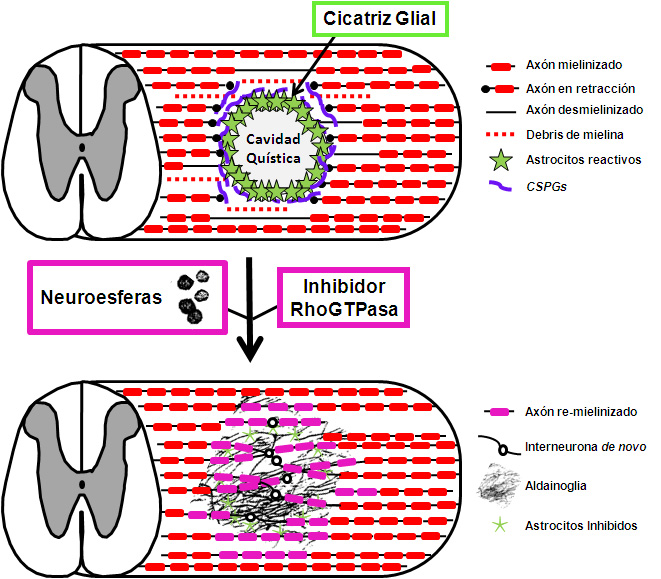
Figura 1. Modelo para la reparación de la lesión medular mediante tratamiento con aldainoglia derivada de neuroesferas e inhibición de la actividad RhoGTPase. Después de una lesión medular, los astrocitos proliferan cerca de la zona dañada, se agrandan sus procesos fibrosos, producen CSPGs y forman una cicatriz glial con una cavidad quística en la médula espinal. Se interrumpe los tractos de neuronas y provoca la retracción axonal de las neuronas lesionadas. Los restos de mielina del SNC provenientes de los axones dañados generan MAIs, MAG y OMgp, que inhiben el crecimiento axonal e inducen la muerte neuronal (Panel A). La administración de un inhibidor de RhoGTPasa reduce el tamaño de los astrocitos reactivos e inhibe su producción de CSPGs. La inyección de células precursoras neurales (neuroesferas) induce su diferenciación a aldainoglia, que promueve el crecimiento axonal, la re-mielinización y la re-conexión de las vías nerviosas por interneuronas generadas de novo a partir de los precursores neuronales trasplantados o residentes (Panel B).
En cuanto al primer elemento hemos trabajado en la obtención de aldainoglia, células gliales que promueven el crecimiento axonal y se pueden encontrar en diferentes nichos del SNC como el bulbo olfativo, hipotálamo, hipófisis o glándula pineal. Estas células comparten con las células de Schwann (Schwann cells, SCs) del sistema nervioso periférico la capacidad de sobrevivir y proliferar en cultivo, promover el crecimiento de neuritas, así como la envoltura y mielinización de axones. Las células que corresponden respectivamente a las zonas del SNC mencionadas son: células de glía de envolvente olfativa (Olfactory ensheathing cells, OECs), tanicitos, pituicitos y células pineales intersticiales. Estas se pueden identificar en cultivo por expresión concomitante de un conjunto de marcadores inmunológicos, tales como la proteína acida fibrilar de la glia (GFAP), la vimentina, el receptor p75 para NGF, y el receptor de estrógeno tipo α, lo que muestra que poseen propiedades de SCs y astrocitos. 11 Los trasplantes de células aldainoglia tienen un considerable potencial para el tratamiento de las lesiones del SNC. Estas NSCs multipotentes se pueden aislar de las mencionadas regiones del SNC de mamíferos en diferentes etapas de desarrollo y cultivarse como neuroesferas en suspensión. Después de las señales apropiadas, las células de neuroesferas pueden diferenciarse in vitro a neuronas, astrocitos y oligodendrocitos, aunque su comportamiento después de trasplantadas es variable. Las neuroesferas de roedores cuando se trasplantan se diferencian predominantemente a células gliales, mientras que los trasplantes de neuroesferas del cerebro anterior de embriones humanos dieron lugar a una proporción significativa de neuronas. Nuestro grupo ha reportado que neuroesferas mesencefálicas de roedores se diferencian, in vitro, predominantemente a células con propiedades similares a aldainoglia, cuando se expone al medio condicionado por OECs (OEC-CM). Este medio contiene una mezcla de neurotrofinas (NGF, BDNF) y neurregulinas, que instruye a las neuroesferas hacia células progenitores neurales con fenotipo de aldainoglia. Es por esto que OEC-CM causa que las células de neuroesferas se diferencien a células con fenotipo de glia periférica, a juzgar por su expresión de ARNm y los marcadores de proteínas (GFAP, vimentina, nestina, y proteínas S100). En ensayos de co-cultivo de aldainoglia marcada con GFP, con ganglios de la raíz dorsal (dorsal root ganglia, DRG), se observó migración de aldainoglia-GFP hacia estos ganglios, invadiéndolos e interaccionando con las neuronas DRG. La interacción directa aldainoglia-neurona fue necesaria y suficiente para promover la envoltura, mielinización y exo-crecimiento neurítico. 12 La posibilidad de diferenciar las células neuroesferas a aldainoglia podría satisfacer el déficit de células neurales necesarias en trasplantes para reparar grandes lesiones del SNC.
Para conseguir el segundo elemento en este enfoque de terapia SCI conseguimos inhibir de manera específica las células gliales no deseadas (astrocitos y microglia), evitando al mismo tiempo no afectar a otros tipos de células neurales, es decir, las neuronas y oligodendrocitos. En los últimos años, tomando como base la estructura química de un inhibidor natural de astroblastos y de la división de astrocitomas (neurostatin), hemos estudiado los glucósidos inhibidores de la división de glioma. 13 Entre los compuestos ensayados, los glicolípidos sulfatados presentaron la más alta actividad inhibidora de la división de glioma humano y de rata.4 Resulto interesante observar mediante el uso de la tecnología de microarrays de ADN que el gen ARHGDIA fue reprimido de forma significativa. El producto de este gen es el inhibidor de la disociación de nucleótidos de guanina tipo alfa para Rho (RhoGDIα), un regulador de RhoGTPasas. 1,4 Hemos demostrado recientemente que nuestro sulfoglicolipido afecta a células gliales mediante la interacción con la proteína RhoGDIα, provocando un aumento en la expresión de genes TrkB en las células neurales, la producción de mielina por oligodendrocitos y la promoción del crecimiento axonal de neuronas DRG. Las células astroglial cambian su morfología y esto es transducido principalmente por la vía de señalización BDNF / TrkBT1 / RhoGDIα, que también es operativo en microglia. La isoforma TrkT1 corresponde a la forma TrkB truncada del receptor con un corto dominio citoplásmico de 11 residuos de aminoácidos en el C-terminal. Este dominio interactúa con RhoGDIα e induce la afluencia de Ca2+ y cambios morfológicos en las células de la glia. La inhibición de la vía de BDNF / TrkB / RhoGDIα en astrocitos y células microgliales, por secuestro de RhoGDIα, fue propuesto como una nueva diana para el tratamiento de LME. 1
Las NSC injertadas podrían integrarse en la médula espinal y el cerebro del huésped, pero también estas células implantadas pueden dar lugar a tumores y dolor neuropático, según hemos mencionado anteriormente. Una combinación de células precursoras neurales y nuestro glucósido antiproliferativo podría salvar este obstáculo (Figura 1). Las propiedades antiproliferativas de estos compuestos disminuyen el riesgo de crecimiento de tumores y facilita el movimiento de las NSCs trasplantadas en un entorno de laxitud astroglial proporcionada por la actividad inhibitoria del glucósido.
La promoción del crecimiento axonal por la aldainoglia y la inhibición de la actividad RhoGTPase en células de la glia residente ocurren simultáneamente. Hemos observado que la presencia de sulfoglicolipido potencio el exo-crecimiento del axón en neuronas DRG, y las células aldainoglia no se vieron afectadas por el glucósido.1 Esto indica que la inhibición de la actividad era debido al efecto antiproliferativo del glicósido y no influyó a otras funciones en la aldainoglia. El reclutamiento de astrocitos después de la lesión recae en la proliferación astroglial; así el número de astrocitos reclutados a un sitio de la lesión del SNC se reduce significativamente en ratones deficientes para RhoGTPase. 14 En otros escenarios se ha reportado que una alta actividad RhoGTPase en las células madre hematopoyéticas (HSC) de adultos esta causalmente vinculada al envejecimiento de HSC y correlaciona con una pérdida de la polaridad en las HSCs en la edad adulta; mientras que la inhibición farmacológica de la actividad de la RhoGTPasa Cdc42 rejuveneció funcionalmente a HSCs adultas, aumento la proporción de células polarizadas en la población de HSC adultas y restauro el nivel y la distribución espacial de la acetilación de histonas a un estado similar al observado en HSCs juveniles. 15
Las células de aldainoglia son precursores de células neurales con capacidad de diferenciarse a neuronas, promover la envoltura, mielinización y crecimiento axonal. La inhibición selectiva de la actividad RhoGTPase en astroglia y microglia por sulfoglicolipido específico reduce su proliferación celular, induce la retracción de los procesos de células gliales y aumenta de la producción de mielina por oligodendrocitos. 1, 12, 16 Estas son propiedades fundamentales en la terapia de LME donde la potenciación funcional de neuronas y oligodendrocitos resultará en una mejor recuperación del ritmo locomotor. Hemos reportado que ratas con una contusión moderada de la médula espinal, tratadas con inyección espinal de sulfoglicolipido, mostraron una recuperación funcional significativa. 1 Adicionalmente observamos en un modelo en ratón con ictus lacunar estriatal, que nuevas neuronas derivadas de aldainoglia se integraron en los circuitos del SNC del huésped y se lograron establecer contactos sinápticos. 16 Estos datos apoyan el uso de la aldainoglia y los inhibidores de la actividad RhoGTPasa como herramientas útiles para la terapia en el trauma del SNC, particularmente en el tratamiento de LME.
Referencias
1. Garcia-Alvarez, I., et al., Inhibition of glial proliferation, promotion of axonal growth and myelin production by synthetic glycolipid: A new approach for spinal cord injury treatment. Restor Neurol Neurosci, 2015. 33(6): p. 895-910.
2. Bovolenta, P., F. Wandosell, and M. Nieto-Sampedro, Neurite outgrowth over resting and reactive astrocytes. Restor Neurol Neurosci, 1991. 2(4): p. 221-8.
3. Kaplan, A., S. Ong Tone, and A.E. Fournier, Extrinsic and intrinsic regulation of axon regeneration at a crossroads. Front Mol Neurosci, 2015. 8: p. 27.
4. Doncel-Perez, E., et al., Synthetic glycolipids for glioma growth inhibition developed from neurostatin and NF115 compound. Bioorg Med Chem Lett, 2013. 23(2): p. 435-9.
5. Sun, F., et al., Sustained axon regeneration induced by co-deletion of PTEN and SOCS3. Nature, 2011. 480(7377): p. 372-5.
6. Lu, P., et al., Long-distance growth and connectivity of neural stem cells after severe spinal cord injury. Cell, 2012. 150(6): p. 1264-73.
7. Sung, J.K., et al., A possible role of RhoA/Rho-kinase in experimental spinal cord injury in rat. Brain Res, 2003. 959(1): p. 29-38.
8. Boato, F., et al., C3 peptide enhances recovery from spinal cord injury by improved regenerative growth of descending fiber tracts. J Cell Sci, 2010. 123(Pt 10): p. 1652-62.
9. Lord-Fontaine, S., et al., Local inhibition of Rho signaling by cell-permeable recombinant protein BA-210 prevents secondary damage and promotes functional recovery following acute spinal cord injury. J Neurotrauma, 2008. 25(11): p. 1309-22.
10. Steward, O., K.G. Sharp, and K. Matsudaira Yee, Long-distance migration and colonization of transplanted neural stem cells. Cell, 2014. 156(3): p. 385-7.
11. Gudino-Cabrera, G. and M. Nieto-Sampedro, Schwann-like macroglia in adult rat brain. Glia, 2000. 30(1): p. 49-63.
12. Doncel-Perez, E., S. Caballero-Chacon, and M. Nieto-Sampedro, Neurosphere cell differentiation to aldynoglia promoted by olfactory ensheathing cell conditioned medium. Glia, 2009. 57(13): p. 1393-409.
13. Nieto-Sampedro, M., E. Doncel-Perez, and A. Fernandez-Mayoralas, Natural, synthetic and semisynthetic glycolipid inhibitors of glioma growth. Expert Opin Ther Pat, 2004. 14(4): p. 487-97.
14. Robel, S., et al., Genetic deletion of cdc42 reveals a crucial role for astrocyte recruitment to the injury site in vitro and in vivo. J Neurosci, 2011. 31(35): p. 12471-82.
15. Florian, M.C., et al., Cdc42 activity regulates hematopoietic stem cell aging and rejuvenation. Cell Stem Cell, 2012. 10(5): p. 520-30.
16. Muneton-Gomez, V.C., et al., Neural differentiation of transplanted neural stem cells in a rat model of striatal lacunar infarction: light and electron microscopic observations. Front Cell Neurosci, 2012. 6: p. 30.
Recibido:7 septiembre 2016
Aprobado: 15 noviembre 2016
Ernesto Doncel-Pérez 1
1 Grupo de Química Neuro-Regenerativa, Hospital Nacional de Parapléjicos, Servicio de Salud de Castilla La Mancha (SESCAM), Finca La Peraleda s/n, 45071 Toledo, España.
e-mail: [email protected]
