2018.03.02.8
Files > Volume 3 > Vol 3 No 2 2018
INVESTIGATION / RESEARCH
Cepas autóctonas de Bacillus subtilis como agente de biocontrol in vitro de Alternaria spp. en Brassica oleracea var. italica
Native strains of Bacillus subtilis as a biocontrol agent in vitro Alternaria spp. In Brassica oleracea var. italica
Native strains of Bacillus subtilis as a biocontrol agent in vitro Alternaria spp. In Brassica oleracea var. italica
Acurio, R.1, Ñacato, C. Valencia, M.
Available from: http://dx.doi.org/10.21931/RB/2018.03.02.8
RESUMEN
La enfermedad provocada por el hongo fitopatógeno Alternaria spp. es una de las principales causas de daños en cultivos de brócoli en Ecuador, llegando a ocasionar hasta el 30% en pérdidas. Este trabajo se realizó con el fin de determinar la capacidad antagónica de cepas autóctonas de Bacillus subtilis frente a Alternaria spp., mediante pruebas in vitro. En el estudio se utilizaron cepas de B. subtilis aisladas de las principales zonas productoras de brócoli en el Ecuador. Tanto las cepas patógenas como las antagonistas fueron aisladas e identificadas a partir de muestras en campo tomadas aleatoriamente de cultivos de brócoli en las provincias de Cotopaxi, Imbabura y Tungurahua. La capacidad antagónica se midió utilizando la escala de Bell. Los resultados obtenidos indican que la cepa ATCC 6633 y la cepa AB-4 identificadas y caracterizadas bioquímicamente como Bacillus subtilis subsp. licheniformis, presentaron una actividad antagónica con un valor promedio de 45.21 cm clase 2 según la escala de Bell, determinado así el potencial de Bacillus subtilis como controlador biológico contra Alternaria spp.
Palabras clave: Biocontrol, brócoli, capacidad antagónica, Escala de Bell
ABSTRACT
The disease caused by the phytopathogenic fungus Alternaria spp., is one of the main causes of damages in broccoli crops in Ecuador, inducing losses of up to 30%. This research was carried out in order to determine the antagonistic capacity of native strains of Bacillus subtilis against Alternaria spp. by the means of in vitrotechniques. In the study, we used strains of Bacillus subtilis isolated, belonging to the main broccoli producing areas in Ecuador. Both pathogenic strains and antagonists were isolated and identified from soil samples randomly taken from broccoli crops in the provinces of Cotopaxi, Imbabura and Tungurahua. The antagonistic capacity was measured using the Bell’s Scale. The results obtained indicate that the strain ATCC 6633 and strain AB-4 identified and characterized biochemically as Bacillus subtilis subsp. licheniformis, exhibit antagonistic activity with an average value of 45.21 cm Class 2 according to the Bell’s Scale. These observationsestablish that Bacillus subtilis has a potential to act as a biological control against Alternaria spp.
Key words: Biocontrol, broccoli, antagonistic capacity, Bell’s Scale
INTRODUCCIÓN
Uno los factores que afectan la producción del cultivo de brócoli en el Ecuador son las enfermedades causadas por hongos fitopatógenos, Alternaria spp. es uno de los principales causantes de enfermedades que afectan al brócoli (Brassica oleracea var. italica), este se caracteriza por producir un atizonamiento y daño en la inflorescencia que se inicia como una decoloración café y puede involucrar un florete o varios a la vez, se pude apreciar en el envés de las hojas manchas de color oscuro a manera de una mancha de aceite; cuando esto ocurre es casi seguro que la pella, en cualquier estado de formación, presentará una o varias inflorescencias con pudriciones, por ello la presencia de la enfermedad en el cultivo de brócoli impide que estas puedan ser comercializadas. Se ha estimado que esta enfermedad puede ocasionar hasta un 30% de pérdidas de pellas. 1,2
B. subtilis provee un control efectivo de enfermedades causadas por hongos y bacterias. El potencial de esta bacteria se basa en su capacidad para producir una amplia gama de moléculas bioactivas, que muestran propiedades antifúngicas, junto con una baja toxicidad y alta biodegradabilidad, adicionalmente, la capacidad de formar endosporas, le proporcionan un alto nivel de resistencia a condiciones ambientales extremas. 3
Este trabajo se realizó con el fin de determinar la capacidad antagónica de cepas autóctonas de B. subtilis aisladas y purificadas de las principales zonas productoras de brócoli en el Ecuador frente a Alternaria spp. en pruebas in vitro; para obtener un potencial biocontrolador natural que no afecte a la calidad del brócoli generando una en el uso de pesticidas que puedan causar daño al consumidor.
MATERIALES Y MÉTODOS
Recolección de muestras
Las diferentes cepas de B. subtilis fueron aisladas de muestras de suelo provenientes de fincas productoras de brócoli ubicadas en las provincias de Cotopaxi, Imbabura y Tungurahua. Las muestras de Alternaria spp. se obtuvieron de hojas provenientes de las mismas zonas en las que se tomaron las muestras de suelo. La recolección y procesamiento de muestras se hizo entre los meses de abril y julio de 2015.
Obtención de Bacillus subtilis
Se pesó 10 g de cada muestra de suelo y se realizaron diluciones en suero fisiológico estéril hasta obtener la dilución 10-3. Posteriormente con un asa microbiológica se sembró en cajas Petri con medio Plate Count agar (PCA) + púrpura de bromocresol y se incubó a 37ºC por 48 h, se seleccionaron las cajas con UFC con características macroscópicas de Bacillus sp.
Las cajas con consideradas como posibles contenedoras de B. subtilis fueron resembradas, en agar nutritivo y se incubó a 37ºC por 48 h. Una vez identificadas macroscópicamente, se procedió a identificar microscópicamente mediante tinción con azul de metileno para identificar la morfología de un bacilo y tinción con verde brillante para la distinción de esporas centrales típicas de B. subtilis.
La identificación bioquímica se realizó mediante el kit Microgen BACILLUS-ID MID-66 siguiendo las indicaciones de fábrica. Las cepas caracterizadas fueron almacenas empleando el sistema de conservación de cepas CRYOBANK a -20 °C.
Obtención Alternaria spp.
De la muestra vegetal infectadas con Alternaria spp. se procedió a recortar en la zona en la cual se desarrolló el micelio del hongo, se sembró en medio Agar Papa Dextrosa (PDA) y se incubó a 27º C con exposición a la luz alrededor de 4 días. Se seleccionaron los hongos que presentaron coloración verde obscuro, borde irregular, superficie plana polvosa algodonosa, características macroscópicas del género Alternaria.4
Para la caracterización morfológica microscópica se realizó una impronta con azul de lactofenol y se observó en el microscopio, se utilizó la clave de identificación de hongos y fitopatógenos comunes.5
Pruebas de Antagonismo
Las pruebas de antagonismo se realizaron utilizando la técnica de cultivos duales.7 En cajas Petri con medio PDA se procedió a sembrar discos de Alternaria spp. de 5mm de diámetro de manera equidistante con ayuda de una plantilla, se inoculó B. subtilis en la caja con Alternaria spp. hundiendo el porta objetos en medio de la caja petri y se incubó a 24ºC.
Se utilizó un control positivo (cepa ATCC 6633 B. subtillis subsp. spezizenii) y un testigo solo con Alternaria spp. En las pruebas duales se evaluó el crecimiento de B. subtilis a los siete días en cajas de Petri, así como el crecimiento de Alternaria spp.6
Escala de Bell Competencia por sustrato
Para la evaluación de la capacidad antagónica se midió el tiempo que tardó en tener contacto el antagonista y el patógeno; durante 7 días cada 24 h se midió el crecimiento radial del antagonista y el patógeno; como referencia se utilizó la escala de Bell indicada en la tabla 1.
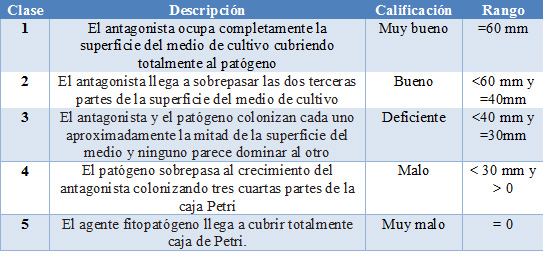
Tabla 1. Escala de Bell para evaluar la competencia por sustrato in vitro16
Porcentaje de inhibición del crecimiento (PIC)
Se evaluó a los siete días utilizando la fórmula propuesta por Skidmore & Dickinson.7
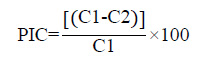
C1= Crecimiento radial del testigo
C2= crecimiento radial del fitopatógeno en los tratamientos de cultivo dual.
Análisis estadístico
Se evaluó las cepas encontradas con 14 repeticiones en un DCA, la evaluación se realizó a través de un ADEVA de una vía y pruebas Post Hoc de Tukey 5%, en el programa Infostat versión 2013.
RESULTADOS
Obtención Alternaria spp.
El hongo perteneciente a la provincia de Imbabura presenta características macroscópicas similares a las descritas por Arias y Ramirez4 para el género Alternaria spp. Se determinó el resultado en la clave de la siguiente manera Clave IV: CC-Q-RR-UUU que corresponde Alternaria spp., confirmándose la identidad del hongo como Alternaria spp.
Obtención de Bacillus subtilis
Se obtuvieron un total de 28 cepas aisladas candidatas de B. subtilis, la caracterización microscópica de los 28 microorganismos asilados se basó en las siguientes características: Bacilos Gram positivos de aproximadamente 0,8 mm de diámetro por 2 a 3 mm de largo con bordes redondeados, B. subtilis presentan esporas esféricas y centrales que no deforman el bacilo, de esta manera se obtuvo 14 microorganismos aislados, cuyas caracteristicas que coincidieron con las definidas por Realpe et al.8
Pruebas bioquímicas API para Bacillus subtilis
La tabla 2 muestra la confirmación de la identidad mediante pruebas macroscópicas, microscópicas y bioquímicas, esta última mediante la prueba Microgen Bacillus-ID, encontrándose 7 cepas de B. subtilis con ayuda del software Microgen Identification System.

Tabla 2. Cepas pertenecientes al género Bacillus subtilis aisladas de tres provincias productoras de brócoli en Ecuador.
Pruebas de Antagonismo
Análisis Estadístico
En el ADEVA existió diferencia en al menos uno de los tratamientos en el crecimiento de B. subtilis con un (p< 0,001). Se diferenciaron cinco rangos de significación para el crecimiento de B. subtilis frente a Alternaria spp. como se indica en la Figura 1. En el rango E se ubica la cepa ATCC 6633 con un crecimiento promedio de 17,60 mm; seguido de la cepa AB-4 en el rango DE con un crecimiento promedio de 13,78 mm; valores de crecimiento altos en comparación con el resto de cepas, indicando que AB-4 y ATCC 6633 pueden desarrollarse en presencia de Alternaria spp.
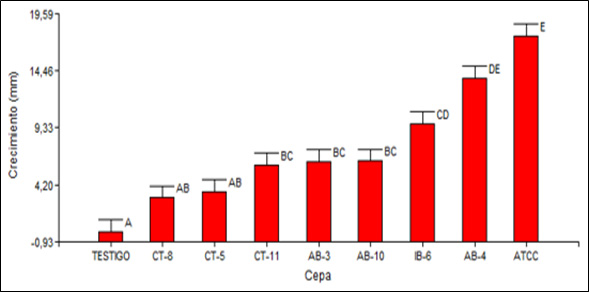
Figura 1. Prueba Tukey 5% para el crecimiento en milímetros de las diferentes cepas de B. subtilis en pruebas duales con Alternaria spp.
De igual forma se establecieron diferencias significativas en el crecimiento de Alternaria spp. con un (p<0,001), se diferenciaron seis rangos de significación mostrados en la Figura 2.
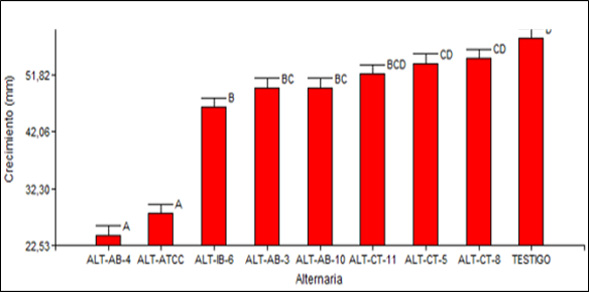
Figura 2. Prueba Tukey 5% para el crecimiento en milímetros de Alternaria spp. en pruebas duales con. B. subtilis
En el rango A se ubicaron los tratamientos que contenían las cepas AB-4 y ATCC 6633 con valores promedio de crecimiento de Alternaria spp bajos en comparación al resto de tratamientos, indicándonos que existió actividad antagónica de B. subtilis.
Escala de Bell competencia por sustrato
En la tabla 3 se muestra los valores obtenidos para la Escala de Bell.
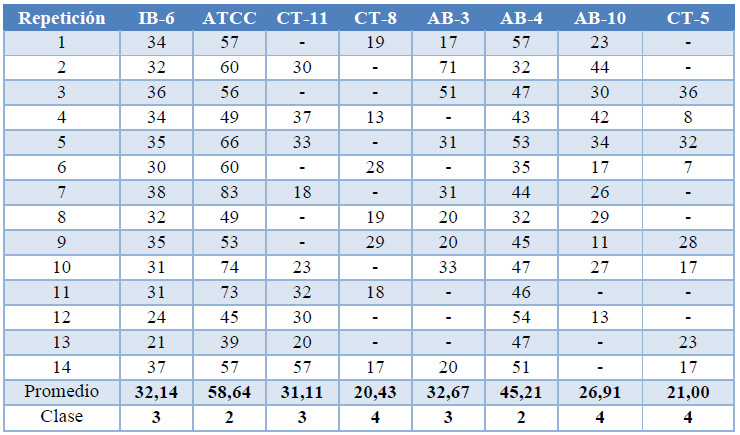
Tabla 3. Valores crecimiento (mm) al séptimo día de Bacillus subtilis y evaluación en la Escala de Bell.
Según la escala de Bell la cepa AB-4 con un valor promedio de 45,21 y la cepa ATCC 6633 con un valor promedio de 58,64, se ubicaron en la clase 2 considerada como buena dentro de la escala para antagonismo.
Porcentaje de inhibición del crecimiento (PIC)
La cepa AB-4 presentó el valor más alto de inhibición de crecimiento con un PIC de 58%, seguido por la cepa ATCC 6633 que presentó un PIC de 52%, valores superiores al resto de cepas como se aprecia en la Tabla 4, también se observan diferencias significativas entre las diferentes cepas.
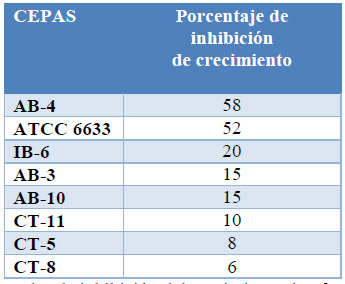
Tabla 4. Valores porcentuales de inhibición del crecimiento de Alternaria spp. por cepas de Bacillus subtilis.
DISCUSIÓN
Se demuestra así que la cepa B. subtilis presentan actividad antagónica por competencia, puesto que este género de bacterias al ser también promotoras de crecimiento vegetal compite por la adquisición de nutrientes, siendo el mecanismo mediante el cual actúa B. subtilis, es competir por uno de los nutrientes esenciales en desarrollo de cualquier organismo como lo es el hierro (Fe3+). Tejera et al. 9
Estudios de esta bacteria plantean que los sideróforos producidos por B. subtilis tienen mayor afinidad por los compuestos de hierro.10 Por lo tanto, el agente patógeno que compite con B. subtilis por el hierro de manera ineficiente, es un patógeno cuyo desarrollo se ve afectado pudiendo ser en este caso el de Alternaria spp., además de que la deficiencia de este elemento afecta a su sistema enzimático11 impidiéndole sintetizar micotoxinas necesaria para ejercer su acción patogénica.
La capacidad antagónica de B. subtilis radica principalmente en su capacidad de producir distintos metabolitos con capacidad antifúngica y antibacteriana, dentro del grupo de metabolitos antifúngicos se encuentran las surfactinas, fengicinas e iturinas; además de una gran variedad de enzimas líticas entre las cuales se destacan lipasas, proteasas y β glucanasas.9, 12,13
Sin embargo, el mecanismo de antibiosis utilizado por B. subtilis involucra la interacción de más de uno de estos metabolitos para ejecer su actividad fungicida biocontroladora, ademas de la especificidad que poseea contra el patógeno. La familia de las surfactinas no son substancias con actividad fungicida, estas muestran actividad antifúngica en sinergismo con iturina A; a diferencia de las iturinas, ya que estas muestran actividad antifúngica e inhibitoria contra una gran variedad de patógenos, las fengicinas presentan actividad fungitóxica fuerte, especialmente contra hongos filamentosos.3,13 Hecho que explica el bajo valor de PIC que obtuvieron el resto de cepas, es por ello que resulta razonable pensar que la cepa AB-4 y ATCC 6633 presentaron mayor concentración, mejor interacción y especificidad de los metabolitos secretados contra el patógeno a diferencia del resto de cepas que a pesar de haber secretado estos metabolitos no mostraron interacción entre estos o no tuvieron afinidad contra el patógeno.
La variabilidad de la acción antagonista entre las diferentes cepas se debe a que esta actividad es muy cambiante entre microorganismos, ya que estos se expresan dependiendo de las condiciones ambientales en las que se encuentre, entre otros factores. 14
CONCLUSIONES
Las cepas aisladas de B. subtilis mostraron capacidad antagónica en las pruebas in vitro realizadas contra el hongo fitopatógeno Alternaria spp., ya que el crecimiento del patógeno Alternaria spp. se vio afectado significativamente con un PIC de 58% y 52%, demostrando que la B. subtilis posee potencial como controlador biológico contra el hongo fitopatógeno Alternaria spp.
Se determinó que el tratamiento AB-4 (cepa nativa) es la mejor cepa con capacidad antagónica ya que obtuvo los mejores resultados, ubicándose en Clase 2 según la escala de Bell y en el rango A de la prueba de Tukey al 5%, incluso llegando a superar al control positivo que fue la cepa ATCC 6633
LITERATURA CITADA
1. Fraire M., & Nieto D. (2010). Alternaria tenuissima, A. alternata y Fusarium oxysporum Hongos Causantes de la Pudrición del Florete de Brócoli. Retrieved Enero 2016, from http://www.scielo.org.mx/scielo.php?script=sci_arttext&pid=S0185-33092010000100003&lng=es&tlng=es.
2. Cadena D. (2011). Efecto de tres dosis en tres épocas de aplicación de pyraclostrobin (COMET®) en el control de la mancha. (Tesis, Universidad Técnica de Cotopaxi). Retrieved Febrero 2016, from http://repositorio.utc.edu.ec/bitstream/27000/775/1/T-UTC-0598
3. Yánez V. (2012). Potencial de la cepa CPA-8 de Bacillus subtilis como agente de biocontrol de enfermedades de postcosecha de fruta. Lleida: (Tesis, Universitat de Lleida). Retrieved from http://www.tesisenred.net/bitstream/handle/10803/80456/Tvrym1de1.pdf?sequence=1
4. Arias J., & Ramirez A. (2008). Elaboración de un atlas para la descripción macroscópica y microscópica de hongos fitopatógenos de interés en especies de flores de corte cultivadas en la sabana de Bogotá. Quito: (Tesis, Pontificia Universidad Javeriana). Retrieved Noviembre 2015, from http://www.javeriana.edu.co/biblos/tesis/ciencias/tesis223
5. Gepp V. (2009). Curso de Fitopatología. Retrieved Diciembre 2015, from http://www.pv.fagro.edu.uy/fitopato/cursos/fitopato/practicas/Clave_hongos.pdf
6. Acurio R. (2007). Aislamiento, caracterización y pruebas de eficiencia in vitro y bajo invernadero de Cepas de Bacillus subtilis para Control de Phytophthora infestans con el fin de establecer un banco de microorganismos benéficos. Quito: Tesis. Retrieved 2015 Diciembre, from http://repositorio.espe.edu.ec/handle/21000/2564
7. Skidmore A., & Dickinson, C. (1976). Colony interactions and hyphal interference between Septoria Nodorum and phylloplane fungi. Transactions of the British Mycological Society, 57-64. Retrieved Enero 2016, from http://www.sciencedirect.com/science/article/pii/S0007153676800927
8. Realpe M. E., Hernández, C. A., & Agudelo, C. I. (2002). Revista biomedica. Retrieved Febrero 2016, from Especies del género Bacillus:Especies del género Bacillus: morfología macroscópica y microscópica: http://www.revistabiomedica.org
9. Tejera B., Rojas M., & Heydrich M. (2011, Diciembre). Potencialidades del género Bacillus en la promoción del crecimiento vegetal y el control biológico de hongos fitopatógenos. Revista CENIC Ciencias Biológicas, 131-138. Retrieved Febrero 2016, from http://www.redalyc.org/articulo.oa?id=181222321004
10. Robles A. (2011). Evaluación de microorganismos antagonistas y sustancias naturales en el control de enfermedades foliares en tomate. 20-21. Cuba: Universidad Central Marta Abreu de las Villas. Retrieved Diciembre 2015, from http://repositorio.educacionsuperior.gob.ec/handle/28000/335
11. Benavides A. (2008). Fisiología, Absorción y Asimilación de Hierro en las Plantas. Retrieved Enero 2016, from http://exa.unne.edu.ar/biologia/fisiologia.vegetal/hierro_en_plantas.pdf
12. Layton C., Maldonado E., Monroy L., Corrales L., & Sánchez L. (2011). Bacillus spp.; perspectiva de su efecto biocontrolador mediante antibiosis en cultivos afectados por fitopatógenos. 177-187. Bogotá, Colombia: Universidad Colegio Mayor de Cundinamarca. Retrieved Enero 2016, from http://www.unicolmayor.edu.co/invest_nova/NOVA/NOVA16_ARTREVIS1_BACILLUS.pdf
13. Yesid A., & Sánchez L. (2012). Determinación de metabolitos secundarios a partir de Bacillus subtilis efecto biocontrolador sobre Fusarium sp. Retrieved Septiembre 2015, from http://www.scielo.org.co/scielo.php?script=sci_arttext&pid=S1794-24702012000200002
14. Calvo J., Rivera G., Orozco S., & Orozco R. (2012). Agronomía Mesoamericana. 225-231. doi:http://dx.doi.org/10.15517/am.v23i2.6481
Recibido 19 diciembre 2017
Aprobado 20 febrero 2018
Acurio, R.1, Ñacato, C. Valencia, M.
1Grupo de Investigación BIOARN. Universidad Politécnica Salesiana. Quito-Ecuador.
Autor de correspondencia: [email protected]
