2023.08.02.38
Files > Volume 8 > Vol 8 No 2 2023
Obtención de un colorante natural a partir Tropaeolum tuberosum Ruíz & Pavón para su aplicación en yogur
Obtaining a natural dye from Tropaeolum tuberosum Ruíz & Pavón for application in yogurt
Elton Mendoza1, Jhunior Marcía 1, 2* , Roberto Chuquilín-Goicochea 3
, Roberto Chuquilín-Goicochea 3 , Juan López 1, Franklin Areche 4
, Juan López 1, Franklin Areche 4 , Jenny Ruíz 5, Alejandro Herrera 5
, Jenny Ruíz 5, Alejandro Herrera 5
1 Facultad de Ciencias Tecnológicas, Universidad Nacional de Agricultura, Honduras; [email protected]
2 Dirección de Investigación y Posgrado, Universidad Nacional de Agricultura, Honduras; [email protected].
3 Facultad de Ingeniería, Universidad Privada del Norte, Perú; [email protected].
4 Departamento de Agroindustria, Universidad Nacional de Huancavelica, Perú;
5 Departamento de Ingeniería Agroindustrial, Universidad Nacional Autónoma de Honduras (UNAH), Tegucigalpa, Honduras; [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.02.38
El objetivo de este estudio fue obtener un colorante natural mediante extracción asistida por ultrasonido a partir de Tropaeolum tuberosum Ruíz & Pavón para aplicarlo en yogur. Se utilizó un diseño Box-Behnken para optimizar los parámetros de extracción mediante metodología de superficie de respuesta. Las variables de estudio para la extracción fueron temperatura, concentración de etanol y tiempo; mientras que las variables respuesta fueron contenido total de antocianinas y polifenoles; y se determinaron por el método de pH diferencial y Folin-Ciocalteu, respectivamente. Las condiciones óptimas de extracción fueron: temperatura de 48 °C; concentración de etanol de 33,93% y 20 minutos. El rendimiento de antocianinas y polifenoles estuvo en un rango de 347,34 a 419,92 mg eq. cianidina-3-glucósido /L y 63,68 a 105,09 mg/ 100 g, respectivamente. El extracto optimizado, presentó una capacidad antioxidante de 0,275 ± 0,003 mM Trolox eq. /mL, determinado por el método DPPH. Se formularon 3 yogur (2, 4 y 6% v, de extracto) y un testigo (0%v), los cuales fueron sometidos a evaluación sensorial para determinar la aceptabilidad con una escala hedónica de 9 puntos y 60 panelistas. El yogur con 6% de colorante presentó mayor aceptabilidad frente a las demás muestras de yogur coloreado. El extracto obtenido puede emplearse como colorante natural en el yogur, y como alternativa a los colorantes sintéticos, para desarrollar alimentos potencialmente funcionales debido su contenido de compuestos bioactivos.
Palabras clave: Antocianinas, polifenoles, extracción, ultrasonido, antioxidante, extracto, optimización.
ABSTRACT
This study aimed to obtain a natural dye through ultrasound-assisted extraction from Tropaeolum tuberosum Ruíz & Pavón for application in yogurt. A Box-Behnken design optimized the extraction parameters using response surface methodology. The study variables for extraction were temperature, ethanol concentration, and time. In contrast, the response variables were the total content of anthocyanins and polyphenols, determined by the differential pH and Folin-Ciocalteu methods, respectively. The optimal extraction conditions were a temperature of 48 °C, ethanol concentration of 33.93%, and 20 minutes. The yield of anthocyanins and polyphenols ranged from 347.34 to 419.92 mg eq. cyanidin-3-glucoside/L and from 63.68 to 105.09 mg/100 g, respectively. The optimized extract exhibited an antioxidant capacity of 0.275 ± 0.003 mM Trolox eq./mL, determined by the DPPH method. Three yogurt formulations (2%, 4%, and 6% v/v of extract) and control (0% v/v) were prepared and subjected to sensory evaluation for acceptability using a 9-point hedonic scale with 60 panelists. The yogurt with 6% showed higher acceptability than other colored yogurt samples. The obtained extract can be used as a natural dye in yogurt, serving alternative to synthetic colorants, to develop potentially functional foods due to their bioactive compound content.
Keywords: Anthocyanins, polyphenols, extraction, ultrasound, antioxidant, extract, optimization.
INTRODUCCION
Actualmente el uso de colorantes sintéticos en alimentos es cuestionado 1 debido a que algunos colorantes como la tartrazina y la carmoisina han demostrado ser tóxicos para los humanos y son atribuidos a insuficiencia renal y hepatotoxicidad 2,3 . La preocupación de los consumidores acerca de la seguridad de los colorantes artificiales y la preferencia por el uso de colorantes naturales4 incrementó desde la publicación de un artículo en la revista The Lancet en 2007 que asociaba el consumo de aditivos presentes comúnmente en alimentos infantiles con el incremento de la hiperactividad en los niños.5 Además de ser más inocuos que sus pares sintéticos, algunos otorgan al producto distintos tipos de funcionalidad6 . Tal es el caso de las antocianinas, compuestos bioactivos perteneciente a la clase de los flavonoides que está presente en la nutrición humana a través de alimentos de origen vegetal1 . Su relevancia como colorantes naturales ha ido en aumento,7 gracias a sus propiedades antioxidantes y antimicrobianas 8 . Además, ciertas plantas como los tubérculos son fuente de antocianinas 7 .
La mashua negra (Tropaeolum tuberosum Ruíz & Pavón) es un tubérculo andino y junto a la papa, olluco y oca, son los tubérculos con mayor relevancia en Perú, y es una potencial fuente de antocianias9,10 . Estudios con mashua morada han demostrado un mayor contenido de antocianinas con respecto a tubérculos como la oca y la papa nativas, que incluyen antocianinas, glucosinolatos y compuestos fenólicos11 . Asimismo, la mashua cocida al vapor aporta cantidades considerables de polifenoles ofreciendo la posibilidad de modular la absorción de azúcares y el estrés oxidativo12 . Sumado a lo anterior, la mashua morada y mashua negra han demostrado tener una mayor capacidad antioxidante, en comparación con el resto de los tubérculos de Perú13 .
Por otro lado, la eficiencia de extracción de estos compuestos está muy influenciada por varios factores, incluidas sus condiciones de almacenamiento, la naturaleza química, especialmente las condiciones de extracción, así como el uso de métodos de extracción14 . La extracción asistida por ultrasonido es un método que ofrece varias ventajas en comparación con los métodos tradicionales. Entre estas ventajas se incluyen una menor cantidad de solvente requerido, un tiempo de extracción más corto y una temperatura de operación más baja, lo que resulta en una tasa de extracción más alta15 .
Por ello, el objetivo de este trabajo fue la extracción asistida con ultrasonido de antocianinas a partir de la mashua negra (Tropaeolum tuberosum Ruíz & Pavón) para aplicarlo en yogur como colorante natural a diferentes concentraciones. Para su logro, se determinó composición química proximal de mashua negra deshidratada (Tropaeolum tuberosum Ruíz & Pavón) de la cual se obtuvo un extracto. Se optimizó la extracción asistida por ultrasonido para la obtención del colorante mediante el análisis de maximización de multirrespuesta empleando Stat-Ease 360, tomando como variables independientes la temperatura, tiempo de sonicación y concentración de etanol. Se tomó como variables de respuesta el contenido de antocianinas y polifenoles totales. Con el colorante extraído se elaboraron tres formulaciones de yogur batido y se evaluaron frente a un control mediante una prueba sensorial afectiva por parte del consumidor.
MATERIALES Y METODOS
Materiales y reactivos
El tubérculo de mashua negra se compró en el mercado de abastos del distrito y provincia de Acobamba, departamento de Huancavelica, Perú. Los reactivos utilizados se adquirieron en la empresa MERCK: Etanol 96%, agua destilada, Ácido Clorhídrico al 37%, Cloruro de Potasio, Acetato de Sodio, Folin-Ciocalteau y Carbonato de Sodio al 7,5%.
Preparación de la muestra de mashua pulverizada y solución extractora
La mashua fue lavada manualmente con agua potable durante 5 minutos. Luego se escaldó con agua en ebullición por 2 minutos para inactivar las enzimas. Posteriormente se cortó manualmente en rodajas de 2 mm de espesor y se deshidrató a una temperatura de 50 °C por 12 horas siguiendo la metodología de Celis16 y se determinó la humedad por el método de secado con estufa (BINDER ED53, Alemania). Después las rodajas secas se pulverizaron con ayuda de un molino y la muestra se almacenó a temperatura ambiente en una bolsa con cierre hermético (bolsa ziploc). Para el solvente se elaboraron tres soluciones extractoras de agua destilada y etanol (80:20; 70:30; 60:40; v/v) y se acidificaron agregando 100µl de ácido clorhídrico al 37%.
Extracción Asistida por Ultrasonido (EAU)
Se prepararon 15 tratamientos por triplicado en fiolas de 10 ml en las cuales el polvo de mashua se homogenizó con soluciones extractoras de 3 diferentes concentraciones de etanol, siendo la proporción de sólido a disolvente (1:20 p/v). Posteriormente cada muestra se colocó en un tubo para centrífuga de 15 ml, luego se rotuló con el número de tratamiento y se almacenaron a 4 °C. Después se llevaron a lixiviación en un limpiador ultrasónico de 40 kHz (BRANSON 5510, Ohio, Estados Unidos) a diferentes temperaturas y tiempo de extracción. Posteriormente se separó el extracto utilizando una centrifugadora (Centurion Scientific Limited, Stoughton, Reino Unido) a 5000 rpm durante 10 minutos a temperatura de 17 °C. Los sobrenadantes se filtraron utilizando una bomba de vacío y papel filtro, las réplicas de cada tratamiento se combinaron en un matraz volumétrico de 50 ml y finalmente se almacenaron a 4 °C.
Una vez ya obtenidos los parámetros óptimos de extracción con la proporción (1:20 p/v) se homogenizó en un matraz volumétrico de 1000 ml, 50 g de polvo de mashua en 1000 ml de solución extractora óptima y se dejó en maceración por 5 horas. Posteriormente, se separó en tubos para centrífuga de 15 ml en proporciones de 12 ml y se llevó a ultrasonido por el tiempo y temperatura óptima. Además, se centrifugó a 5000 rpm durante 10 minutos. El extracto se filtró al vacío en un matraz Kitazato usando un embudo Buchner y papel filtro N° 40. Luego se concentró a 65 °C utilizando un rotavapor (BIOBASE RE-301, Shandong, China) a vacío y 70 rpm. Finalmente, el extracto se almacenó a 4 °C durante 24 horas para su posterior aplicación al yogur.
Formulación de yogur batido
La leche utilizada para la elaboración del yogur fue previamente preparada siguiendo la metodología de Ruiz17. Posteriormente, se adicionó el cultivo (marca SACCO, Cadorago, Italia) y se llevó a la incubadora (Venticell, Múnich, Alemania) a una temperatura de 41 °C durante 5 horas. Luego se elaboraron las 3 formulaciones de yogur incorporando el extracto mediante agitación manual hasta su completa disolución a concentraciones de 2, 4 y 6% más el control (yogur con 0% de extracto).
Evaluación sensorial
La prueba de aceptación se realizó con 60 juicios, con habitantes de la provincia de Acobamba, Huancavelica (57 % hombres y 43 %, mujeres). Con edades comprendidas entre 18 y 39 años (85%) y entre 40 y 59 años (15%). Se consideró a los consumidores habituales de mashua negra como jueces. La evaluación sensorial se llevó a cabo en el laboratorio sensorial de la Universidad Nacional De Huancavelica en cabinas de paneles individuales. A cada consumidor se le entregaron las 3 formulaciones (2%, 4% y 6%) más el control en un orden de servido establecido por permutaciones preliminares. Los atributos de color, sabor, aroma, consistencia y aceptabilidad general se evaluaron en una escala hedónica de 9 puntos. Se instruyó a los participantes para que enjuagaran con agua su boca para limpiar sus paladares después de probar cada muestra de yogur.
Análisis de laboratorio
Análisis proximal de Tropaeolum tuberosum Ruíz & Pavón pulverizada
El análisis proximal se realizó en el Laboratorio de Servicios de Análisis Químico de la Universidad Nacional Agraria La Molina, Perú. A partir de la normativa de la AOAC Internacional del año 2012 La 19ª edición, que incluye, contenido de humedad (2012.925.10), cenizas totales (2012.923.03), grasa (2012.922.06) y proteína cruda (2012.920.87)18 .
Determinación antocianinas totales
Se utilizó el método de pH diferencial19 . Se prepararon dos soluciones buffer: cloruro de potasio de pH 1,0 (0,025 M) y acetato de sodio de pH 4,5 (0,4 M) en fiolas de 50ml, se recubrieron con hojas de aluminio para impedir la entrada de luz y se almacenaron a 4°C. El pH de ambas soluciones se ajustó adicionando HCl al 37% y se medía con un medidor portátil de pH (Hi991002, Bogotá, Colombia) antes de ser utilizado. Las muestras de extracto se diluyeron (1:80 v/v) con cada solución tampón (el factor de dilución se determinó en función de la absorbancia que no sobrepase de 0,7 ni menos de 0nm). Luego se midió la absorbancia para el pH 1 a 510 nm y 700 nm utilizando un espectrofotómetro (Zuzi 4251/50, Beriáin, España) Así mismo, se determinó la absorbancia para el de pH 4,5 a 510 nm y 700 nm y cada lectura se realizó por triplicado. Con estas lecturas se calculó la absorbancia a partir de:
A= (A510 nm - A 700 nm) pH=1 -(A510 nm - A700 nm) pH=4,5 (1)
Una vez calculada la absorbancia, se calculó la cantidad de antocianinas monomérica:
Antocianina manomérica (mg/L) = (A x MW x DF x 1000) / (ε x 1) (2)
Donde:
MW = peso molecular (449,2)
ε = Coeficiente de extinción molar (26900)
DF = factor de dilución (80 para este caso)
A = Absorbancia de la muestra calculada
Debido a que la muestra es desconocida se expresó la concentración final del pigmento como Cianidina -3 – glucósido
Los resultados se expresaron como mg equivalentes de cianidin-3-glucósido / g de peso fresco.
Determinación de polifenoles totales
El contenido fenólico total se determinó por el método espectrofotométrico con el reactivo Folin-Ciocalteu20 . Se tomó la muestra de extracto de cada tratamiento y se diluyó a 1:80 v/v puesto que, el extracto tenía un color muy intenso. Se midió por duplicado la absorbancia a 765 nm. Se calculó la cantidad de polifenoles totales mediante la ecuación:
Polifenoles totales (µg/g) = Ā / (m x D) (3)
Donde:
Ā = absorbancia promedio
m = pendiente de la curva de calibración (mL/ µg)
D = Dilución de extracto del polvo de mashua negra (0,5g/ml en p/v)
Los resultados se expresaron como µg equivalentes de ácido gálico / g de peso fresco.
Determinación de capacidad antioxidante del extracto óptimo
La actividad antioxidante se desarrolló en el laboratorio del Instituto de Biotecnología de la Universidad Nacional Agraria La Molina, mediante el método adaptado de Brand-Williams21 . Se preparó en un matraz completamente cubierto con papel aluminio, una solución del radical libre 1,1-difenil-2-picril-hidrazilo (DPPH) subsiguientemente se transfirió a un frasco cubierto con papel aluminio para evitar su rápida degradación22. El procedimiento consistió en la medida de la absorbancia del radical DPPH 100 μM (3,9 mL) disuelto en metanol al 80 %. Se añadió 0,1 mL de la muestra o estándar, la mezcla se homogenizó cuidadosamente, y se mantuvo en la oscuridad durante 30 minutos. Las medidas de absorbancia a 515 ηm se realizaron antes de añadir la muestra (A0) y pasados los 30 y 60 minutos (Af). La concentración de DPPH en el medio de reacción se calculó a partir de una curva de calibración obtenida por regresión lineal. Los resultados se expresaron en actividad antioxidante equivalente a Trolox (TEAC). Estos ensayos se realizaron por triplicado (n=3). Para medir el % de inhibición, se utilizó la ecuación 122.
Inhibición (%) = 1((Abs muestra – Abs blanco) / (Abs control -Abs blanco)) x 100 (4)
Diseño experimental
Se empleó el diseño de Box-Behnken con tres niveles y tres factores, y se analizó con metodología de superficie respuesta. Las variables independientes fueron temperatura, tiempo de sonicación y concentración de etanol. Se tomó como variables de respuesta el contenido de antocianinas y polifenoles totales.

Tabla 1. Diseño Box-Behnken para la extracción asistida.
Análisis estadístico
La optimización se realizó con el análisis de maximización de multirrespuesta empleando Stat-Ease 360 versión de prueba (Serie N° 6388-2255-1949-EVAL). Los resultados de evaluación sensorial se analizaron en primer lugar el cumplimiento de los tres supuestos de: normalidad (Prueba de Anderson-Darling), homoscedasticidad, e independencia de residuos. Cuando no se cumplió con uno de los supuestos se aplicó una prueba no paramétrica de Friedman para determinar si existen diferencias significativas entre los tratamientos.
Análisis proximal de mashua negra pulverizada
En la Tabla 2 se puede observar que, la harina de mashua negra que se utilizó para la extracción del colorante muestra una humedad del 7%, valor que fue menor 15% como indica la norma técnica para harina de tubérculo de Perú23 .

Tabla 2. Composición química de la mashua negra
Evaluación de la extracción de antocianinas y polifenoles totales
El contenido de antocianinas osciló entre 347,34 a 419,92 mg/L. Por otro lado, el contenido de polifenoles se mostró en un rango de 63,68 a 105,09 mg/ 100 g. El contenido de antocianinas totales está expresado en mg eq, cianidina-3-glucósido/ L de extracto, y; el contenido de polifenoles totales está expresado en mg eq. acido gálico/ 100 g extracto (Tabla 3). En la Tabla 4 se observa el análisis de varianza para el modelo cuadrático y se observó que, la variable concentración de etanol tuvo un efecto significativo en el contenido de polifenoles totales (p < 0,05), por otro lado, la interacción de la concentración de etanol con la temperatura y tiempo de sonicación tuvieron efecto significativo en el contenido de antocianinas totales (p < 0,05).

Tabla 3. Rendimiento de antocianinas y polifenoles totales de cada tratamiento de extracción del colorante de Tropaeolum tuberosum Ruiz & Pavón
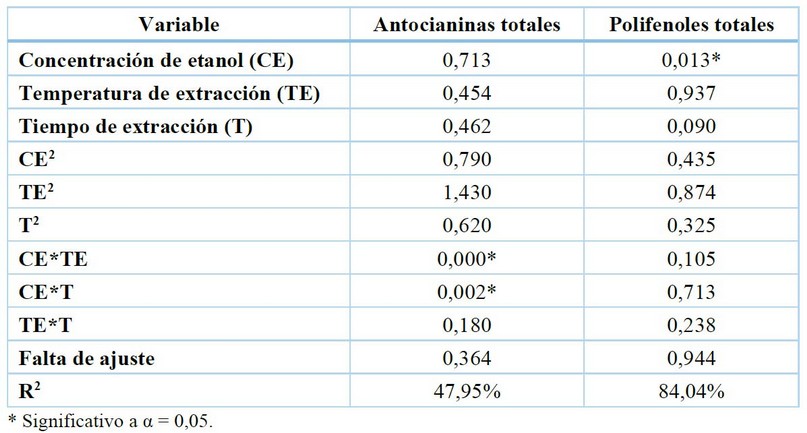
Tabla 4. Análisis de varianza del modelo cuadrático Box-Behnken
En la Figura 1 se confirma la falta de ajuste no significativa (p > 0,05) pues para la variable denominada contenido de antocianinas se observa una superficie completamente plana, y en cuanto al contenido de polifenoles se observa una correspondencia de las variables tiempo temperatura y concentración.

Figura 1. Superficie respuesta para la extracción asistida
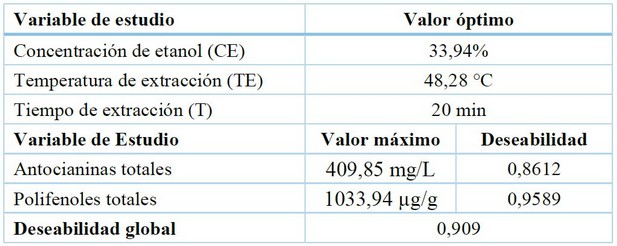
Tabla 5. Optimización multirrespuesta.
Según los análisis de maximización de respuesta (contenido de antocianinas y polifenoles totales) realizados a los factores concentración de etanol, temperatura y tiempo, se determinó que las condiciones óptimas de obtención del colorante de Tropaeolum tuberosum Ruíz & Pavón, son: 33,94 % de concentración etanol, 48 °C de temperatura y 20 minutos de tiempo de sonicación para un resultado teórico de antocianinas y polifenoles totales de 409,85 mg/L y 1033,94 µg/g respectivamente. La deseabilidad fue aceptable (0,909).
Capacidad antioxidante del extracto óptimo
La capacidad antioxidante del colorante extraído en condiciones óptimas fue de 0,275 ± 0,003 mM Trolox eq. /mL. Gonzáles-Torre24 encontró una capacidad antioxidante de 2221,02 ± 2,0 µM Trolox eq. / 100 g, en la mashua fresca de la misma zona de estudio, lo que significa que el proceso de extracción originó pérdida en el contenido de antocianinas. Debido a que este estudio utilizó el secado con lecho fluidizado; se puede afirmar que, el secado afectó el contenido de antocianinas, como otros estudios lo han reportado25 .
Resultados de evaluación sensorial
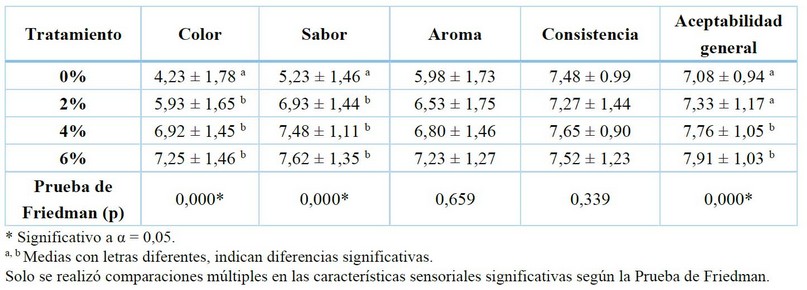
Tabla 6. Análisis de media y desviación estándar de la aceptación de las características evaluadas del yogur coloreado y comparación de medias de los atributos sensoriales de yogur coloreado entre tratamientos.
De acuerdo con estos resultados, la muestra de yogur coloreado con 6% de extracto de mashua negra tuvo el promedio más alto en todos los atributos sensoriales excepto en la consistencia. Una mayor concentración de extracto (6%) de Tropaeolum tuberosum Ruíz & Pavón dio un color más atractivo al yogur con respecto a las otras muestras. Los atributos de color, sabor y aceptabilidad general presentaron significancia (p < 0,05), esto se debe a que, el extracto tuvo un color morado muy pronunciado y conservó el sabor característico de la mashua. Los consumidores actuales demandan tanto materias primas como productos intermedios o finales, con mejores y variadas características nutricionales percibidos como naturales y, si posible, que contribuyan a su salud y bienestar26 .
En resumen, el tratamiento 2 y 3 que contienen 4% y 6% de extracto de mashua negra respectivamente, fueron los más aceptados por los consumidores.
Los resultados del análisis proximal de la mashua negra determinados (Tabla 2), en cuanto a la cantidad de humedad, proteínas, grasas, ceniza; y carbohidratos, se asemejan a los valores reportados por Cuya27 y Taipe28 . La humedad reportada en este estudio garantiza estabilidad en el almacenamiento de la harina debido que el porcentaje de humedad fue menor a lo que indica la norma técnica para harina de tubérculo de Perú23 .
En la Tabla 3 se muestra el rendimiento de antocianinas que osciló entre 347,34 a 419,92 mg/L. valores mayores a los propuestos por Velásquez et al., (2020)29. Por otro lado, el contenido de polifenoles se mostró en un rango de 63,68 a 105,09 mg/ 100 g. En otra investigación con Rubia sylvatica en la que se tomaron las mismas variables independientes, se encontró que estas tres variables de estudio tuvieron efecto significativo en el contenido de antocianinas30 , lo que resulta contrario a lo que se ha observado con mashua. Estos resultados pueden atribuirse a que el ultrasonido facilita la penetración del solvente en las muestras, combinado con la destrucción de las paredes celulares ocasionada por la energía ultrasónica, por lo tanto, mejora la disolución de antocianinas y compuestos fenólicos en el solvente 31,32 . Otra variable que tomar en cuenta es la matriz de la fuente donde se extraen los pigmentos, que de acuerdo con su mayor resistencia debería ser tratada con mayor severidad 33 . Por otro lado, en ambas variables respuesta no se observó una falta de ajuste significativa (p > 0,05), lo que significa que no hay una curvatura en la superficie respuesta. El coeficiente de determinación de los modelos cuadráticos fue diferente, pero el que asegura una buena predictibilidad es el modelo para el contenido de polifenoles totales puesto que fue mayor a 70%34 (R2 = 84,04%).
El contenido de polifenoles en este estudio se presentó en menor cantidad a lo reportado por Gonzáles-Torre24 . Esto se atribuye a la variable de concentración de etanol que tuvo un efecto significativo en el contenido de polifenoles totales (p < 0,05). En un estudio con rosa de Pingyin se menciona que a medida que la concentración de etanol aumenta del 30 % al 50 %, el contenido de polifenoles totales aumenta en un 15 %. Pero cuando la concentración es superior al 50%, el contenido de polifenoles disminuye35 . Por lo que se recomienda trabajar con concentraciones de etanol por encima de 30%.
El colorante que se obtuvo a partir de Tropaeolum tuberosum Ruiz & Pavón aplicado al yogur fue aceptado por los consumidores, siendo el yogur con proporciones de 6% y 4% de extracto los más aceptados, dichas formulaciones son estadísticamente iguales. Esto puede deberse a que presentan un color más atractivo. Por lo cual el extracto de mashua negra, es una potencial alternativa como colorante natural al color morado que se utiliza en la industria alimentaria.
El colorante que se obtuvo a partir de Tropaeolum tuberosum Ruíz & Pavón aplicado al yogur fue aceptado por los consumidores, siendo el yogur con proporciones de 4% y 6% de extracto los más aceptados, dichas formulaciones son estadísticamente iguales. Por lo cual el extracto de mashua negra, es una potencial alternativa como colorante natural al color morado que se utiliza en la industria alimentaria. Es necesario seguir generando nuevos conocimientos con relación al aprovechamiento de la mashua negra, principalmente con relación al contenido de fenoles y la identificación de estos compuestos bioactivos, empleando nuevas metodologías de extracción como fluidos presurizados y su cuantificación a partir de Cromatografía Líquida de Alta Resolución acoplada a espectrometría de masas (HPLC-MS, por sus siglas en inglés). En cuanto al yogur coloreado, es necesario realizar un perfil sensorial más completo mediante estudio de intención de compra.
1. Salinas Moreno Y, Rubio Hernández D, Díaz Velázquez A. Extracción y uso de pigmentos del grano de maíz (Zea mays L.) como colorantes en yogur. Arch Latinoam Nutr. 2005;55(3):293–8.
2. Reza MSA, Hasan MM, Kamruzzaman M, Hossain MI, Zubair MA, Bari L, Abedin MZ, Reza MA, Khalid-Bin-Ferdaus KM, Haque KMF, Islam K, Ahmed MU, Hossain MK. Study of a common azo food dye in mice model: Toxicity reports and its relation to carcinogenicity. Food Sci Nutr. 2019;7(2):667-677.
3. Amin KA, Abdel Hameid H 2nd, Abd Elsttar AH. Effect of food azo dyes tartrazine and carmoisine on biochemical parameters related to renal, hepatic function and oxidative stress biomarkers in young male rats. Food Chem Toxicol. 2010;48(10):2994-9.
4. Inostroza LA, Castro AJ, Hernández EM, Carhuapoma M, Yuli RA, Collado A, et al. Actividad antioxidante de Tropaeolum tuberosum Ruiz & Pavón (mashua) y su aplicación como colorante para yogur. Cienc Invest. 2015;18(2):83–9.
5. McCann D, Barrett A, Cooper A, Crumpler D, Dalen L, Grimshaw K, Kitchin E, Lok K, Porteous L, Prince E, Sonuga-Barke E, Warner JO, Stevenson J. Food additives and hyperactive behaviour in 3-year-old and 8/9-year-old children in the community: a randomised, double-blinded, placebo-controlled trial. Lancet. 2007;370(9598):1560-7.
6. Carmona I. De colorantes sintéticos a naturales en la industria alimentaria. Odepa Santiago de Chile. 2013;5:1–6.
7. Jansen G, Flamme W. Coloured potatoes (Solanum tuberosum L.)–anthocyanin content and tuber quality. Genet Resour Crop Evol. 2006;53:1321–31.
8. Liu J, Zhou H, Song L, Yang Z, Qiu M, Wang J, et al. Anthocyanins: Promising natural products with diverse pharmacological activities. Molecules. 2021;26(13):3807.
9. Aguirre Huayhua LL, Oré Areche F, Ticsihua Huamán J. Evaluación de factores determinantes en el rendimiento y antioxidación de antocianinas extraídas en mashua negra (Tropaeolum tuberosum) por fluidos supercríticos (FSC).
10. Córdova Marcelo KE, Inga Ynca JE. Actividad diurética del extracto hidroalcóholico del tubérculo de Tropaeolum tuberosum R&P.(Mashua negra) en ratas albinas. 2020;
11. Guevara-Freire DA, Valle-Velástegui L, Barros-Rodríguez M, Vásquez C, Zurita-Vásquez H, Dobronski-Arcos J, et al. Nutritional composition and bioactive components of mashua (Tropaeolum tuberosum Ruiz and Pavón). Tropical and Subtropical Agroecosystems. 2018;21(1).
12. Castro Meco B, Paucar-Menacho LM, Peñas E, Hernández-Ledesma B, Frías J, Martínez Villaluenga C. Effect of steaming on phenolic compounds bioaccessibility, antioxidant and antidiabetic activities of Andean black mashua tubers. 2019;
13. Feliciano-Muñoz O, Robles-Calderón R, Chirre-Flores JH, Santisteban-Rojas O, Feliciano-Nishikawa JC, de León WDFP. Identificación de los principios activos de la mashua negra (Tropaeolum tuberosum) y el efecto del proceso de elaboración de una bebida mix de mashua con piña. Ingeniería Industrial. 2021;(40):171–90.
14. Akhbari M, Hamedi S, Aghamiri Z sadat. Optimization of total phenol and anthocyanin extraction from the peels of eggplant (Solanum melongena L.) and biological activity of the extracts. Journal of Food Measurement and Characterization. 2019;13:3183–97.
15. Scudino H, Silva EK, Gomes A, Guimarães JT, Cunha RL, Sant’Ana AS, et al. Ultrasound stabilization of raw milk: Microbial and enzymatic inactivation, physicochemical properties, and kinetic stability. Ultrason Sonochem. 2020;67:105185.
16. Celis RA. Efecto de temperatura y velocidad de secado en la actividad antioxidante de la mashua (Tropaeolum tuberosum) en el secado en bandejas. Revista Científica UNTRM: Ciencias Naturales e Ingeniería. 2020;3(1):16–21.
17. Ruiz Rivera, J.A, & Ramírez Matheus, A.O. Elaboración de yogurt con probióticos (Bifidobacterium spp. y Lactobacillus acidophilus) e inulina. Revista de la Facultad de Agronomía, 2009; 26(2)223-242.
18. AOAC. Official Methods of Analysis. 21st ed. Association of Official Analytical Chemists, editor. Washington: Association of Official Analytical Chemists; 2019.
19. Giusti MM, Wrolstad RE. Characterization and Measurement of Anthocyanins by UV-Visible Spectroscopy. Current Protocols in Food Analytical Chemistry [Internet]. 2001 Apr [cited 2020 Jan 16];00(1): F1.2.1-F1.2.13. Available from: http://doi.wiley.com/10.1002/0471142913.faf0102s00
20. Singleton VL, Orthofer R, Lamuela-Raventós RM. [14] Analysis of total phenols and other oxidation substrates and antioxidants using folin-ciocalteu reagent. Methods Enzymol. 1999;299:152–78.
21. Brand-Williams W, Cuvelier ME, Berset C. Use of a free radical method to evaluate antioxidant activity. LWT - Food Science and Technology. 1995 Jan 1;28(1):25–30.
22. Marcía Fuentes, J., Montero Fernández, I., Zumbado, H., Lozano Sánchez, J., Santos Alemán, R., Navarro Alarcon, M., Borrás Linares, I., Saravia Maldonado, S. Quantification of Bioactive Molecules, Minerals and Bromatological Analysis in Carao (Cassia grandis). J. Agric. Sci. Technol,2020, 12 (3), 88-94
23. Zavaleta BA, Calderón WGP, Rojas ML, Silva CEB. Substitution of Wheat Flour for Sweet Potato, Oca, and Pea Flour in a Sponge Cake: Sensory Acceptability and Nutritional Composition. In: Proceedings of the 8th Brazilian Technology Symposium (BTSym’22) Emerging Trends and Challenges in Technology. Springer; 2023. p. 351–60.
24. Gonzales-Torre H, Aliaga-Barrera I, Velásquez-Barreto FF. Effect of chlorpropham on the sprouting and behavior of bioactive compounds in purple mashua (Tropaeolum tuberosum Ruíz & Pavón) during postharvest storage. Bioagro. 2020;32(1):49–58.
25. Valle Campos M, García Ceccarelli J, Laos Anchante D, Yarasca CE, Loyola Gonzales E, Surco-Laos F. Análisis proximal y cuantificación de antocianinas totales en Zea mays variedad morada sometido a diferentes procesos de secado. Revista de la Sociedad Química del Perú. 2019;85(1):109–15.
26. Salazar D, Arancibia M, Ocaña I, Rodríguez-Maecker R, Bedón M, López-Caballero ME, et al. Characterization and technological potential of underutilized ancestral Andean crop flours from Ecuador. Agronomy. 2021;11(9):1693.
27. Cuya Ayala RA. Efecto de secado sobre la actividad antioxidante de la harina de mashua (Tropaeolum tuberosum R&P). 2009;
28. Taipe Quispe L. Fenoles totales y actividad antioxidante en mashua (Tropaeolum tuberosum) en estado fresco, soleado y cocido de las variedades amarillo zapallo y negra [Tesis de pregrado]. [Huancayo]: Universidad Nacional del Centro del Perú; 2017.
29. Velásquez, F., Ramírez, E., Chuquilín, R., & Aliaga, I. (2020). Optimization of the functional properties of a drink based on tubers of purple mashua (Tropaeolum tuberosum Ruíz y Pavón). Agroindustrial Science. 2020; 10(1):63-70
30. Chen XQ, Li ZH, Wang ZJ, Liu LL, Sun TT, Ma JZ, et al. Ultrasound-assisted extraction of total anthocyanins from Rubia sylvatica Nakai fruit and radical scavenging activity of the extract. Ind Crops Prod. 2020;150:112420.
31. Jiang HL, Yang JL, Shi YP. Optimization of ultrasonic cell grinder extraction of anthocyanins from blueberry using response surface methodology. Ultrason Sonochem. 2017;34:325–31.
32. Fernandez-Barbero G, Pinedo C, Espada-Bellido E, Ferreiro-Gonzalez M, Carrera C, Palma M, et al. Optimization of ultrasound-assisted extraction of bioactive compounds from jabuticaba (Myrciaria cauliflora) fruit through a Box-Behnken experimental design. Food Science and Technology. 2019;39:1018–29.
33. Rodriguez-Amaya DB. Natural food pigments and colorants. Curr Opin Food Sci. 2016 Feb 1;7:20–6.
34. Gutiérrez Pulido H, de la Vara Salazar R. Análisis y diseño de experimentos. 2nd ed. México DF: Mc Graw Hill - Interamericana; 2008. 564 p.
35. Liao J, Xue H, Li J. Extraction of phenolics and anthocyanins from purple eggplant peels by multi-frequency ultrasound: Effects of different extraction factors and optimization using uniform design. Ultrason Sonochem. 2022;90:106174.
Received: 15 May 2023/ Accepted: 10 June, 2023 / Published:15 June 2023
Citation: Mendoza E, Marcía J, Chuquilín-Goicochea R, López J, Areche F, Ruíz J, Herrera A. Obtención de un colorante natural a partir Tropaeolum tuberosum Ruíz & Pavón para su aplicación en yogur. Revis Bionatura 2023;8 (2) 38. http://dx.doi.org/10.21931/RB/2023.08.02.38
