2023.08.04.22
Files > Volume 8 > Vol 8 no 4 2023
Evaluación de la viabilidad, estabilidad y pureza post liofilización en diferentes modelos fúngicos de la Colección de Microorganismos de la Escuela de Microbiología de la Universidad de Antioquia, Colombia
Evaluation of viability, stability and purity after lyophilization in different fungal models from the Microorganisms Collection of the Escuela de Microbiología of the Universidad de Antioquia, Colombia
Daniela Montoya-Arango 1,5 , Maria Paula Quintero-Rodriguez 2,5
, Maria Paula Quintero-Rodriguez 2,5 , Deisy Cristina Restrepo-Posada 3,5
, Deisy Cristina Restrepo-Posada 3,5 , Diana Marcela González-Gil 4,5*
, Diana Marcela González-Gil 4,5*
1 Escuela de Microbiología, Universidad de Antioquia, calle 67 No. 53 – 108, Medellín-Colombia; [email protected].
2 Escuela de Microbiología, Universidad de Antioquia, calle 67 No. 53 – 108, Medellín-Colombia; [email protected].
3 Facultad de medicina, Universidad de Antioquia, Cra. 51D No. 62-29, Medellín-Colombia; [email protected].
4 Colección de Microorganismos, Escuela de Microbiología, Universidad de Antioquia, calle 67 No. 53 – 108, Medellín-Colombia; [email protected].
5 Grupo de Investigación Microbiología Básica y Aplicada (MICROBA), Escuela de Microbiología, Universidad de Antioquia, calle 67 No. 53 – 108, Medellín-Colombia
* Correspondencia: [email protected]
Available from. http://dx.doi.org/10.21931/RB/2023.08.04.22
RESUMEN
Uno de los retos de las colecciones biológicas vivas consiste en preservar microorganismos viables, puros y estables con el empleo de diferentes métodos. Entre ellas, las colecciones de hongos cumplen un papel fundamental al resguardar y documentar la biodiversidad y el recurso genético fúngico. Los métodos que se recomiendan para cumplir con estos objetivos a largo plazo son la criopreservación y liofilización. La Colección de Microorganismos de la Escuela de Microbiología de la Universidad de Antioquia requiere evaluar la liofilización para preservar hongos, dado que bajo condiciones óptimas puede mejorar algunas limitaciones de otros métodos empleados. En esta investigación se liofilizó una levadura y tres hongos filamentosos durante 24 horas empleando diferentes sustancias protectoras y se evaluó la viabilidad, pureza y estabilidad antes y después de liofilizar. Los resultados evidenciaron que en la mayoría de los hongos la viabilidad, estabilidad y pureza fue exitosa usando sacarosa al 10% con un inóculo aproximado de 108 células/mililitro a una temperatura de 80°C bajo cero y 6 pascales de presión. Aunque la sacarosa fue el lioprotector que presentó mejor porcentaje de viabilidad, mantuvo estables y puros a los microorganismos, y cumplió con las características físicas del producto seco, los demás lioprotectores constituyen una alternativa válida de uso.
Palabras clave: conservación; colecciones fúngicas; hongos; levaduras; liofilización; preservación.
ABSTRACT
One of the challenges of living biological collections is to preserve viable, pure and stable microorganisms using different methods. Among these, fungal collections play a fundamental role in protecting and documenting fungal biodiversity and genetic resources. The recommended procedures to meet these long-term goals are cryopreservation and freeze-drying. The Collection of Microorganisms of the Escuela de Microbiología of the Universidad de Antioquia needs to evaluate freeze-drying for preserving fungi because it can improve some limitations of other methods used under optimal conditions. In this research, one yeast and three filamentous fungi were freeze-dried for 24 hours using different protective substances, and the viability, purity and stability were evaluated before and after freeze-drying. The results showed that viability, stability and purity were satisfactory for most fungi using 10% sucrose as a lyoprotectant with an inoculum of approximately 108 cells/milliliter at a temperature of 80°C below zero and 6 pascals of pressure. Although sucrose was the lyoprotectant that presented the best percentage of viability, kept the microorganisms stable and pure, and complied with the physical characteristics of the dry product, the other lyoprotectants constitute a valid alternative for its use.
Keywords: conservation; fungal collections; fungi; yeast; freeze-drying; preservation.
INTRODUCCIÓN
Las colecciones fúngicas cumplen un papel fundamental como reservorio de la Funga de nuestro planeta y la preservación de cepas con potencial desarrollo biotecnológico en la industria y la salud, proporcionando la base esencial, representada en recursos genéticos y biodiversidad, para industrias ecoeficientes de biotecnología emergentes. Adicionalmente, su uso en docencia e investigación cobra importancia cuando el material biológico se almacena debidamente identificado, evaluando periódicamente su pureza, viabilidad y estabilidad.1 En nuestro caso, esto favorece el proceso de aprendizaje de más de 200 estudiantes al semestre a partir de cepas que conservan sus características originales a través del tiempo, criterio que también debe cumplirse en investigación para garantizar la fiabilidad y reproducibilidad de los resultados, otorgando gran relevancia a la elección de métodos de preservación adecuados. Con el objetivo de minimizar la pérdida de hongos, se sugiere almacenar cada microorganismo por dos métodos, idealmente por criopreservación o liofilización puesto que minimizan los riesgos de modificación genética.2
Actualmente, la Colección de Microorganismos de la Escuela de Microbiología de la Universidad de Antioquia (CM-EM-UDEA) conserva las especies fúngicas en agua, repique seriado o por criopreservación a -80ºC, sin embargo, estos métodos presentan algunas limitaciones como la viabilidad a corto y mediano plazo, el cambio de características macroscópicas y microscópicas, el riesgo biológico aumentado, contaminaciones frecuentes, poco espacio para almacenamiento y la necesidad de adquirir ultracongeladores de manera constante para garantizar un buen número de alícuotas en cada microorganismo.3 Lo anterior tiene un alto costo y una dependencia de conexión eléctrica para mantener bajas temperaturas, lo cual no es seguro en nuestro laboratorio dado que periódicamente hay inestabilidad en la energía o se debe suspender para realizar mantenimiento de la red eléctrica. En otros laboratorios, si bien no se utilizan ultracongeladores, las muestras se criopreservan en tanques de nitrógeno líquido, generando altos costos por el suministro periódico del mismo.4 Adicionalmente, la ultracongelación parece tener un efecto bastante lesivo en ciertos hongos dado que algunos crioprotectores resultan tóxicos y sus estructuras tienen mayor susceptibilidad a la formación de cristales durante el proceso, lo que evidencia la necesidad de establecer opciones de métodos de preservación que se adapten a cada tipo de microorganismo.4
A pesar de que clásicamente la preservación de hongos se ha llevado a cabo mediante subcultivos seriados, almacenamiento en aceite mineral, en agua estéril o en gel de sílice, son métodos dispendiosos, preservan a corto o mediano plazo, tienen alto riesgo de contaminación, son bioinseguros por manipular microorganismos metabólicamente activos y no garantizan la estabilidad genética.3,4 En contraste, la liofilización es un método de preservación a largo plazo que favorece la estabilidad genética, el transporte y el almacenamiento, y si bien se debe usar un equipo costoso, es suficiente para preservar altas cantidades y múltiples alícuotas de microorganismos. El proceso consiste en la detención del metabolismo celular mediante la ultracongelación inicial de la muestra, paso esencial para permitir que el solvente se separe de los componentes celulares y de las sustancias protectoras mediante la formación de cristales de hielo, que posteriormente será eliminado en el segundo paso llamado sublimación, en este, la muestra inicia el secado por evaporación del agua a muy baja temperatura y presión de vacío. Finalmente, se realiza un secado definitivo para obtener una muestra desecada que mantiene la estabilidad celular y es fácilmente reconstituida.5 Durante las diferentes etapas de este método de preservación, las estructuras celulares pueden sufrir daños, siendo fundamental la elección y estandarización de sustancias protectoras que mitiguen dicho deterioro para alcanzar condiciones óptimas en el proceso; entre las más usadas se encuentran carbohidratos, polímeros, péptidos y sustancias antioxidantes. Las condiciones previas del microorganismo como la concentración de la muestra también tienen impacto en el resultado del proceso; previamente se ha establecido que concentraciones por encima de 1x108 células/ml permite una óptima recuperación celular. Así mismo, establecer un tiempo y temperatura de liofilización adecuada mejora las características del producto seco y reduce el daño celular, esto depende del tipo de producto y la concentración de la muestra, a mayor complejidad celular se requiere mayor tiempo de liofilización y menor temperatura, a menudo por debajo de -50 °C o lo más cercana a la temperatura de congelación inicial para optimizar el proceso de sublimación; no obstante, dado que la temperatura depende también de la presión de vapor dentro de la cámara de liofilización, mantener una presión de vacío menor a 10 pascales garantiza este equilibrio durante todo el proceso; 5-7 teniendo en cuenta lo anterior y las características del liofilizador 8 se definieron los parámetros del proceso.
Aunque la liofilización es un método ampliamente usado en bacterias, su uso en micología es menos extendido y las investigaciones en este campo tienen limitaciones metodológicas por la alta diversidad entre los hongos y, consecuentemente, una gran variabilidad de estructuras morfológicas incluso en una misma especie, lo cual puede afectar de forma importante la viabilidad y estabilidad fenotípica y genotípica.4,9,10 Por esta razón, seleccionamos diferentes modelos de hongos a partir de los cuales se pudieran extrapolar los resultados. Candida albicans es una levadura que hace parte de la microbiota de piel y mucosas, también puede causar infecciones vulvovaginales, cutáneas, onicomicosis y otras infecciones sistémicas principalmente en personas inmunodeficientes, con capacidad de afectar casi cualquier órgano o sistema corporal. No obstante, también es usada en la industria para producción de biomasa, y dada su similitud con otras levaduras nuestros resultados son relevantes para aplicarlos en la preservación de levaduras de importancia en salud o de amplio uso en la industria alimentaria.11 En el mismo sentido, los resultados de la preservación de Aspergillus sección Nigri, uno de los hongos filamentosos más importantes en la biotecnología industrial y en investigaciones de generación renovable de materia prima para la producción de biocombustibles, permitirá, no solo preservar sus características genéticas originales y modificadas, sino también extrapolar hacia otros hongos ambientales con importancia industrial o en investigación clínica por ser agentes de micosis profundas o productores de enzimas y productos metabólicos usados en medicina. 12,13 Por otro lado, Trichophyton mentagrophytes hace parte de los hongos dermatofitos, responsables de las principales afecciones de piel, cuero cabelludo y uñas en todo el mundo, representando un alto costo para los sistemas de salud, por consiguiente, la preservación de dicho grupo clínico es de gran relevancia en docencia, investigación de tratamientos, pruebas de identificación y diagnóstico.14 Finalmente, Rhizopus sp. Representa los hongos filamentosos no septados, su preservación adecuada tiene relevancia en docencia e investigación clínica porque son causantes de micosis profundas e infecciones oportunistas graves en el ser humano, así como importancia en la industria alimentaria y farmacéutica.15,16
Publicaciones previas, en algunas especies de hongos, han mostrado buenos resultados con la liofilización, no obstante, existe inconsistencia según las estructuras micóticas preservadas, las características evaluadas o la forma de reportar los resultados, 10, 17-21 por lo que se requiere estandarizar un protocolo de liofilización que se pueda aplicar de forma satisfactoria y homogénea a la mayoría de los hongos que se encuentran almacenados en la CM-EM-UDEA. En este sentido, el objetivo de este estudio fue evaluar la viabilidad, estabilidad y pureza post liofilización en Trichophyton mentagrophytes, Rhizopus spp., Aspergillus sección Nigri y Candida albicans, hongos de la Colección de Microorganismos de la Escuela de Microbiología de la Universidad de Antioquia, utilizando diferentes sustancias protectoras.
MATERIALES Y MÉTODOS
Microorganismos evaluados
Se evaluaron un dermatófito, un moho aseptado, un moho septado y una levadura a partir de aislados clínicos de la CM-EM-UDEA (Trichophyton mentagrophytes, Rhizopus spp. Aspergillus sección Nigri) y una cepa de referencia (Candida albicans ATCC 14053).
Activación de microorganismos
La activación metabólica de los hongos se hizo realizando dos repiques de manera consecutiva a partir del método de conservación. Se empleó Agar Sabouraud Dextrosa (SDA, por su sigla en inglés) (Becton, Dickinson and Company, Sparks, USA) para el primer y segundo repique para C. albicans y para los hongos filamentosos se usó Agar Papa Dextrosa (PDA, por su sigla en inglés) (MCD Lab, Oaxaca, México) en el segundo repique con fin de estimular la esporulación. La temperatura de incubación fue de 28 a 30 °C durante 48 horas para C. albicans, 96 horas para Aspergillus sección Nigri y Rhizopus spp., y 120 horas para T. mentagrophytes.
Sustancias protectoras
Se realizaron cinco evaluaciones con tres lioprotectores: leche descremada 10%, glucosa 10%, sacarosa 10%, leche descremada + glucosa 10%, leche descremada + sacarosa 10%, (% p/v).
Estandarización del inóculo
Para la levadura se realizó una curva de crecimiento en el equipo Multiskan GO (Thermo Fisher, Massachusetts, USA) con el fin de identificar la fase de crecimiento exponencial tardía. A partir del segundo repique de C. albicans, se ajustó un patrón 1 McFarland en medio líquido de infusión cerebro corazón (siglas en inglés BHI) (Merck, Bogotá, Colombia) y a partir de éste se realizó una dilución 1:10, se inocularon 200 µl en un plato Corning U-buttom y se introdujo en el equipo programado a 37°C, en agitación constante a velocidad media (parámetro del equipo), a 620 nm y con lecturas cada 30 minutos durante 24 horas. El mismo patrón McFarland diluido se replicó con mayor volumen (110 ml) en agitación constante a 200 rpm, a 37°C en simultáneo a la curva de crecimiento hasta detectar la fase exponencial tardía en el equipo. Cuando alcanzó dicha fase, se distribuyó el volumen total en 6 alícuotas iguales para ser centrifugadas a 3500 rpm durante 20 minutos. Después de retirar el sobrenadante se reconstituyó cada alícuota con 4 ml de las diferentes preparaciones de los lioprotectores y luego se distribuyeron en dos tubos, cada uno con 2 ml de suspensión para liofilizar. Un tubo adicional se reconstituyó con 2 ml de caldo BHI para evaluar el efecto de la liofilización en la levadura cuando no se adicionó una sustancia protectora; finalmente, se preparó otro tubo con 2 ml de cada lioprotector sin microorganismo como control de pureza.
Para los hongos filamentosos se aplicó el mismo protocolo (en caldo Sabouraud, a 25°C) con el fin de identificar dicha fase, sin embargo, por la reducción de conidias observadas durante el tiempo de incubación se modificó el procedimiento con el fin de favorecer la esporulación y posteriormente se estandarizó el inóculo a liofilizar mediante lavado de conidias. Para lo anterior, después del tiempo de incubación en agar PDA, se verificó la esporulación y se realizó un lavado de conidias de cada microorganismo con 2 ml de TWEEN 80 al 0.01% (Suquin, Bucaramanga, Colombia) y se ajustó al patrón 1 McFarland con caldo extracto de levadura 1% (p/v) (Merck, Bogotá, Colombia). La suspensión se dividió en 6 tubos de ensayo con 4 ml cada uno y se centrifugaron a 3500 rpm durante 20 minutos; después de precipitar la biomasa se realizó el mismo procedimiento descrito para la levadura.
Los tubos a liofilizar fueron congelados en inclinación con el fin de formar una capa delgada y optimizar los resultados de la liofilización, a una temperatura de -80 °C durante un tiempo no menor a 20 horas.
Liofilización
La liofilización se llevó a cabo en un liofilizador Labconco Freezone plus 2.5 (Marshall Scientific, Hampton, USA), programado a -80 °C, a una presión de 6 pascales, durante 24 horas.
Reconstitución de los liofilizados
Después de liofilizar se reconstituyó con 2 ml de caldo BHI para C. albicans y 2 ml de extracto de levadura 1% para los hongos filamentosos.
Evaluación de la viabilidad
Antes y después de liofilizar se sembraron 10 µL de forma cuantitativa y por duplicado, la levadura en agar BHI, durante 48 horas a 25°C; los hongos filamentosos en SDA, incubando Trichophyton mentagrophytes a 30 °C; Aspergillus sección Nigri y Rhizopus spp. a 28 °C durante 120 horas. Tras el periodo de incubación se hizo el cálculo de Unidades Formadoras de Colonia por mililitro (UFC/ml) y para el conteo de hongos filamentosos se hizo una revisión periódica cada 24 horas durante 120 horas, en ambos casos se realizó el conteo de cada replica y se calculó en número promedio. Posteriormente se calculó el porcentaje de viabilidad para cada hongo en cada lioprotector, empleando las siguientes fórmulas:19

Donde:
Xi = número de UFC / ml antes de liofilizar
Xf = número de UFC / ml después de liofilizar.
Evaluación de la estabilidad
Antes y después de liofilizar, se realizó tubo germinal a C. albicans y en todos los hongos, incluyendo los filamentosos, se enfatizó en la comparación de las características macroscópicas (visualización de las colonias) y microscópicas (visualización de estructuras micóticas con azul de lactofenol con objetivo microscópico de 10x y 40x), para identificar cambios fenotípicos de las cepas evaluadas que pudieran ser explicadas por el proceso de liofilización. Lo anterior, partiendo de los medios de cultivo para recuento de UFC/ml antes y después de liofilizar.
RESULTADOS Y DISCUSIÓN
El presente proyecto de investigación detalla la información encontrada durante la estandarización del proceso de liofilización de hongos, aportando evidencia científica no solo en la viabilidad de los microorganismos, sino también sobre su estabilidad y pureza, lo cual es difícil hallar de manera unificada en estudios publicados, dado que la mayoría solo reportan viabilidad o parámetros en forma cualitativa. 17-19 Además, los microorganismos evaluados en este estudio son modelos específicos que permiten ampliar el alcance de los resultados a otros hongos compatibles, con fisiología o estructuras micóticas similares.
En cuanto a la estabilidad de los hongos evaluados, no se observaron cambios microscópicos o macroscópicos significativos. En C. albicans, el tiempo para alcanzar la fase exponencial tardía necesaria para el inóculo inicial de la liofilización fue de 12 horas; antes de liofilizar se obtuvieron colonias blancas, cremosas, de borde definido y tamaño mediano (Figura 1A-B); microscópicamente se observaron levaduras de tamaño variable, unigemantes (figura 1C-D) y el tubo germinal fue positivo (figura 1E-F); ninguna de estas características se modificó tras la liofilización. Para los hongos filamentosos se mantuvieron las mismas características antes y después de liofilizar. T. mentagrophytes con colonias blancas, algodonosas, de borde definido (figura 2A-B); microscópicamente tenía hifas septadas hialinas delgadas, sin espirales y microconidias piriformes (figura 2C-D); Rhizopus spp. tuvo un crecimiento en toda la caja de cultivo, con micelio aéreo abundante y color gris oscuro (figura 3A-B), microscópicamente se observaron los característicos rizoides, esporangias esférica de pared gruesa, que al romperse daban la apariencia de sombrero chino y esporangiosporas ovaladas pigmentadas color café (figura 3C-D). Las colonias de Aspergillus sección Nigri eran negras con aspecto punteado sobre un fondo blanco en el anverso (figura 4A-B), microscópicamente se observaron cabezuelas radiadas, fértiles en toda la superficie, con bifiálides, conidias globosas y equinuladas color café (figura 4C-D).
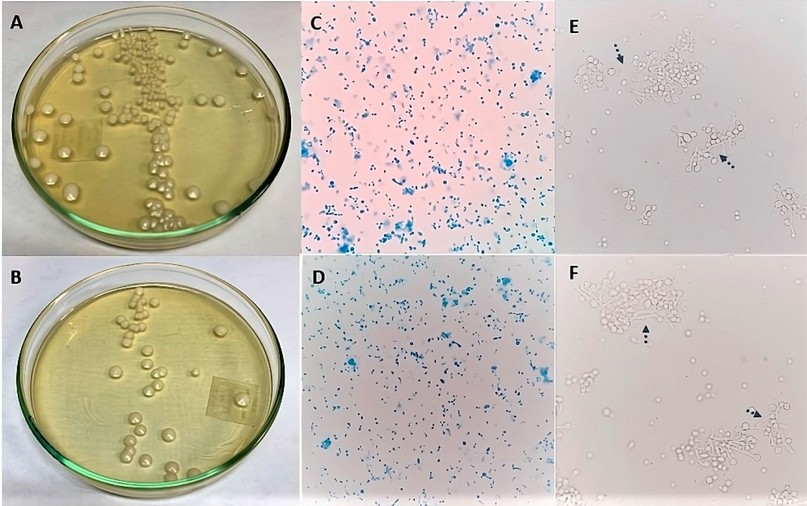
Figura 1. Candida albicans. Cultivo antes (A) y después de liofilizar (B). Morfología microscópica (aumento 400x) antes (C) y después de liofilizar (D), usando azul de lactofenol como colorante; tubo germinal positivo (flechas) antes (E) y después de liofilizar (F).
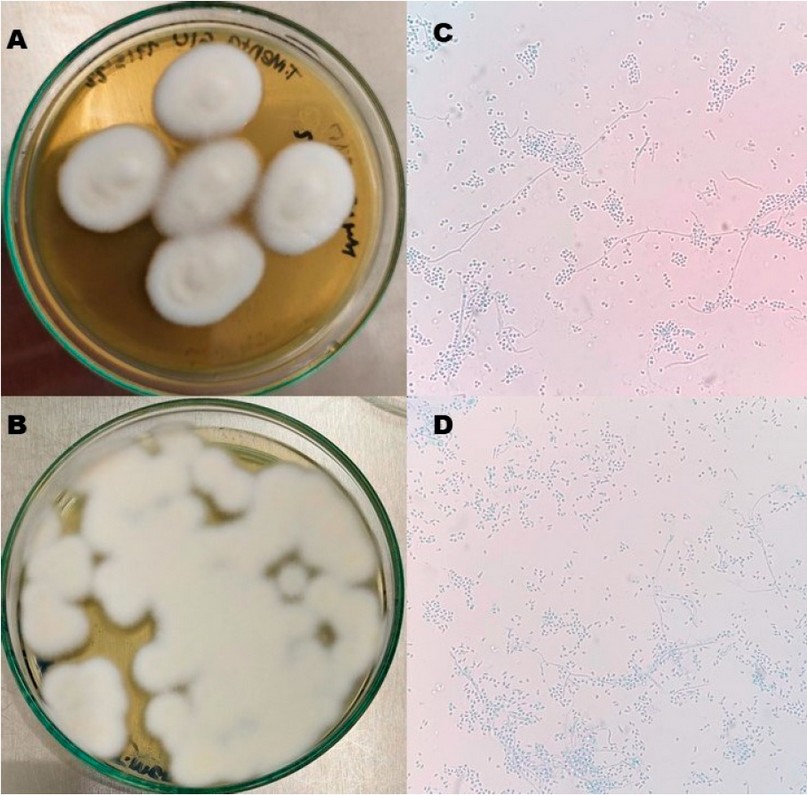
Figura 2. T. mentagrophytes. Morfología macroscópica antes (A) y después (B) de liofilizar. Morfología microscópica (aumento 400x) antes (C) y después de liofilizar (D), usando azul de lactofenol como colorante.
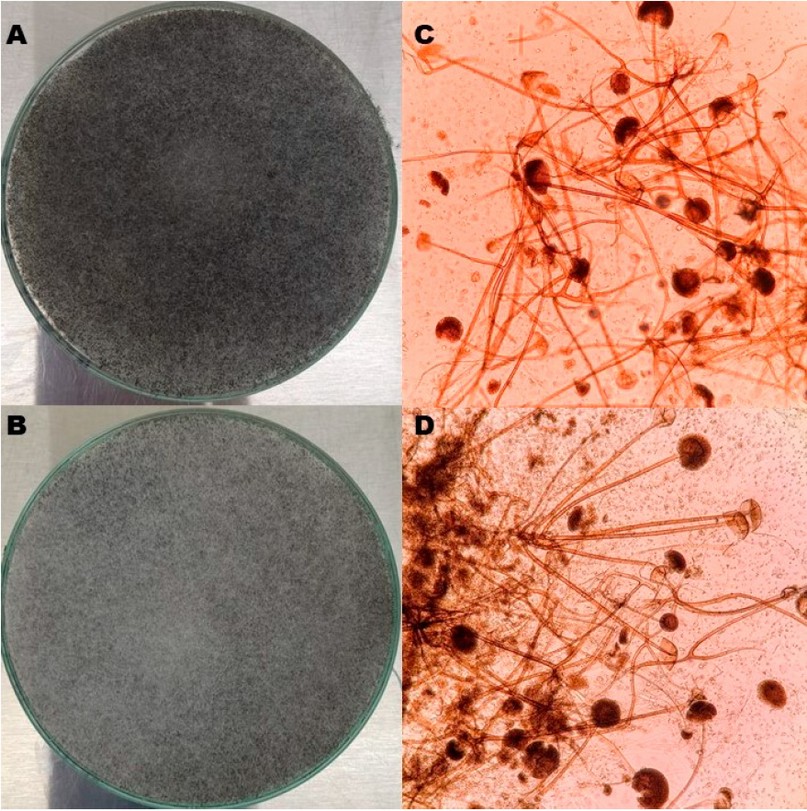
Figura 3. Rhizopus sp. Morfología macroscópica antes (A) y después (B) de liofilizar. Morfología microscópica (aumento 100x) antes (C) y después (D) de liofilizar.
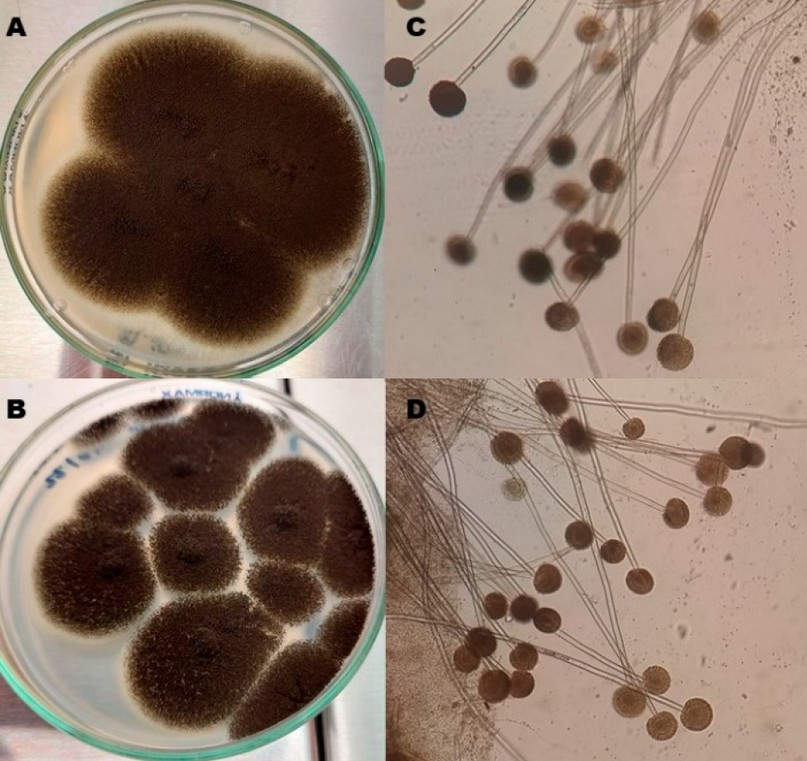
Figura 4. Aspergillus sección Nigri. Morfología macroscópica antes (A) y después (B) de liofilizar. Morfología microscópica (aumento 100x) antes (E) y después (F) de liofilizar.
Los porcentajes de viabilidad (figura 5) fueron mayores al 70% cuando se usó glucosa como lioprotector, excepto para T. mentagrophytes que fue alrededor del 50%, similar a la viabilidad con leche descremada para este microorganismo; de hecho, comparativamente con los demás hongos éste tuvo menor viabilidad en la mayoría de los lioprotectores. Lo contrario se observó con C. albicans en la que todos los lioprotectores presentaron viabilidad del 100%, excepto leche descremada; inclusive su viabilidad fue completa cuando solo se usó caldo de cultivo durante la liofilización, resultado observado también en Rhizopus spp., aunque en este último es llamativo que con lioprotectores como glucosa, sacarosa y leche descremada con sacarosa, el porcentaje de viabilidad se redujo alrededor de 20% y la reducción fue mayor con las otras sustancias. En Aspergillus sección Nigri, la viabilidad fue alrededor del 70% con sacarosa y glucosa y cuando se combinaron éstos con leche descremada estuvo entre 40% y 50%, respectivamente. Cabe resaltar que no se obtuvo crecimiento en las alícuotas donde se usó sólo las sustancias protectoras evidenciando la pureza del proceso.
Los lioprotectores fueron elegidos por asequibilidad, uso frecuente y efectividad.22 Como se mencionó en el párrafo anterior, la leche descremada, lioprotector ampliamente usado puesto que sus componentes inhiben la formación de cristales y protege las membranas celulares de los microorganismo liofilizados, no tuvo los altos porcentajes de viabilidad esperados en este estudio y aunque diferentes autores 17-18,23 reportaron altos resultados de viabilidad, estabilidad y pureza cuando liofilizaron hongos con éste y otros lioprotectores, se basaron en la presencia o ausencia de crecimiento de los microorganismos, mediante ensayos por duplicado, triplicado o con una sola replica; dificultando la comparación con los resultados obtenidos en este estudio puesto que además de reportar crecimiento en todos los lioprotectores también se calculó el porcentaje de viabilidad. Para algunos hongos, el porcentaje de viabilidad mejoró cuando se combinó leche descremada con glucosa y sacarosa, aunque fue menor comparada con el uso de azúcares como lioprotectores solos; Ávila et al.19 reportaron resultados similares cuando se utilizó leche descremada con miel como lioprotector y Burguet et al.24 cuando emplearon leche descremada; ambos evidenciaron una marcada disminución de la viabilidad en el tiempo, efectos no deseados que pudieran atribuirse a este lioprotector.
También fueron evaluados carbohidratos como lioprotectores, sustancias que regulan la deshidratación, aumentan la resistencia a bajas temperaturas y presiones y estabilizan las membranas celulares.25 En este ensayo, lo hongos presentaron mejor viabilidad con glucosa 10%, sin embargo, esta última no tuvo las propiedades físicas generales y la velocidad de reconstitución recomendadas; este resultado podría haberse presentado al sobrepasar el valor crítico de temperatura y presión para este carbohidrato, produciéndose burbujeo, deshidratación incompleta, interrupción de la sublimación, pérdida de rigidez del producto final y apariencia no satisfactoria.25 Aunque no se halló ningún cambio en las características morfológicas antes y después de liofilizar, sería importante que futuros estudios evalúen el uso de la glucosa en concentraciones menores al 10%, además de las características físicas e higroscópicas durante el almacenamiento para determinar el efecto en la viabilidad, estabilidad y pureza de los microorganismos en el tiempo, variable que también debe evaluarse con los demás lioprotectores.
Con la sacarosa también se obtuvieron altos porcentajes de viabilidad para todos los hongos evaluados, obteniéndose un producto seco con las características adecuadas; todos los microorganismos se aislaron 100% puros y con un alto grado de estabilidad, por lo tanto, la sacarosa se convierte en un lioprotector promisorio para elegir en nuestra colección, máxime la comparativa costo efectividad que tiene frente a la trehalosa, con el que también se ha reportado efectos benéficos en la viabilidad micótica. 20-21,26
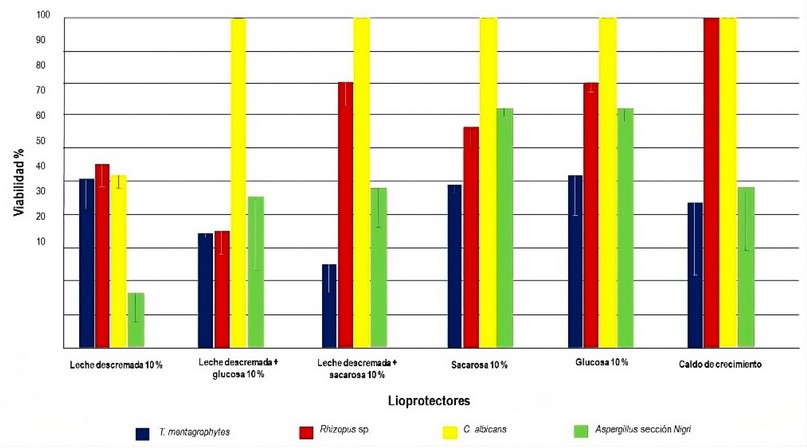
Figure 5. Porcentajes de viabilidad de los hongos con cada lioprotector evaluado
Es llamativo que la liofilización solo con BHI y extracto de levadura conservaron adecuadamente la viabilidad de C. albicans y Rhizopus spp., respectivamente, con resultados del 100% y sin cambios fenotípicos significativos; lo que podría deberse a que estos medios de cultivos contienen componentes que se usan comúnmente como sustancias protectoras durante este proceso, evidenciando el potencial uso de estos caldos de cultivo como lioprotectores, teniendo en cuenta su relación costo-beneficio, amplia disponibilidad en los laboratorios y fácil preparación.27
Durante el establecimiento de las condiciones óptimas de liofilización, no se utilizó curva de crecimiento en los mohos ya que durante el ensayo se evidenció que a medida que pasaba el tiempo de incubación se disminuía la formación de estructuras que resisten mejor el proceso de liofilización como esclerocios, conidias o esporas, resultado que no favorece el proceso.28 Henao et al.,29 también reportaron una tendencia a la disminución en el recuento de conidias durante la curva de crecimiento en medio líquido y en agitación, con aumento en la biomasa, mostrando que el medio de cultivo líquido aporta a los hongos filamentosos las condiciones nutricionales para el desarrollo vegetativo, favoreciendo en menor medida el estadio reproductivo;30 en este sentido, para estos microorganismos, recomendamos priorizar la esporulación en un medio adecuado más que a la fase de crecimiento, estandarizando el inóculo para tener un protocolo controlado durante la liofilización que reduzca las variaciones.
Como limitaciones del estudio, se debe considerar que, aunque se estandarizó un protocolo que garantizó viabilidad, estabilidad y pureza después de liofilizar con las sustancias protectoras evaluadas, sería importante evaluar el efecto que tiene el almacenamiento a largo plazo en la estabilidad del producto seco y, específicamente para C. albicans, evaluar si el uso de caldo de extracto de levadura, peptona y dextrosa (YPD por sus siglas en inglés) mejora la viabilidad post liofilización, al ser un medio de cultivo ampliamente usado en hongos. Adicionalmente, incluir análisis de fisiología y métodos moleculares de estabilidad genética, además de características morfológicas, permitiría identificar con mayor precisión los cambios que puede generar el proceso de liofilización en los hongos.
CONCLUSIONES
A pesar de la naturaleza inestable de algunos hongos, este ensayo de liofilización garantizó viabilidad, estabilidad y pureza de los microorganismos evaluados, estandarizado a temperatura de -80 °C, presión de 6 pascales, densidad celular inicial aproximada de 3 x 108 UFC/ml y tiempo de liofilización de 24 horas; reportando parámetros de forma cuantitativa que permiten obtener resultados más objetivos y la comparación más precisa entre estudios de preservación fúngica.
Pese a que la glucosa fue el lioprotector que en general tuvo mayor viabilidad, sus características físicas finales hacen necesario evaluar diferentes concentraciones y junto con las demás sustancias protectoras, evaluar su impacto en el almacenamiento a largo plazo, incluyendo el desempeño de los caldos de cultivo como lioprotectores dado su favorable relación costo/beneficio, teniendo en cuenta que para la liofilización de hongos filamentosos recomendamos la utilización de un medio de cultivo que estimule la producción de conidias previo al procedimiento de preservación. Nuestros resultados evidenciaron que la sacarosa 10% fue el lioprotector que presentó mejor porcentaje de viabilidad, mantuvo estables y puros a los microorganismos, y cumplió con las características físicas del producto seco, sin embargo, los demás lioprotectores constituyen una alternativa válida según la disponibilidad y necesidades de cada laboratorio.
Contribución de los autores: Todos los autores contribuyeron al diseño, adquisición, análisis e interpretación de los datos, redacción y revisión del artículo y aprobación de la versión a publicar.
Financiamiento: Esta investigación recibió recursos de financiación del Centro de Investigación de la Escuela de Microbiología de la Universidad de Antioquia, Colombia.
Consejo de Revisión Institucional: No aplica.
Consentimiento informado: No aplica.
Agradecimientos: Las autoras agradecen al Centro de Investigación de la Escuela de Microbiología de la Universidad de Antioquia y al grupo de investigación Microbiología Básica y Aplicada, especialmente a su Línea de Epidemiología Molecular por el apoyo recibido y los espacios brindados. Así mismo, a la Colección de Microorganismos por los recursos y disposición durante el desarrollo de este trabajo de investigación.
Conflicto de intereses: Las autoras declaran no tener conflicto de intereses durante la realización de este proyecto de investigación.
REFERENCES
1. Sette, L.D.; Pagnocca, F.C.; Rodrigues, A. Microbial culture collections as pillars for promoting fungal diversity, conservation and exploitation. Fungal Genet. Biol, 2013, 60, pp. 2-8.
2. World Federation for Culture Collections WFCC [Internet], Guidelines for the establishment and op-eration of collections of cultures of microorganisms, Thirds edition, 2010. Disponible en: https://www.wfcc.info/guideline
3. Hu, X.; Webster, G.; Xie, L.; Yu, C.; Li, Y.; Liao, X. A new method for the preservation of axenic fungal cultures. J Microbiol Methods, 2014, 99, pp. 81-3.
4. Ryan, M.J.; Smith, D. Fungal genetic resource centres and the genomic challenge. Mycol. Res, 2004, 108, pp. 1351-62.
5. Morgan, C. Freeze-Drying of Microorganisms. Encyclopedia of Microbiology, 2009, pp. 162–173.
6. Assegehegn, G.; Fuente, E.; Franco, J.M.; Gallegos, C. Freeze-drying: A relevant unit operation in the manufacture of foods, nutritional products, and pharmaceuticals. Advances in Food and Nutrition Re-search, 2020, 93, pp. 1–58.
7. Nowak, D.; Jakubczyk, E. The Freeze-Drying of Foods-The Characteristic of the Process Course and the Effect of Its Parameters on the Physical Properties of Food Materials. Foods, 2020, 9(10), pp. 1488.
8. Labconco Corporation [Internet]. Kansas, USA; [Citado diciembre de 2022]. Recuperado a partir de: https://www.labconco.com/product/freezone-25-liter-benchtop-freeze-dry-systems/5363
9. Jones, R.J.; Sizmur, K.J.; Wildman, H.G. A miniaturised system for storage of fungal cultures in water, Mycologist, 1991, 5(4), 1991, pp. 184-186.
10. Boundy, K.; McCluskey, K.; Elia, P.; Glaeser, J.A.; Lindner, D.L.; Nobles, D.R.; et al. Preserving US microbe collections sparks future discoveries, J Appl Microbiol, 2020, 129(2), pp. 162-174.
11. Żymańczyk-Duda, E.; Brzezińska-Rodak, M.; Klimek-Ochab, M.; Duda, M.; Zerka, A. Yeast - Industrial aplications, 1st ed, IntechOpen, Croatia, 2017, p. 3-40
12. Cairns, T.; Nai, C.; Meyer, V. How a fungus shapes biotechnology: 100 years of Aspergillus niger re-search. Fungal Biol Biotechnol, 2018, 5(13), pp. 1-14.
13. Ostos, O.; Rosas, S.; González, J. Biotechnological applications of microorganisms, NOVA, 2019, 17(31), pp. 129-163.
14. Moskaluk, A.E.; VandeWoude, S. Current Topics in Dermatophyte Classification and Clinical Diag-nosis. Pathogens, 2022, 23, 11(9), pp. 957.
15. Wagner, L.; de Hoog, S.; Alastruey-Izquierdo, A.; Voigt, K.; Kurzai, O.; Walther, G. A Revised Species Concept for Opportunistic Mucor Species Reveals Species-Specific Antifungal Susceptibility Profiles. Antimicrob Agents Chemother, 2019, 25, 63(8), pp. 653-19.
16. Morin-Sardin, S.; Nodet, P.; Coton, E.; Jany, J. Mucor: A Janus-faced fungal genus with human health impact and industrial applications, Fungal Biol. Rev, 2017, 31(1), pp 12-32.
17. Leiva-Espinoza, S.T.; Hernández, E.; Mattos, L.L. Estabilidad de cepas nativas de Trichoderma con-servadas mediante liofilización. Rev Investig Agroproducción Sustentable, 2021, 5(1), pp. 25-31.
18. Elkadi, O.A.; Elanany, M.; Ramadan, M.A. Long-Term Survival of Three Fungal Species in Lyophilized Human Blood Plasma. Microbiol Spectr, 2021, 9(1), pp. 222-21.
19. Ávila, L.C.; Vasco, J.M.; Vásquez, J.C. Viabilidad de levaduras y bacterias conservadas por liofili-zación: efecto de agentes lioprotectores, Revista Vector, 2015, 10, pp. 7-13.
20. Berny, J.F., Hennebert, G.L. Viability and Stability of Yeast Cells and Filamentous Fungus Spores During Freeze-Drying: Effects of Protectants and Cooling Rates. Mycologia, 1991, 83 (6), pp. 805-15.
21. Gouwei, S.; Yang, X.; Li, C.; et al. Comprehensive optimization of composite cryoprotectant for Sac-charomyces boulardii during freeze-drying and evaluation of its storage stability. Preparative Bio-chemistry & Biotechnology, 2019, 49 (9), pp. 846-57.
22. Hubálek, Z. Protectants used in the cryopreservation of microorganisms, Cryobiology, 2003, 46(3), pp. 205-29.
23. Gutiérrez, Y.A.; Bustamante, S.L.; Buitrago, G. Evaluación de métodos para la conservación de hongos fitopatógenos del ñame (Dioscorea sp). Rev. Colomb. Biotecnol, 2009, 11(2), pp. 8-18.
24. Burguet, N. Evaluación del cultivo liofilizado de Candida albicans utilizado en esquemas de certifica-ciones de calidad. Rev Cuba Hig Epidemiol, 2014, 52(3), pp. 321-329.
25. Moreira, T.; Gutiérrez, A.; Heminia, D. Aspectos físicos relacionados con los aditivos en el proceso de liofilización. Papel relevante de los carbohidratos. Biotecnología aplicada, 1994; pp. 113-6.
26. Tan, C.S., Ingen, C.W., Talsma, H.. et al. Freeze-Drying of Fungi: Influence of Composition and Glass Transition Temperature of the Protectant. Cryobiology, 1995, 32 (1), pp. 60-67.
27. Balows, A.; Hausler, J.; Herrmann, K.L.; Isenberg, H.D. Manual of Clinical Microbiology. Rev Inst Med Trop São Paulo, 1991, 33, pp. 434-434.
28. Alarcón, D. Evaluación de técnicas de conservación para hongos filamentosos y levaduriformes en el cepario de la pontificia universidad javeriana. Tesis de grado, microbiología industrial, Pontificia Universidad Javeriana, 2006;152. Disponible en http://hdl.handle.net/10554/8280
29. Henao, I.; Correa, M.F.; Marín, G. Evaluación de métodos de conservación para a Aspergillus niger con actividad enzimática amilolítica. Univ Sci, 2006, 11(2), pp. 51-60.
30. Lee, J.J. ATCC Preservation Methods: Freezing and Freeze-Drying, J Protozool, 1992, 39(5), 1992, pp. 651-651.
Received: 28 September 2023/ Accepted: 15 November 2023 / Published:15 December 2023
Citación: Montoya-Arango, D.; Quintero-Rodríguez M.; Restrepo-Posada, D.; González-Gil, D. Evaluación de la viabilidad, estabilidad y pureza post liofilización en diferentes modelos fúngicos de la Colección de Microorganismos de la Escuela de Microbiología de la Universidad de Antioquia, Colombia.
Revis Bionatura 2023;8 (4) 22. http://dx.doi.org/10.21931/RB/2023.08.04.22
