2020.05.03.21
Files > Volume 5 > Vol 5 No 3 2020
NEWS AND VIEWS /NOTICIAS Y OPINIONES
Pruebas rápidas para COVID-19, la mejor alternativa para Ecuador
Rapid tests for COVID-19, the best alternative for Ecuador
Ruth T. Valencia Portillo1, Bernardina Amorín Uscata1, Fernando Alexis Gonzales-Zubiate2, Katia Juscamaita Medina3, Orlando R. Sevillano1, Eduardo Milton Ramos-Sanchez1, 4
Available from: http://dx.doi.org/10.21931/RB/2020.05.03.21
RESUMEN
La enfermedad respiratoria COVID-19 causada por el virus SARS-Cov-2 cuenta con más de 18 millones de personas infectadas y más de 600 mil muertes en el mundo, en Ecuador se tienen ya más de 88 mil infectados. Siendo el cuarto país con menos pruebas de diagnóstico realizadas, Ecuador podría afrontar un retraso en la investigación epidemiología y una ausencia de datos reales de la población afectada. Se cuenta con dos tipos de pruebas para el diagnóstico de SARS-CoV-2: las pruebas moleculares que son el Gold estándar y que se basan en la detección del virus (qRT-PCR y RT-LAMP) y las pruebas rápidas que detectan anticuerpos generados por la respuesta inmunológica del paciente. Ambas pruebas presentan pros y contras que las hacen complementarias y aumentan su alcance, ya que el foco poblacional es distinto. Las pruebas moleculares pueden detectar la presencia del virus en media, una semana antes y hasta una semana después de la aparición de los síntomas. Sin embargo, qué ocurre con los individuos asintomáticos que no fueron sometidos a ningún tipo de prueba diagnóstica y que ignoran si fueron infectados o no, y en qué momento fueron infectados. Para este grupo existen las pruebas rápidas, pruebas que detectan la respuesta inmunológica del individuo. Es así como las pruebas de diagnóstico se convierten en herramientas de vital importancia, complementando los estudios de los cuadros clínicos y la búsqueda activa de personas asintomáticas que ya pasaron del pico de carga viral. Inicialmente, la cuarentena controló el número de infectados pero la dinámica económica ha obligado a la población a salir de su hogar y es por esto que en este momento se necesitan nuevas estrategias para minimizar los efectos del SARS-CoV-2. En conclusión, las pruebas rápidas serían una solución que aceleraría la identificación y aislamiento de los individuos infectados, estimando con mayor exactitud el número de contagios, lo que permitiría una mejor toma de decisiones y el desarrollo de políticas públicas para contrarrestar la presente pandemia.
Palabras clave: COVID-19, SARS-CoV-2, Ecuador, pruebas moleculares, pruebas rápidas
ABSTRACT
The respiratory disease COVID-19 caused by the SARS-Cov-2 virus has more than 18 million people infected and more than 600 thousand deaths worldwide, in Ecuador there are already more than 88 thousand infected. Being the fourth country with less diagnostic tests performed, Ecuador could face a delay in epidemiological research and an absence of real data from the affected population. There are two types of tests for the diagnosis of SARS-CoV-2: molecular tests that are the gold standard and are based on virus detection (qRT-PCR and RT-LAMP) and rapid tests that detect antibodies generated by the immune response. Both tests have pros and cons that make them complementary and increase their scope, since the population-focused is different. Molecular tests can detect the presence of the virus on average, one week before and up to one week after the onset of symptoms. However, what happens to asymptomatic individuals who did not undergo any type of diagnostic test and who do not know if they were infected or not, and at what time they were infected. For this group there are rapid tests that detect the immune response of the individual. That is how diagnostic tests become vital tools, complementing the studies of clinical pictures and the active search for asymptomatic individuals who have already passed the peak of viral load. Initially, the quarantine controlled the number of infected, but the economic dynamics have forced the population to leave their homes, and this is why new strategies are currently needed to minimize the effects of SARS-CoV-2. In conclusion, rapid tests would be a solution that would accelerate the identification and isolation of infected individuals, estimating the number of infections more accurately, allowing better decision-making and the development of public policies to counter the current pandemic.
Keywords: COVID-19, SARS-CoV-2, Ecuador, molecular tests, rapid tests
La pandemia global COVID-19, enfermedad infecciosa causada por el beta coronavirus SARS-Cov-2, actualmente cuenta con 18,6 millones de personas infectadas y más de 700 mil muertes en el mundo 1. El nuevo epicentro de infección el día de hoy es Sudamérica y a pesar de las duras medidas ejercidas por las autoridades sanitarias, no se avizora el pico de la pandemia en los países de esta región. Ecuador se posiciona en el sexto país más afectado con más de 88 mil casos (5.07/1000 habitantes); siendo las provincias de Guayas (22.1 % de casos), Pichincha (19.4. % de casos) y Manabí (8.5 % de casos) las más afectadas 2.
Actualmente Ecuador es el cuarto país en América del Sur con menor número de pruebas de diagnóstico realizadas por millón de personas1, estas pruebas comprenden pruebas moleculares (o PCR) y pruebas rápidas. La cantidad exigua de estas pruebas trae como consecuencia un retraso en la investigación epidemiológica, así como también en la evaluación real del impacto generado por el virus. Las pruebas moleculares se basan en la detección de material genético del virus (carga viral), que puede identificar una infección precoz (aún en ausencia de síntomas) o en un estadio inicial 3. Por otro lado, las pruebas serológicas detectan los anticuerpos producidos como respuesta a la infección a partir del sexto día después de los primeros síntomas. anticuerpos que duran en media 6 semanas o más 3. El desarrollo de pruebas serológicas nace de la necesidad de tener una herramienta para el diagnóstico y estudios seroepidemiológicos, ya que estas pruebas son más fáciles de aplicar y necesitan de menos infraestructura que las pruebas moleculares.
Las pruebas moleculares están basadas en la técnica de transcripción reversa seguida de la reacción en cadena de polimerasa cuantitativa (qRT-PCR) denominada como el Gold estándar para detección de SARS-CoV-2. Esta prueba detecta genes conservados del virus como el gen RNA dependiente de RNA polimerasa (RdRp), el gen de la cápside (E) y el gen de la proteína Spike (S) 4; actualmente existen kits moleculares en los que se identifica más de un gen, mejorando así la especificidad y eficiencia de la prueba 5. Para la detección de genes virales se usan muestras de hisopado nasofaríngeo, heces, esputo y lavado bronquio-alveolar de una persona infectada, siendo estos dos últimos los de mejor sensibilidad 6,7; esta técnica, en algunos casos, permite la detección incluso hasta una semana antes del inicio de los síntomas. Además del qRT-PCR, existe otra técnica molecular siendo implementada recientemente para la detección de SARS-CoV-2, la transcripción reversa seguida de una amplificación isotérmica mediada por lazo (RT–LAMP) desarrollada por Baek y colaboradores a inicios de este año 8. En este ensayo se utilizan primers diseñados para amplificar genes del virus SARS-CoV-2, como por ejemplo el gen de la nucleocápside del RNA viral 8 o, como es mostrado en otros estudios, los genes orf1ab y Spike 8. RT-LAMP genera resultados en aproximadamente 30 minutos y es interpretado por una evaluación colorimétrica que no tiene reacción cruzada aparente con otros coronavirus, virus de influenza u otros virus respiratorios.8 Tanto qRT-PCR como RT-LAMP tienen alta especificidad en casos de bajo o nulo sesgo operacional, sin embargo la existencia de un error en la toma de muestra puede dar como resultado un falso negativo 6,7,9, siendo este uno de los problemas más frecuentes. Eventualmente la falta de experiencia del personal de colecta, dan como resultado una amplificación insatisfactoria o un resultado falso negativo. Un paciente falso negativo es un riesgo para la salud pública por la capacidad de diseminación, obstaculizando así el objetivo de contener la propagación del virus. No obstante, la sensibilidad de la prueba puede variar no solo por un error en la colecta sino también dependiendo del tipo de muestra colectada, el tiempo de infección (periodo ventana de la prueba) o la carga viral del paciente 10 (Tabla 1).
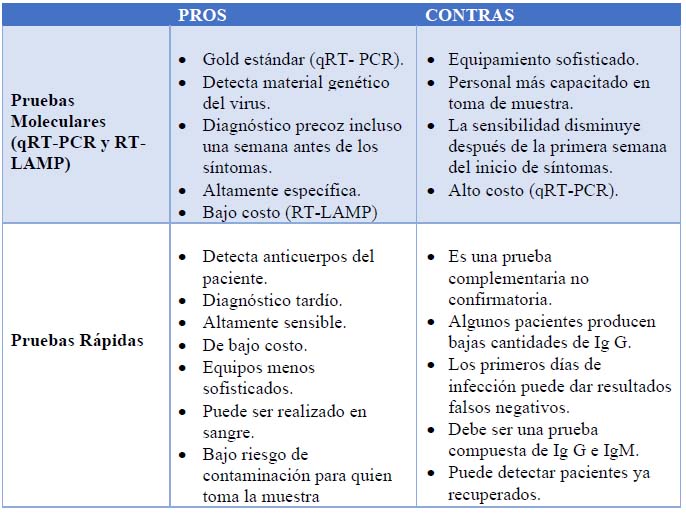
Tabla 1. Análisis de los pros y los contras de las pruebas Moleculares y las pruebas rápidas para SARS-CoV-2
Con relación a las pruebas rápidas, estas son complementarias en el diagnóstico por SARS–CoV–2, especialmente en la segunda semana del inicio de los síntomas cuando la probabilidad de un resultado falso negativo de la prueba qRT – PCR es alta 11. Las pruebas rápidas detectan anticuerpos generados por la respuesta inmunológica del paciente ante las infecciones virales, inicia con la producción de la inmunoglobulina M (IgM) considerada como la respuesta adaptativa , detectable a partir del día 5–7 del inicio de la infección (primer día de la aparición de síntomas), seguida de inmunoglobulina G (IgG) o respuesta humoral adaptativa (anticuerpos de alta afinidad) que aumenta los niveles en la semana tres y decrece después de la novena semana 12,13(Figura 1). Las pruebas rápidas son de bajo costo, rápidas (aproximadamente 15 min) y requiere menos personal ya que utilizan equipamiento menos sofisticado, reduciendo los sesgos operacionales y presentando baja probabilidad de contaminación para el operador (Tabla 1).
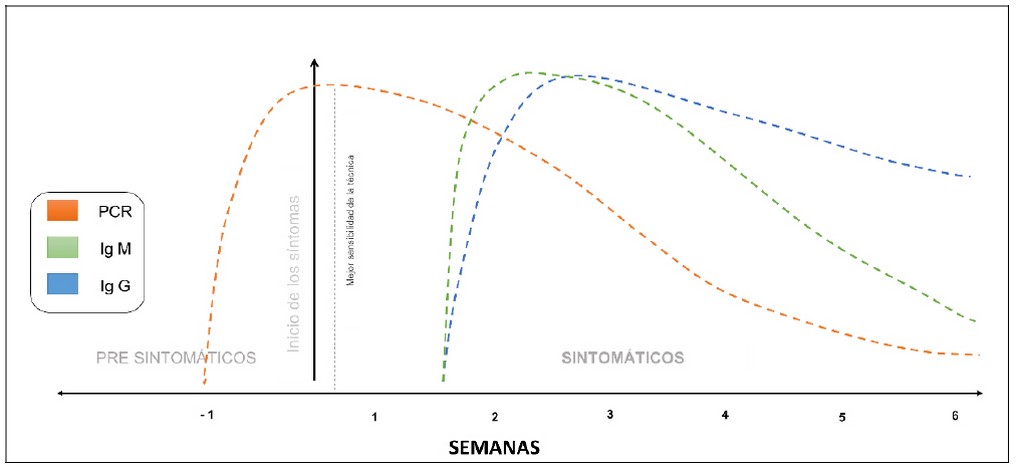
Figura 1. Variación estimada de la curva de eficiencia de los métodos moleculares y serológicas desde el inicio de la infección por SARS–CoV–2. Las técnicas moleculares son las únicas que tienen la capacidad de detectar un paciente con SARS – CoV – 2 antes de presentar síntomas, la detección de las inmunoglobulinas se da a partir de la segunda semana de presentar síntomas (el presente gráfico con los intervalos de tiempo estimados y las tasas de detección viral se basan en datos de varios informes publicados).
A diferencia de las pruebas moleculares que utilizan secreciones mucosas que contienen virus, las pruebas rápidas y en general las actuales pruebas serológicas son de primera generación y aún están siendo perfeccionadas, estas pruebas serológicas incluyen Ensayos por inmunoadsorción ligado a enzimas (ELISA), Inmunoensayos de quimioluminiscencia (CLIA), e Inmunoensayos de electroquimioluminiscencia (EIA), analizan principalmente sangre, suero o plasma. Se sabe que las pruebas serológicas que usan suero y plasma son consideradas como fuentes de baja contaminación viral y tienen mejor sensibilidad que las realizadas con sangre total o capilar 14. Las pruebas rápidas también pueden ser complementarias al diagnóstico debido a la existencia de pacientes con sospecha de COVID-19 que obtuvieron resultados negativos en las pruebas moleculares debido a factores mencionados anteriormente.
¿Cuál sería la real importancia de las pruebas rápidas? Estas son importantes porque brindan la facilidad de identificar a las personas con síntomas y también a un grupo no tan estudiado: “los individuos asintomáticos”. Estos individuos normalmente no serían detectados por una prueba molecular ya que el periodo ventana de la prueba es de aproximadamente 15 días (una semana antes y hasta una semana después de iniciados los síntomas) (Figura 1) y en el caso de los individuos asintomáticos este periodo es inidentificable. La identificación de estos dos grupos en un metaanálisis serológico de la población generaría información suficiente que permitiría la toma de decisiones para la instauración de políticas públicas como aislamiento social y apertura económica.
En la actualidad se realizan estudios serológicos de diversos tipos como por ejemplo medición de niveles de anticuerpos entre hombres y mujeres para observar correlaciones en cuanto a la producción de Ig G 15, otros estudios comparan seroprevalencia de Ig G en diversos grupos etarios 16 o estudios de metaanálisis como los ya realizados en Alemania (Gangelt), Suiza (Ginebra) y en algunas ciudades de Estados Unidos (Chelsea-MA, San Miguel-CO, Santa Clara-CA, Los Ángeles-CA) donde se identificaron no solo a personas con síntomas sino también asintomáticas 17.
Los individuos asintomáticos tienen la capacidad de transmisión del virus 16, por ello los estudios de seroprevalencia de anticuerpos Ig M e Ig G contra SARS–CoV–2 están orientados a su identificación y seguimiento, incluyendo el histórico de contacto con personas para de esta forma mitigar la propagación de la enfermedad en las ciudades 16,18. La identificación de las personas asintomáticas tiene dos objetivos: saber el número real de personas infectadas o potencialmente expuestas a infección en una población y la identificación de estas para realizar estudios futuros de respuesta inmunológica, ya que por el momento se tiene información limitada de la inmunología de estos pacientes 19.
CONCLUSIONES
Con un número creciente de contagios y expansión del virus en el mundo, la implementación de un plan para identificar y aislar a las personas infectadas en Ecuador es imprescindible para el control y reducción del número de casos, ya que se necesita una aproximación más real del número de contagios y de población afectadas para que el Ministerio de Salud Pública pueda demarcar estrategias futuras.
Es importante resaltar que aún se sabe poco sobre cómo evoluciona la infección asintomática, por consiguiente, las pruebas rápidas ayudarían a la identificación de individuos asintomáticos y esto promovería la formulación de proyectos nacionales estratégicos en los cuales se estudie la respuesta inmune protectora presente en este grupo, el perfil temporal del anticuerpo sérico con el objetivo de evaluar el tiempo de duración de inmunidad humoral y la evaluación de la protección inmune de la población.
Si bien la cuarentena brindó cierto control sobre el número de infectados, pierde fuerza a medida que la dinámica económica se va reiniciando en diferentes partes del Ecuador. En este contexto, las pruebas rápidas viabilizan una alternativa no solo de identificación sino también una estrategia de seguimiento clínico, más aún en cantones donde no se posee la infraestructura ni el número adecuado de personal calificado para realizar las pruebas moleculares.
REFERENCIAS
1. Worldometer. Coronavirus Cases. Worldometer 1–22 https://www.worldometers.info/coronavirus/#countries (2020) doi:10.1101/2020.01.23.20018549V2.
2. SITUACIÓN NACIONAL POR COVID-19. INFOGRAFÍA N°160. Inicio 29/02/2020- Corte 05/08/2020 08:00. Fuente: Ministerio de Salud Pública del Ecuador. https://www.salud.gob.ec/wp-content/uploads/2020/08/INFOGRAFIA-NACIONALCOVI-19-COE-NACIONAL-08h00-05082020-v2-2.pdf
3. Ma, H. et al. Serum IgA, IgM, and IgG responses in COVID-19. Cellular and Molecular Immunology (2020) doi:10.1038/s41423-020-0474-z.
4. Corman, V. M. et al. Detection of 2019 novel coronavirus (2019-nCoV) by real-time RT-PCR. Eurosurveillance 25, (2020).
5. Romano, C. M., Chebabo, A. & Levi, J. E. Past, present, and future of COVID-19: A review. Brazilian Journal of Medical and Biological Research vol. 53 1–8 (2020).
6. World Health Organization. Laboratory testing for 2019 novel coronavirus (2019-nCoV) in suspected human cases. WHO - Interim guidance 2019, 1–7 (2020).
7. Sethuraman, N., Jeremiah, S. S. & Ryo, A. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA - Journal of the American Medical Association vol. 323 2249–2251 (2020).
8. Baek, Y. H. et al. Development of a reverse transcription-loop-mediated isothermal amplification as a rapid early-detection method for novel SARS-CoV-2. Emerging Microbes and Infections 9, 998–1007 (2020).
9. Zhao, J. et al. Antibody responses to SARS-CoV-2 in patients of novel coronavirus disease 2019 | Clinical Infectious Diseases | Oxford Academic. Clinical Infectious Diseases ciaa344, (2020).
10. Vashist, S. K. In vitro diagnostic assays for COVID-19: Recent advances and emerging trends. Diagnostics vol. 10 (2020).
11. Wölfel, R. et al. Virological assessment of hospitalized patients with COVID-2019. Nature 581, 465–469 (2020).
12. Document of Royal College of Pathologists of Australasia (RCPA), of 01/04/2020 - RCPA advises against COVID-19 IgG/IgM rapid tests for the detection of early COVID disease.
13. Azkur, A. K. et al. Immune response to SARS-CoV-2 and mechanisms of immunopathological changes in COVID-19. Allergy: European Journal of Allergy and Clinical Immunology vol. 75 1564–1581 (2020).
14. Montesinos, I. et al. Evaluation of two automated and three rapid lateral flow immunoassays for the detection of anti-SARS-CoV-2 antibodies. Journal of Clinical Virology 128, (2020).
15. Zeng, F. et al. A comparison study of SARS-CoV-2 IgG antibody between male and female COVID-19 patients: A possible reason underlying different outcome between sex. Journal of Medical Virology (2020) doi:10.1002/jmv.25989.
16. Ling, R. et al. Seroprevalence and epidemiological characteristics of immunoglobulin M and G antibodies against SARS-CoV-2 in asymptomatic people in Wuhan, China. doi:10.1101/2020.06.16.20132423.
17. Levesque, J. & Maybury, D. W. A note on COVID-19 seroprevalence studies: a meta-analysis using hierarchical modelling. (2020) doi:10.1101/2020.05.03.20089201.
18. Yu, X. et al. Unclear but present danger: An asymptomatic SARS-CoV-2 carrier. Genes & Diseases (2020) doi:10.1016/j.gendis.2020.07.010.
19. Long, Q.-X. et al. Clinical and immunological assessment of asymptomatic SARS-CoV-2 infections. Nature Medicine (2020) doi:10.1038/s41591-020-0965-6.
Recibido: 10 julio 2020
Aceptado: 6 agosto 2020
Ruth T. Valencia Portillo1, Bernardina Amorín Uscata1, Fernando Alexis Gonzales-Zubiate2, Katia Juscamaita Medina3, Orlando R. Sevillano1, Eduardo Milton Ramos-Sanchez1, 4
1 Instituto de Medicina Tropical de São Paulo, Faculdade de Medicina, Universidade de São Paulo, IMTSP-USP, São Paulo, Brazil;
2 School of Biological Sciences and Engineering, Yachay Tech University, Ecuador;
3 Hospital Nacional Carlos Alberto Seguin Escobedo EsSalud, Red Asistencial, Arequipa, Perú;
4 Departamento de Salud Pública, Facultad de Ciencias de la Salud, Universidad Nacional Toribio Rodríguez de Mendoza de Amazonas, Chachapoyas 0100, Perú
Autor de correspondencia: Eduardo Milton Ramos Sanchez [email protected]
Ruth T. Valencia Portillo https://orcid.org/0000-0003-3552-8318
Bernardina Amorín Uscata https://orcid.org/0000-0002-4140-5915
Fernando Alexis Gonzales-Zubiate https://orcid.org/0000-0001-9519-4079
Katia Juscamaita Medina https://orcid.org/0000-0002-0718-440X
Orlando R. Sevillano https://orcid.org/0000-0002-7845-6126
Eduardo Milton Ramos-Sanchez https://orcid.org/0000-0001-8700-5469
