2021.06.03.33
Files > Volume 6 > Vol 6 No 3 2021
Herramientas biotecnológicas en el diagnóstico, prevención y tratamiento frente a pandemias
Biotechnological tools in the diagnosis, prevention, and treatment of pandemics

Pamela, Molina1 and Marbel, Torres Arias1,2
Available from http://dx.doi.org/10.21931/RB/2021.06.03.33
RESUMEN
Las pandemias son consideradas como un problema emergente de salud pública a nivel mundial, las cuales además de caracterizarse por tasas altas de morbilidad y mortalidad, ocasionan conflictos en los aspectos sociales, económicos y políticos. Las herramientas biotecnológicas, por su parte, han ido evolucionando conforme al avance tecnológico-científico, lo que ha permitido optimizar métodos de diagnóstico con alta sensibilidad y especificidad, además de mejorar el desarrollo de productos biológicos para la prevención y terapia de enfermedades. El objetivo de esta revisión es identificar la actualización de las herramientas biotecnológicas en el diagnóstico, tratamiento terapéutico y profiláctico frente a los patógenos causantes de las enfermedades pandémicas a lo largo de la historia, mediante la recopilación de información científica. Con este estudio se logró establecer que las herramientas y productos de origen biotecnológico han constituido un papel fundamental en el control de pandemias a través de la innovación constante que ha permitido alcanzar resultados eficientes tanto en diagnóstico como en el tratamiento.
Palabras clave: diagnóstico, herramientas biotecnológicas, pandemias, productos biológicos, vacunas
ABSTRACT
Pandemics are considered as an emerging public health problem worldwide, which in addition to being characterized by high rates of morbidity and mortality cause conflicts in social, economic and political aspects. Biotechnological tools, for their part, have evolved according to technological-scientific advance, which has allowed optimizing diagnostic methods with high sensitivity and specificity; in addition to improving the development of biological products for the prevention and therapy of diseases. The objective of this review is to identify the performance of biotechnological tools in the diagnosis, therapeutic and prophylactic treatment against pathogens that cause pandemic diseases throughout history, through the collection of scientific information. Finally, with this study it was possible to establish that tools and products of biotechnological origin have constituted an fundamental role in the control of pandemics through constant innovation that has allowed achieving efficient results in both diagnosis and treatment.
INTRODUCCIÓN
La manifestación de enfermedades infecciosas a lo largo de la historia de la humanidad además de ser una de las principales causas de mortalidad y morbilidad 1,2, han dejado secuelas letales y duraderas en el ámbito social, económico y político, siendo las de mayor proporción las enfermedades que han sido capaces de provocar pandemias3–5. Es así que una de las catástrofes más devastadoras que ha golpeado al mundo es la peste negra, en el siglo XIV, ocasionando el fallecimiento del 30-50% de la población europea de la época, en un corto periodo de tiempo (1347-1351) 6.
El desarrollo de enfermedades infecciosas emergentes puede ocurrir por tres eventos claves: 1) el cruce de barreras geográficas debido a la invasión de espacios silvestres, 2) el cruce de barreras por compatibilidad gracias a la evolución y 3) el levantamiento de barreras por el cambio de condiciones ambientales que favorecen la formación del nicho ecológico adecuado, siendo la primera la que define la situación 7. Jones et al. 8 concluyeron en su investigación que el 60,3% de enfermedades infecciosas son originadas por patógenos zoonóticos y el 71.8% de estas son de origen silvestre, lo que indica que estos microorganismos figuran una amenaza potencial para la salud mundial, con perspectiva a la manifestación de epidemias y posibles pandemias, en caso de no tomar las medidas precautelares.
Durante el origen de una epidemia y/o pandemia, el diagnóstico temprano, el tratamiento, el seguimiento epidemiológico y la prevención de futuras infecciones han sido procesos fundamentales para el manejo clínico, control y mitigación de la enfermedad 9,10. Aquí la biotecnología juega un papel fundamental, por lo que en este estudio se consideran las herramientas biotecnológicas modernas empleadas en el desarrollo de pruebas de diagnóstico, producción de moléculas biotecnológicas para el tratamiento y en el diseño de vacunas. Con el objetivo de identificar la evolución y optimización a través del tiempo de las herramientas biotecnológicas cuando nos enfrentamos a infecciones a nivel pandémico, mediante la comparación de sensibilidad y especificidad de los diferentes enfoques establecidos para el diagnóstico, y la recopilación de los resultados de los principales productos biotecnológicos llevados a ensayos clínicos en cada enfermedad.
Para la redacción del artículo se llevó a cabo una revisión bibliográfica exhaustiva en revistas de alto impacto, en las que se tomó en cuenta: artículos originales, revisiones, resúmenes de conferencias y demás. Obteniéndose datos actualizados de nueva tecnología desarrollada para diagnóstico, tratamientos biológicos, desarrollo de vacunas y su influencia en el manejo de epidemias y pandemias para apoyar al control de la Salud Publica.
Epidemias y pandemias importantes a partir de 1950
El término epidemia se refiere a “un brote de una enfermedad (especialmente una enfermedad infecciosa) que afecta a un gran número de personas dentro de una población al mismo tiempo” 11. Por otro lado, pandemia se define como “una epidemia que ocurre en un área muy amplia, cruzas fronteras
internacionales y generalmente afecta a un gran número de personas” 12.
Existen condiciones imprescindibles para la aparición de una epidemia, entre las características se hallan: transmisión eficiente entre humanos, un índice significativo de letalidad, falta de un tratamiento médico efectivo, una población inmunológicamente deprimida y una forma de diseminación rápida 13.
Es asi que, una pandemia se entiende como una enfermedad que ha alcanzado los cinco continentes, mientras que una epidemia es una enfermedad se esparce localmente 11,12.
A continuación, se abordarán el diagnóstico (Tabla 1), tratamientos biológicos (Tabla 2) y vacunas (Tabla 3) de las pandemias y epidemias más importantes en época cronológica, a partir del inicio de la biotecnología moderna (Figura 1).

Figura 1. Las principales pandemias a partir de 1950. Origen y número de muertes a nivel mundial.
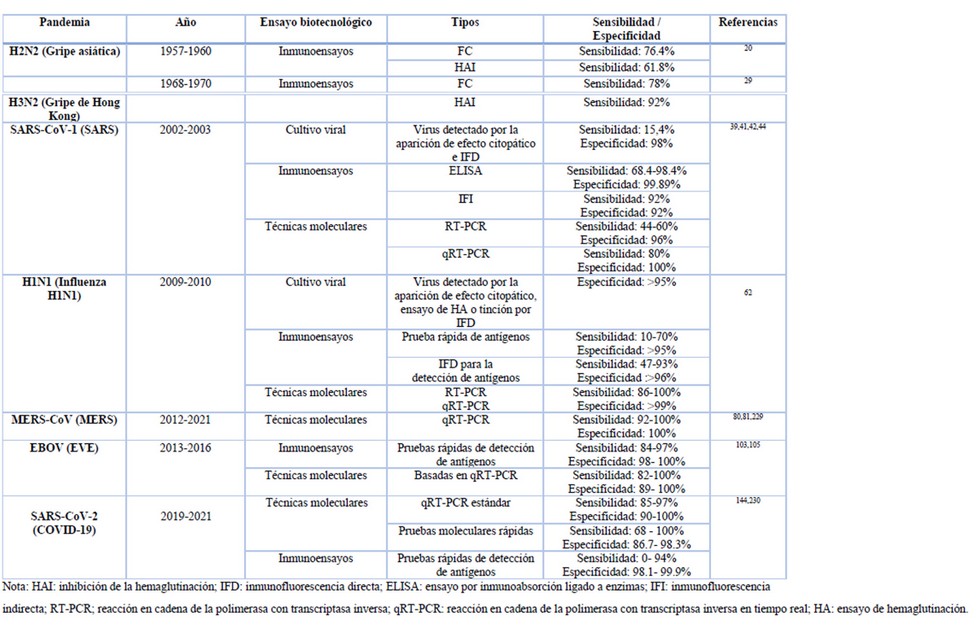
Tabla 1. Especificidad y sensibilidad de las herramientas biotecnológicas frente al diagnóstico de pandemias
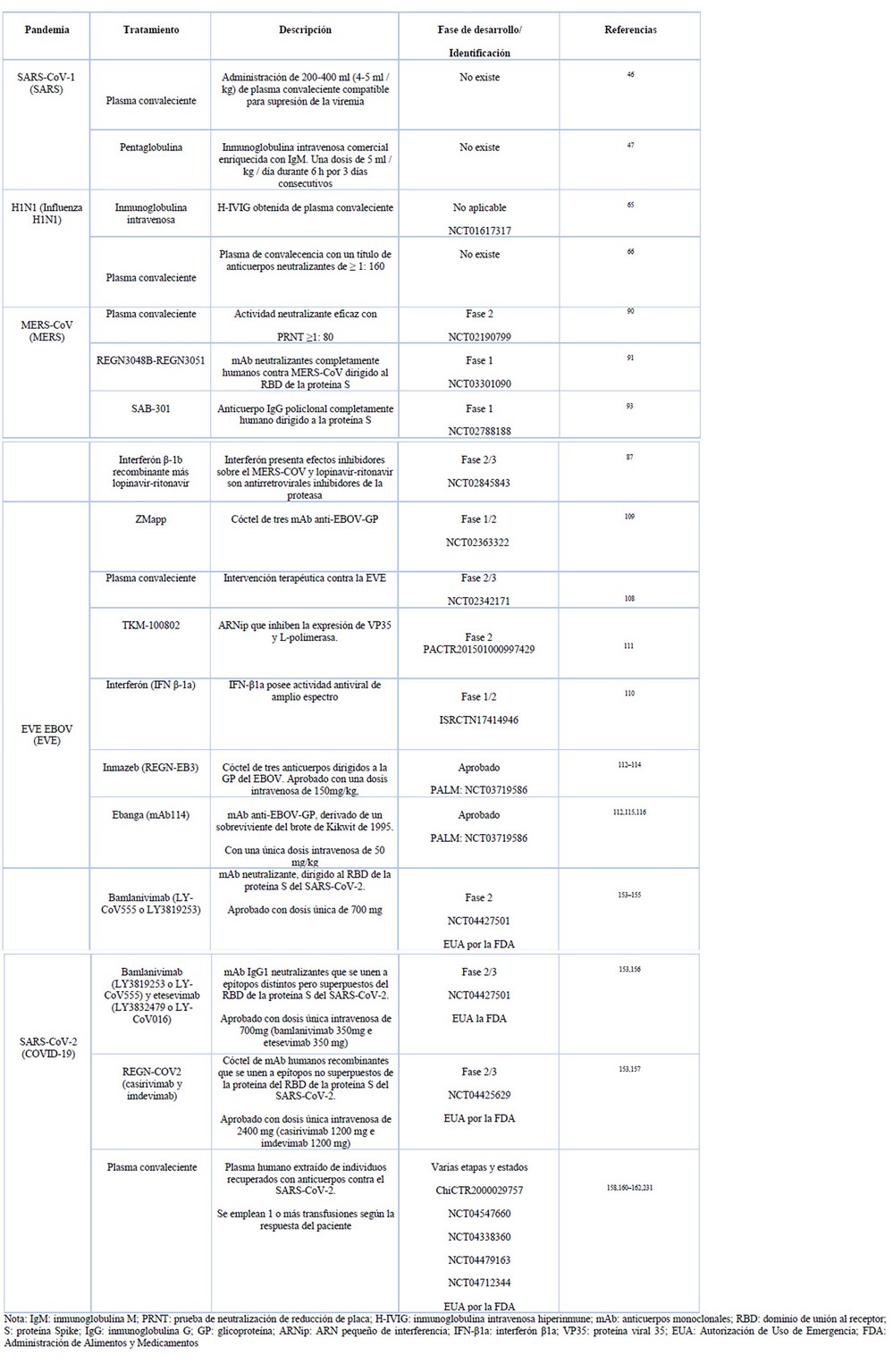
Tabla 2. Principales ensayos clínicos de herramientas biotecnológicas usadas como tratamiento terapéutico y profiláctico de pandemias
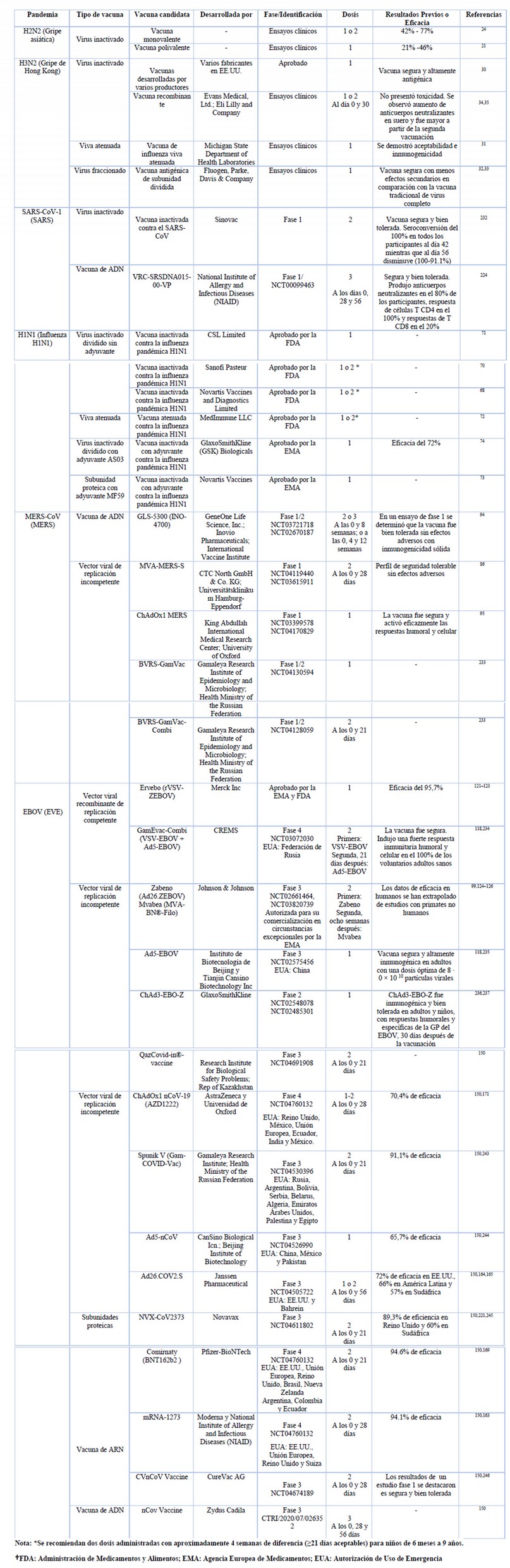
Tabla 3. Desarrollo de vacunas frente a pandemias
H1N1 (1918-1919)
La pandemia de influenza más grave de la historia fue la gripe española H1N1 en 1918 14, cubrió el mundo en cuatro meses cobrando aproximadamente de 50 a 100 millones de vidas 15. La falta de recursos limitó la identificación del origen de la gripe con lo que se hizo imposible el hallazgo de vacunas, además, no se logró controlar las infecciones secundarias con neumonía bacteriana debido a que la penicilina no se descubrió hasta 1928. A pesar del esfuerzo de las compañías farmacéuticas el virus desapareció antes de conseguir aislarlo 14.
H2N2 (1957-1960)
Segunda gran pandemia de influenza registrada, la gripe asiática surgió en Singapur a finales de febrero de 1957 y duró hasta 1960, fue provocada por un subtipo de virus de la influenza A, denominado H2N2 16,17. A nivel mundial se registraron 1,1 millones de fallecimientos 18.
El diagnóstico de la enfermedad se ejecutó mediante pruebas serológicas de laboratorio. La identificación de anticuerpos contra el antígeno viral del subtipo H2N2 a partir de suero de personas afectadas se realizó con la técnica de fijación del complemento (FC) y la prueba de inhibición de la hemaglutinación (HAI) con el uso de tripsina y periodato de potasio para la inactivación de inhibidores específicos 19,20. Los estudios y la experiencia de campo demostraron que la FC presentó mayor sensibilidad, sin embargo, existieron casos en los que se requirieron de las dos técnicas para un diagnóstico confirmatorio 20.
Tratamiento terapéutico y profiláctico
La mortalidad de la pandemia de gripe asiática se redujo aproximadamente un 97% en comparación con la pandemia de gripe española 15. Una de las aportaciones fundamentales en el control de la propagación de la influenza asiática fue el rápido proceso de preparación y distribución de la vacuna frente al virus H2N2, se estima que en julio de 1957 inició el primer estudio clínico 21,22.
Existieron varias vacunas inactivadas de influenza en ensayos en humanos, desarrolladas a partir de líquido alantoideo de embriones de pollo infectados con diferentes cepas de influenza23,24. Entre las que se encontraron vacunas monovalentes 21–23,25 y polivalentes, en el caso de las polivalentes en algunas se incluyó el virus H2N2 25. Para la inactivación del virus se manejaron técnicas como irradiación ultravioleta 21 y el empleo de formalina 22,23,25.
Las vacunas fueron probadas con diversas concentraciones de unidades de aglutinación de células de pollo (CCA) por mililitro, oscilando entre 200 CCA a 750 CCA 24, los resultados evidenciaron un porcentaje de eficacia estimado de 42% a 77% 24. Asimismo, se observó que la protección inducida era directamente proporcional a la dosis administrada de vacuna ante la presencia de una cepa de H2N2, estos datos se evaluaron mediante FC e HAI, en los que se determinaron el aumento de los niveles de anticuerpos contra el virus de la influenza asiática posterior a la vacunación en pacientes participantes 21,23,25.
Debido a que Centro América y Sudamérica no contaban con los recursos ni la tecnología para el desarrollo de una vacuna, y sumando los problemas serios en la salud pública, los sistemas de control no fueron efectivos como en Norteamérica. Por lo que, solo grupos selectos de personas en Chile, Brasil y Argentina accedieron al medicamento 26.
H3N2 (1968-1970)
La siguiente pandemia provocada por un virus de la influenza A surgió en julio de 1968 al sureste de China, con el subtipo H3N2, extendiéndose hasta 1970. La enfermedad se denominó gripe de Hong Kong, la cual provocó entre 1 y 4 millones de muertes a nivel mundial 27,28. El diagnóstico se basó en la identificación de síntomas combinado con ensayos serológicos. Para la detección de anticuerpos contra el virus H3N2 se empleó HAI y FC, con el uso de antígenos obtenidos del líquido alantoideo de huevo de las variantes aisladas de las diferentes propagaciones. Dando mejores resultados la HAI, sin embargo, fue recomendable realizar los dos métodos para obtener una máxima eficiencia en el serodiagnóstico 29.
Tratamiento terapéutico y profiláctico
Posterior al aislamiento viral y la confirmación de la aparición de H3N2, una variante antigénica del virus de la influenza con potencial epidémico, la cepa aislada fue distribuida a los laboratorios para la investigación y producción de vacunas 27,30. En EE. UU., en noviembre del mismo año estuvo disponible el primer lote de producción con 110 000 dosis, se trató de una vacuna inactivada monovalente de 400 CCA, desarrollada en huevos fértiles de gallina con la cepa Aichi de la influenza H3N2. A diferencia de la anterior pandemia, en esta ocasión existió un mayor número de vacunados, principalmente personas pertenecientes al grupo prioritario. Las semanas siguientes al lanzamiento del primer lote se produjeron y comercializaron alrededor de 123 millones de dosis 30.
Maassab et al. 31 diseñaron y probaron una vacuna de influenza viva atenuada desarrollada en huevos de gallina. La atenuación de una línea del virus de Hong Kong se llevó a cabo mediante cambios abruptos en la temperatura de incubación de la cepa viral, esta técnica acortó el proceso a 3 meses, en comparación con métodos anteriores que empleaban cambios decrecientes de temperatura de forma gradual, las cuales duraban de 6 a 8 meses. Los ensayos clínicos de esta vacuna demostraron aceptabilidad e inmunogenicidad de la cepa atenuada, por lo que este proceso se consideró prometedor para el desarrollo futuro de vacunas contra la influenza. Por otro lado, se aprobó la aplicación de vacunas de virus fraccionados, mediante éter 32 o desoxicolato de sodio 33, que se conformaron de fragmentos específicos del virus capaces activar la inmunidad de forma más segura. Las respuestas inmunológicas inducidas por dichas vacunas fueron tan eficientes como las desarrolladas por las vacunas convencionales, constituidas por el virus completo, además se observó menos efectos secundarios después de la vacunación 32,33.
Otra de las investigaciones que marcó el control de futuras epidemias y pandemias, fue el uso de recombinación genética para la facricación de una vacuna 34,35. Este avance mostró que la producción de variantes genéticas adecuadas para la construcción de una vacuna, fue posible desarrollarlas de forma deliberada 34, sustituyendo a métodos de selección tradicionales 30. La construcción del virus recombinante de alto rendimiento (X-31) se realizó mediante el reordenamiento genético de una cepa estándar de laboratorio de alto rendimiento (A0 / PR / 8), la cual proporcionó los genes de adaptación y crecimiento; con la cepa Aichi del virus de Hong Kong, considerada como una cepa de bajo rendimiento, la cual aportó los genes que codificarían el nuevo antígeno de interés 34. Los ensayos clínicos de una vacuna inactivada recombinante con el virus X-31 mostraron ausencia de toxicidad, alta antigenicidad y protección frente a la influenza 35.
SARS-CoV-1 (epidemia 2002-2003)
El síndrome respiratorio agudo severo (SARS), provocado por el coronavirus del SARS (SARS-CoV) fue la primera gran epidemia del siglo XXI, apareció en Guangdong-China en noviembre de 2002 y finalizó en julio de 2003, hasta donde se registraron 8437 infectados y 813 muertes a nivel mundial 36,37.
Para el diagnóstico de la infección por SARS-CoV la Organización Mundial de la Salud (OMS) estableció tres ensayos de laboratorio, entre los que se encontraron: pruebas moleculares, pruebas de anticuerpos y cultivo celular 38, a partir de diferentes muestras clínicas como esputo, aspirado o lavado nasofaríngeo, hisopos nasofaríngeos y orofaríngeos, lavado bronquio alveolar, heces, orina y suero o plasma 39–41.
Una de las técnicas modernas fue la detección de ARN del coronavirus mediante RT-PCR dirigida al gen de la nucleocápside (N) o al marco abierto de lectura (ORF) 1b, con la que se consiguió alta especificidad; sin embargo, la sensibilidad fue inferior a la necesaria en los primeros días del desarrollo de la infección. Esta prueba se optimizó con el análisis de más de una muestra originaria del mismo paciente, o con la doble ejecución del ensayo, logrando el aumento de la sensibilidad del diagnóstico 39,40. Otra forma de mejorar la sensibilidad y precisión del examen molecular fue el perfeccionamiento de los métodos de extracción de ARN previo a la qRT-PCR, facilitando la cuantificación de la carga viral y el reconocimiento precoz del SARS, por lo que se convirtió en el ensayo pilar para el diagnóstico prematuro de la enfermedad 41.
En el aislamiento viral a partir de cultivo celular se emplearon muestras clínicas para infectar células cómo células de riñón fetal de mono rhesus (FRhK-4) o células Vero E6, en las que se analizó el efecto citopático y se realizó tinción por inmunofluorescencia. Los resultados indicaron un rendimiento menor en comparación con los ensayos moleculares, debido a que únicamente muestran la presencia del virus vivo 39,42. Finalmente, la detección de seroconversión fue la prueba estándar para la confirmación virológica retrospectiva de la infección por SARS-CoV, se manejó ELISA e IFI para la identificación de anticuerpos IgG, los cuales se reconocieron después de la primera semana de infección 39,43,44.
Tratamiento terapéutico y profiláctico
Debido a que no existió un tratamiento específico para el SARS, se probaron varios agentes inmunomoduladores y compuestos con potencial antivírico 45,46. La terapia con plasma convaleciente fue una de las alternativas de tratamiento y prevención. La administración antes de los 14 días desde el inicio de la infección o durante la fase virémica y seronegativa, presentó una tasa de alta médica más temprana y una tasa de mortalidad menor en comparación con los pacientes que recibieron el plasma posterior a los 14 días. Además, no se evidenció efectos secundarios inmediatos después de la aplicación del plasma 46. Por otro lado, la pentaglobulina se administró como una solución enriquecida en IgM a 12 pacientes en etapa grave de SARS. Diez personas tuvieron una recuperación favorable sin eventos adversos, posterior al tratamiento. Como evidencia se estableció el progreso relevante en las puntuaciones radiográficas y en el requerimiento de oxígeno 47.
En el caso del tratamiento profiláctico, se produjeron varias vacunas candidatas contra el SARS-CoV. Zhou et al. 48 llevaron a cabo estudios preclínicos de una vacuna inactivada con formaldehído, en monos Rhesus. Los resultados expusieron que a una dosis de 50 µg, la vacuna fue capaz de inducir inmunidad humoral específica 7 días después de la primera inmunización y el título de anticuerpos IgG se elevó posterior a la segunda inmunización; mientras que con la administración de dosis de 0.5 y 5 µg se observó inmunidad parcial. Además, no se presenció efectos adversos significativos en los animales inmunizados hasta con una dosis de 5000 µg y en el 41.7% de los monos que recibieron la vacuna se determinó anticuerpos IgA anti-SARS-V en las mucosas nasofaríngeas.
Yang et al.49 experimentaron una vacuna de ADN que tradujo la glicoproteína Spike (S) del SARS-CoV, en modelos animales, la cual estimuló respuestas de células T, producción de anticuerpos neutralizantes e inmunidad protectora. La replicación viral se redujo seis veces en los pulmones de los ratones inmunizados después de la infección por el coronavirus. Las vacunas de vectores virales fueron otra opción, Gao et al.50, desarrollaron tres vectores basados en adenovirus, los que expresaron proteínas antigénicas de estructura del SARS-CoV con codones optimizados, entre las que se encontraron el fragmento S1 de la proteína S, la proteína de membrana (M) y la proteína N. La inmunización se realizó con una combinación de los tres vectores en macacos Rhesus al día 0, y una vacuna de refuerzo con el mismo régimen a los 28 días. En todos los animales tratados se encontró anticuerpos neutralizantes específicos contra el fragmento S1 y respuesta de células T contra la proteína N, al mismo tiempo, todas las muestras de suero de los animales vacunados mostraron una gran capacidad neutralizante contra el virus SARS-CoV.
A pesar de que no se logró llegar a ensayos clínicos durante esta pandemia, en años posteriores dos vacunas lograron desarrollar estudios clínicos fase 1 (Tabla 3).]
H1N1 (2009-2010)
[El virus de la influenza A H1N1 de origen porcino apareció por primera vez en abril de 2009 en los Estados Unidos y en México 51, la pandemia finalizó en agosto de 2010, sin embargo, el virus continúa circulando y provocando la gripe estacional 52. Se estima que la pandemia dejó 151 700 - 575 500 muertes a nivel mundial 53.
La OMS 54 estableció varias pruebas de laboratorio para la confirmación de la infección causada por el virus de influenza de origen porcino (S-OIV) H1N1. Entre las que se encontraron: diagnóstico molecular con ensayos de RT-PCR y qRT-PCR; aislamiento y la tipificación viral, detección de antígenos para lo que se recomendaron pruebas rápidas de flujo lateral e IFD, y finalmente ensayos serológicos como HAI y micro-neutralización para la evaluación de títulos de anticuerpos contra S-OIV. Las muestras de vías respiratorias superiores fueron las más recomendadas, como aspirados e hisopos nasofaríngeos, hisopos nasales o de garganta; además se empleó muestras de suero en pacientes convalecientes para el reconocimiento de títulos de anticuerpos 55.
La qRT-PCR fue la prueba de referencia para el diagnóstico de la influenza A (H1N1), la identificación de diferentes genes diana fue apropiado para el diagnóstico preciso 54,56. La primera prueba de este tipo aprobada por la Administración de Alimentos y Medicamentos (FDA) con una autorización de uso de emergencia (EAU), fue realizada por los Centros para el Control y Prevención de Enfermedades (CDC) y fue dirigida al gen de la proteína M, la cual mostró una sensibilidad 99.3% y una especificidad del 92.3%, se trató de un ensayo singleplex para la tipificación y subtipificación viral 57–59. Para el diagnóstico mediante cultivo viral, la OMS recomendó aislar el virus en células de riñón canino Madin-Darby (MDCK) en presencia de tripsina o en huevos embrionados 54. Entre las desventajas de esta técnica se establecieron el tiempo tardío para la obtención de resultados (3-14 días) y la baja sensibilidad 58.
Las pruebas rápidas de diagnóstico de influenza (RIDTS) mostraron una sensibilidad variable y menor que las pruebas moleculares y el cultivo viral, por lo que un resultado negativo no descartó la infección por el virus de la influenza A (H1N1) 57,60. Vasoo et al. 61 evaluaron tres RIDTS para el virus de la influenza pandémica A/H1N1 en muestras positivas confirmadas con RT-PCR. Las sensibilidades halladas estuvieron en un nivel de bajo a moderado (46.7%, 38.3% y 53.3%) y presentaron una excelente especificidad, sin reactividad cruzada con otros virus estacionales. El ensayo de IFD, otra de las pruebas para la detección de antígenos mostró amplia disponibilidad y un tiempo de procesamiento promedio de 2-4 horas, sin embargo, al igual que las RIDTS no fueron capaces de distinguir la influenza H1N1 2009 de otros virus de la influenza A 62.
Tratamiento terapéutico y profiláctico
Un porcentaje de la población mayor a los 65 años poseían anticuerpos contra el nuevo virus de esta influenza pandémica, esto pudo ser posible por la exposición anterior al virus H1N1 en 1918 52. Debido a la aparición del S-OIV H1N1 en humanos con una composición genética previamente no conocida, diferente al virus de la influenza A estacional 63; además de la fácil transmisibilidad entre humanos 64, el sistema de salud mundial inició rápidamente el desarrollo de antivirales y de una nueva vacuna para el tratamiento y prevención de la infección.
La terapia con inmunoglobulina intravenosa hiperinmune (H-IVIG) obtenida a partir de plasma convaleciente de personas recuperadas fue probado como una alternativa antiviral en pacientes con infección por la influenza pandémica, los resultados mostraron que la administración de H-IVIG dentro de los 5 días posteriores al inicio de los síntomas se asoció a una disminución de la carga viral y reducción de mortalidad 65. De igual manera, la administración de plasma convaleciente con un título de anticuerpos neutralizantes ≥ 1:160 en pacientes afectados, disminuyó la carga viral, las respuestas de citocinas séricas y la mortalidad 66.
Para el control de esta pandemia se autorizaron dos tipos de vacunas monovalentes, un grupo de vacunas inactivadas divididas de administración intramuscular y otro grupo de vacunas atenuadas en aerosol de administración intranasal 67.
En septiembre de 2009, la FDA aprobó las primeras vacunas para el tratamiento contra la gripe porcina con la cepa A / California / 7/2009 (H1N1)68,69, entre las que se encontraron tres vacunas monovalentes, inactivadas y sin adyuvante, fabricadas por Sanofi Pasteur 70, Novartis Vaccines and Diagnostics Limited 68 y CSL Limited 71, con 15 µg de hemaglutinina (HA), y la cuarta fue una vacuna, monovalente, viva atenuada y sin adyuvante elaborada por MedImmune LLC 72. En Europa la Agencia Europea de Medicamentos (EMA) aprobó vacunas con adyuvantes en una emulsión aceite-agua, una de ellas con MF59 y 7.5 µg de HA desarrollada por Novartis Vaccines 73, y otra con AS03 y 3.75 µg de HA fabricada por GlaxoSmithKline (GSK) Biologicals 74. Una revisión sistemática identificó que las vacunas inactivadas monovalentes A (H1N1) pdm09 fueron efectivas para prevenir la influenza pandémica. En los niños, las vacunas con adyuvante fueron más efectivas en comparación con las vacunas sin adyuvante 75. Por otro lado, otro estudio que analizó la efectividad de una vacuna inactivada con adyuvante y una atenuada, mostró que las vacunas fueron eficaces para prevenir la infección confirmada por la influenza pandémica A (H1N1) 2009 a a partir de una semana después de la vacunación 74.
MERS-CoV (epidemia 2012-2021)
Entre las pruebas de laboratorio empleadas para la detección de MERS se encuentran las moleculares y las serológicas. Los ensayos moleculares se utilizan para el diagnóstico de la infección viral activa en personas con síntomas clínicos o que han estado en contacto con casos confirmados con MERS-CoV. Por otra parte, los estudios serológicos llevados a cabo por la detección de anticuerpos, se aplican con fines de vigilancia e investigación, y no de diagnóstico 78.
El ensayo de qRT-PCR a partir de muestras respiratorias inferiores, superiores, suero y heces, ha sido la técnica tradicional en el diagnóstico de MERS-CoV. Para la confirmación de la infección se requiere un resultado positivo de qRT-PCR para dos regiones genómicas únicas y específicas del virus, o un resultado positivo para una sola diana y la secuenciación de otra 78,79. Entre las dianas genéticas recomendadas para la detección primaria del MERS se encuentran las regiones aguas arriba del gen de la proteína E (UpE) y el gen N 79,80, mientras que las pruebas confirmatorias se orientaron al ORF1a, ORF1b o al gen N 79,81.
Se han investigado otras posibles técnicas moleculares apropiadas para el diagnóstico. Por ejemplo, la RT-RPA mostró una especificidad comparable a la de la RT-PCR, con beneficios adicionales como el corto tiempo de determinación (3-7 minutos) y la facilidad de movilidad 82. La RT-LAMP fue posible llevarla a cabo en menos de una hora, con una alta especificidad y sin reacciones cruzadas 83. Huang et al. 84 optimizaron dicha técnica, y establecieron un ensayo de visualización de ácidos nucleicos con la combinación del ensayo RT-LAMP y una tira de visualización de flujo vertical (RT-LAMP-VF), con el fin de detectar el gen N del MERS-CoV, con alta especificidad, en un tiempo estimado de 35 minutos y sin el empleo de equipos de alto costo.
Tratamiento terapéutico y profiláctico
La atención de apoyo y la prevención de complicaciones, como el síndrome de dificultad respiratoria y las infecciones nosocomiales son las principales estrategias para prevenir la epidemia del MERS. Hasta el momento, se han registrado vacunas y antivirales en fase de desarrollo 85–87.
Varias de las opciones de tratamiento, se han basado en anticuerpos neutralizantes 88,89. En el brote de Corea en el 2015, se evaluó la infusión de plasma convaleciente en 3 de 13 pacientes con insuficiencia respiratoria producto del MERS. El empleo de plasma con un título en la prueba de neutralización por reducción de placa (PRNT) de 1:80 reveló una respuesta serológica significativa en comparación con el de un título PRNT de 1:40. Los autores recomendaron el uso de plasma convaleciente de donantes con una actividad neutralizante PRNT ≥1: 80 para conseguir resultados eficaces 90. Por otro lado, de Wit et al. 91 evaluaron la eficacia terapéutica y profiláctica de dos anticuerpos monoclonales (mAb) neutralizantes completamente humanos (REGN3048 y REGN3051) que se dirigen al dominio de unión al receptor (RBD) de la proteína S del MERS-CoV en primates no humano, los resultados mostraron niveles altos de actividad neutralizante y reducción de la carga viral en los pulmones de los animales, sin embargo, se observó una mejor respuesta como régimen profiláctico. Además, se llevó a cabo un ensayo de seguridad, tolerabilidad, farmacocinética e inmunogenicidad de la combinación de REGN3048 y REGN3051, administrado por vía intravenosa en voluntarios sanos, este estudio ha completado su fase 1 (NCT03301090).
Los anticuerpos policlonales son otra opción terapéutica, Luke et al. 92 produjeron inmunoglobulina G (IgG) policlonal completamente humana contra la proteína de pico del MERS-CoV, a partir de la inmunización de ganado transcromosómico. En modelos murinos, estos anticuerpos (SAB-301) tuvieron la capacidad de reducir los títulos virales con la aplicación de una única dosis a las 24 o 48 horas, después de la exposición del coronavirus. Un estudio clínico de fase 1, en el que se evaluó la seguridad, tolerabilidad y farmacocinética de SAB-301 en adultos sanos, interpretó que las infusiones únicas de SAB-301 con una concentración de hasta 50 mg / kg parecen ser seguras y bien toleradas 93.
La combinación de antivirales e interferones ha sido la base de varios tratamientos ensayados. Un estudio clínico fase 2/3 en el que se probó la combinación de interferón β-1b recombinante más lopinavir-ritonavir, durante 14 días, concluyó que el tratamiento produjo menor mortalidad en comparación con el placebo en pacientes confirmados con MERS y produjo efectos adversos graves en el 9% de la población. Existieron mejores resultados cuando este se aplicó entre los 7 días posteriores a la aparición de síntomas 87.
Desde el inicio de la epidemia provocada por el MERS-CoV, se planteó el objetivo de desarrollar una vacuna contra el virus, por lo que diferentes grupos de investigadores alrededor del mundo se han unido al proceso. La vacuna GLS-5300 basada en plásmido de ADN que expresa la proteína S del MERS-CoV 94, en el ensayo fase 1 reveló que las respuestas inmunitarias fueron independientes de la concentración de la dosis, además se observó seroconversión en 86% de los participantes y respuestas de células T en el 71% después de dos dosis, mientras que en el grupo que se administró tres dosis se presenció seroconversión en el 94% de los participantes y respuestas de células T en el 76%, asimismo se observaron anticuerpos neutralizantes en el 50% de la población estudiada 94. Además, se están llevando a cabo dos ensayos clínicos fase 1/2 en los que se está evaluando la inmunogenicidad y la seguridad de las vacunas de vectores virales BVRS-GamVac-Combi (NCT04128059) y BVRS-GamVac (NCT04130594).
Las otras dos vacunas que publicaron sus ensayos fase 1 se basaron en vectores virales de replicación incompetente, en las que se evaluó la seguridad, tolerabilidad e inmunogenicidad. La vacuna MVA-MERS-S, basada en la Vacuna Modificada de Ankara (MVA) que expresa la glicoproteína S 86; y la vacuna ChAdOx1 MERS vectorizada de adenovirus de chimpancé (ChAdOx1) que de igual forma expresa la proteína S de longitud completa 95. En los resultados, los dos ensayos mostraron seguridad con ausencia de efectos secundarios graves, además de respuestas humorales y celulares contra el MERS-CoV 86,95. En el caso de la vacuna MVA-MERS-S en el 75% de los participantes se observó seroconversión después de la segunda inmunización con dosis baja y en el 100% con la dosis alta. Se detectaron respuestas de células T en el 83% y en el 91% de la población dependiendo del tipo de dosis administrada 86.
ÉBOV (epidemia 2013-2016)
La enfermedad del virus del ébola (EVE), es una infección grave y letal provocada por el virus del ébola de Zaire (EBOV), que apareció por primera vez en República Democrática del Congo en 1976 96. Sin embargo, el brote más grande reportado en la historia surgió en diciembre de 2013 en África Occidental y duró hasta 2016, periodo en el que se registraron 18 616 casos y 11 310 muertes 97. Los brotes de EBOV del 2013-2016 y los últimos brotes registrados en República Democrática del Congo 98, han permitido mejorar la comprensión de la enfermedad y optimizar las estrategias para la prevención, el diagnóstico, la atención clínica y el tratamiento de EVE, debido a la aplicación de técnicas moleculares modernas en la caracterización del virus 99,100.
Las pruebas de diagnóstico para el EVE recomendadas por la OMS son las pruebas de ácido nucleico automatizadas o semiautomatizadas para la detección de ARN viral y las pruebas rápidas de detección de antígenos como test de vigilancia 101. En general, la sangre es la muestra de preferencia para el diagnóstico en pacientes y los hisopos orofaríngeos son de utilidad para el diagnóstico post mortem 101,102.
La qRT-PCR es la prueba estándar para el diagnóstico, capaz de detectar el virus de 3-6 días después del inicio de los síntomas 102,103. Uno de los ensayos importantes desarrollados y con EUA por la FDA y la OMS, en el brote del 2013-2016, fue la prueba molecular automatizada Gene Xpert Ebola (Cepheid) basada en qRT-PCR con señal fluorescente de sondas para control de calidad, que amplifica dos genes del EBOV, el gen N y el de la glicoproteína (GP), el doble objetivo de esta prueba permitió disminuir falsos negativos cuando se analizaron muestras con nuevas variantes de virus, los resultados mostraron una alta sensibilidad analítica (100%) y especificidad (99.5-100%), con un tiempo corto de respuestas, en comparación con la RT-PCR común 104 ; este ensayo fue empleado en su mayoría en el último brote de República del Congo (2018-2020) 99.
Además, se han diseñado varias pruebas portátiles de flujo lateral para la detección rápida de antígenos 105. La primera prueba de este tipo aprobada por la FDA en el 2019 fue OraQuick Ebola Rapid Antigen Test de OraSure Technologies, un ensayo inmunocromatográfico dirigido a la proteína viral 40 (VP40) o de la matriz proteica con una sensibilidad de 97.1-100% y una especificidad del 98-100% 106,107.
Tratamiento terapéutico y profiláctico
Durante el gran brote de EVE del 2013-2016 varios fármacos biotecnológicos con actividad antiviral o como inmunoterapia contra EBOV fueron llevados a ensayos clínicos, entre los que estuvieron: administración de plasma convaleciente 108; un cóctel de tres anticuerpos monoclonales neutralizantes (ZMapp) dirigidos hacia la GP de superficie del EBOV 109; interferón IFNβ-1a 110 ; y un producto de nanopartículas lipídicas de ARNip que inhibe la producción de dos proteínas virales fundamentales, la L-polimerasa, la cual interviene en la transcripción y replicación del EVE, y la proteína viral 35 (VP35), comprometida con la destrucción de la respuesta inmune del huésped 111. Sin embargo, estas terapias no cumplieron con los criterios establecidos para ser aprobadas para su uso masivo 99,103.
Durante el brote de República del Congo de 2018 inició el ensayo Pamoja Tulinde Maisha (PALM) que significa “Juntos salvamos vidas”, un ensayo controlado, aleatorio, abierto y multicéntrico, en el que se estudió las terapias experimentales más prometedoras. Esta investigación comparó a Zmapp contra tres nuevos agentes: remdesivir, mAb114 y REGN-EB3 (NCT03719586) 112. Inmazeb (REGN-EB3 ) fue el primer fármaco aprobado por la FDA para tratar el EVE (14 de octubre de 2020) con una única perfusión intravenosa de 150 mg por kg 113. Se trata de un cóctel de tres anticuerpos IgG1 humanizados en una proporción 1:1:1 dirigidos a la tres epítopes no superpuestos de la GP del EBOV, los tres anticuerpos pueden unirse simultáneamente bloqueando la unión y entrada del virus a la célula huésped 114. El segundo tratamiento aprobado por la FDA, en diciembre de 2020, fue Ebanga (mAb114), un único anticuerpo monoclonal IgG1 dirigido a un epítope altamente conservado del dominio de unión al receptor de la GP del EBOV, este es administrado por vía intravenosa con una sola dosis de 50 mg/kg 115. Ebanga previene la interacción de GP del EBOV con el receptor NPC1, bloqueando la infección del virus a la célula huésped 116.
Debido a que la GP del EBOV es el inmunógeno más importante detectado 117, la mayoría de las vacunas en desarrollo durante el brote de ébola 2013-2016 fueron diseñadas para activar la respuesta inmune del huésped frente a este antígeno 118. Entre las vacunas candidatas llevadas a ensayos clínicos se encontró rVSV-ZEBOV, una vacuna de vector viral competente para la replicación basada en el virus de estomatitis vesicular recombinante que expresa la GP de superficie del EBOV del Zaire 119. El ensayo Ebola ça Suffit (“Ébola esto es suficiente”) de fase 3 llevado a cabo en Guinea en el 2015, evaluó la eficacia y efectividad de una sola dosis intramuscular de la vacuna rVSV-ZEBOV con una estrategia de vacunación en anillo abierta y aleatorizada por grupos, mediante la cual se administra la vacuna a individuos con conexión social o geográfica a un caso confirmado 119. La eficacia de la vacuna fue del 100%, con alta tolerancia en los seres humanos, una activación rápida de la respuesta inmune después de una única dosis y sin casos confirmados entre las personas vacunadas después de los 10 días de inmunización 120. En 2019 esta vacuna denominada Ervebo desarrollada por Merck Inc., fue la primera vacuna aprobada por la EMA y por la FDA para su uso médico 121,122, con una eficacia estimada de 95.7% evaluada por la OMS en 90 000 personas asociadas al brote del 2018 de República Democrática del Congo 123.
Otra de las vacunas empleadas para la prevención del EVE es la vacuna fabricada por Johnson & Johnson, autorizada para su comercialización en circunstancias excepcionales por la EMA en julio de 2020 124. Esta vacuna fue desarrollada en el brote de 2013- 2016 y ha alcanzado ensayos clínicos de fase 1, los que demostraron seguridad, tolerabilidad e inmunogenicidad 125. El régimen de vacunación consta de dos dosis conformado por vacunas diferentes: Zabeno (Ad26.ZEBOV), una vacuna de adenovirus humano serotipo 26 no replicante que codifica la GP del EBOV de Zaire, y una vacuna de refuerzo administrada ocho semanas después, denominada Mvabea ® (MVA-BN-Filo), constituida por MVA de replicación incompetente que expresa tres GP y una nucleoproteína de diferentes variantes del virus del Ébola 125,126.
SARS-CoV-2 (2019-2021)
La pandemia en curso de la enfermedad por coronavirus 2019 (COVID-19), provocada por el Coronavirus del Síndrome Respiratorio Agudo Severo 2 (SARS-CoV-2), inició en diciembre de 2019 en un mercado de animales en Wuhan, provincia de Hubei, China 127. Hasta inicios de marzo de 2021, la OMS ha reportado 113.6 millones de casos confirmados, 2.5 millones de muertes en todo el mundo y 223 países afectados 128.
En el caso de esta pandemia, la FDA recomendó tres tipos de pruebas: las pruebas de diagnóstico que identifican una infección activa por presencia del virus, las pruebas serológicas o de anticuerpos y las pruebas de manejo de pacientes con COVID-19 para detectar biomarcadores relacionados con la inflamación 129,130.
La prueba estándar para el diagnóstico de COVID-19 es la qRT-PCR 131, esta técnica molecular va dirigida a regiones altamente conservados o que se expresan con abundancia como el gen E, N, S y el gen de la ARN polimerasa dependiente de ARN (RdRp) del ORF1ab 132,133. Sin embargo, a pesar de la alta especificidad de la prueba ha demostrado sensibilidad inestable, comparada con otras técnicas como la tomografía computarizada (TC) de tórax, esto puede depender varios factores como: la carga viral del paciente, la forma de muestreo, el procesamiento y el transporte de la muestra, la tasa de detección de los diferentes fabricantes, entre otras 133,134.
Con los antecedentes antes mencionados el objetivo de varios grupos de investigación se han centrado en diseñar pruebas de diagnóstico alternativas, entre ellas se halla la RT-LAMP, una tecnología de amplificación de ADN, que se emplea para detectar ARN del SARS-CoV-2, los resultados se logran obtener en aproximadamente 45 minutos en muestras con una baja concentración viral, sin el empleo de equipamiento costoso debido a que la reacción final se puede observar a simple vista por un cambio colorimétrico; además el diseño de los cebadores ha sido dirigido a regiones conservadas con baja frecuencia de mutación como el gen S, gen ORF1ab y el gen N, lo que garantiza la especificidad 135,136. Huang et al. 137 probaron el ensayo RT-LAMP en un solo paso, es decir sin la extracción de ARN, el resultado fue la amplificación de ARN directamente de una muestra; por lo que aseguraron que la meta final es desarrollar un dispositivo capaz de extraer, purificar, retro transcribir ARN, y llevar a cabo la amplificación isotérmica mediada por bucle (LAMP) para la detección de SARS-CoV-2.
La tecnología Crispr-Cas es una nueva herramienta biotecnológica que ha revolucionado el diagnóstico molecular de rápida detección, alta precisión y sensibilidad, gran versatilidad y portabilidad sin la intervención de equipos sofisticados de laboratorio 138. En mayo de 2020 la FDA otorgó una EUA a la primera prueba de CRISPR combinada con RT-LAMP para el diagnóstico de la infección activa por SARS-CoV-2 en el punto de atención, denominada SHERLOCK, desarrollada por Sherlock BioSciences 139. Este protocolo se basa en la enzima Cas13a guiada por el ARN Crispr (ARNcr) para reconocer un ARN de cadena simple o un ARN mensajero viral, cuando el complejo Crispr -Cas se une a su diana, la actividad nucleasa colateral de la enzima conduce a la escisión inespecífica de una molécula marcada con fluorescencia, tras este proceso la señal será detectada mediante fluorescencia o tiras de flujo lateral 140. Según Joung et al. 141 SHERLOCK proporciona una sensibilidad comparable con la qRT-PCR y posee un límite de detección de 100 copias del genoma viral; en muestras de hisopados de nariz, boca o garganta, además de fluido pulmonar. 141.
Otro de los kits de diagnóstico frente a COVID-19 disponible comercialmente y basado en los mismos principios es DETECTR, diseñado por Mammoth Biosciences 138. Este sistema por su parte usa la enzima Cas12a para dirigirse a una secuencia de ADN de doble cadena (dsADN) del SARS-CoV-2, una vez hallada la diana genética la enzima escinde indiscriminadamente moléculas indicadoras de ADN de cadena simple (ssADN) marcadas con el flouróforo y ocurre el mismo proceso antes mencionado 140,142. DETECTR muestra una alternativa visual y más rápida que la técnica estándar para la tipificación de secuencias moleculares del SARS-CoV-2, con una sensibilidad del 95% y una especificidad del 100% 142.
Las pruebas rápidas de detección de antígenos son otra opción para el diagnóstico de COVID-19, estos inmunoensayos están esquematizados para localizar partículas virales en muestras nasofaríngeas o de frotis nasal. Las ventajas de las pruebas de antígenos es la rapidez de detección, aproximadamente 15 minutos, a un bajo costo y alta especificidad 143,144. Hasta la fecha la FDA ha otorgado la EUA a quince test comerciales con este principio 129.
La pandemia por COVID-19 sigue vigente y cada día que pasa continúa la I + D en pruebas de diagnóstico más rápidas, simples, baratas, escalables y precisas en comparación con las existentes 145. Como el desarrollo de biosensores fototérmicos plasmónicos de doble función con una alta precisión 146, o un ensayo de CRISPR potencializado y ultrasensible con la posibilidad de ser integrado en un chip de microfluidos que pueda ser leído por un teléfono celular inteligente 147,148.
Tratamiento terapéutico y profiláctico
Existe una gran variedad de tratamientos en investigación para el COVID-19 por ejemplo antivirales, terapias celulares y genéticas, inmunomoduladores, anticuerpos neutralizantes y tratamientos combinadas; de los cuales, varios se encuentran en ensayos en etapa temprana donde se evalúan la seguridad y dosificación, mientras que otros se hallan en etapa tardía en los que se prueba la seguridad y la efectividad 149. Por otro lado, se han empleado múltiples plataformas biotecnológicas tanto tradicionales como modernas para el desarrollo de vacunas contra el COVID-19 150,151 (Figura 3).
Las terapias basadas en anticuerpos neutralizantes se han mostrado efectivas en las primeras etapas de la infección por SARS-CoV-2, cuando el virus empieza su proceso de replicación y el huésped aún no reacciona con una respuesta inmune eficaz 152. La FDA ha concedido la EUA a ciertos anticuerpos monoclonales neutralizantes anti-SARS-COV-2 dirigidos al RBD de la proteína S como tratamiento para pacientes ambulatorios con COVID-19 de leve a moderado, la función de estos anticuerpos es bloquear la unión del RBD a la célula huésped y neutralizar el virus 153,154.
Bamlanivimab, ha alcanzado estudios clínicos fase 2, los resultados obtenidos en un análisis intermedio sugirieron que una única infusión intravenosa de este mAb con una dosis de 2800 mg aceleró la disminución de la carga viral, además los pacientes no hospitalizados que recibieron el tratamiento mostraron síntomas más leves y una tasa de hospitalización menor que el grupo placebo. Sin embargo, no es posible sacar conclusiones finales, por lo que se necesitan datos de ensayos clínicos más amplios 155. Al mismo tiempo se está llevando a cabo un ensayo fase 2/3 para determinar el efecto de la monoterapia de bamlanivimab y la terapia combinada de bamlanivimab con etesevimab. El estudio concluyó que el tratamiento combinado se asoció con una reducción de la carga viral estadísticamente significativa al día 11, en contraste con la monoterapia y el grupo placebo 156.
Finalmente, el análisis intermedio del estudio clínico fase 1/3 del cóctel de anticuerpos humanos neutralizantes REGN-COV2 (casirivimab y imdevimab), informó que una sola dosis de REGN-COV2 de 2,4 g o 8,0 g fue capaz de reducir la carga viral al día 7 con un efecto mayor en pacientes con anticuerpos séricos negativos (anticuerpos endógenos) contra el SARS-CoV-2. Asimismo, el porcentaje de participantes con visitas médicas fue menor en el grupo que recibió el cóctel de anticuerpos que en el grupo placebo 157.
Actualmente, existen 182 vacunas en desarrollo preclínico y 74 en desarrollo clínico de las cuales 3 han obtenido la EUA por parte de la FDA, pertenecientes a Moderna Therapeutics, Pfizer-BioNTech y Johnson & Johnson 150.
Moderna Therapeutics junto con Instituto Nacional de Alergias y Enfermedades Infecciosas (NIAID) produjeron la primera vacuna en ser llevada a ensayos clínicos, se trata de mRNA-1273, una vacuna de ARN encapsulada en nanopartículas lipídicas que contiene la información de la proteína de S de longitud completa estabilizada previa a la fusión, un ensayo fase 3 determinó una eficacia del 94.1% con dos dosis de 100 µg de esta vacuna.163. La vacuna producida por Johnson & Johnson, Ad26.COV2.S, es una vacuna de dosis única (5×1010 partículas virales) basada en un adenovirus serotipo 26 incompetente para la replicación que expresa la proteína S del SARS-CoV-2, los ensayos clínicos muestran diferentes eficacias de la vacuna frente al virus; 72% en EE.UU., 66% en Latino América y 57% en Sudáfrica 150,164,165.
Por otro lado, la primera vacuna para la prevención de COVID-19 que recibió un EUA fue BNT162b2 de Pfizer-BioNTech, el 2 de diciembre por la Agencia Reguladora de Medicamentos y Productos Sanitarios (MHRA) del Reino Unido 166 y el 11 de diciembre de 2020 por la FDA 167.
En Ecuador esta vacuna desarrollada por Pfizer-BioNTech, fue la primera en ser aprobada para uso de emergencia por la Agencia Nacional de Regulación, Control y Vigilancia Sanitaria (ARCSA) 168. BNT162b2 es una vacuna de ARNm modificado con nucleósidos y formulada con partículas lipídicas que codifica la proteína S transmembrana de longitud completa. Un ensayo global fase 2/3 manifestó que la administración de dos dosis (30 μg de vacuna por dosis) de BNT162b2 con 21 días de diferencia alcanza 95% de eficacia en la prevención de COVID-19 y un perfil de seguridad caracterizado por dolor leve en el lugar de la inyección, dolor de cabeza y fatiga, con una baja incidencia de efectos secundarios graves 169.
La segunda vacuna aprobada por el ARCSA es ChAdOx1 nCoV-19 (AZD1222) 170, una vacuna de vector no replicante ChAdOx1 que contiene el gen de la proteína S del virus, diseñada por AstraZeneca y la Universidad de Oxford. Un análisis de cuatro ensayos con una administración de dos dosis (dosis estándar 5 × 1010 partículas virales) demostró que en aquellos participantes que recibieron dos dosis estándar la eficacia de la vacuna fue del 62%, mientras que en el grupo que adoptó media dosis estándar seguida de una dosis completa la eficacia fue de 90%, obteniendo una eficacia global de la vacuna del 70,4% contra el COVID-19 sintomático con un perfil de seguridad aceptable 171.
A continuación se describirán las herramientas de la biotecnología y sus múltiples aplicaciones, además se mencionarán sus características más importantes empleadas en el control, manejo y prevención de las diferentes pandemias.
Herramientas biotecnológicas
En 1919, el ministro de alimentos húngaro, Kark Ereky, mencionó por primera vez la palabra biotecnología refiriéndose a todas las áreas de trabajo en las cuales los productos son obtenidos a partir de materia prima orgánica mediante la intervención de organismos vivos 172. Sobre esta base la biotecnología ha ido evolucionando y ha sido dividida en tres periodos en función del tiempo: la biotecnología antigua, la biotecnología clásica y la biotecnología moderna 173,174. El último periodo inició con la revelación del modelo de doble hélice del ácido desoxirribonucleico (ADN) en 1953, desde este evento, la biotecnología fue considerada como una ciencia moderna capaz de desarrollar sus propias aplicaciones 175, basadas en técnicas modernas como las técnicas de ADN recombinante 176 o la técnica de la hibridoma 177.
En la actualidad se puede definir a la biotecnología como una ciencia multidisciplinaria e interdisciplinaria que emplea organismos vivos, células o sus derivados para el desarrollo de productos y procesos orientados al bienestar humano empleando diversos tipos de herramientas y tecnologías 173,178. Otra de las clasificaciones de esta ciencia se basa en un código de colores que diferencia las principales áreas 179. Un área de la biotecnología de interés en esta revisión es la biotecnología roja, médica o farmacéutica, que se relaciona con la producción y desarrollo de métodos de diagnóstico y productos biofarmaceúticos como biofármacos recombinantes, productos de ingeniería de tejidos, productos de ingeniería de proteínas, anticuerpos monoclonales, vacunas, medicamentos regenerativos (terapia de células madre y génica), nanopartículas y biosensores173,178,179. Las herramientas biotecnológicas han permitido la obtención de estos productos a escala industrial, incluyendo agentes novedosos y tradicionales los cuales eran producidos en minoría, para lo que se emplean bioprocesamientos conocidos como biotecnología blanca o industrial 178,179.
Era de las “OMICAS” para el desarrollo de herramientas biotecnológicas
Las tecnologías “omicas” inspiradas en el proceso natural de producción de biomoléculas en las células, han aportado significativamente en el avance del diagnóstico, manejo y pronóstico de varias enfermedades, siendo elementales para el perfeccionamiento de la medicina personalizada de próxima generación 180,181, debido a que permiten una mejor comprensión de los mecanismos moleculares y celulares que interfieren en la progresión de una enfermedad en humanos 180. Entre las “ómicas” con mayor avance están la genómica, transcriptómica, proteómica y metabolómica 181, siendo la genómica y proteómica las “omicas”, con un protagonismo superior en la investigación de diagnóstico y tratamiento en enfermedades infecciosas 182. La genómica trata de la estructura, función, evolución y mapeo de genomas, con el objetivo de cuantificar y caracterizar genes 180. La obtención y análisis de secuencias completas de los genomas de patógenos causantes de enfermedades emergentes ha sido valioso para el análisis filogenético de estos microorganismos, conocer su origen, caracterizar los patrones de transmisión, el desarrollo acelerado de pruebas de diagnóstico eficientes, además, ha sido la base para el diseño de nuevas tecnologías terapéuticas, incluidos biotecnológicos y ha permitido la identificación de epítopes claves para la construcción de vacunas. Asimismo, ha influido en el seguimiento epidemiológico de las pandemias y en la detección de nuevas variantes virales 76,183–186.
La proteómica, por otro lado, estudia todas las proteínas presentes en una célula, tejido u organismo, centrándose en las propiedades bioquímicas, roles funcionales y sus cambios frente al crecimiento o a estímulos internos y externos 182,187,188. La proteómica a través de espectrometría de masas facilita los análisis de precisión, sensibles y de alto rendimiento de proteínas a gran escala 187. Además, es posible comprender y descubrir interacciones claves proteína-proteína, redes de señalización, interacciones complejas huésped-patógeno, respuestas del huésped al invasor y los mecanismos de aprovechamiento del microorganismo, lo que ha proporcionado información sobre la patogénesis de una enfermedad, caracterización de biomarcadores para métodos de diagnóstico y fármacos antivirales durante una epidemia 182,188. Al mismo tiempo el prototipado por espectrometría de masas puede ser un método de diagnóstico alternativo 188.
Herramientas biotecnológicas en el diagnóstico
[Las herramientas biotecnológicas modernas aplicadas para el diagnóstico se han optimizado a lo largo de la aparición de las diferentes pandemias, gracias a la investigación y el avance tecnológico, con el fin de producir pruebas sencillas, de bajo costo, que requieran menor tiempo de detección, con sensibilidad y especificidad alta 58,148,189. Los métodos para la identificación de patógenos se han basado principalmente en cultivo viral 58, detección de antígenos 61,105, identificación indirecta de anticuerpos 20,29 y detección de ácidos nucleicos 42,130,132 (Figura 2). Debido a la necesidad de pruebas de diagnóstico en el punto de atención (POCT) se están efectuando estudios trascendentales para convertir las técnicas conocidas en herramientas POCT rápidas, eficientes y ultrasensibles, sin la necesidad de mano de obra experimentada y laboratorios sofisticados 84,130,189,190.

Figura 2. Herramientas biotecnológicas para el diagnóstico de enfermedades pandémicas - Ventajas y desventajas.
Técnicas de diagnóstico molecular
Los test moleculares son las pruebas de diagnóstico con mayor demanda en los últimos años, debido a su elevada sensibilidad y precisión 133,189. Estas tecnologías mecanizadas detectan y amplifican secuencias específicas y conservadas del genoma del patógeno en muestras de pacientes infectados 41,133. Las cuales se describen a continuación:
Reacción en cadena de la polimerasa (PCR)
Es una técnica que se emplea para amplificar exponencialmente pequeños fragmentos de ADN diana. El principio de la PCR se fundamenta en el ciclo repetitivo de tres reacciones: desnaturalización, alineación y extensión, el proceso se repite de 30 a 40 veces, con el doble de la cantidad de material genético objetivo en cada ciclo. Al final se producen millones de fragmentos de la secuencia de ADN diana, en un período corto de tiempo 191.
Existen algunas variaciones de la PCR. PCR de transcripción inversa (RT-PCR) inicia con la obtención de ADNc a partir de ARN mediante transcripción inversa, seguido por la amplificación del ADNc. Esta técnica se usa para la detección de virus de ARN 80.PCR cuantitativa en tiempo real (qPCR) se basa en el empleo de sondas marcadas con fluorescencia que permiten cuantificar los productos de PCR a medida que se generan, en esta técnica el ciclo de temperatura ocurre más rápido que en los ensayos de PCR estándar, la hibridación de sondas se produce continuamente durante la reacción de amplificación y el tinte fluorescente acoplado a la sonda emite una señal solo cuando tiene lugar la hibridación 192. Por otro lado, PCR múltiple es utilizada para la identificación simultánea de varias secuencias de genes que pertenecen al mismo patógeno o a una mezcla de diferentes patógenos. Esta técnica permite ahorrar tiempo y reactivos al dirigirse a múltiples dianas a la vez 193. Otro tipo de PCR es la PCR anidada, este ensayo implica dos reacciones de amplificación secuenciales con un par de cebadores diferentes en cada una, el segundo conjunto de cebadores amplifica un objetivo secundario dentro del producto de la primera reacción. Esto proporciona ejecutar un mayor número de ciclos mientras se reducen los productos no específicos, aumentando la especificidad y sensibilidad de detección 194,195.
Técnicas de diagnóstico molecular en desarrollo
A lo largo del tiempo se han ido desarrollando técnicas moleculares modernas para el diagnóstico (Figura 2).
La amplificación isotérmica mediada por LOOP (LAMP) amplifica secuencias específicas de ADN empleando un conjunto de cuatro o seis cebadores únicos, la mezcla de reacción se incuba en una sola temperatura y el producto de amplificación puede detectarse por la presencia de precipitado de pirofosfato de magnesio como subproducto del proceso de amplificación o por fluorescencia bajo luz UV, además es posible monitorear la reacción en tiempo real midiendo la turbidez del pirofostato. Este ensayo se caracteriza por su simplicidad y alta sensibilidad 83,135,196. La técnica LAMP se combina con una transcripción inversa para la identificación de ARN (RT-LAMP) 83,137.
Por otro lado, las Repeticiones Palindrómicas Cortas agrupadas y Regularmente Espaciadas (CRISPR), secuencias asociadas con las nucleasas Cas son la base de la tecnología CRISPR/Cas. CRISPR son una familia de secuencias de ADN propias de organismos procariota y Cas son un grupo de endonucleasas que precisan de un ARN guía para reconocer y cortar una secuencia complementaria de ADN. Estas enzimas pueden ser programadas para ser dirigidas a ARN viral 142,197. La amplificación mediada por transcripción (TMA) es un ensayo de amplificación isotérmica de un único tubo que emplea una transcriptasa inversa y una polimerasa de ARN para amplificar segmentos específicos de ADN o ARN con mayor eficiencia que la RT-PCR 198. Mientras que una alternativa isotérmica de la PCR, es la amplificación isotérmica de recombinasa y polimerasa (RPA), un ensayo rápido, portátil y de detección múltiple 189.
Inmunoensayos en el diagnóstico
Las pruebas de anticuerpos identifican el aumento de estas proteínas en el suero de pacientes, los anticuerpos son producto de la activación de una respuesta inmune humoral pos infección de microorganismos patógenos 44. Estos ensayos suelen estar diseñados para detectar anticuerpos humanos IgA, IgM o/y IgG, usualmente, los anticuerpos IgM son hallados pocos días después de la infección, y los anticuerpos IgG aparecen más tarde 199. Los estudios de cuantificación de anticuerpos permiten determinar infecciones recientes o pasadas 200,201, sin embargo, estas pruebas no se las utiliza para diagnosticar pacientes infectados debido a problemas de mutaciones de células B 202 y deficiencia en la producción de anticuerpos 203, por lo que son aprovechadas como una herramienta de estudios serológicos para conocer el estado de la respuesta inmune 204 y para evaluar la dinámica de las respuestas humorales activadas por vacunas 70,95,125 (Figura 2).
Otro tipo de inmunoensayo son las pruebas de detección de antígenos (Figura 2), que se encargan de identificar directamente partículas de patógenos en muestras biológicas, es decir son capaces de detectar la infección activa en personas afectadas. Las más comunes son las pruebas rápidas de detección de antígenos (RAP) que se basan en inmunoensayos de flujo lateral (LFIA) 61, estas realizan una determinación cualitativa del antígeno mediante un anticuerpo específico inmovilizado en el dispositivo 205. Las RAP son ideales en pacientes que se encuentran en la etapa inicial de la enfermedad, cuando la carga viral es comúnmente elevada; además en sujetos con exposición a casos confirmados. La sensibilidad de las RAP es menor en comparación con las pruebas moleculares y el cultivo viral 206,207. En consecuencia, los resultados negativos de las pruebas basadas en este método no son capaces de descartar infecciones.
Productos biotecnológicos
Los productos de origen biológico son moléculas grandes y complejas, compuestos de azúcares, proteínas o ácidos nucleicos o combinaciones de estas sustancias, también pueden ser entidades vivas como células y tejidos que se emplean para diagnosticar, prevenir, tratar o curar enfermedades. Estos productos se obtienen de fuentes naturales (humanos, animales, microorganismos, células animales o vegetales), y se producen mediante métodos biotecnológicos y otras tecnologías de vanguardia como la nanotecnología 208,209.
Los productos biológicos constituyen un producto creciente en el mercado farmacéutico, a nivel mundial los gastos en productos biológicos sumaron $277 mil millones durante el 2017 y se predice que en el 2022 aumenten a $452 mil millones 210. Estos biofármacos se encuentran protegidos por una mayor cantidad de patentes que los fármacos de origen químico puesto que la fabricación biológica posee mayor complejidad, por lo que es necesario conservar la propiedad intelectual no sólo sobre las composiciones de materia, sino también sobre los procesos de fabricación 211,212. El gran número de patentes existentes representan un desafío al momento de identificar los procesos que deben ser eludidos para evitar litigios, por lo que el proyecto de Ley de Transparencia de Patentes Biológicas propuesto en el Congreso de los EE. UU. en 2019, busca solucionar este conflicto estableciendo una lista de búsqueda imperativa de patentes que resguarda los productos biológicos, la cual se incorporará en el Libro Púrpura de la FDA 211,213.
Por otro lado, a diferencia de los fármacos de molécula pequeña la mayoría de biológicos son composiciones complejas y heterogéneas que requieren principios asépticos en todo el proceso de fabricación 208. Es así que la licencia de comercialización de un producto biológico es otorgada por organismos reguladores como la FDA y la EMA, que cumplen con los requisitos que garantizan seguridad, pureza y potencia continua del producto 214.
Los principales productos biotecnológicos dirigidos a enfermedades causantes de pandemias se observan en la Figura 3.

Figura 3. Productos biológicos usados en el control de pandemias (Creado en BioRender)
Los anticuerpos monoclonales (mAb) neutralizantes se aíslan de personas recuperadas de la infección o de modelos animales inmunizados y se pueden administrar en pacientes antes o después de una infección viral para aplicaciones terapéuticas o profilácticas, los cuales van dirigidos a una diana específica del patógeno evitando la infección de este a la célula huésped 93,114,155. Por otro lado, los interferones (IFN) son proteínas señalizadoras de origen natural producidas por células del sistema inmunológico, que poseen propiedades antivirales e inmunomoduladoras no específicas 87,110. Son estimulados por infecciones virales, estos se secretan y se unen a la célula afectada o a sus células vecinas y activa la expresión de genes con función antiviral 215. Existen tres clases principales de interferones empleados en farmacoterapia los alfa (IFN-α), los beta (IFN-β) y los gamma (INF-γ) 216. Comúnmente los interferones son estudiados en combinación con otros agentes antivirales, ribavirina o lopinavir / ritonavir 87,217. Otro de los tratamientos valorados en la aparición de pandemias es el empleo de ARN de interferencia, como ARN de interferencia pequeños (siRNA) y micro ARN (miARN), la función de estas moléculas es la supresión de la expresión de genes claves de los patógenos mediante interferencia por ARN 111,218,219.
Vacunas
Las plataformas empleadas para el diseño de vacunas han evolucionado conforme las necesidades de la humanidad y la disponibilidad de tecnología (Figura 3).
Vacunas de virus (inactivadas y atenuadas)
En las vacunas inactivadas se aplican enfoques químicos o físicos para eliminar las propiedades infecciosas del patógeno 21,23. Las ventajas de estas vacunas son la facilidad de producción, además de su seguridad y eficacia en el reconocimiento inmunológico, sin embargo, el rendimiento podría ser limitado debido a la baja producción del virus y la necesidad de instalaciones de altos niveles de bioseguridad 48,71.
Las vacunas vivas atenuadas constan de una versión debilitada del patógeno que se replica limitadamente con el fin de no causar la enfermedad y al mismo tiempo activar las respuestas inmunes de manera similar a una infección natural. Algunas de las desventajas son los problemas de seguridad y el desafío en el proceso de atenuación 31,72.
Vacunas basadas en proteínas (subunidad proteica y partículas similares a virus)
En el caso de las vacunas de subunidades se administran proteínas altamente antigénicas del patógeno en el individuo, debido a su baja complejidad antigénica su eficacia protectora puede ser limitada, además de provocar respuestas inmunes no regulares 220,221. Las vacunas de partículas similares al virus constan de proteínas de la cápside viral, que generan una alta activación del sistema inmune debido a la repetición de sus estructuras, además confieren seguridad debido a la ausencia de material genético del patógeno, sin embargo, existen complicaciones en el proceso diseño de la plataforma 222.
Vacunas de vectores virales (replicantes y no replicantes)
Las vacunas de vectores virales se basan en un virus modificado con un gen que exprese una proteína de interés del patógeno en cuestión. Los vectores virales de replicación incompetente son virus inhabilitados para la replicación mediante la eliminación de partes de su genoma, entre las ventajas de esta plataforma es que no es necesario manipular el patógeno in vivo, estos vectores son capaces de activar respuestas inmunitarias celulares y humorales, y existe gran experiencia en la producción de este tipo de vacunas 95,125. Por otro lado, para el empleo de vectores de replicación competente se considera a virus que no se replican de manera eficiente o virus de animales que no causan enfermedades en humanos, la ventaja de esta plataforma es que tiene la capacidad de promover una inmunidad robusta debido a que existe una infección real 119.
Vacunas génicas (ADN o ARN)
En este tipo de vacunas la información genética del patógeno, ADN o ARN, es administrada para luego dirigirse a las células del individuo vacunado y expresar una proteína de interés capaz de activar efectivamente el sistema inmunitario y lograr defender al huésped en caso en una futura infección. La tecnología de ADN se puede producir a gran escala, sin embargo, muestran baja inmunogenicidad y necesitan de dispositivos eficientes para su administración 94,223,224. Mientras que, las vacunas de ARNm poseen capacidad de desarrollo breve, elevada potencia y fabricación rentable, pero requiere almacenamiento a bajas temperaturas para su estabilidad, sin embargo, con los últimos desarrollos referentes a ARNm encapsulado en nanopartículas se podría almacenar este tipo de vacunas a temperaturas de 4°C 169,225.
DISCUSIÓN Y CONCLUSIONES
En cuanto a las herramientas de diagnóstico, se debe tener en cuenta que ninguna prueba biológica puede alcanzar una especificidad del 100% y una sensibilidad del 100% 130. Por su parte, la sensibilidad se define como la capacidad de una prueba de arrojar un resultado positivo en una persona enferma, mientras que la especificidad es la capacidad de la prueba de obtener un resultado negativo en un sujeto libre de la enfermedad 226,227. Como se muestra en la comparación de resultados de la Tabla 1, la sensibilidad y especificidad de cada una de las técnicas no son 100%, sin embargo, las herramientas moleculares presentan la mejor alternativa para el diagnóstico de enfermedades pandémicas, reduciendo en gran medida los falsos positivos y falsos negativos, elevando así la eficiencia de las pruebas. Según Yuan et al. 148 los resultados del diagnóstico dependen de varias condiciones como las características del kit de detección, sus controles, su especificidad, sensibilidad y calidad de la muestra, como se demuestra en la Figura 2, nuevamente las técnicas moleculares alcanzan un porcentaje superior en comparación con el cultivo celular que presenta dificultades en el tiempo de ejecución, baja sensibilidad; y los inmunoensayos para la detección de antígenos, los cuales no se recomiendan como un diagnóstico confirmatorio debido al alto índice de falsos negativos. No obstante, las pruebas de antígenos debido a que permiten la obtención resultados acelerados a un menor costo, se pueden aplicar masivamente teniendo un mayor impacto en la salud pública.
La qRT-PCR ha sido la técnica más empleada como estándar de oro para el diagnóstico de pandemias, sin embargo, a pesar de los altos índices de especificidad y sensibilidad, han surgido algunos problemas como costos elevados, tiempo de procesamiento, requerimiento de personal capacitado y altos estándares de bioseguridad, por lo que se están desarrollando varias alternativas con resultados prometedores como LAMP, CRISPR-Cas y biosensores con el fin de minimizar las desventajas y optimizar el diagnóstico de enfermedades pandémicas 148,189.
Por otro lado, el gran avance en el desarrollo de los productos biotecnológicos se debe a varias ventajas como su alta eficiencia, efectos secundarios más seguros y reducidos en contraste con los fármacos de moléculas pequeñas, además de los costos relativamente bajos que presentan en comparación con sus beneficios y terapias completamente innovadoras. En el caso de la fabricación de vacunas fue posible observar una diferencia significativa en esta pandemia del SARS-CoV-2 en contraposición con brotes anteriores, gracias al nivel científico actual, debido que a pesar de la capacidad de investigación, de los avances biomédicos y biotecnológicos, y del desarrollo de la tecnología, las vacunas podrían tardar años, hasta décadas en ser llevadas al mercado para el beneficio de la humanidad, como es el caso de la primera vacuna contra el EBOV aprobada en el 2019 por la FDA y la EMA 122. En la actualidad, la situación ha sido diferente frente a la pandemia de COVID-19, a un año y tres meses del inicio del brote del SARS-CoV-2 existen 3 vacunas aprobadas por la FDA, 4 vacunas candidatas en fase 4 y 12 vacunas en estudios clínicos fase 3 150, los expertos afirman que todo el proceso de fabricación y experimentación se han dado en un tiempo récord gracias a la gran inversión tanto pública como privada que se ha llevado a cabo y al sobrelapamiento de las fases preclínicas y clínicas en los diferentes estudios.
Las perspectivas futuras sobre las herramientas y productos biotecnológicos son prometedoras, con técnicas de diagnóstico eficientes con características ultrasensibles con requerimientos de concentraciones a escala nano y tecnología basadas en inteligencia artificial o biología sintética 148,228, las cuales permitirán brindar un apoyo intensivo en el diagnostico y seguimiento en la propagación de la enfermedad y transmisión del patógeno. Los biofármacos, por su parte, constituyen la vanguardia de la investigación biomédica, por lo que se aspira que en el futuro representen una opción más eficiente en el control de enfermedades infecciosas que en la actualidad carecen de tratamiento o poseen muy pocas alternativas 208, además de terapias personalizadas optimizando drásticamente la seguridad y eficacia de los medicamentos 178.
Finalmente, podemos concluir que el desarrollo y uso de las herramientas biotecnológicas actuales han revolucionado el campo de la medicina en este caso el control de enfermedades emergentes con potencial pandémico. Con todos los conocimientos y lecciones adquiridas a lo largo de las diferentes pandemias y epidemias ocurridas a través de la historia, en posteriores brotes se poseerá la capacidad de un mejor manejo y contención de las enfermedades.
REFERENCIAS
1 Dobson AP, Carper ER. Infectious diseases and human population history. Bioscience 1996; 46: 115–126.
2 World Health Organization. Disease burden and mortality estimates: Cause-specific mortality, 2000–2016. 2017.http://www.who.int/healthinfo/global_burden_disease/estimates/en/ (accessed 27 Feb2021).
3 Smith KM, Machalaba CC, Seifman R, Feferholtz Y, Karesh WB. Infectious disease and economics: The case for considering multi-sectoral impacts. One Heal 2019; 7: 100080.
4 Nicola M, Alsafi Z, Sohrabi C, Kerwan A, Al-Jabir A, Iosifidis C et al. The socio-economic implications of the coronavirus pandemic (COVID-19): A review. Int J Surg 2020; 78: 185–193.
5 Koplan JP, McPheeters M. Plagues, public health, and politics. Emerg Infect Dis 2004; 10: 2039–2043.
6 DeWitte SN. Mortality risk and survival in the aftermath of the medieval Black Death. PLoS One 2014; 9: e96513.
7 Ogden NH, Wilson JRU, Richardson M, Hui C, Davies SJ, Kumschick S et al. Emerging infectious diseases and biological invasions : a call for a One Health collaboration in science and management. R Soc Open Sci 2019; 6. doi:https://doi.org/10.1098/rsos.181577.
8 Jones KE, Patel NG, Levy MA, Storeygard A, Balk D, Gittleman JL et al. Global trends in emerging infectious diseases. Nature 2008; 451: 990–994.
9 Sun Q, Qiu H, Huang M, Yang Y. Lower mortality of COVID-19 by early recognition and intervention: experience from Jiangsu Province. Ann Intensive Care 2020; 10. doi:10.1186/s13613-020-00650-2.
10 Rauch S, Jasny E, Schmidt KE, Petsch B. New vaccine technologies to combat outbreak situations. Front Immunol 2018; 9. doi:10.3389/fimmu.2018.01963.
11 Hine R. A Dictionary of Biology. 2019 doi:10.1093/acref/9780198821489.001.0001.
12 Porta M. A Dictionary of Epidemiology. 2016 doi:10.1093/acref/9780199976720.001.0001.
13 Adalja AA, Watson M, Toner ES, Cicero A, Inglesby T V. The characteristics of pandemic pathogens. 2018https://www.centerforhealthsecurity.org/our-work/pubs_archive/pubs-pdfs/2018/180510-pandemic-pathogens-report.pdf.
14 Taubenberger JK, Morens DM. 1918 Influenza: The mother of all pandemics. Emerg. Infect. Dis. 2006; 12: 15–22.
15 Johnson N, Muelle J. Updating the accounts: global mortality of the 1918 – 1920 ‘spanish’ influenza pandemic. Bull Hist Med 2002; 76: 105–115.
16 Dunn FL. Pandemic influenza in 1957: Review of international spread of new asian strain. J Am Med Assoc 1958; 166: 1140–1148.
17 Glezen WP. Emerging infections: pandemic influenza. Epidemiol Rev 1996; 18: 64–76.
18 Viboud C, Simonsen L, Fuentes R, Flores J, Miller MA, Chowell G. Global mortality impact of the 1957 – 1959 influenza pandemic. J Infect Dis 2016; 213: 738–745.
19 Blumenfeld H, Kilbourne E, Louria D, Rogers D. Studies on influenza in the pandemic of 1957-1958. I. An epidemiologic, clinical and serologic investigation of an intrahospital epidemic, with a note on vaccination efficacy. J Clin Invest 1958; 38: 199–212.
20 Jensen KE, Hogan RB. Laboratory diagnosis of asian influenza. Public Health Rep 1958; 73: 140–144.
21 Gundelfinger BF, Stille WT, Bell JA. Effectiveness of influenza vaccines during an epidemic of asian influenza. N Engl J Med 1958; 259: 1005–1009.
22 Culver JO, Nitz RE, Lennette EH. The protective effect of monovalent asian-strain vaccine against asian influenza. J Am Med Assoc 1957; 165: 2174–2177.
23 Dull BH, Jensen KE, Rakich JH, Cohen A, Henderson DA, Pirkle CI. Monovalent asian influenza vaccine: evaluation of its use during two waves of epidemic asian influenza in partly immunized penitentiary population. J Am Med Assoc 1960; 172: 87–93.
24 Davenport FM. Role of the commission on influenza. Public Health Rep 1958; 73: 133–139.
25 Meiklejohn G, Morris AJ. Influenza vaccination. Ann Intern Med 1958; 49: 529–535.
26 Langmuir A. Epidemiology of Asian influenza. With special emphasis on the United States. Am Rev Respir Dis 1961; 83: 2–14.
27 Cockburn WC, Delon PJ, Ferreira W. Origin and progress of the 1968-69 Hong Kong influenza epidemic. Bull World Health Organ 1969; 41: 345–348.
28 Rogers K. 1968 Flu pandemic. Encycl. Br. 2020.https://www.britannica.com/event/1968-flu-pandemic (accessed 21 Sep2020).
29 Coleman MT, Dowdle WR. Properties of the Hong Kong influenza virus. I. General characteristics of the Hong Kong virus. Bull World Health Organ 1969; 41: 415–418.
30 Murray R. Production and testing in the USA of influenza virus vaccine made from the Hong Kong variant in 1968-69. Bull World Health Organ 1969; 41: 495–496.
31 Maassab HF, Francis T, Davenport FM, Hennessy A V, Minuse E, Anderson G. Laboratory and clinical characteristics of attenuated strains of influenza virus. Bull World Health Organ 1969; 41: 589–594.
32 Brandon FB, Cox F, Quinn E, Timm EA, Mclean IW. Influenza immunization: clinical studies with ether-split subunit vaccines. Bull World Health Organ 1969; 41: 629–637.
33 Warburton MF. Desoxycholate-split influenza vaccines. Bull World Health Organ 1969; 41: 639–641.
34 Kilbourne ED. Future influenza vaccines and the use of genetic recombinants. Bull World Health Organ 1969; 41: 643–645.
35 Couch RB, Douglas RG, Fedson DS, Kasel JA. Correlated studies of a recombinant influenza-virus vaccine. III. Protection against experimental influenza in man. J Infect Dis 1971; 124: 473–480.
36 Ksiazek TG, Erdman D, Goldsmith CS, Zaki SR, Peret T, Emery S et al. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med 2003; 348: 1953–1966.
37 World Health Organization. Cumulative number of reported probable cases of SARS. 2015.https://www.who.int/csr/sars/country/2003_07_11/en/ (accessed 25 Jan2021).
38 World Health Organization. Alert, verification and public health management of SARS in the post-outbreak period. 2003.https://www.who.int/csr/sars/postoutbreak/en/ (accessed 30 Dec2020).
39 Chan KH, Poon LLLM, Cheng VCC, Guan Y, Hung IFN, Kong J et al. Detection of SARS coronavirus in patients with suspected SARS. Emerg Infect Dis 2004; 10: 294–299.
40 Yam WC, Chan KH, Poon LLM, Guan Y, Yuen KY, Seto WH et al. Evaluation of reverse transcription-PCR assays for rapid diagnosis of severe acute respiratory syndrome associated with a novel coronavirus. J Clin Microbiol 2003; 41: 4521–4524.
41 Poon LLM, Chan KH, Wong OK, Yam WC, Yuen KY, Guan Y et al. Early diagnosis of SARS Coronavirus infection by real time RT-PCR. J Clin Virol 2003; 28: 233–238.
42 Chan PKS, To WK, Ng KC, Lam RKY, Ng TK, Chan RCW et al. Laboratory diagnosis of SARS. Emerg Infect Dis 2004; 10: 825–831.
43 Peiris JSM, Lai ST, Poon LLM, Guan Y, Yam LYC, Lim W et al. Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet 2003; 361: 1319–1325.
44 Shi Y, Yi Y, Li P, Kuang T, Li L, Dong M et al. Diagnosis of Severe Acute Respiratory Syndrome (SARS) by Detection of SARS coronavirus nucleocapsid antibodies in an antigen-capturing enzyme-linked immunosorbent assay. J Clin Microbiol 2003; 41: 5781–5782.
45 Lu A, Zhang H, Zhang X, Wang H, Hu Q, Shen L et al. Attenuation of SARS coronavirus by a short hairpin RNA expression plasmid targeting RNA-dependent RNA polymerase. Virology 2004; 324: 84–89.
46 Cheng Y, Wong R, Soo YOY, Wong WS, Lee CK, Ng MHL et al. Use of convalescent plasma therapy in SARS patients in Hong Kong. Eur J Clin Microbiol Infect Dis 2005; 24: 44–46.
47 Ho JC, Wu AY, Lam B, Ooi GC, Khong P-L, Ho PL et al. Pentaglobin in steroid-resistant severe acute respiratory syndrome. Int J Tuberc Lung Dis 2004; 8: 1173–1179.
48 Zhou J, Wang W, Zhong Q, Hou W, Yang Z, Xiao SY et al. Immunogenicity, safety, and protective efficacy of an inactivated SARS-associated coronavirus vaccine in rhesus monkeys. Vaccine 2005; 23: 3202–3209.
49 Yang ZY, Kong WP, Huang Y, Roberts A, Murphy BR, Subbarao K et al. A DNA vaccine induces SARS coronavirus neutralization and protective immunity in mice. Nature 2004; 428: 561–564.
50 Gao W, Tamin A, Soloff A, D’Aiuto L, Nwanegbo E, Robbins PD et al. Effects of a SARS-associated coronavirus vaccine in monkeys. Lancet 2003; 362: 1895–1896.
51 Centers for Disease Control and Prevention. Update: novel influenza A (H1N1) virus infections - worldwide, May 6, 2009. MMWR Morb Mortal Wkly Rep 2009; 58: 453–458.
52 Centers for Disease Control and Prevention. 2009 H1N1 Pandemic (H1N1pdm09 virus). 2019.https://www.cdc.gov/flu/pandemic-resources/2009-h1n1-pandemic.html (accessed 25 Jan2021).
53 Dawood FS, Iuliano AD, Reed C, Meltzer MI, Shay DK, Cheng PY et al. Estimated global mortality associated with the first 12 months of 2009 pandemic influenza A H1N1 virus circulation: a modelling study. Lancet Infect Dis 2012; 12: 687–695.
54 World Health Organization. WHO information for laboratory diagnosis of pandemic ( H1N1 ) 2009 virus in humans ‐revised. 2009https://www.who.int/csr/resources/publications/swineflu/WHO_Diagnostic_RecommendationsH1N1_20090521.pdf.
55 Peiris JM, Poon LLM, Guan Y. Emergence of a novel swine-origin influenza A virus (S-OIV) H1N1 virus in humans. J Clin Virol 2009; 45: 169–173.
56 Centers for Disease Control and Prevention. Interim guidance on specimen collection, processing, and testing for patients with suspected novel influenza A (H1N1) virus infection. 2009.https://www.cdc.gov/h1n1flu/specimencollection.htm (accessed 20 Jan2021).
57 Balish A, Warnes C, Wu K, Barnes N, Emery S, Berman L et al. Evaluation of rapid influenza diagnostic tests for detection of novel influenza A (H1N1) virus - United States, 2009. Morb Mortal Wkly Rep 2009; 58: 826–829.
58 Kumar S, Henrickson KJ. Update on influenza diagnostics: lessons from the novel H1N1 influenza A pandemic. Clin Microbiol Rev 2012; 25: 344–361.
59 World Health Organization. CDC protocol of realtime RTPCR for influenza A (H1N1). Atlanta, 2009.
60 Kim D, Poudel B. Tools to Detect Influenza Virus. Yosei Med J 2013; 54: 560–566.
61 Vasoo S, Stevens J, Singh K. Rapid antigen tests for diagnosis of pandemic (Swine) influenza A/H1N1. Clin Infect Dis 2009; 49: 1090–1093.
62 Centers for Disease Control and Prevention. Interim Recommendations for Clinical Use of Influenza Diagnostic Tests During the 2009-10 Influenza Season. 2009.https://www.cdc.gov/h1n1flu/guidance/diagnostic_tests.htm#_ftn1 (accessed 4 Feb2021).
63 Garten RJ, Davis CT, Russell CA, Shu B, Lindstrom S, Balish A et al. Antigenic and Genetic Characteristics of the Early Isolates of Swine-Origin 2009 A(H1N1) Influenza Viruses Circulating in Humans. Science 2009; 325: 197–201.
64 Yang Y, Sugimoto JD, Halloran ME, Basta NE, Chao DL, Matrajt L et al. The transmissibility and control of pandemic influenza A (H1N1) virus. Science 2009; 326: 729–733.
65 Hung IFN, To KKW, Lee CK, Lee KL, Yan WW, Chan K et al. Hyperimmune IV immunoglobulin treatment: A multicenter double-blind randomized controlled trial for patients with severe 2009 influenza A(H1N1) infection. Chest 2013; 144: 464–473.
66 Hung IFN, To KKW, Lee CK, Lee KL, Chan K, Yan WW et al. Convalescent plasma treatment reduced mortality in patients with severe pandemic influenza A (H1N1) 2009 virus infection. Clin Infect Dis 2011; 52: 447–456.
67 Prevention C for DC and. Key Facts About 2009 H1N1 Flu Vaccine. 2010.https://www.cdc.gov/h1n1flu/vaccination/vaccine_keyfacts.htm (accessed 5 Feb2021).
68 Centers for Disease Control and Prevention. Update on Influenza A (H1N1) 2009 Monovalent Vaccines. MMWR Morb Mortal Wkly Rep 2009; 58: 1100–1101.
69 Neumann G, Kawaoka Y. The first influenza pandemic of the new millennium. Influenza Other Respi Viruses 2011; 5: 157–166.
70 Plennevaux E, Sheldon E, Blatter M, Reeves-Hoché MK, Denis M. Immune response after a single vaccination against 2009 influenza A H1N1 in USA: a preliminary report of two randomised controlled phase 2 trials. Lancet 2010; 375: 41–48.
71 Greenberg ME, Lai MH, Hartel GF, Wichems CH, Gittleson C, Bennet J et al. Response to a monovalent 2009 influenza A (H1N1) vaccine. New Engl J Med 2009; 361: 2405–2413.
72 Mallory RM, Malkin E, Ambrose CS, Bellamy T, Shi L, Yi T et al. Safety and immunogenicity following administration of a live, attenuated monovalent 2009 H1N1 influenza vaccine to children and adults in two randomized controlled trials. PLoS One 2010; 5: e13755.
73 Clark TW, Pareek M, Hoschler K, Dillon H, Nicholson KG, Groth N et al. Trial of 2009 influenza A (H1N1) monovalent MF59-adjuvanted vaccine. N Engl J Med 2009; 361: 2424–2435.
74 Hardelid P, Fleming DM, Mcmenamin J, Andrews N, Robertson C, SebastianPillai P et al. Effectiveness of pandemic and seasonal influenza vaccine in preventing pandemic influenza A(H1N1)2009 infection in England and Scotland 2009-2010. Eurosurveillance 2011; 16: 19763.
75 Lansbury LE, Smith S, Beyer W, Karamehic E, Pasic-Juhas E, Sikira H et al. Effectiveness of 2009 pandemic influenza A(H1N1) vaccines: A systematic review and meta-analysis. Vaccine 2017; 35: 1996–2006.
76 Zaki AM, Van Boheemen S, Bestebroer TM, Osterhaus ADME, Fouchier RAM. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med 2012; 367: 1814–1820.
77 World Health Organization. Middle East respiratory syndrome coronavirus (MERS-CoV) – The Kingdom of Saudi Arabia. 2021.http://www.who.int/csr/don/01-february-2021-mers-saudi-arabia/en/ (accessed 16 Feb2021).
78 Centers for Disease Control and Prevention. Laboratory Testing for MERS-CoV. 2019.https://www.cdc.gov/coronavirus/mers/lab/lab-testing.html#molecular (accessed 21 Dec2020).
79 World Health Organization. Laboratory testing for Middle East Respiratory Syndrome Coronavirus- Interim guidance (revised). 2018https://www.who.int/csr/disease/coronavirus_infections/mers-laboratory-testing/en/ (accessed 18 Dec2020).
80 Corman VM, Eckerle I, Bleicker T, Zaki A, Landt O, Eschbach-Bludau M et al. Detection of a novel human coronavirus by real-time reverse-transcription polymerase chain reaction. Eurosurveillance 2012; 17. doi:10.2807/ese.17.39.20285-en.
81 Corman VM, Müller MA, Costabel U, Timm J, Binger T, Meyer B et al. Assays for laboratory confirmation of novel human coronavirus (hCoV-EMC) infections. Eurosurveillance 2012; 17: 20334.
82 Abd El Wahed A, Patel P, Heidenreich D, Hufert FT, Weidmann M. Reverse transcription recombinase polymerase amplification assay for the detection of middle east respiratory syndrome coronavirus. PLoS Curr 2013; 5. doi:10.1371/currents.outbreaks.62df1c7c75ffc96cd59034531e2e8364.
83 Shirato K, Yano T, Senba S, Akachi S, Kobayashi T, Nishinaka T et al. Detection of Middle East respiratory syndrome coronavirus using reverse transcription loop-mediated isothermal amplification (RT-LAMP). Virol J 2014; 11. doi:https://doi.org/10.1186/1743-422X-11-139.
84 Huang P, Wang H, Cao Z, Jin H, Chi H, Zhao J et al. A rapid and specific assay for the detection of MERS-CoV. Front Microbiol 2018; 9. doi:10.3389/fmicb.2018.01101.
85 Memish ZA, Perlman S, Van Kerkhove MD, Zumla A. Middle East respiratory syndrome. Lancet 2020; 395: 1063–1077.
86 Koch T, Dahlke C, Fathi A, Kupke A, Krähling V, Okba NMA et al. Safety and immunogenicity of a modified vaccinia virus Ankara vector vaccine candidate for Middle East respiratory syndrome: an open-label, phase 1 trial. Lancet Infect Dis 2020; 20: 827–838.
87 Arabi YM, Asiri AY, Assiri AM, Balkhy HH, Al Bshabshe A, Al Jeraisy M et al. Interferon beta-1b and lopinavir–ritonavir for middle east respiratory syndrome. N Engl J Med 2020; 383: 1645–1656.
88 Widjaja I, Wang C, van Haperen R, Gutiérrez-Álvarez J, van Dieren B, Okba NMA et al. Towards a solution to MERS: protective human monoclonal antibodies targeting different domains and functions of the MERS-coronavirus spike glycoprotein. Emerg Microbes Infect 2019; 8: 516–530.
89 Raj VS, Okba NMA, Gutierrez-Alvarez J, Drabek D, van Dieren B, Widagdo W et al. Chimeric camel / human heavy-chain antibodies protect against MERS-CoV infection. Sci Adv 2018; 4: eaas9667.
90 Ko JH, Seok H, Cho SY, Ha YE, Baek JY, Kim SH et al. Challenges of convalescent plasma infusion therapy in Middle East respiratory coronavirus infection: A single centre experience|. Antivir Ther 2018; 23: 617–622.
91 de Wit E, Feldmann F, Okumura A, Horne E, Haddock E, Saturday G et al. Prophylactic and therapeutic efficacy of mAb treatment against MERS-CoV in common marmosets. Antiviral Res 2018; 156: 64–71.
92 Luke T, Wu H, Zhao J, Channappanavar R, Coleman CM, Jiao J-A et al. Human polyclonal immunoglobulin G from transchromosomic bovines inhibits MERS-CoV in vivo. Sci Transl Med 2016; 8: 326ra21.
93 Beigel JH, Voell J, Kumar P, Raviprakash K, Wu H, Jiao JA et al. Safety and tolerability of a novel, polyclonal human anti-MERS coronavirus antibody produced from transchromosomic cattle: a phase 1 randomised, double-blind, single-dose-escalation study. Lancet Infect Dis 2018; 18: 410–418.
94 Modjarrad K, Roberts CC, Mills KT, Castellano AR, Paolino K, Muthumani K et al. Safety and immunogenicity of an anti-Middle East respiratory syndrome coronavirus DNA vaccine: a phase 1, open-label, single-arm, dose-escalation trial. Lancet 2019; 19: 1013–1022.
95 Folegatti PM, Bittaye M, Flaxman A, Lopez FR, Bellamy D, Kupke A et al. Safety and immunogenicity of a candidate Middle East respiratory syndrome coronavirus viral-vectored vaccine: a dose-escalation, open-label, non-randomised, uncontrolled, phase 1 trial. Lancet Infect Dis 2020; 20: 816–826.
96 Pattyn S, van der Groen G, Jacob W, Piot P, Courteille G. Isolation of Marburg-like virus from a case of hæmorrhagic fever in Zaire. Lancet 1977; 309: 573–574.
97 World Health Organization. Ebola outbreak 2014-2016. 2016.http://www.who.int/csr/disease/ebola/en/ (accessed 23 Oct2020).
98 Centers for Disease Control and Prevention. 2020 Democratic Republic of the Congo, Equateur Province. 2020.https://www.cdc.gov/vhf/ebola/outbreaks/drc/2020-june.html (accessed 6 Feb2021).
99 Jacob ST, Crozier I, Fischer WA, Hewlett A, Kraft CS, Vega MA de La et al. Ebola virus disease. Nat Rev Dis Prim 2020; 6. doi:https://doi.org/10.1038/s41572-020-0147-3.
100 Dudas G, Carvalho LM, Bedford T, Tatem AJ, Baele G, Faria NR et al. Virus genomes reveal factors that spread and sustained the Ebola epidemic. Nature 2017; 544: 309–315.
101 World Health Organization. Ebola virus disease. 2020.https://www.who.int/news-room/fact-sheets/detail/ebola-virus-disease (accessed 6 Feb2021).
102 Erickson BR, Sealy TK, Flietstra T, Morgan L, Kargbo B, Matt-Lebby VE et al. Ebola virus disease diagnostics, Sierra Leone: analysis of real time RT-PCR values in clinical blood and oral swab specimens. J Infect Dis 2016; 214: S258–S262.
103 Malvy D, McElroy AK, de Clerck H, Günther S, van Griensven J. Ebola virus disease. Lancet 2019; 393: 936–948.
104 Pinsky BA, Sahoo MK, Sandlund J, Kleman M, Kulkarni M, Grufman P et al. Analytical performance characteristics of the cepheid GeneXpert Ebola Assay for the detection of Ebola virus. PLoS One 2015; 10: e0142216.
105 Cnops L, De Smet B, Mbala-Kingebeni P, van Griensven J, Ahuka-Mundeke S, Ariën KK. Where are the Ebola diagnostics from last time? Nature 2019; 565: 419–421.
106 OraSure Technologies I. OraQuick ® Ebola rapid antigen test customer letter. Bethlehem, 2019https://www.orasure.com/documents/products/ebola/Ebola_Instruction_PI-ENG.pdf (accessed 6 Feb2021).
107 U.S. Food and Drug Administration. FDA allows marketing of first rapid diagnostic test for detecting Ebola virus antigens. 2019.https://www.fda.gov/news-events/press-announcements/fda-allows-marketing-first-rapid-diagnostic-test-detecting-ebola-virus-antigens (accessed 6 Feb2021).
108 van Griensven J, De Weiggheleire A, Delamou A, Smith PG, Edwards T, Vandekerckhove P et al. The use of ebola convalescent plasma to treat ebola virus disease in resource-constrained settings: a perspective from the field. Clin Infect Dis 2016; 62: 69–74.
109 The PREVAIL II Writing Group for the Multi-National PREVAIL II Study Team. A randomized, controlled trial of ZMapp for ebola virus infection. N Engl J Med 2016; 375: 1448–1456.
110 Konde MK, Baker DP, Traore FA, Sow MS, Camara A, Barry AA et al. Interferon β-1a for the treatment of Ebola virus disease: A historically controlled, single-arm proof-of-concept trial. PLoS One 2017; 12: e0169255.
111 Dunning J, Sahr F, Rojek A, Gannon F, Carson G, Idriss B et al. Experimental treatment of Ebola virus disease with TKM-130803: A single-arm phase 2 clinical trial. PLoS Med 2016; 13: e1001997.
112 Mulangu S, Dodd LE, Davey RT, Tshiani Mbaya O, Proschan M, Mukadi D et al. A randomized, controlled trial of ebola virus disease therapeutics. N Engl J Med 2019; 381: 2293–2303.
113 U.S. Food and Drug Administration. FDA Approves First Treatment for Ebola Virus. 2020.https://www.fda.gov/news-events/press-announcements/fda-approves-first-treatment-ebola-virus (accessed 9 Feb2021).
114 Sivapalasingam S, Kamal M, Slim R, Hosain R, Shao W, Stoltz R et al. Safety, pharmacokinetics, and immunogenicity of a co-formulated cocktail of three human monoclonal antibodies targeting Ebola virus glycoprotein in healthy adults: a randomised, first-in-human phase 1 study. Lancet Infect Dis 2018; 18: 884–893.
115 U.S. Food and Drug Administration. FDA Approves Treatment for Ebola Virus. 2020.https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-treatment-ebola-virus (accessed 9 Feb2021).
116 Gaudinski MR, Coates EE, Novik L, Widge A, Houser K V., Burch E et al. Safety, tolerability, pharmacokinetics, and immunogenicity of the therapeutic monoclonal antibody mAb114 targeting Ebola virus glycoprotein (VRC 608): an open-label phase 1 study. Lancet 2019; 393: 889–898.
117 Park DJ, Dudas G, Wohl S, Goba A, Whitmer SLM, Andersen KG et al. Ebola virus epidemiology, transmission, and evolution during seven months in Sierra Leone. Cell 2015; 161: 1516–1526.
118 Henao Restrepo AM. Update on candidate Ebola vaccines: available data on immunogenicity, efficacy and safety. 2018https://www.who.int/immunization/sage/meetings/2018/october/SAGE_october_2018_ebola_Henaorestrepo.pdf (accessed 9 Feb2021).
119 Henao-Restrepo AM, Longini IM, Egger M, Dean NE, Edmunds WJ, Camacho A et al. Efficacy and effectiveness of an rVSV-vectored vaccine expressing Ebola surface glycoprotein: interim results from the Guinea ring vaccination cluster-randomised trial. Lancet 2015; 386: 857–866.
120 Henao-Restrepo AM, Camacho A, Longini IM, Watson CH, Edmunds WJ, Egger M et al. Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!). Lancet 2017; 389: 505–518.
121 European Commission. Vaccine against Ebola: Commission grants market authorisation. 2019.https://ec.europa.eu/commission/presscorner/detail/en/IP_19_6246 (accessed 21 Dec2020).
122 US Food and Drug Administration. First FDA-approved vaccine for the prevention of Ebola virus disease, marking a critical milestone in public health preparedness and response. 2019.https://www.fda.gov/news-events/press-announcements/first-fda-approved-vaccine-prevention-ebola-virus-disease-marking-critical-milestone-public-health (accessed 21 Aug2020).
123 World Health Organization. Preliminary results on the efficacy of rVSV-ZEBOV-GP Ebola vaccine using the ring vaccination strategy in the control of an Ebola outbreak in the Democratic Republic of the Congo: an example of integration of research into epidemic response. 2019https://www.who.int/csr/resources/publications/ebola/ebola-ring-vaccination-results-12-april-2019.pdf (accessed 10 Feb2021).
124 Johnson & Johnson. Johnson & Johnson Announces European Commission Approval for Janssen’s Preventive Ebola Vaccine . 2020.https://www.jnj.com/johnson-johnson-announces-european-commission-approval-for-janssens-preventive-ebola-vaccine#_ednref6 (accessed 10 Feb2021).
125 Milligan ID, Gibani MM, Sewell R, Clutterbuck EA, Campbell D, Plested E et al. Safety and immunogenicity of novel adenovirus type 26-and modified vaccinia Ankara-vectored Ebola vaccines: A randomized clinical trial. JAMA 2016; 315: 1610–1623.
126 Winslow RL, Milligan ID, Voysey M, Luhn K, Shukarev G, Douoguih M et al. Immune responses to novel adenovirus type 26 and modified vaccinia virus Ankara-vectored ebola vaccines at 1 year. JAMA 2017; 317: 1075–1077.
127 Zhu N, Zhang D, Wang W, Li X, Yang B, Song J et al. A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med 2020; 382: 727–733.
128 World Health Organization. WHO Coronavirus Disease (COVID-19) Dashboard. 2021.https://covid19.who.int/ (accessed 1 Mar2021).
129 U.S. Food & Drug Administration. In vitro diagnostics EUAs. 2021.https://n9.cl/wxx8 (accessed 1 Mar2021).
130 Vandenberg O, Martiny D, Rochas O, van Belkum A, Kozlakidis Z. Considerations for diagnostic COVID-19 tests. Nat Rev Microbiol 2020; 19: 171–183.
131 Liu R, Han H, Liu F, Lv Z, Wu K, Liu Y et al. Positive rate of RT-PCR detection of SARS-CoV-2 infection in 4880 cases from one hospital in Wuhan, China, from Jan to Feb 2020. Clin Chim Acta 2020; 505: 172–175.
132 Chu DKW, Pan Y, Cheng SMS, Hui KPY, Krishnan P, Liu Y et al. Molecular diagnosis of a novel coronavirus (2019-nCoV) causing an outbreak of pneumonia. Clin Chem 2020; 66: 549–555.
133 Touma M. COVID-19: molecular diagnostics overview. J Mol Med 2020; 98: 947–954.
134 Fang Y, Zhang H, Xie J, Lin M, Ying L, Pang P et al. Sensitivity of Chest CT for COVID-19: Comparison to RT-PCR. Radiology 2020; 296: E115–E117.
135 Yan C, Cui J, Huang L, Du B, Chen L, Xue G et al. Rapid and visual detection of 2019 novel coronavirus ( SARS-CoV-2 ) by a reverse transcription loop-mediated isothermal amplification assay. Clin Microbiol Infect 2020; 26: 773–779.
136 Park G, Ku K, Baek S, Kim S, Kim S Il, Kim B et al. Development of reverse transcription loop-mediated isothermal amplification assays targeting Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2). J Mol Diagnostics 2020; 22: 729–735.
137 Huang WE, Lim B, Hsu C-C, Xiong D, Wu W, Yu Y et al. RT-LAMP for rapid diagnosis of coronavirus SARS-CoV-2. Microb Biotechnol 2020; 13: 950–961.
138 Rahimi H, Salehiabar M, Barsbay M, Ghaffarlou M, Kavetskyy T, Sharafi A et al. CRISPR Systems for COVID-19 Diagnosis. ACS Sensors 2021; 6: 1430–1445.
139 U.S. Food and Drug Administration. Sherlock CRISPR SARS-CoV-2 Kit. Cambridge, 2020https://www.fda.gov/media/137747/download.
140 Jolany Vangah S, Katalani C, Booneh HA, Hajizade A, Sijercic A, Ahmadian G. CRISPR-Based Diagnosis of Infectious and Noninfectious Diseases. Biol Proced Online 2020; 22. doi:10.1186/s12575-020-00135-3.
141 Joung J, Ladha A, Saito M, Segel M, Bruneau R, Huang MLW et al. Point-of-care testing for COVID-19 using SHERLOCK diagnostics. medRxiv 2020. doi:10.1101/2020.05.04.20091231.
142 Broughton JP, Deng X, Yu G, Fasching CL, Servellita V, Singh J et al. CRISPR – Cas12-based detection of SARS-CoV-2. Nat Biotechnol 2020; 38: 870–874.
143 Centers for Disease Control and Prevention. Interim Guidance for Antigen Testing for SARS-CoV-2. 2020.https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html (accessed 1 Mar2021).
144 Dinnes J, Deeks JJ, Adriano A, Berhane S, Davenport C, Dittrich S et al. Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection. Cochrane Database Syst Rev 2020; 8: CD013705.
145 Sheridan C. COVID-19 spurs wave of innovative diagnostics. Nat Biotechnol 2020; 38: 769–772.
146 Qiu G, Gai Z, Tao Y, Schmitt J, Kullak-Ublick GA, Wang J. Dual-Functional Plasmonic Photothermal Biosensors for Highly Accurate Severe Acute Respiratory Syndrome Coronavirus 2 Detection. ACS Nano 2020; 14: 5268–5277.
147 Huang Z, Tian D, Liu Y, Lin Z, Lyon CJ, Lai W et al. Ultra-sensitive and high-throughput CRISPR-p owered COVID-19 diagnosis. Biosens Bioelectron 2020; 164: 112316.
148 Yuan X, Yang C, He Q, Chen J, Yu D, Li J et al. Current and perspective diagnostic techniques for COVID-19. ACS Infect Dis 2020; 6: 1998–2016.
149 U.S Food & Drug Administration. Coronavirus Treatment Acceleration Program (CTAP). 2021.https://www.fda.gov/drugs/coronavirus-covid-19-drugs/coronavirus-treatment-acceleration-program-ctap (accessed 26 Feb2020).
150 World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines. 2021.https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines (accessed 1 Mar2021).
151 Kyriakidis NC, López-Cortés A, González EV, Grimaldos AB, Prado EO. SARS-CoV-2 vaccines strategies: a comprehensive review of phase 3 candidates. NPJ Vaccines 2021; 6. doi:10.1038/s41541-021-00292-w.
152 Jiang S, Zhang X, Yang Y, Hotez PJ, Du L. Neutralizing antibodies for the treatment of COVID-19. Nat Biomed Eng 2020; 4: 1134–1139.
153 U.S. Food and Drug Administration. Emergency Use Authorization. 2021.https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization#coviddrugs (accessed 13 Feb2021).
154 National Institutes of Health. Anti-SARS-CoV-2 monoclonal antibodies. 2021.https://www.covid19treatmentguidelines.nih.gov/anti-sars-cov-2-antibody-products/anti-sars-cov-2-monoclonal-antibodies/ (accessed 13 Feb2021).
155 Chen P, Nirula A, Heller B, Gottlieb RL, Boscia J, Morris J et al. SARS-CoV-2 neutralizing antibody LY-CoV555 in outpatients with Covid-19. N Engl J Med 2021; 384: 229–237.
156 Gottlieb RL, Nirula A, Chen P, Boscia J, Heller B, Morris J et al. Effect of bamlanivimab as monotherapy or in combination with etesevimab on viral load in patients with mild to moderate COVID-19. JAMA 2021; 325: 632–644.
157 Weinreich DM, Sivapalasingam S, Norton T, Ali S, Gao H, Bhore R et al. REGN-COV2, a neutralizing antibody cocktail, in outpatients with Covid-19. N Engl J Med 2021; 384: 238–251.
158 Li L, Zhang W, Hu Y, Tong X, Zheng S, Yang J et al. Effect of convalescent plasma therapy on time to clinical improvement in patients with severe and Life-threatening COVID-19: a randomized clinical trial. JAMA 2020; 324: 460–470.
159 Agarwal A, Mukherjee A, Kumar G, Chatterjee P, Bhatnagar T, Malhotra P. Convalescent plasma in the management of moderate covid-19 in adults in India: Open label phase II multicentre randomised controlled trial (PLACID Trial). BMJ 2020; 371: m3939.
160 Joyner MJ, Bruno KA, Klassen SA, Kunze KL, Johnson PW, Lesser ER et al. Safety update: COVID-19 convalescent plasma in 20,000 hospitalized patients. Mayo Clin Proc 2020; 95: 1888–1897.
161 Libster R, Pérez Marc G, Wappner D, Coviello S, Bianchi A, Braem V et al. Early high-titer plasma therapy to prevent severe Covid-19 in older adults. N Engl J Med 2021; 384: 610–618.
162 Liu STH, Lin HM, Baine I, Wajnberg A, Gumprecht JP, Rahman F et al. Convalescent plasma treatment of severe COVID-19: a propensity score–matched control study. Nat Med 2020; 26: 1708–1713.
163 Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N Engl J Med 2021; 384: 403–416.
164 Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM et al. Interim results of a phase 1–2a trial of Ad26.COV2.S Covid-19 vaccine. N Engl J Med 2021. doi:10.1056/NEJMoa2034201.
165 Johnson & Johnson. Johnson & Johnson announces single-shot Janssen COVID-19 vaccines candidate met primary endpoints in interim analysis of its phase 3 ENSEMBLE trial . 2021.https://www.jnj.com/johnson-johnson-announces-single-shot-janssen-covid-19-vaccine-candidate-met-primary-endpoints-in-interim-analysis-of-its-phase-3-ensemble-trial (accessed 15 Feb2021).
166 Ledford H, Cyranoski D, Van Noorden R. The UK has approved a COVID vaccine - here’s what scientists now want to know. Nature 2020; 588: 205–206.
167 U.S. Food & Drug Administration. Pfizer-BioNTech COVID-19 Vaccine. 2020.https://www.fda.gov/emergency-preparedness-and-response/coronavirus-disease-2019-covid-19/pfizer-biontech-covid-19-vaccine (accessed 1 Mar2021).
168 Ministerio de Salud Pública. Inició la vacunación contra la COVID-19 en Ecuador. 2021.https://www.salud.gob.ec/en-ecuador-inicio-la-vacunacion-contra-la-covid-19/ (accessed 14 Feb2021).
169 Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S et al. Safety and efficacy of the BNT162b2 mRNA Covid-19 vaccine. N Engl J Med 2020; 383: 2603–2615.
170 Ministerio de Salud Pública. Vacuna de AstraZeneca contra la COVID-19 se aplicará en Ecuador. 2021.https://www.salud.gob.ec/vacuna-de-astrazeneca-contra-la-covid-19-se-aplicara-en-ecuador/ (accessed 14 Feb2021).
171 Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet 2021; 397: 99–111.
172 Bud R. History of ’ biotechnology ’. Nature 1989; 337: 10.
173 Amarakoon II, Hamilton C, Mitchell SA, Tennant PF, Roye ME. Biotechnology. In: Pharmacognosy: Fundamentals, Applications and Strategies. Elsevier Inc., 2017, pp 549–563.
174 Verma A, Agrahari S, Rastogi S, Singh A. Biotechnology in the realm of history. J Pharm Bioallied Sci 2011; 3: 321–324.
175 Bud R. Biotechnology in the twentieth century. Soc Stud Sci 1991; 21: 415–457.
176 Wright S. Recombinant DNA technology and its social transformation, 1972-1982. Osiris 1986; 2: 303–360.
177 Köhler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity. Nature 1975; 256: 495–497.
178 Gupta V, Sengupta M, Prakash J, Tripathy BC. An Introduction to Biotechnology. In: Basic and Applied Aspects of Biotechnology. Springer Singapore: Singapore, 2017, pp 1–21.
179 DaSilva EJ. The colours of biotechnology: science, development and humankind. Electron J Biotechnol 2004; 7.http://www.ejbiotechnology.info/index.php/ejbiotechnology/article/view/1114 (accessed 15 Dec2020).
180 Olivier M, Asmis R, Hawkins GA, Howard TD, Cox LA. The need for multi-omics biomarker signatures in precision medicine. Int J Mol Sci 2019; 20: 4781.
181 Eckhardt M, Hultquist JF, Kaake RM, Hüttenhain R, Krogan NJ. A systems approach to infectious disease. Nat Rev Genet 2020; 21: 339–354.
182 Sperk M, Van Domselaar R, Rodriguez JE, Mikaeloff F, Sá Vinhas B, Saccon E et al. Utility of proteomics in emerging and re-emerging infectious diseases caused by RNA viruses. J Proteome Res 2020; 19: 4259–4274.
183 Cherry JD, Krogstad P. SARS: The first pandemic of the 21st century. Pediatr Res 2004; 56. doi:10.1203/01.PDR.0000129184.87042.FC.
184 Zumla A, Chan JFW, Azhar EI, Hui DSC, Yuen KY. Coronaviruses-drug discovery and therapeutic options. Nat Rev Drug Discov 2016; 15: 327–347.
185 Gire SK, Goba A, Andersen KG, Sealfon RSG, Park DJ, Kanneh L et al. Genomic surveillance elucidates Ebola virus origin and transmission during the 2014 outbreak. Science (80- ) 2014; 345: 1369–1372.
186 Rahimi A, Mirzazadeh A, Tavakolpour S. Genetics and genomics of SARS-CoV-2: A review of the literature with the special focus on genetic diversity and SARS-CoV-2 genome detection. Genomics 2021; 113: 1221–1232.
187 Schubert OT, Röst HL, Collins BC, Rosenberger G, Aebersold R. Quantitative proteomics: challenges and opportunities in basic and applied research. Nat Protoc 2017; 12: 1289–1294.
188 Grenga L, Armengaud J. Proteomics in the COVID-19 battlefield: first semester check-up. Proteomics 2020; 21: e2000198.
189 Srivastava S, Upadhyay DJ, Srivastava A. Next-Generation molecular diagnostics development by CRISPR/Cas tool: rapid detection and surveillance of viral disease outbreaks. Front Mol Biosci 2020; 7. doi:10.3389/fmolb.2020.582499.
190 World Health Organization. Urgently needed: rapid, sensitive, safe and simple Ebola diagnostic tests. 2014.https://www.who.int/mediacentre/news/ebola/18-november-2014-diagnostics/en/ (accessed 19 Nov2020).
191 National Human Genome Research Institute. Polymerase Chain Reaction (PCR) fact sheet. 2020.https://www.genome.gov/about-genomics/fact-sheets/Polymerase-Chain-Reaction-Fact-Sheet (accessed 27 Jan2021).
192 VanGuilder HD, Vrana KE, Freeman WM. Twenty-five years of quantitative PCR for gene expression analysis. Biotechniques 2008; 44: 619–626.
193 Poritz MA, Lingenfelter B. Multiplex PCR for detection and identification of microbial pathogens. In: Springer C (ed). Advanced Techniques in Diagnostic Microbiology. Springer, Cham, 2018, pp 475–493.
194 Zhang Y, Dai C, Wang H, Gao Y, Li T, Fang Y et al. Analysis and validation of a highly sensitive one-step nested quantitative real-time polymerase chain reaction assay for specific detection of severe acute respiratory syndrome coronavirus 2. Virol J 2020; 17. doi:10.1186/s12985-020-01467-y.
195 Green MR, Sambrook J. Nested polymerase chain reaction (PCR). Cold Spring Harb Protoc 2019; 2019. doi:10.1101/pdb.prot095182.
196 Mori Y, Nagamine K, Tomita N, Notomi T. Detection of loop-mediated isothermal amplification reaction by turbidity derived from magnesium pyrophosphate formation. Biochem Biophys Res Commun 2001; 289: 150–154.
197 The McGovern Institute for Brain Research. What is CRISPR? Ask the Brain. Massachusetts Inst. Technol. 2019.https://mcgovern.mit.edu/2019/01/01/crispr-in-a-nutshell/ (accessed 27 Jan2021).
198 Carter LJ, Garner L V., Smoot JW, Li Y, Zhou Q, Saveson CJ et al. Assay techniques and test development for COVID-19 diagnosis. ACS Cent Sci 2020; 6: 591–605.
199 Racine R, Winslow GM. IgM in microbial infections: Taken for granted? Immunol Lett 2009; 125: 79–85.
200 Wang H, Li X, Li T, Zhang S, Wang L, Wu X et al. The genetic sequence, origin, and diagnosis of SARS-CoV-2. Eur J Clin Microbiol Infect Dis 2020; 39: 1629–1635.
201 Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S et al. Development and clinical application of a rapid IgM-IgG combined antibody test for SARS-CoV-2 infection diagnosis. J Med Virol 2020; 92: 1518–1524.
202 Davis CW, Jackson KJL, McElroy AK, Halfmann P, Huang J, Chennareddy C et al. Longitudinal analysis of the human B cell response to ebola virus infection. Cell 2019; 177: 1566-1582.e17.
203 Okba NMA, Stalin Raj V, Widjaja I, GeurtsvanKessel CH, De Bruin E, Chandler FD et al. Sensitive and specific detection of low-level antibody responses in mild Middle East respiratory syndrome coronavirus infections. Emerg Infect Dis 2019; 25: 1868–1877.
204 Augustine R, Das S, Hasan A, S A, Abdul Salam S, Augustine P et al. Rapid antibody-based COVID-19 mass surveillance: relevance, challenges, and prospects in a pandemic and post-pandemic world. J Clin Med 2020; 9: 3372.
205 Broadhurst MJ, Kelly JD, Miller A, Semper A, Bailey D, Groppelli E et al. ReEBOV Antigen Rapid Test kit for point-of-care and laboratory-based testing for Ebola virus disease: a field validation study. Lancet 2015; 386: 867–874.
206 Centers for Disease Control and Prevention. Interim Guidance for Rapid Antigen Testing for SARS-CoV-2. 2020.https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html#table2 (accessed 24 Nov2020).
207 Chen Y, Chan KH, Kang Y, Chen H, Luk HKH, Poon RWS et al. A sensitive and specific antigen detection assay for Middle East respiratory syndrome coronavirus. Emerg Microbes Infect 2015; 4: e26.
208 U.S. Food & Drug Administration. What Are ‘Biologics’ Questions and Answers. 2018.https://www.fda.gov/about-fda/center-biologics-evaluation-and-research-cber/what-are-biologics-questions-and-answers (accessed 28 Jan2021).
209 U.S. Food & Drug Administration. Licensed Biological Products with Supporting Documents. 2021.https://www.fda.gov/vaccines-blood-biologics/licensed-biological-products-supporting-documents (accessed 1 Mar2021).
210 Instituto IQVIA. Advancing Biosimilar Sustainability in Europe. 2018.https://www.iqvia.com/insights/the-iqvia-institute/reports/advancing-biosimilar-sustainability-in-europe (accessed 25 Apr2021).
211 Druedahl LC, Almarsdóttir AB, Kälvemark Sporrong S, De Bruin ML, Hoogland H, Minssen T et al. A qualitative study of biosimilar manufacturer and regulator perceptions on intellectual property and abbreviated approval pathways. Nat Biotechnol 2020; 38: 1253–1256.
212 Price WN, Rai AK. How logically impossible patents block biosimilars. Nat Biotechnol 2019; 37: 862–863.
213 Collins S. Biologic Patent Transparency Act (S. 659). In: 116th Congress (2019-2020). 2019https://www.congress.gov/bill/116th-congress/senate-bill/659/text (accessed 25 Apr2021).
214 U.S. Food and Drug Administration. Frequently Asked Questions About Therapeutic Biological Products. 2015.https://www.fda.gov/drugs/therapeutic-biologics-applications-bla/frequently-asked-questions-about-therapeutic-biological-products (accessed 25 Apr2021).
215 Steel J, Staeheli P, Mubareka S, García-sastre A, Palese P, Lowen AC. Transmission of pandemic H1N1 influenza virus and impact of prior exposure to seasonal strains or interferon treatment. J Virol 2010; 84: 21–26.
216 Samuel CE. Antiviral actions of interferons. Clin Microbiol Rev 2001; 14: 778–809.
217 Falzarano D, de Wit E, Rasmussen AL, Feldmann F, Okumura A, Scott DP et al. Treatment with interferon-α2b and ribavirin improves outcome in MERS-CoV-infected rhesus macaques. Nat Med 2013; 19: 1313–1317.
218 Li BJ, Tang Q, Cheng D, Qin C, Xie FY, Wei Q et al. Using siRNA in prophylactic and therapeutic regimens against SARS coronavirus in Rhesus macaque. Nat Med 2005; 11: 944–951.
219 Gallicano GI, Casey JL, Fu J, Mahapatra S. Molecular targeting of vulnerable RNA sequences in SARS CoV-2: identifying clinical feasibility. Gene Ther 2020. doi:10.1038/s41434-020-00210-0.
220 Tang J, Zhang N, Tao X, Zhao G, Guo Y, Tseng C-TK et al. Optimization of antigen dose for a receptor-binding domain-based subunit vaccine against MERS coronavirus. Hum Vaccin Immunother 2015; 11: 1244–1250.
221 Keech C, Albert G, Cho I, Robertson A, Reed P, Neal S et al. Phase 1–2 trial of a SARS-CoV-2 recombinant spike protein nanoparticle vaccine. N Engl J Med 2020; 383: 2320–2332.
222 Fuenmayor J, Gòdia F, Cervera L. Production of virus-like particles for vaccines. N Biotechnol 2017; 39: 174–180.
223 Tebas P, Kraynyak KA, Patel A, Maslow JN, Morrow MP, Sylvester AJ et al. Intradermal SynCon® Ebola GP DNA vaccine is temperature stable and safely demonstrates cellular and humoral immunogenicity advantages in healthy volunteers. J Infect Dis 2019; 220: 400–410.
224 Martin JE, Louder MK, Holman LSA, Gordon IJ, Enama ME, Larkin BD et al. A SARS DNA vaccine induces neutralizing antibody and cellular immune responses in healthy adults in a Phase I clinical trial. Vaccine 2008; 26: 6338–6343.
225 Pardi N, Hogan MJ, Porter FW, Weissman D. mRNA vaccines — a new era in vaccinology. Nat Rev Drug Discov 2018; 17: 261–279.
226 Glaros AG, Kline RB. Understanding the accuracy of tests with cutting scores: The sensitivity, specificity, and predictive value model. J Clin Psychol 1988; 44: 1013–1023.
227 Shreffler J, Huecker MR. Diagnostic Testing Accuracy: Sensitivity, Specificity, Predictive Values and Likelihood Ratios. StatPearls. 2021.http://www.ncbi.nlm.nih.gov/pubmed/32491423 (accessed 25 Apr2021).
228 Pereira R, Oliveira J, Sousa M. Bioinformatics and computational tools for next-generation sequencing analysis in clinical genetics. J Clin Med 2020; 9: 132.
229 Pas SD, Patel P, Reusken C, Domingo C, Corman VM, Drosten C et al. First international external quality assessment of molecular diagnostics for Mers-CoV. J Clin Virol 2015; 69: 81–85.
230 Böger B, Fachi MM, Vilhena RO, Cobre AF, Tonin FS, Pontarolo R. Systematic review with meta-analysis of the accuracy of diagnostic tests for COVID-19. Am J Infect Control 2021; 49: 21–29.
231 Joyner MJ, Senefeld JW, Klassen SA, Mills JR, Johnson PW, Theel ES et al. Effect of convalescent plasma on mortality among hospitalized patients with COVID-19: Initial three-month experience. medRxiv 2020. doi:10.1101/2020.08.12.20169359.
232 Lin JT, Zhang JS, Su N, Xu JG, Wang N, Chen JT et al. Safety and immunogenicity from a Phase I trial of inactivated severe acute respiratory syndrome coronavirus vaccine. Antivir Ther 2007; 12: 1107–1113.
233 Li Y Der, Chi WY, Su JH, Ferrall L, Hung CF, Wu TC. Coronavirus vaccine development: from SARS and MERS to COVID-19. J. Biomed. Sci. 2020; 27. doi:10.1186/s12929-020-00695-2.
234 Dolzhikova I V., Zubkova O V., Tukhvatulin AI, Dzharullaeva AS, Tukhvatulina NM, Shcheblyakov D V. et al. Safety and immunogenicity of GamEvac-Combi, a heterologous VSV- and Ad5-vectored Ebola vaccine: An open phase I/II trial in healthy adults in Russia. Hum Vaccines Immunother 2017; 13: 613–620.
235 Zhu FC, Wurie AH, Hou LH, Liang Q, Li YH, Russell JBW et al. Safety and immunogenicity of a recombinant adenovirus type-5 vector-based Ebola vaccine in healthy adults in Sierra Leone: a single-centre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2017; 389: 621–628.
236 Tapia MD, Sow SO, Mbaye KD, Thiongane A, Ndiaye BP, Ndour CT et al. Safety, reactogenicity, and immunogenicity of a chimpanzee adenovirus vectored Ebola vaccine in children in Africa: a randomised, observer-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis 2020; 20: 719–730.
237 Tapia MD, Sow SO, Ndiaye BP, Mbaye KD, Thiongane A, Ndour CT et al. Safety, reactogenicity, and immunogenicity of a chimpanzee adenovirus vectored Ebola vaccine in adults in Africa: a randomised, observer-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis 2020; 20: 707–718.
238 Mallapaty S. China COVID vaccine reports mixed results — what does that mean for the pandemic? Nature 2021. doi:10.1038/d41586-021-00094-z.
239 Xia S, Duan K, Zhang Y, Zhao D, Zhang H, Xie Z et al. Effect of an inactivated vaccine against SARS-CoV-2 on safety and immunogenicity outcomes: interim analysis of 2 randomized clinical trials. JAMA 2020; 324: 951–960.
240 Xia S, Zhang Y, Wang Y, Wang H, Yang Y, Gao GF et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomised, double-blind, placebo-controlled, phase 1/2 trial. Lancet Infect Dis 2021; 21: 39–51.
241 Ella R, Vadrevu KM, Jogdand H, Prasad S, Reddy S, Sarangi V et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBV152: a double-blind, randomised, phase 1 trial. Lancet Infect Dis 2021. doi:10.1016/s1473-3099(20)30942-7.
242 Pu J, Yu Q, Yin Z, Zhang Y, Li X, Li D et al. An in-depth investigation of the safety and immunogenicity of an inactivated SARS-CoV-2 vaccine. medRxiv 2020. doi:10.1101/2020.09.27.20189548.
243 Logunov DY, Dolzhikova I V, Shcheblyakov D V, Tukhvatulin AI, Zubkova O V, Dzharullaeva AS et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet 2021. doi:10.1016/s0140-6736(21)00234-8.
244 Zhu FC, Guan XH, Li YH, Huang JY, Jiang T, Hou LH et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet 2020; 396: 479–488.
245 Novavax. Novavax COVID-19 vaccine demonstrates 89.3% efficacy in UK phase 3 trial . 2021.https://ir.novavax.com/news-releases/news-release-details/novavax-covid-19-vaccine-demonstrates-893-efficacy-uk-phase-3 (accessed 15 Feb2021).
246 Kremsner P, Mann P, Bosch J, Fendel R, Gabor JJ, Kreidenweiss A et al. Phase 1 assessment of the safety and immunogenicity of an mRNA- lipid nanoparticle vaccine candidate against SARS-CoV-2 in human volunteers. medRxiv 2020. doi:10.1101/2020.11.09.20228551.
Recibido: 10 Marzo 2021
Aceptado: 20 Julio 2021
Pamela, Molina1 and Marbel, Torres Arias1,2
1Departamento de Ciencias de la Vida y Agricultura, Carrera de Ingeniería en Biotecnología, Universidad de las Fuerzas Armadas ESPE.
2 Laboratorio de Inmunología y Virología, CENCINAT, GISAH, Universidad de las Fuerzas Armadas ESPE]
Av. General Rumiñahui S/N y Ambato, PO BOX 171-5-231B, Sangolquí, Pichincha, Ecuador.
Autor corresponsal: [email protected]