2023.08.03.19
Files > Volume 8 > Vol 8 No 3 2023
Influencia del ácido giberélico (AG3), etanol y cianamida hidrogenada (Dormex) sobre la brotación de yemas a partir de tubérculos de Solanum tuberosum L. var. Cecilia.
Influence of gibberellic acid (AG3), ethanol and hydrogenated cyanamide (Dormex) on buds sprouting from Solanum tuberosum L. var tubers. Cecilia.
Catherine Silva – Agurto 1* , Michel Leiva Mora2
, Michel Leiva Mora2 , Tatiana Macarena Acosta3
, Tatiana Macarena Acosta3 and Nayeli Estefania Sánchez Ortiz3
and Nayeli Estefania Sánchez Ortiz3 
1* Laboratorio de Biotecnología. Departamento de Agronomía, Facultad de Ciencias Agropecuarias, Universidad Técnica de Ambato.
2 Laboratorio de Biotecnología. Departamento de Agronomía, Facultad de Ciencias Agropecuarias, Universidad Técnica de Ambato.
3 Estudiante de la Maestría de Agronomía Mención Nutrición Vegetal cohorte 2022, Universidad Técnica de Ambato.
3 Estudiante de la Maestría de Agronomía Mención Nutrición Vegetal cohorte 2022, Universidad Técnica de Ambato.
* Correspondence: [email protected]; Tel.: +593 998969778.
Available from: http://dx.doi.org/10.21931/RB/2023.08.03.19
RESUMEN
Los inductores de brotación se utilizan ampliamente en tubérculos de Solanum tuberosum con la finalidad de reducir el tiempo de crecimiento de los brotes. El objetivo principal de este artículo fue evaluar el efecto de diferentes concentraciones de ácido giberélico (AG3), etanol y cianamida hidrogenada (Dormex) sobre la brotación de yemas, longitud y número de brotes de tubérculos de Solanum tuberosum L. var. Cecilia. Se utilizaron tubérculos previamente desinfectados, los cuales se sumergieron en tres tipos de inductores de brotación a diferentes concentraciones y se colocaron en dos tipos de sustratos a base de turba rubia (TS1 y TS2). Para el àcido giberélico los tubérculos se sumergieron durante 72 h mientras que para la cinanamida hidrogenada (Dormex) y el etanol se sumergieron durante 15 minutos. Se evaluaron el número de brotes y la longitud por tubérculo. Se empleó un diseño de bloques completamente aleatorizado en cada experimento. A los 21 días al utilizar ácido giberélico (AG3) (5 mg.L-1, 9 mg.L-1, 7 mg.L-1 y 3 mg.L-1), etanol (0.5 %, 0.7 %, 0.3 %, 0.9 % y 0.1 % ) y cianamida hidrogenada (Dormex) (3 %, 4 %, 2 %, 0.5 y 1 %) se incrementó la longitud de los brotes en los tubérculos de S. tuberosum var. Cecilia pero no tuvo efecto sobre el número de brotes. Los tipos de sustratos (TS1 y TS4) no influyeron sobre la longitud de los brotes ni en el número de brotes en la brotación de yemas de tubérculos de papa var. Cecilia. En base a los resultados del presente trabajo se concluyó que el AG3, etanol y Dormex favorecieron la brotación de yemas en tubérculos de S. tuberosum var. Cecilia.
Palabras clave: activadores, brotes, dormancia, inductores, latencia.
ABSTRACT
Induction of sprouting is widely used in Solanum tuberosum tubers to reduce the sprout growth time. The main objective of this article was to evaluate the effect of different concentrations of gibberellic acid (GA3), ethanol, and hydrogen cyanamide (Dormex) on the budding of buds, length, and number of sprouts in Solanum tuberosum L. var. Cecilia tubers. Previously disinfected tubers were immersed in three sprouting inducers at different concentrations and placed in two peat-based substrates (TS1 and TS2). The tubers were submerged for 72 hours for gibberellic acid, while hydrogen cyanamide (Dormex) and ethanol were immersed for 15 minutes. The number and length of sprouts per tuber were evaluated. A completely randomized block design was used in each experiment. At 21 days of using gibberellic acid (GA3) (5 mg.L-1, 9 mg.L-1, 7 mg.L-1, and 3 mg.L-1), ethanol (0.5%, 0.7%, 0.3%, 0.9%, and 0.1%), and hydrogen cyanamide (Dormex) (3%, 4%, 2%, 0.5%, and 1%), the length of the sprouts in S. tuberosum var. Cecilia tubers increased, but it did not affect the number of projections. The types of substrates (TS1 and TS4) did not influence the length or number of sprouts in the budding of Cecilia potato tubers. Based on the results of this study, it was concluded that GA3, ethanol, and Dormex promoted the budding of buds in S. tuberosum var. Cecilia tubers.
Keywords: activators, dormancy, inductor, latency, shoots.
INTRODUCCIÓN
La papa Solanum tuberosum L. pertenece a la familia de las Solanáceas, es una dicotiledónea herbácea, anual1, su rendimiento está determinado principalmente por el comportamiento de los factores abióticos y bióticos, la variedad, el desarrollo de la superficie foliar y su manejo agronómico2.
Es uno de los cinco productos de mayor importancia en la alimentación humana a nivel mundial, debido a sus características nutricionales3, se resalta su aporte de carbohidratos, proteínas, vitaminas (B1, B3, B6 y C) y minerales (magnesio, potasio, hierro, fósforo y calcio), lo cual asegura una demanda significativa durante todo el año4,5.
En contraste con las semillas de cereales, en los tubérculos no se produce deshidratación y mantienen activo su metabolismo, por ello, el manejo de la duración del período de latencia tiene una importancia económica considerable6. La latencia es un estado fisiológico en el que se presenta una etapa en donde no se produce un crecimiento autónomo de los brotes, inclusive si existen las condiciones necesarias, este período empieza desde la iniciación hasta el momento en que se produce la brotación7.
Existen tres tipos de latencia definidas para la papa: endodormancia, ecodormancia y paradormancia8. La duración de este período depende de factores genéticos y manejo previo y posterior a la cosecha9. La temperatura es un factor ambiental que puede mantener o acelerar la latencia10,11, así mismo, la aplicación de tratamientos químicos como el uso de ácido giberélico o peróxido de hidrógeno, pueden ser de gran utilidad para inducir el crecimiento de los brotes de los tubérculos12.
El etanol es un compuesto químico muy conocido, una investigación para inducir la brotación de yemas en microtubérculos de S. tuberosum mostró que la utilización de etanol provocó el aumento de los niveles de NADH por medio de la actividad de alcohol deshidrogenasa (ADH), esto permite un incremento de la carga redox catabólica (CRC). El aumento de la CRC puede ser la señal que bloquea el almacenamiento y la actividad relacionada con el ciclo celular en el tejido del tubérculo, mediante la disminución del almacenamiento y la expresión génica. Simultáneamente, conduce a una redirección del flujo de sacarosa hacia la yema apical, en donde sus niveles se incrementan. El aumento de los niveles de sacarosa en la yema apical puede ser la causa de la inducción local de la actividad del ciclo celular13.
El ácido giberélico (AG3) es un regulador de crecimientoque tiene la capacidad de eliminar la latencia14,15, además, estimula el crecimiento y desarrollo de las yemas de los tubérculos de manera más rápida, promoviendo la aparición de brotes16.
La cianamida hidrogenada es una sustancia perteneciente a los nitrilos clásicos, tiene la capacidad de penetrar fácilmente la corteza del material vegetal. Su mecanismo de acción implica la activación de dos vías: el metabolismo de la sacarosa y el almidón y la transducción de señales de fitohormonas17.
El retraso y la falta de uniformidad en la brotación de las yemas en los tubérculos de papa plantea un importante problema científico que requiere abordar la necesidad de lograr una brotación sincronizada y oportuna para mejorar la productividad de este cultivo. La brotación inconsistente puede provocar un crecimiento desigual, tamaños variables de los tubérculos y una reducción en el rendimiento, lo que finalmente afecta la rentabilidad agrícola. Lograr una brotación de yemas sincronizada y oportuna es crucial para optimizar la asignación de recursos, la gestión del cultivo y la logística de la cosecha10. Mediante la comprensión de los factores que contribuyen al retraso y la falta de uniformidad en la brotación, los investigadores pueden desarrollar estrategias innovadoras, como la regulación hormonal para mejorar la sincronización de la aparición de las yemas, lo que conduce a un crecimiento más uniforme, un mayor rendimiento y una productividad mejorada18.
En base a la problemática anterior, la presente investigación se propuso evaluar el efecto de diferentes concentraciones de ácido giberélico (AG3), etanol y cianamida hidrogenada (Dormex) sobre la brotación de yemas, longitud y número de brotes de las mismas en tubérculos de Solanum tuberosum L. var. Cecilia.
MATERIALES Y MÉTODOS
El experimento se realizó en el Laboratorio de Biotecnología Vegetal de la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Ambato, ubicado en el cantón Cevallos, provincia de Tungurahua, en el período comprendido de abril-septiembre 2022.
Material vegetal
Se seleccionaron tubérculos de 100 gramos aproximadamene, los cuales se lavaron con agua de grifo, se sumergieron en una solución de hipoclorito de sodio al 5 % por 5 min posteriormente se enjuagaron con agua desionizada estéril, luego se volvieron a sumergir en una solución de alcohol al 70% por 5 min, se enjuagaron con agua desionizada estéril y se dejaron secar. Para determinar el efecto de diferentes tipos de inductores de brotación y sus concentraciones se realizaron ensayos individuales para cada tipo de inductor.
Se pesaron y disolvieron diferentes concentraciones de ácido giberélico (AG3), etanol y cianamida hidrogenada (Dormex), se procedió a sumergir los tubérculos en las diferentes soluciones por los tiempos establecidos, se dejaron secar y se colocaron en bandejas con dos tipos de sustratos compuestos por turba rubia (TS1 y TS4), el sustrato fue humedecido con agua desionizada estéril. Se colocaron 10 tubérculos por cada tratamiento.
Ensayo 1. Influencia de cinco concentraciones de ácido giberélico (AG3) sobre la brotación de yemas de tubérculos de papa var. Cecilia.
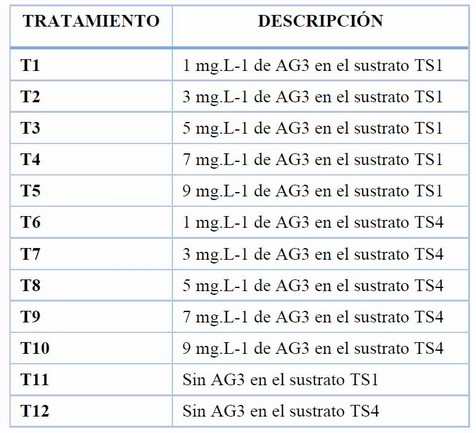
Tabla 1. Tratamientos correspondientes a diferentes concentraciones del ácido giberélico (AG3) aplicadas mediante inmersión de 72 h en tubérculos de papa var. Cecilia.
Ensayo 2. Influencia de cinco concentraciones de etanol en la brotación de yemas de tubérculos de papa var. Cecilia.
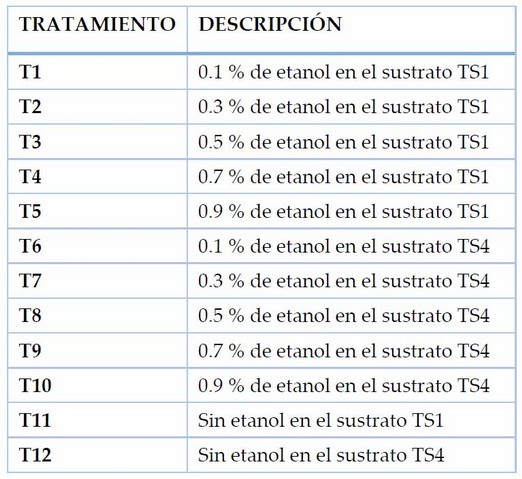
Tabla 2. Tratamientos correspondientes a diferentes concentraciones de etanol aplicadas mediante inmersión de 15 min en tubérculos de papa var. Cecilia.
Ensayo 3. Influencia de cinco concentraciones de cianamida hidrogenada (Dormex) en la brotación de yemas de tubérculos de papa var. Cecilia.
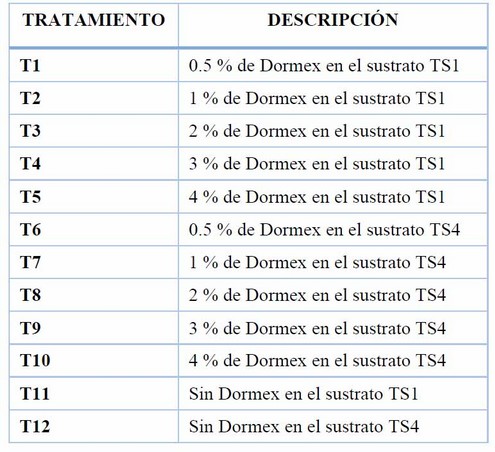
Tabla 3. Tratamientos correspondientes a diferentes concentraciones de Dormex aplicadas mediante inmersión de 15 min en tubérculos de papa var. Cecilia.
Evaluaciones
Se determinó la longitud de brote (cm) y número de brotes por tubérculo a los 21 días para cada ensayo.
Diseño experimental y análisis estadístico
Se utilizó un diseño de bloques completamente aleatorizado con arreglo factorial. Se incluyó un control para cada inductor de brotación (sin aplicación de inductor). Los datos obtenidos de las variables: longitud y número de brotes, se registraron en el paquete SPSS versión 26.0, se comprobaron si presentaban distribución normal por medio de la prueba de Kolmogorov Smirnov y la homogeneidad de varianza mediante la prueba de Levene. Para las variables que no cumplieron con estos requerimientos, se utilizó la prueba de Kruskal Wallis completada con una prueba de U Mann Whitney. Para un nivel de significación de un 95 %.
RESULTADOS
Ensayo 1. Influencia de cinco concentraciones de ácido giberélico (AG3) sobre la brotación de yemas de tubérculos de papa var. Cecilia.
El factor concentraciones de ácido giberélico fue quien tuvo efectos estadísticamente significativos sobre los valores del número de brotes y la longitud de brotes de tubérculos de S. tuberosum var. Cecilia, mientras que el factor tipos de sustratos (TS1 y TS4) no influyó sobre estas variables (Tabla 4).
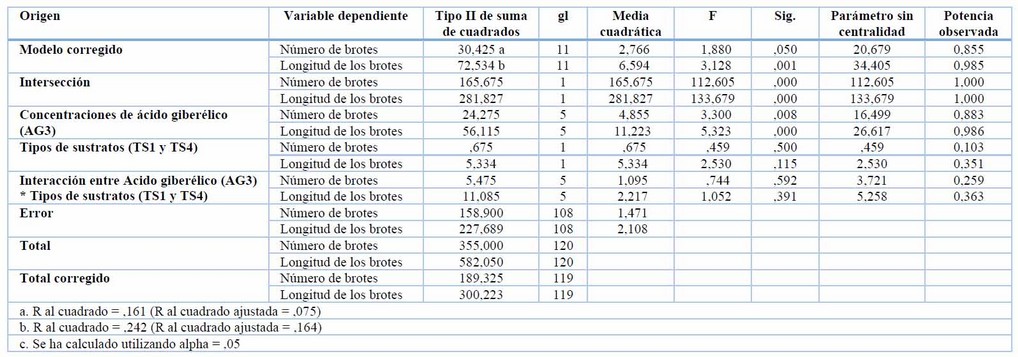
Tabla 4. Efecto de las concentraciones de ácido giberélico (AG3) y tipos de sustratos (TS1 y TS4) sobre el número de brotes y longitud de brote en la brotación de yemas de S. tuberosum var. Cecilia a los 21 días.
Las concentraciones de 5 mg.L-1, 9 mg.L-1, 7 mg.L-1 y 3 mg.L-1 de AG3 por 72 h obtuvieron la mayor longitud de los brotes con respecto al tratamiento sin AG3 a los 21 días (Tabla 5 y Figura 1).
Tabla 5. Efecto de las concentraciones de ácido giberélico (AG3) sobre la longitud de los brotes en la brotación de yemas de S. tuberosum var. Cecilia a los 21 días.

Figura 1. Yemas brotadas a partir de tubérculos de S. tuberosum var. Cecilia tratados con 5 mg.L-1 y 9 mg.L-1 de ácido giberélico (AG3) a los 21 días.
Ensayo 2. Influencia de cinco concentraciones de etanol en la brotación de yemas de tubérculos de papa var. Cecilia.
El factor concentraciones de etanol fue quien tuvo efectos estadísticamente significativos sobre los valores de la longitud de brotes de tubérculos de S. tuberosum var. Cecilia, mientras que el factor tipos de sustratos (TS1 y TS4) no influyó sobre las variables número de brotes y longitud de los brotes (Tabla 6).
Las concentraciones de 0.5 %, 0.7 %, 0.3 %, 0.9 % y 0.1 % de etanol por 15 min obtuvieron la mayor longitud de los brotes con respecto al tratamiento sin etanol a los 21 días (Tabla 7 y Figura 2).
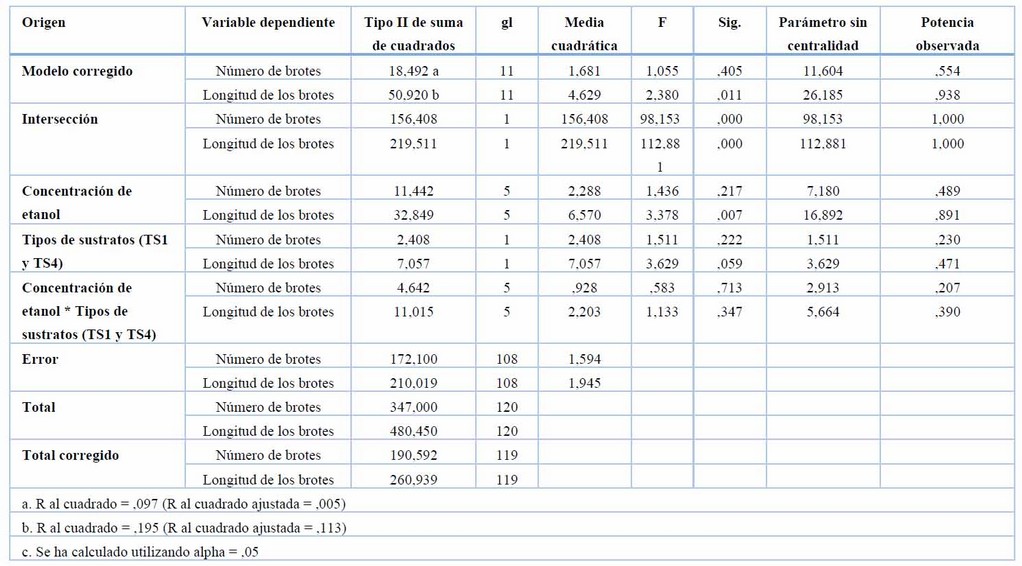
Tabla 6. Efecto de las concentraciones de etanol y tipos de sustratos (TS1 y TS4) sobre el número de brotes y longitud de los brotes en la brotación de yemas de S. tuberosum var. Cecilia a los 21 días.
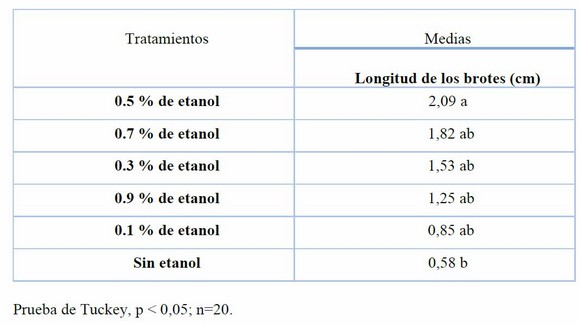
Tabla 7. Efecto de las concentraciones de etanol sobre la longitud de los brotes en la brotación de yemas de S. tuberosum var. Cecilia a los 21 días.

Figura 2. Yemas brotadas a partir de tubérculos de S. tuberosum var. Cecilia tratados con 0.5 % y 0.7 % de etanol a los 21 días.
Ensayo 3. Influencia de cinco concentraciones de cianamida hidrogenada (Dormex) en la brotación de yemas de tubérculos de papa var. Cecilia.
El factor concentraciones de Dormex fue quien tuvo efectos estadísticamente significativos sobre los valores de la longitud de brotes de tubérculos de S. tuberosum var. Cecilia, mientras que el factor tipos de sustratos (TS1 y TS4) no influyó sobre las variables número de brotes y longitud de los brotes (Tabla 8).
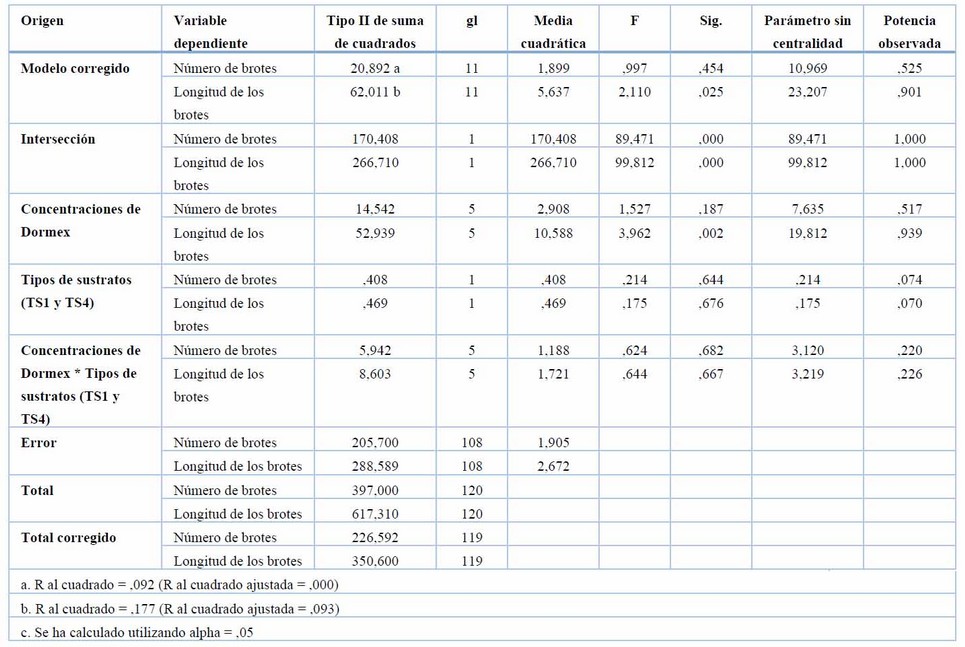
Tabla 8. Efecto de las concentraciones de Dormex y Tipos de sustratos (TS1 y TS4) sobre el número de brotes y longitud de los brotes de yemas de S. tuberosum var. Cecilia a los 21 días.
Las concentraciones de 3 %, 4 %, 2 %, 0.5 y 1 % de Dormex por 15 min obtuvieron la mayor longitud de los brotes con respecto al tratamiento sin etanol a los 21 días (Tabla 9 y Figura 3).
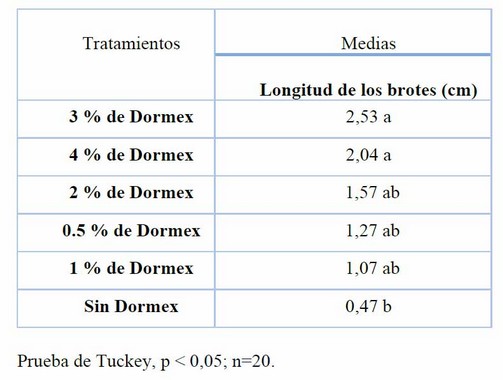
Tabla 9. Efecto de las concentraciones de Dormex sobre la longitud de los brotes en la brotación de yemas de S. tuberosum var. Cecilia a los 21 días.

Figura 3. Yemas brotadas a partir de tubérculos de S. tuberosum var. Cecilia tratados con 3% y 4 % de Dormex a los 21 días.
DISCUSIÓN
Influencia de cinco concentraciones de ácido giberélico (AG3) sobre la brotación de yemas de tubérculos de papa var. Cecilia.
Respecto a la influencia del AG3 en la brotación de tubérculos de papa, aunque los resultados no mostraron cambios en el número de brotes, sí se observó un efecto en la longitud de los mismos. Estos resultados quizás se debieron a que el AG3 puede estimular la elongación celular al afectar la plasticidad de la pared celular, permitiendo que las células vegetales se alarguen más de lo que lo harían normalmente19. Esto podría conducir a yemas más largas sin necesariamente aumentar su número20.
A su vez el AG3 también se sabe que promueve la biosíntesis de proteínas, lo cual es crucial para el crecimiento y desarrollo de las plantas21. Esto podría favorecer un mayor crecimiento en las yemas existentes, resultando en yemas más largas, pero no necesariamente en un mayor número de yemas22. Asimismo, la acción del AG3 en las plantas a menudo implica interacciones complejas con otras hormonas vegetales, como las auxinas y las citoquininas22. En el caso de la brotación de los tubérculos de papa, es posible que las citoquininas, que son conocidas por papel de promover la división celular, no estuvieran presentes en cantidades suficientes para permitir un aumento en el número de brotes a pesar de la presencia de AG323. Alternativamente, el AG3 puede estar inhibiendo la producción o acción de citoquininas, lo que resultaría en una inhibición del número de brotes.
Influencia de cinco concentraciones de etanol en la brotación de yemas de tubérculos de papa var. Cecilia.
El etanol tiene propiedades inhibidoras sobre brotación de los tubérculos de papa. Algunos estudios han demostrado que altas concentraciones de etanol pueden retrasar o incluso inhibir completamente la brotación de los tubérculos24. El etanol actúa como un agente deshidratante, lo que puede interferir con los procesos metabólicos y enzimáticos necesarios para la brotación de yemas a partir de tubérculos de papa25. Sin embargo, algunos autores sostienen que las concentraciones bajas de etanol estimular el crecimiento de los brotes.
El etanol puede afectar la regulación fitohormonal necesaria para la brotación de los tubérculos de papa. La presencia de etanol puede alterar el equilibrio hormonal necesario para la brotación adecuada, lo cual provocaría a una reducción en el número y la calidad de los brotes26. El etanol, al ser aplicado en los tubérculos de papa, puede interferir con la síntesis, el transporte o la percepción de estas hormonas vegetales, lo que altera el equilibrio fitohormonal necesario para la garantizar una brotación adecuada27. Varios estudios han demostrado que el etanol puede inhibir la síntesis de auxinas28 y giberelinas29, o podría bloquear sus efectos al interferir con los receptores de hormonas en las células vegetales.
El etanol también puede tener un efecto negativo en la actividad enzimática y el metabolismo celular, lo cual repercutiría en la producción y la señalización de las hormonas30. El etanol podría afectar los procesos de biosíntesis y degradación de las hormonas vegetales, lo que altera su disponibilidad y concentración en los tejidos de los tubérculos de papa26.
Influencia de cinco concentraciones de cianamida hidrogenada (Dormex) en la brotación de yemas de tubérculos de papa var. Cecilia.
Las diferentes variedades de papa pueden tener respuestas genéticas variables a la aplicación de Dormex. Algunas variedades pueden ser más sensibles y responder favorablemente a la cianamida hidrogenada, mientras que otras pueden mostrar una respuesta limitada o incluso no responder en absoluto31.
Las condiciones ambientales y el estado fisiológico de los tubérculos en el momento de la aplicación pueden afectar la respuesta al Dormex32. Aunque los resultados no mostraron cambios en el número de brotes, sí se observó un efecto favorable en la longitud de los mismos.
Los factores ambientales, como la temperatura y la humedad, pueden influir en la eficacia de Dormex33. La cianamida hidrogenada funciona en algunos frutales acorde con las condiciones específicas de temperatura y humedad que prevalezcan (bajas temperaturas y periodos de humedad prolongados), y su eficacia puede verse reducida si no se cumplen estos requisitos óptimos34. Si las condiciones ambientales no fueron favorables durante la aplicación de Dormex, es posible que no se haya observado un aumento significativo en el número de brotes35.
La concentración de Dormex utilizada en el estudio puede haber sido insuficiente o excesiva para promover un aumento en el número de brotes de los tubérculos de papa36. La cianamida hidrogenada puede tener un rango óptimo de concentración en el cual es efectiva para estimular la brotación. Si la concentración utilizada no estaba dentro de este rango, es posible que no se haya observado ningún efecto en el número de brotes37.
Desde el punto de vista fisiológico los tubérculos de papa tienen un período de latencia natural que inhibe la brotación de las yemas hasta que las condiciones sean favorables38. Durante este período, los brotes se mantienen inactivos debido a la presencia de inhibidores endógenos y a la falta de estímulos para la brotación39. La cianamida hidrogenada actúa como un agente rompedor de la latencia al inhibir la actividad de los inhibidores endógenos40.
La aplicación de cianamida hidrogenada en los tubérculos de papa promueve cambios metabólicos que activan los procesos de iniciación y crecimiento de los brotes41. La cianamida hidrogenada induce la síntesis de enzimas y proteínas relacionadas con la brotación de las yemas42, lo que aumenta la disponibilidad de metabolitos necesarios para la división celular y el alargamiento de los brotes43.
A su vez la cianamida hidrogenada podría influir en el balance fitohormonal de los tubérculos de papa, lo que desencadena en condiciones favorables la brotación, también se incrementa la síntesis de auxinas44 y las giberelinas45, que son clave en la regulación del crecimiento y desarrollo de los brotes45. Estas hormonas estimulan la elongación y el desarrollo de nuevos brotes47.
CONCLUSIONES
Al utilizar ácido giberélico (AG3) (5 mg.L-1, 9 mg.L-1, 7 mg.L-1 y 3 mg.L-1), etanol (0.5 %, 0.7 %, 0.3 %, 0.9 % y 0.1 % ) y cianamida hidrogenada (Dormex) (3 %, 4 %, 2 %, 0.5 y 1 %) se incrementó la longitud de los brotes en los tubérculos de S. tuberosum var. Cecilia pero no tuvo efecto sobre el número de brotes.. Los tipos de sustratos (TS1 y TS4) no influyeron sobre la longitud de los brotes ni en el número de brotes en la brotación de yemas de tubérculos de papa var. Cecilia.
Contribuciones de los autores: Conceptualización, Catherine Silva Agurto, Metodología, Catherine Silva Agurto y Michel Leiva Mora, software, Catherine Silva Agurto y Tatiana Acosta Villacis, validación, Catherine Silva Agurto y Nayeli Sánchez Ortiz, análisis formal, Catherine Silva Agurto y Nayeli Sánchez Ortiz; investigación, Catherine Silva Agurto y Michel Leiva Mora; recursos, Michel Leiva Mora, Catherine Silva Agurto y Tatiana Acosta Villacis, curado de datos, Michel Leiva Mora, Catherine Silva Agurto; redacción—redacción borrador original, Michel Leiva Mora, Catherine Silva Agurto; redacción, revisión y edición, Michel Leiva Mora, Catherine Silva Agurto, Tatiana Acosta Villacis y Nayeli Sánchez Ortiz; supervisión, Catherine Silva Agurto; administración del proyecto, Michel Leiva Mora, adquisición del financiamiento, Michel Leiva Mora y Catherine Silva Agurto; Todos los autores han leído y están de acuerdo con la versión publicada del manuscrito.
Agradecimientos: Agradecemos al apoyo ofrecido por la coordinadora de investigación Deysi Alexandra Guevara Freire y a las autoridades de la Facultad de Ciencias Agropecuarias de la Universidad Técnica de Ambato, así como a la Dirección de Investigación y Desarrollo (DIDE-FCAGP) por reconocer y brindar el apoyo a los esfuerzos realizados en este proyecto, mismo que fue autofinanciado por la Ingeniera Catherine Silva Agurto y el Doctor Michel Leiva Mora.
Conflictos de interés: “Los autores declaran no tener conflicto de interés”.
REFERENCIAS
1- Reddy BJ, Mandal R, Chakroborty M, Hijam L, Dutta P. A review on potato (Solanum tuberosum L.) and its genetic diversity. Int J Genet. 2018; ISSN(0975-2862).
2- Sahair A, Sneha S, Raghu N, Gopenath T, Karthikeyan M, Gnanasekaran A, et al. Solanum tuberosum L: Botanical, Phytochemical, pharmacological and Nutritional significance. Int J Phytomed. 2018; 10(3): 115-124.
3- Ngobese NZ, Workneh TS. Potato (Solanum tuberosum L.) nutritional changes associated with French fry processing: Comparison of low-temperature long-time and high-temperature short-time blanching and frying treatments. Lwt. 2018; 97: 448-455.
4- Dereje B, Chibuzo N. Nutritional composition and biochemical properties of Solanum tuberosum. In: Solanum tuberosum: A Promising Crop for Starvation Problem. 2021: 106-118.
5- Cerón-Lasso M, Alzate-Arbeláez A, Rojano B, Ñuztez-Lopez C. Composición Fisicoquímica y Propiedades Antioxidantes de Genotipos Nativos de Papa Criolla (Solanum tuberosum Grupo Phureja). Información tecnológica. 2018; 29(3) :205-216.
6- Shukla S, Pandey SS, Chandra M, Pandey A, Bharti N, Barnawal D, et al. Application of essential oils as a natural and alternate method for inhibiting and inducing the sprouting of potato tubers. Food Chem. 2019; 284: 171-179.
7- Visse-Mansiaux M, Soyeurt H, Herrera JM, Torche JM, Vanderschuren H, Dupuis B. Prediction of potato sprouting during storage. Field Crops Res. 2022; 278: 108396.
8- Bisognin DA, Manrique-Carpintero NC, Douches DS. QTL Analysis of Tuber Dormancy and Sprouting in Potato. Am J Potato Res. 2018; 95: 374-382.
9- Arnon-Rips H, Sabag A, Tepper-Bamnolker P, Chalupovich D, Levi-Kalisman Y, Eshel D, et al. Effective suppression of potato tuber sprouting using polysaccharide-based emulsified films for prolonged release of citral. Food Hydrocolloids. 2020; 103: 105644.
10- Jia B, Xu L, Guan W, Lin Q, Brennan C, Yan R, et al. Effect of citronella essential oil fumigation on sprout suppression and quality of potato tubers during storage. Food Chem. 2019; 284: 254-258.
11- Murigi W, Nyankanga R, Shibairo S. Effect of Storage Temperature and Postharvest Tuber Treatment with Chemical and Biorational Inhibitors on Suppression of Sprouts During Potato Storage. J Hortic Res. 2021; 29(1): 83-94.
12- Boivin M, Bourdeau N, Barnabé S, Desgagné-Penix I. Sprout Suppressive Molecules Effective on Potato (Solanum tuberosum) Tubers during Storage: a Review. Am J Potato Res. 2020; 97: 451-463.
13- Claassens M, Verhees J, van der Plas L, van der Krol A, Vreugdenhil D. Ethanol breaks dormancy of the potato tuber apical bud. J Exp Bot. 2005; 56(419): 2515-2525.
14- Haider MW, Nafeesa M, Amina M, Asadb HU, Ahmad I. Physiology of tuber dormancy and its mechanism of release in potato. J Hortic Sci Technol. 2021; 4(1): 13-21.
15- Haider MW, Nafees M, Ahmad I, Ali B, Maryam Iqbal R, Vodnar DC, et al. Postharvest dormancy-related changes of endogenous hormones in relation to different dormancy-breaking methods of potato (Solanum tuberosum L.) tubers. Front Plant Sci. 2022; 13: 94525.
16- Zhang H, Liu X, Nie B, Song B, Du P, Liu S, et al. Nitrogen management can inhibit or induce the sprouting of potato tubers: Consequences of regulation tuberization. Postharvest Biol Technol. 2022; 183: 111722.
17- Liang D, Huang X, Shen Y, Shen T, Zhang H, Lin L, et al. Hydrogen cyanamide induces grape bud endodormancy release through carbohydrate metabolism and plant hormone signaling. BMC Genomics. 2019; 20(1): 1-14.
18- Shimoda S., Kanno H, Hirota, T. Time series analysis of temperature and rainfall-based weather aggregation reveals significant correlations between climate turning points and potato (Solanum tuberosum L) yield trends in Japan. Agricultural and Forest Meteorology. 2018; 263: 147-155.
19- Suttle JC, Olson LL, Lulai EC. The involvement of gibberellins in 1, 8-cineole-mediated inhibition of sprout growth in Russet Burbank tubers. Am J Potato Res. 2016;93:72-79.
20- Salimi K, Afshari RT, Hosseini MB, Struik PC. Effects of gibberellic acid and carbon disulphide on sprouting of potato minitubers. Sci Hortic. 2010;124(1):14-18.
21- Hu Q, Tang C, Zhou X, Yang X, Luo Z, Wang L, et al. Potatoes dormancy release and sprouting commencement: A review on current and future prospects. Food Frontiers. 2023.
22- Haider MW, Nafees M, Ahmad I, Ali B, Maryam, Iqbal R, et al. Postharvest dormancy-related changes of endogenous hormones in relation to different dormancy-breaking methods of potato (Solanum tuberosum L.) tubers. Front Plant Sci. 2022; 13: 945256.
23- Haider MW, Nafeesa M, Amina M, Asadb HU, Ahmad I. Physiology of tuber dormancy and its mechanism of release in potato. J Hortic Sci Technol. 2021; 4(1): 13-21.
24- Wróbel S, Kęsy J, Treder K. Effect of growth regulators and ethanol on termination of dormancy in potato tubers. Am J Potato Res. 2017; 94: 544-555.
25- Gong HL, Dusengemungu L, Igiraneza C, Rukundo P. Molecular regulation of potato tuber dormancy and sprouting: a mini-review. Plant Biotechnol Rep. 2021;15(4):417-434.
26- Claassens MM, Verhees J, van der Plas LH, van der Krol AR, Vreugdenhil D. Ethanol breaks dormancy of the potato tuber apical bud. J Exp Bot. 2005;56(419):2515-2525.
27- Gong HL, Dusengemungu L, Igiraneza C, Rukundo P. Molecular regulation of potato tuber dormancy and sprouting: a mini-review. Plant Biotechnol Rep. 2021; 15(4): 417-434.
28- Nonhebel HM, Cooney TP, Simpson R. The route, control and compartmentation of auxin synthesis. Funct Plant Biol. 1993; 20(5): 527-539.
29- Retnoningrum MD, Setiawan MA. Concentration Effect of Ethanol Extract Pinus merkusii Leaves Litter on Zea mays L. Seed Germination. J Phys: Conf Ser. 2021; 1783(1): 012003.
30- Kader AA, Saltveit ME. Respiration and gas exchange. In: J. Kader AA, Saltveit ME, eds. Postharvest Physiology and Pathology of Vegetables. CRC Press; 2002:31-56.
31- Northcott D, Nowak J. Effects of hydrogen cyanamide on seed potato. Potato Res. 1988; 31: 95-103.
32- Amberger A. Cyanamide in plant metabolism. Int J Plant Physiol Biochem. 2013; 5(1): 1-10.
33- Bajji M, M'Hamdi M, Gastiny F, Rojas-Beltran JA, Du Jardin P. Catalase inhibition accelerates dormancy release and sprouting in potato (Solanum tuberosum L.) tubers. Biotechnol Agron Soc Environ. 2007; 11(2).
34- Harmon P, Liburd O, Dittmar P, Williamson J, Phillips D. 2022 Florida Blueberry Integrated Pest Management Guide: HS380/HS1156, rev. 11/2021. EDIS. 2021(6).
35- Rosa AM, Marodin GAB, Fialho FB, Marchi VDV, Santos HPD. Alternative budburst management in Campanha Gaúcha vineyards. Rev Bras Frutic. 2020; 42.
36- Abdlhamid AS. Impact of Dormex Concentration and Spraying Date on the Fruitful Flame Seedless Grapevines. Ann Agric Sci Moshtohor. 2021;59(4):961-974.
37- Sassine YN, Al Turki SM, El Sebaaly Z, Bachour L, El Masri IY. Finding alternatives for Dormex (Hydrogen Cyanamid) as dormancy breaking agent. Fresenius Environ Bull. 2019; 28(12A): 10214-10224.
38- Haider MW, Nafeesa M, Amina M, Asadb HU, Ahmad I. Physiology of tuber dormancy and its mechanism of release in potato. J Hortic Sci Technol. 2021; 4(1): 13-21.
39- Gong HL, Dusengemungu L, Igiraneza C, Rukundo P. Molecular regulation of potato tuber dormancy and sprouting: a mini-review. Plant Biotechnol Rep. 2021; 15(4): 417-434.
40- Lin SY, Agehara S. Budbreak patterns and phytohormone dynamics reveal different modes of action between hydrogen cyanamide-and defoliant-induced flower budbreak in blueberry under inadequate chilling conditions. PLoS One. 2021;16(8):e0256942.
41- Amberger A. Cyanamide in plant metabolism. Int J Plant Physiol Biochem. 2013; 5(1): 1-10.
42- Krasuska U, Gniazdowska A. Nitric oxide and hydrogen cyanide as regulating factors of enzymatic antioxidant system in germinating apple embryos. Acta Physiol Plant. 2012; 34: 683-692.
43- Lin M, Wang S, Liu Y, Li J, Zhong H, Zou F, et al. Hydrogen cyanamide enhances flowering time in tea oil camellia (Camellia oleifera Abel.). Ind Crop Prod. 2022;176:114313.
44- Liang D, Huang X, Shen Y, Shen T, Zhang H, Lin L, et al. Hydrogen cyanamide induces grape bud endodormancy release through carbohydrate metabolism and plant hormone signaling. BMC Genomics. 2019; 20(1): 1-14.
45- Lin M, Wang S, Liu Y, Li J, Zhong H, Zou F, et al. Hydrogen cyanamide enhances flowering time in tea oil camellia (Camellia oleifera Abel.). Ind Crop Prod. 2022; 176: 114313.
46- Cao D, Chabikwa T, Barbier F, Dun EA, Fichtner F, Dong L, et al. Auxin-independent effects of apical dominance induce changes in phytohormones correlated with bud outgrowth. Plant Physiol. 2023; 192(2): 1420-1434.
47- Bagale P, Pandey S, Regmi P, Bhusal S. Role of plant growth regulator “Gibberellins” in vegetable production: an overview. Int J Hort Sci Technol. 2022; 9(3): 291-299.
Received: 28 May 2023/ Accepted: 15 July 2023 / Published:15 September 2023
