2023.08.03.73
Files > Volume 8 > Vol 8 No 3 2023
Capacidad de absorción del clotrimazol por parte de diferentes polímeros como material para impresión en 3D de las celdas de difusión vertical de Franz: estudio preliminar
The clotrimazole absorption capacity of different polymers as material for 3D printing of the Franz cells: a preliminary study
1 Instituto de Investigaciones en Ciencias Tecnológicas y Aplicadas (IICAT), Universidad Nacional Autónoma de Honduras (UNAH), Tegucigalpa, Honduras
2 Instituto de Investigaciones en Microbiologia, Universidad Nacional Autónoma de Honduras (UNAH), Tegucigalpa, Honduras.
3 Dirección de Investigación Científica, Humanística y Tecnológica (DICIHT), Universidad Nacional Autónoma de Honduras (UNAH), Tegucigalpa, Honduras.
*autor de correspondencia: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.03.73
RESUMEN
Los ensayos biofarmacéuticos forman parte de una de las ramas de la farmacología denominada farmacocinética. Estos ensayos son necesarios para determinar si las formulaciones farmacéuticas, cosméticas o alimentos funcionales, pueden ser liberados de sus excipientes hacia el torrente sanguíneo mediante técnicas in vitro y ex vivo haciendo uso de las celdas de difusión vertical de Franz. Objetivo. Realizar análisis químicos para determinar la absorción de fármaco por parte de diversos polímeros termorresistentes como material para impresión 3D de las celdas de Franz. Materiales y métodos. Se utilizaron tres diferentes polímeros: PEGT, ABS, y PLA. El clotrimazol fue utilizado como fármaco para el ensayo de absorción. La técnica utilizada para cuantificar el clotrimazol fue la espectrofotometría ultravioleta. Resultados. Se descartó el ABS como material de impresión ya que, al sumergirse en diversos solventes, este se decoloró y, no así, el PEGT y el PLA. Conclusión. El PEGT fue el mejor polímero ya que este no absorbió fármaco.
Palabras clave. Celdas de Franz, polímeros, espectrofotometría UV, impresión 3D.
ABSTRACT
Biopharmaceutical trials are part of one of the branches of pharmacology called pharmacokinetics. These tests are necessary to determine whether pharmaceutical formulations, cosmetics, or functional foods can be released from their excipients into the bloodstream using in vitro and ex vivo techniques using Franz vertical diffusion cells. Aim. Perform chemical analyses to determine drug absorption by various thermoresistant polymers as a material for Franz cell in 3D printing. Three different polymers were used: PEGT, ABS, and PLA. Clotrimazole was used as the drug for the absorption test. The technique used to quantify clotrimazole was ultraviolet spectrophotometry. Results. ABS was discarded as a printing material since it discolored when immersed in various solvents, and the PEGT and the PLA did not. Conclusion. PEGT was the best polymer since it did not absorb the drug.
Keywords. Franz cells, polymers, UV spectrophotometry, 3D printing
INTRODUCCIÓN
La farmacología es la ciencia que estudia la acción de los fármacos sobre los sistemas biológicos tanto en humanos como animales. Asimismo, es una ciencia básica no solamente para la medicina sino también para farmacia, enfermería, odontología y medicina veterinaria1. Esta ciencia se divide en dos áreas muy bien diferenciadas: la farmacodinamia y la farmacocinética. La farmacodinamia estudia el efecto del medicamento, cosmético o alimento funcional en el organismo, mientras que, la farmacocinética estudia el efecto que ejerce el organismo en el medicamento2. Cuando elaboramos un nuevo medicamento, alimento o cosmético, es importante saber si estos se podrán liberar al sitio de acción para ejercer el efecto deseado. Se sabe que para ello se realizan ensayos clínicos en seres humanos, no obstante, antes de llegar a esto es de vital importancia realizar ensayos in vitro, in vivo (en animales de experimentación) y ex vivo. Para ello, se requieren de pruebas con material biológico ya sea piel, ojo, vagina, uñas, cuero cabelludo, mucosa oral entre otros haciendo uso de un dispositivo denominado celdas de difusión vertical de Franz3.
Las celdas de Franz fueron desarrolladas en 1975 como uno de los principales métodos utilizados para evaluar la liberación de fármacos y la penetración transepitelial a través de los tejidos4. Estas celdas están constituidas por un sistema compuesto de dos compartimentos, uno donador y otro receptor, separadas por una membrana de origen animal, humana o sintética que permite evaluar la difusión de moléculas biológicamente activas de un compartimento a otro. En el compartimento superior se adiciona una solución o dispersión que contiene el compuesto activo (medicamento, alimento funcional, cosmético o cosmeceutico) y en el inferior se agrega una sustancia biocompatible que simula la sangre. En la parte externa se encuentra un pequeño tubo por donde se toman las muestras correspondientes, que posteriormente son cuantificadas mediante técnicas analíticas como espectrofotometría Ultravioleta (UV) o por Cromatografía Líquida de Alta Resolución (HPLC, por sus siglas en inglés)5. Dentro de los parámetros que influyen en la difusión de dicho compuesto, están la temperatura, la velocidad de agitación, el tipo y naturaleza de la membrana y el medio del compartimento receptor6 (ver figura 1).

Figura 1. Celdas de Franz. A. Diferentes cámaras y tubo de extracción de muestra. B. Diferentes tipos de membranas que se pueden colocar entre el compartimento donador y receptor. Fuente: elaboración propia.
Comúnmente, las celdas de Franz se elaboran con vidrio ya sea transparente o color topacio. Dicho equipo tiene un precio en el mercado de aproximadamente 30,000 dólares, con lo cual, no está fácilmente disponible para cualquier industria, laboratorios de investigación y desarrollo o en centros de experimentación, especialmente en los países donde los fondos para la investigación son escasos. Para ello se consideró fabricar estos dispositivos haciendo uso de la impresión 3D y, utilizando como material polímeros resistentes al calor y que no absorban el compuesto activo que deseamos estudiar con el objetivo de obtener las celdas en un menor costo y similar utilidad.
Bajo este contexto, previo a la impresión de las celdas de Franz, se propuso como objetivos: i. Elegir diversos tipos de polímeros resistentes al calor, ii. Sumergirlos en una sustancia comúnmente utilizada como medio receptor y observar la resistencia ante el mismo, y iii. Ensayar la absorción de fármacos por parte de estos polímeros.
MATERIALES Y MÉTODOS
Se utilizó Clotrimazol 99% de pureza obtenida de Acofarma (Barcelona, España), Transcutol®-P donada por Gattefosse (Saint-Priest, France), propilenglicol, polietilenglicol, buffer pH 4.0 y 7.0 obtenidos de Distribuidora Caribe (Tegucigalpa, Honduras). Los polímeros utilizados fueron: Polyethylen terephtalate glicol (PETG), Acrylonitrile butadiene styrene (ABS) y Polylactic acid (PLA). Cada polimero fue impreso en 3D en placas con un tamaño de 10 mm x 10 mm x 1 mm.
Pruebas de calor
Las placas de PETG, ABS, y PLA se sumergieron en 30 mL de agua destilada y se colocaron en baño maría a 32 ± 0.5 ◦C durante 24 horas (n=3).
Pruebas en solución
Las placas de PETG, ABS, y PLA se sumergieron en 10 mL de Transcutol®-P, propilenglicol, polietilenglicol, solución pH 4.0 y 7.0 y se colocaron en baño maría a 32 ± 0.5 ◦C durante 24 horas (n=3).
Pruebas de absorción
Se disolvieron 0.5 g de CLT en 50 mL en Transcutol®-P y se agitaron hasta completa disolución a 25 ◦C (Solución A). Posteriormente, se tomaron 2 mL de la solución A en un recipiente de polipropileno y se sumergieron las placas de PETG, ABS y PLA a 25 ± 0.5 ◦C durante 24 horas. Se tomó una muestra para cuantificar el CLT antes de agregar los polímeros. Por último, las placas de PETG, ABS y PLA sumergidas en Transcutol®-P se colocaron a 32 ± 0.5 ◦C durante 24 horas (n=3). Esto para determinar si la temperatura aplicada permite la absorción de fármaco por parte de los polímeros.
Pruebas de cuantificación de CLT en las placas de PEGT, ABS y PLA
Las muestras obtenidas de los ensayos de absorción de CLT por parte de los polímeros fueron analizadas por espectrofotometría UV-Vis.
Para el análisis, primero se preparó una curva de calibración tomando 10 mg de CLT en 10 mL de metanol grado HPLC. Seguidamente, se tomó 1 mL de la solución anterior y se llevó a 10 mL con una mezcla de K2HPO4 al 0.05 M y metanol 75:25 v/v. Posteriormente, se tomaron las siguientes alícuotas: 2000 µL, 1000 µL, 500 µL y 250 µL y se llevaron a 10 mL con una mezcla de K2HPO4 al 0.05 M y metanol 75:25 v/v.
Posteriormente, las muestras se trataron de la siguiente manera: se disolvió 1.0 g de CLT en 100 mL de Transcutol®-P hasta total disolución. Posteriormente, se tomaron 2 mL de la solución y se disolvieron en 2 mL de propilenglicol, 2 mL de polietilenglicol, 2 mL de buffer pH 4.0 y 2 mL de buffer pH 7.0. Seguidamente, se tomó una muestra de 100 µL de cada una de las soluciones y se llevaron a 10 mL con metanol grado HPLC. Finalmente, se tomó 1.5 mL de la solución anterior y se llevó a 10 mL con la mezcla de K2HPO4 0.05 M y metanol 75:25 v/v.
Las lecturas de absorbancia se llevaron a cabo a una λ = 220 nm utilizando una microcubeta de cuarzo con una capacidad de 800 µL de muestra en un espectrofotómetro Amersham Biosciences Ultrospect 1100 Pro UV/Visible (Amersham Biosciences, Piscataway, New Jersey).

Figura 2. Representación esquemática del procedimiento realizado para elegir el polímero para la fabricación de la celda de Franz. Fuente: elaboración propia.
RESULTADOS
Pruebas de calor
Las placas no se dañaron al ponerse en contacto con agua a temperatura de 32 ◦C. Las piezas no se destiñeron por lo que estos materiales resisten a la temperatura aplicada.
Pruebas en solución
Las piezas de PETG, ABS, y PLA resistieron en las diversas soluciones ensayadas. Únicamente se observó que el ABS se decoloró sumergido en el Transcutol®-P. Para el caso del propilenglicol, polietilenglicol, solución pH 4.0 y pH 7.0, los polímeros no se decoloraron.
Pruebas de absorción
Se obtuvo una curva de calibración con un r2 de 0.9978. El valor de la pendiente fue de 71.61 y con un intercepto de 0.0587 (ver figura 3). En la tabla 1 se puede observar el valor de las absorbancias.

Tabla 1. Valores de las absorbancias en dependencia de la concentración al momento de elaborar la curva de calibrado. Fuente: elaboración propia.
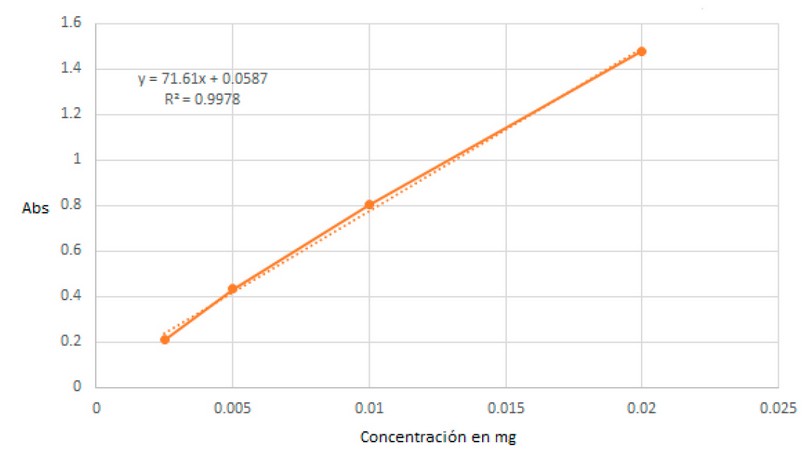
Figura 3. Curva de calibración del CLT. Fuente: elaboración propia.
Referente a la absorción de CLT por parte del PEGT y PLA, podemos decir que los resultados fueron similares para ambos. No obstante, la concentración de CLT absorbida por el PLA fue ligeramente mayor que la de PEGT especialmente al haberse sumergido en el propilenglicol y polietilenglicol. En la tabla 2 se pueden observar los valores en porcentaje de CLT cuantificado antes y después de colocar las placas de polímero.
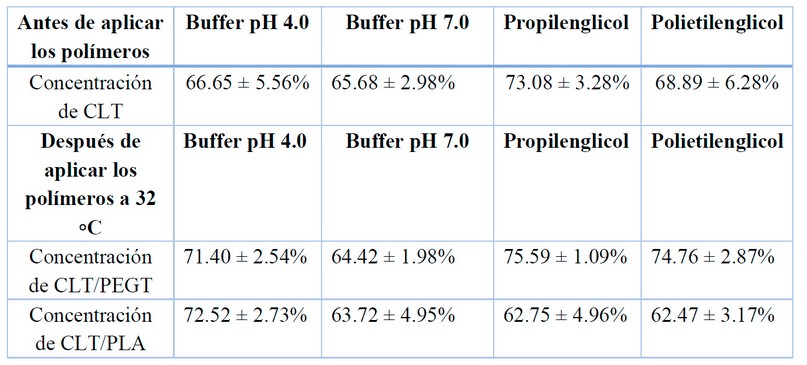
Tabla 2. Concentración de CLT antes y después de aplicar los polímeros ensayados
DISCUSIÓN
Las celdas de Franz convencionales que se utilizan en los laboratorios de desarrollo de matrices farmacéuticas, cosméticas y alimenticias se fabrican comúnmente de vidrio y las podemos ver en diferentes formas y tamaños dependiendo de las condiciones experimentales requeridas7. Al ser estas celdas de vidrio, son frágiles y el manejo que se le debe de dar por parte del analista debe ser cuidadoso tanto al montar el experimento como al desmontarlo ya que se pueden sufrir cortaduras y contaminación del material de estudio. Es por ello que, las nuevas tecnologías emergentes como la impresión 3D permiten la fabricación de estas celdas utilizando diferentes materiales poliméricos. Estos han mostrado excelente potencial para la producción de diversas piezas de equipo de laboratorio8. Los materiales de bajo coste han hecho que las impresoras 3D se vuelvan imprescindibles. Asimismo, mediante estas técnicas, los ensayos biofarmacéuticos haciendo uso de celdas de Franz sean mucho más económicos con resultados equivalentes al utilizar celdas de vidrio.
En el presente estudio se utilizaron tres tipos de polímeros: ABS en color azul, PEGT en color negro y PLA en color blanco como posible material para la fabricación de las celdas de Franz. Las tres placas resistieron a la aplicación de temperatura a 32◦C. Esta temperatura es la utilizada al realizar ensayos con piel humana por lo que los polímeros deben ser termorresistentes. Condición que los 3 polímeros cumplieron. Asimismo, cuando se realizan ensayos de liberación de fármacos y permeaciones transepidermicas, en el medio receptor de la celda de Franz, se colocaron diversas sustancias las cuales deben cumplir la característica de biocompatibilidad. Dentro de las sustancias más utilizadas tenemos el agua9, propilenglicol10, Transcutol-P11, soluciones tamponadas12. En este estudio fuerón utilizados el propilenglicol, polietilenglicol, soluciones buffer a pH 4.0 y pH 7.0 y Transcutol®-P. Específicamente, el polietilenglicol fue utilizado ya que el fármaco con el que se trabajó fue el CLT. Este fármaco es soluble en polietilenglicol aplicándole un poco de temperatura. Como el parámetro de la solubilidad es muy importante, primero se solubilizó el CLT en Transcutol®-P hasta tener una solución completamente transparente. Posterior a ello, se realizaron las soluciones de CLT con las sustancias elegidas para el ensayo.
De los resultados obtenidos en el ensayo especificado en la sección 2.2.3, fue descartada la placa de ABS, ya que, esta destiñó completamente al ponerse en contacto con el Transcutol®-P. Con base en lo anterior, los ensayos de absorción de fármaco se realizaron únicamente con las placas de PEGT y PLA. En el presente estudio, el método de cuantificación para el CLT fue por espectrofotometría UV-Vis, ya que esta técnica fue validada previamente siguiendo la metodología de Soriano et al con algunas modificaciones13. La ventaja de la espectrofotometría UV-Vis frente al HPLC es que es más económica y fácil de realizar14,15. Además, mediante HPLC se tuvieron algunas dificultades como una ligera precipitación por parte del K2HPO4.
De las placas de PEGT y PLA, la de PEGT no absorbió fármaco después de ponerse en contacto con los solventes elegidos y a temperatura de 32 ◦C. Referente a las placas de PLA, absorbieron un contenido bajo de fármaco. Esto podría deberse a la porosidad del PLA (aunque el PEGT también es poroso) y a que suele ser menos resistentes a las sustancias químicas que el PEGT. Estudios mediante microscopia de barrido (SEM, por sus siglas en ingles) son necesarias para determinar con más certeza esta característica. Asimismo, para impresiones en 3D, el PETG también es conocido por ser más rígido que el PLA, lo que también tiene sus propios beneficios, especialmente en aplicaciones industriales. Además, el PEGT es más duradero en el tiempo que el PLA. También, el PEGT es mejor para producir piezas flexibles pero resistentes a los golpes y es resistente a los rayos UV con lo cual podríamos realizar ensayos de liberación de sustancias fotosensibles sin que estos se degraden durante los ensayos tales como las vitaminas o antimicóticos como la nistatina y la Anfotericina B. Otra ventaja del PETG es que suele tener una mayor resistencia al calor que el PLA, lo que significa que puede estar expuesto a los elementos más que el PLA antes de comenzar a descomponerse. No es un material tóxico con lo cual se pueden utilizar con seguridad por parte de los analistas16. No obstante, aunque en este estudio los mejores resultados se obtuvieron con el PEGT, estudios han demostrado que el PLA es optimo para la impresión de celdas de Franz en 3D recomendando tener cuidado con la elección del filamento utilizado en el proceso de impresión debido a las posibles interacciones con el fármaco17.
Algunos solventes como Dimetil Sulfoxido (DMSO) también ha sido utilizado como medio receptor en las celdas de Franz para ensayos de liberación. 18,19 Para este estudio no se pudieron realizar pruebas con DMSO. Estudios futuros son necesarios para determinar si esta sustancia podría ser compatible con el PEGT y PLA. Asimismo, estudios a 37 ◦C son necesarios específicamente para realizar ensayos con membranas biológicas como vagina, ojo, oreja e intestino.
CONCLUSIONES
En el presente estudio se utilizaron tres polímeros para futuras impresiones en 3D de las celdas de Franz, ABS, PEGT y PLA. El polímero ABS se descartó del estudio ya que el color que contenía interactuaba con uno de los solventes utilizados (Transcutol®-P). El PEGT y el PLA utilizados para los ensayos de absorción de fármaco (CLT), no destiñeron ni se desintegraron. De ambos, el polímero que no absorbió CLT fue el PEGT. Por otro lado, el PLA absorbió, pero en pequeños porcentajes. Por lo que el PEGT es el polímero de eleccion para la impresión en 3D de las celdas de difusión de Franz. Estudios con otros solventes como el DMSO son necesarios para algunos ensayos con fármacos que son extremadamente lipófilos e insolubles en la mayoría de los solventes orgánicos e inorgánicos.
Contribución de los autores: Conceptualización, L.S. y FZ; metodología, L.S, F.Z y D.R.; validación, LS, análisis formal, L.S y D.R.; investigación, L.S, D.R y F.Z.; recursos, S,R y F.Z.; curación de datos, LS; escritura—preparación del borrador original, L.S.; redacción: revisión y edición, L.S, F.Z, D.R, S.R.; visualización, DR, SR; supervisión; administración de proyectos, F.Z, L.S, D.R y S.R. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Agradecimientos: Agradecemos al IICAT por el apoyo brindado al realizar estas pruebas. A la facultad de Ciencias Químicas y Farmacia por aperturarnos el laboratorio Elvira Castejon de David para realizar las pruebas de absorción. A la Dra. Ana Calpena, Mireia Mallandrich y María Rincón de la Universidad de Barcelona.
Conflicto de intereses: Los Autores declaramos no tener conflictos de intereses
REFERENCES
1. T, Xie L. Providing data science support for systems pharmacology and its Hart implications to drug discovery. Expert Opin Drug Discov. 2016;11(3):241-56.
2. Derendorf, H., Lesko, L.J, Chaikin, P., Colburn, W.A, Lee, P., Miller, R., Powell, R., Rhodes, G., Stanski D., Venitz, J. Pharmacokinetic/pharmacodynamic modeling in drug research and development. J Clin Pharmacol. 2000;40(12 Pt 2):1399-418.
3. Haque, T., Lane, M.E., Sil, B.C., Crowther, J.M. and Moore, D.J. In vitro permeation and disposition of niacinamide in silicone and porcine skin of skin barrier-mimetic formulations. Int. J. Pharm. 2017; 520, 158–62.
4. Villarino, N., Landoni, M. Administración transdérmica de fármacos: Una alternativa terapéutica, Analecta Veterinaria, 2006; 26, 28-37.
5. Chattaraj, S., Swarbrick, J., Kanfer, I. A simple diffusion cell to monitor drug release from semi-solid dosage forms, Int. J. Pharm. 2005, 120, 119-124.
6. Estévez, T., Aguilera, A., Sáez, A., Hardy, E. Diseño y validación de una celda de difusión para estudios de liberación in vitro de biomoléculas, Biotecnología Aplicada, 2000; 17, 187-190.
7. Franz, T.J. Percutaneous absorption on the relevance of in vitro data. J Inv Derm. 1975; 64, 190–5.
8. Mohmmed, S.A., Vianna, M.E., Hilton, S.T., Boniface, D.R., Ng, Y.-L. and Knowles, J.C. Investigation to test potential stereolithography materials for the development of an in vitro root canal model. Mic Res Tech. 2016; 80, 202–10.
9. Berenguer D, Sosa L, Alcover M, Sessa M, Halbaut L, Guillén C, Fisa R, Calpena-Campmany AC, Riera C. Development and Characterization of a Semi-Solid Dosage Form of Meglumine Antimoniate for Topical Treatment of Cutaneous Leishmaniasis. Pharmaceutics. 2019;11(11):613.
10. Fernández Campos F, Calpena Campmany AC, Rodríguez Delgado G, López Serrano O, Clares Naveros B. Development and characterization of a novel nystatin-loaded nanoemulsion for the buccal treatment of candidosis: ultrastructural effects and release studies. J Pharm Sci. 2012;101(10):3739-52.
11. Sosa L, Clares B, Alvarado HL, Bozal N, Domenech O, Calpena AC. Amphotericin B releasing topical nanoemulsion for the treatment of candidiasis and aspergillosis. Nanomedicine. 2017 Oct;13(7):2303-2312.
12. Salamanca CH, Barrera-Ocampo A, Lasso JC, Camacho N, Yarce CJ. Franz Diffusion Cell Approach for Pre-Formulation Characterisation of Ketoprofen Semi-Solid Dosage Forms. Pharmaceutics. 2018;10(3):148.
13. José L. Soriano-Ruiz, Ana C. Calpena-Capmany, Cristina Cañadas-Enrich, Nuria Bozal-de Febrer, Joaquim Suñer-Carbó, Eliana B. Souto, Beatriz Clares-Naveros, Biopharmaceutical profile of a clotrimazole nanoemulsion: Evaluation on skin and mucosae as anticandidal agent, Int. J. Pharm, 2019; 554,105-115.
14. Dhole SM, Khedekar PB, Amnerkar ND. Comparison of UV spectrophotometry and high performance liquid chromatography methods for the determination of repaglinide in tablets. Pharm Methods. 2012;3(2):68-72. doi: 10.4103/2229-4708.103875.
15. Jain PS, Chaudhari AJ, Patel SA, Patel ZN, Patel DT. Development and validation of the UV-spectrophotometric method for determination of terbinafine hydrochloride in bulk and in formulation. Pharm Methods. 2011;2(3):198-202.
16. PLA vs PETG: ¿Qué material de impresión 3D elegir?, disponible en: https://www.3dnatives.com/es/pla-vs-petg-material-elegir-110520212/#!.
17. Fazili, Z., Ward, F., Walton, K., Blunt, L., Asare-Addo, K. Design and development of a novel fused filament fabrication (FFF) 3D printed diffusion cell with UV imaging capabilities to characterize permeation in pharmaceutical formulations, Eur J Pharm Biopharm, 2020;152,202-209,
18. Sosa L, Espinoza L C, Fuentes J M, Siwady J A, Rivas F R, Díaz M R. Polyene macrolide antibiotic nanoemulsion: a proposal for the treatment of cutaneous leishmaniasis. Revis Bionatura, 2022;7(4) 62.
19. Sosa L, Calpena AC, Silva-Abreu M, Espinoza LC, Rincón M, Bozal N, Domenech O, Rodríguez-Lagunas MJ, Clares B. Thermoreversible Gel-Loaded Amphotericin B for the Treatment of Dermal and Vaginal Candidiasis. Pharmaceutics. 2019; 3;11(7):312.
Received: 25 June 2023/ Accepted: 26 August 2023 / Published:15 September 2023
Citation: Sosa L, Zorto F, Ramírez D, Ruiz S J.Capacidad de absorción del clotrimazol por parte de diferentes polímeros como material para impresión en 3D de las celdas de difusión vertical de Franz: estudio preliminar.Revis Bionatura 2023;8 (3) 73. http://dx.doi.org/10.21931/RB/2023.08.03.73
