2022.07.02.29
Files > Volume 7 > Vol 7 No 2 2022
Evaluación de diferentes combinaciones de polímeros en la microencapsulación de licopenos procedentes de residuos de tomate de árbol (Solanum betaceum).
Evaluation of different polymer combinations in the microencapsulation of lycopenes from tree tomato (Solanum betaceum) residues.
1, 2, 3 Facultad de Ciencia e Ingeniería en Alimentos y Biotecnología, Universidad Técnica de Ambato, Ecuador.
4 Instituto de Farmacia y Alimentos, Universidad de la Habana, Cuba
Autor de correspondencia: López, Orestes Darío [email protected]
Available from: http://dx.doi.org/10.21931/RB/2022.07.02.29
RESUMEN
El consumo de tomate de árbol en el Ecuador es muy amplio a lo largo de las diferentes zonas, es decir, tiene una gran demanda, a su vez no es aprovechado en su totalidad generando gran cantidad de residuos orgánicos. Mediante la microencapsulación se pueden elaborar productos derivados de los principios activos que se generan de esta fruta. En este trabajo se extrajeron y concentraron carotenoides de la piel de Solanum betaceum. Además, se microencapsuló los principios activos contenidos en el extracto con polímeros (goma arábiga y maltodextrina) en una concentración del 35 y 40 %. Es necesario controlar la temperatura de microencapsulación para evitar la degradación del material de interés.
Es importante determinar la actividad que presentan dichos metabolitos al ser microencapsulados, se evaluó la actividad antioxidante utilizando un método colorimétrico cuantitativo llamado DPPH. Por otro lado, se usó un modelo in vivo con Saccharomyces cerevisiae en el cual se midió la actividad antioxidante considerandondo de la curva de crecimiento del microorganismo en cuestión sometiéndolo a diferentes factores, uno de ellos el crecimiento normal sin agentes externos, en los dos siguientes se emplearon concentraciones de agentes oxidantes, para simular estrés alto y bajo con hipoclorito de sodio y peróxido de hidrógeno.
Palabras clave: Carotenoides, extracción, secado por aspersión, actividad antioxidante, Saccharomyces cerevisiae, razón de crecimiento.
ABSTRACT
Tree tomato consumption in Ecuador is pervasive across the different areas; it has a great demand, but it is not used in its entirety, generating a large amount of organic waste. Through microencapsulation, products derived from active ingredients generated from this fruit can be developed. Carotenoids were extracted and concentrated from Solanum betaceum’s rind in this work. In addition, active ingredients contained in the extract were microencapsulated using polymers (gum arabic and maltodextrin) at 35 and 40% of concentrations. It is necessary to control the microencapsulation temperature to avoid degradation of the material of interest.
It is essential to define metabolites’ activity when microencapsulated; the antioxidant activity was evaluated using a quantitative colorimetric method called DPPH. On the other hand, an in vivo model with Saccharomyces cerevisiae was used considering the growth curve of the microorganism subjecting to different factors; one of the expected growth without external agents, in the following two concentrations of oxidizing agents, were used to simulate high and low stress with sodium hypochlorite and hydrogen peroxide.
Keywords. Carotenoids, extraction, spray drying, antioxidant activity, Saccharomyces cerevisiae, growth rate.
INTRODUCCIÓN
Una de las causas más comunes que provoca un aumento en la tasa de mortalidad humana son las enfermedades no transmisibles (ENTs), un 71 % de la población representada aproximadamente por 41 millones de personas son afectadas cada año según la Organización Mundial de la Salud (OMS)1 . El Instituto Nacional de Estadística y Censos2 , reportó que el 16,33 % de la población ecuatoriana muere a causa de patologías como: diabetes mellitus, enfermedades cerebrovasculares e hipertensivas.
El estrés oxidativo es uno de los mediadores claves de los efectos producidos por las ENTs como la hiperglucemia3 ; este es el principal factor de riesgo para el desarrollo de complicaciones crónicas diabéticas ya que contribuye a la respuesta inflamatoria que caracteriza a las enfermedades cardiovasculares (ECV)4 . Por otro lado, el estrés oxidativo se ve involucrado en el proceso de degeneración celular debido al alto índice de toxicidad al que se expone la célula al no ser capaz de mediar los productos resultantes del metabolismo, provocando así su necrosis5 .
En el Ecuador se generan alrededor de 2 074 toneladas de residuos al día, de los cuales el 53,81 % son de origen orgánico6 , el licopeno está presente en estos, en una proporción aproximada de 600-800 μg de carotenos/100 g de cáscara de diferentes tipos de tomate6 . Se ha demostrado que el licopeno es un compuesto bioactivo, químicamente inestable y de rápida degradación al estar expuesto a condiciones ambientales externas diferentes a las de su fuente natural de obtención, como el oxígeno, la temperatura, la luz, el pH y algunas otras sustancias reactivas7 . Tales causas han despertado interés en el desarrollo de una tecnología que brinde estabilidad a este principio activo, razón por la que se ha escogido a la microencapsulación con polímeros inocuos para el consumidor como objeto de estudio del presente trabajo de investigación.
MATERIALES Y MÉTODOS
Obtención del material vegetal
Se recolectaron cáscaras de tomate de árbol Solanum betaceum, se secaron a 60 ºC en un horno de circulación forzada de aire (Gander, Canadá), se redujo a polvo en un molino de cuchillas (INOX-EQUIP, Reino Unido). El material en polvo se almacenó en doble funda de polietileno de baja densidad transparente.
Obtención de extractos vegetales
La relación que se ocupó es de 1:70, es decir una parte de material vegetal y setenta partes de etanol al 96 %, se calentó el disolvente a 50 ºC y posteriormente se añadió el material vegetal. La mezcla se agitó a una velocidad de 6000 rpm por 30 minutos. Se filtró y el sobrenadante se almacenó en botellas color ámbar a 4 ºC8 .
Concentración del extracto vegetal
Se colocó el extracto en el balón del rotoevaporador (IKA, Alemania) y se calentó a baño María a 60 ºC con constante rotación a 2000 rpm hasta evidenciar ausencia del etanol.
Cuantificación de licopeno presente en el concentrado obtenido
Para la determinación de la concentración de carotenos (C) se empleó el espectrofotómetro UV-Vis (Fisher Scientific, Estados Unidos) midiendo la absorbancia (A) a 472 nm8 y empleando la Ecuación 1 utilizando como blanco el etanol. Se empleó un valor de 3950 para la absortividad (E) del etanol9 .
Ecuación 1
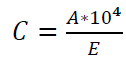
Obtención de microencapsulados con diferentes combinaciones de polímeros
Basándose en las técnicas de microencapsulación empleadas. 10 Haz clic o pulse aquí para escribir texto. se realizó la microencapsulación utilizando el equipo mini spray dryer (BÜCHI) B-290 utilizando los polímeros goma arábiga y maltodextrina. Las variables evaluadas fueron las proporciones polímero-licopeno y las relaciones temperatura de entrada y salida del equipo (Tabla I).
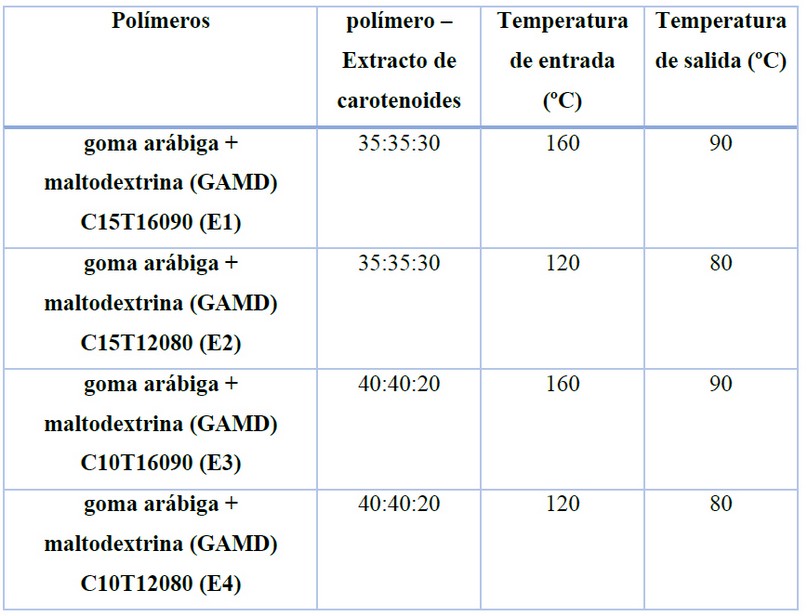
Tabla 1. Proporciones polímero – licopeno y temperatura de entrada/salida
Determinación el porcentaje de eficiencia de la microencapsulación (EME)
Se determinó el porcentaje de eficiencia de la microencapsulación utilizando la Ecuación 2, para lo cual se disolvieron 0,01 g de los microencapsulados en 1 ml de hexano y agua de forma independiente. Se cuantificó la concentración de licopenos en ambas soluciones obteniendo la concentración total de licopenos presentes en las microcápsulas en la disolución con agua (DT) y la concentración parcial de licopenos en la disolución con hexano (DP)11 que corresponde a los que se encuentran en la superficie de las microcápsulas.
Ecuación 2
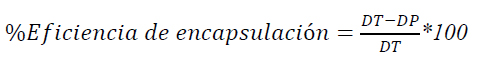
Determinación in vitro de la actividad antioxidante por el método del radical 2,2-diphenil-1-1-picrylhydrazil (DPPH)
En una placa de 96 pocillos se colocaron 20 µL de extracto diluido o disolución estándar, con 180 µl del reactivo radical 2,2-diphenil-1-1-picrylhydrazil (DPPH) (Sigma-Aldrich, USA) disuelto en metanol-agua en una proporción (80:20) a una concentración de 150 µmol/L y se agitó por 60 segundos. Se incubó la placa por 40 minutos en ausencia de la luz a temperatura ambiente, posteriormente se leyó la absorbancia a una longitud de onda de 515 nm a 25 ºC en el espectrofotómetro (Fisher Scientific, Finlandia).
Se determinó el porcentaje de inhibición de DPPH (Ecuación 3), a partir de la curva de calibración realizada con trolox, utilizando la ecuación de la recta se determinó la concentración equivalente de trolox al porcentaje de inhibición obtenido en los extractos. En la Ecuación 3, la absorbancia de la muestra a analizar está representada por A, muestra y la absorbancia obtenida por la muestra control, es decir la conformada por metanol y agua en la proporción 80:20 por A control. Los resultados se expresaron como µmol de trolox/g de muestra.
Ecuación 3
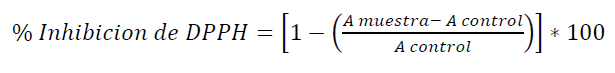
Determinación in vivo de la actividad antioxidante usando Saccharomyces cerevisiae
Se analizó la actividad antioxidante de los microencapsulados de licopenos utilizando como modelo de estudio la Saccharomyces cerevisiae. En este experimento se comparó la razón de crecimiento entre la curva de crecimiento de la levadura sin agentes oxidantes con respecto a la curva de crecimiento de la levadura sometida a diferentes concentraciones de antioxidantes y oxidantes tales como peróxido de hidrógeno e hipoclorito de sodio, obteniendo las curvas resultantes “Curvas Efecto”12 . El estrés oxidativo al que se sometió la levadura consistió en colocar agentes oxidantes a concentraciones de 0,5 mmol/L (estrés bajo) y 50 mmol/L (estrés alto). Los reactivos utilizados fueron peróxido de hidrógeno (H2O2) e hipoclorito de sodio (NaOCl) 13 ,14 .
Se aislaron levaduras a partir de un sobre de levadura comercial (Levapan, Ecuador) en medio PDA (Merck, Alemania), con incubación a 28 ºC por 72 horas. Se tomó una colonia de S. cerevisiae y se inoculó en 5 ml de medio YPD [2 % (m/v) glucosa, 1 % (m/v) extracto de levadura (Conda, España) y 2 % (m/v) peptona (BD, España)] manteniéndose a una temperatura de incubación de 28 ºC por 6 horas y una velocidad de agitación de 100 rpm. Se tomaron 5 µL de una dilución 1/10 del cultivo incubado y se inocularon en un tubo con medio YPD manteniéndose en incubación por 18 horas a 28 ºC y 100 rpm. Posteriormente se centrifugaron los tubos a 2 700 rpm por 20 minutos a temperatura ambiente, se lavó el pellet con buffer fosfato salino (PBS) pH 7,4. Se disolvió el pellet con PBS hasta llegar a una absorbancia a λ de 600 nm (A600) de 0,1 dejando en reposo por 30 minutos a 28 ºC.
Se colocó el peróxido de hidrógeno e hipoclorito de sodio (Ecuaquímica, Ecuador) a concentraciones de 0,5 mol/L y 50 mol/L, se incubó a 28 ºC durante 1 hora sin luz. A continuación, se centrifugó a 2700 rpm por 20 minutos a temperatura ambiente, se lavó el pellet con PBS y se disolvió en 3 mL de medio YPD. Se sembró 180 µL de cada cultivo por triplicado en una placa de 96 pocillos y se llevó a incubación a 28 ºC en el lector multiplaca (Fisher Scientific, Finlandia) con control de crecimiento mediante la A600 por 24 horas a intervalos de 20 minutos con agitación antes de cada lectura.
La razón de crecimiento se determinó con la Ecuación 4 donde relaciona la absorbancia (A) de la curva estándar o del crecimiento de la levadura sometida a varias concentraciones de extractos y agentes oxidantes con respecto a la del crecimiento de la levadura sin tratamiento 15 .
Ecuación 4
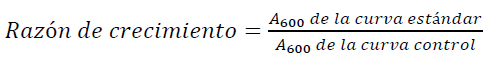
RESULTADOS
Cuantificación de licopeno en el concentrado obtenido
Una vez secadas y molidas las cáscaras de tomate de árbol Solanum betaceum, el material particulado obtenido se empleó para la extracción de sus compuestos bioactivos. Posteriormente, se concentró y se le realizó la cuantificación de licopenos, tomando así un valor de 0,55 ± 0,02 mg de carotenos/L. Estudios realizados por Pérez8 , en los que obtuvo 0,51 mg/L muestran relación con los resultados obtenidos. Por otra parte, Arándiga & Díaz3 tras realizar experimentos en el laboratorio consiguieron una cantidad de 0,44 mg/l ya que utilizaron el fruto maduro, lo que indica que el tiempo de cosecha influye en el proceso de obtención de carotenoides16 .
Determinación del porcentaje de eficiencia de la microencapsulación (EME)
Mediante un diseño experimental 22, con un nivel de confianza del 95 %, se analizó la influencia de las variables proporción polímero-licopeno y las relaciones temperatura de entrada y salida del equipo.
La ecuación del diseño obtenida es la siguiente:
-217,22 + 13,04*A + 1,59*B - 0,08*A*B con un R2= 98,52 (Figura 1).
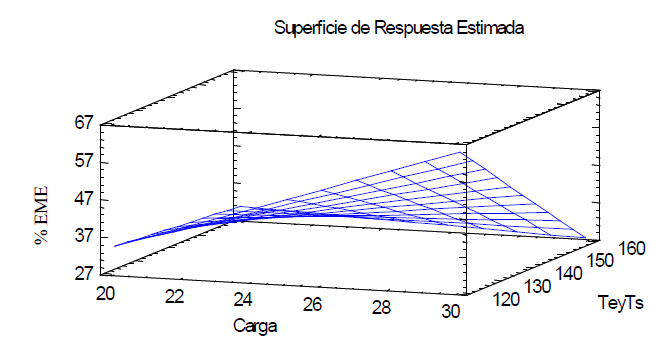
Figura 1. Diagrama de superficie de respuesta para el análisis del porcentaje de eficiencia de microencapsulación (EME)
El gráfico de superficie de respuesta muestra el valor óptimo del porcentaje de eficiencia de la microencapsulación (EME) siendo este del 64,42 % que representa a una carga de licopeno del 30 % con una temperatura de entrada de 120 ºC y una temperatura de 80 ºC para la salida.
Comparando los resultados obtenidos por Soto17 , quien realizó microencapsulación con goma xantana se observó un 77 % de esta variable. Así mismo Rocha18 determinó intervalos del 25 al 80 % empleando goma arábiga y maltodextrina, comparando con los valores obtenidos en el presente trabajo se encuentra dentro de este intervalo. Es importante recalcar que la variación de temperatura afecta tanto a los polímeros que son cadenas alifáticas como es el caso de la maltodextrina y mezclas de ciclo alquenos que brindan mayor estabilidad al compuesto de interés microencapsulado, en este caso licopeno y carotenoides que en su estructura presentan largas cadenas con dobles enlaces y grupos alquilo. Por tal razón es vital controlar esta variable evitando degradación de los componentes. Por otro lado, se ha reportado valores entre el 12 – 88 % de la misma variable utilizando maltodextrina como polímero y temperatura de entrada del equipo de 120 ºC19 .
Determinación in vitro de la actividad antioxidante por el método del radical 2,2-diphenil-1-1-picrylhydrazil (DPPH)
La ecuación obtenida del diseño para la actividad antioxidante es la siguiente:
-44,52 + 15,09*A + 0,76*B - 0,05*A*B, con un valor de R2= 97,43 (Figura 2)
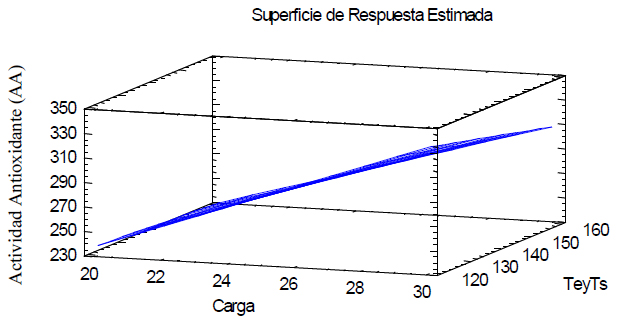
Figura 2. Diagrama de superficie de respuesta estimada de la actividad antioxidante determinada por el radical libre DPPH
El microencapsulado que presentó mayor actividad antioxidante fue la combinación que presentó 30 % de carga de licopeno, 35 % de maltodextrina y 35 % de goma arábiga con una temperatura de entrada (Te) de 120 ºC y de salida (Ts) de 80 ºC, obteniendo un porcentaje de inhibición del 81,84 % lo que equivale a 333,78 ± 4,53 µmol de Trolox/g muestra. Este valor es menor al obtenido por Mera20 , en el cual el extracto de G. mulfordii obtuvo una concentración de 776,42 µmol trolox/g de extracto, al igual que los valores reportados por Hurtado21 para el extracto hidroalcohólico de nogal (Juglans Neotropica) con un valor de 1019,10 µmol trolox/g extracto seco. Por otro lado, tiene una actividad antioxidante mayor a los datos de Moreno22 , quien realizó estudios en aguacate y encontró que la variedad Hass, tiene un valor de 189,80 ± 10,80 µmol trolox/g muestra, uvilla 70,30 ± 9,60 µmol trolox/g extracto 23 , naranjilla 62,45 ± 13,22 µmol trolox/g muestra y taxo 55,47 ± 7,42 µmol trolox/g muestra 24 .
Determinación in vivo de la actividad antioxidante usando Saccharomyces cerevisiae
Para poder determinar de manera preferible la mejor combinación de los microencapsulados se tomó en cuenta que el valor máximo representa a la actividad antioxidante, mientras que el valor mínimo se refiere a la actividad pro-oxidante y la capacidad que muestra el licopeno para ayudar a la levadura para activar su respuesta frente al estrés 25 (Figuras 3, 4, 5, 6).
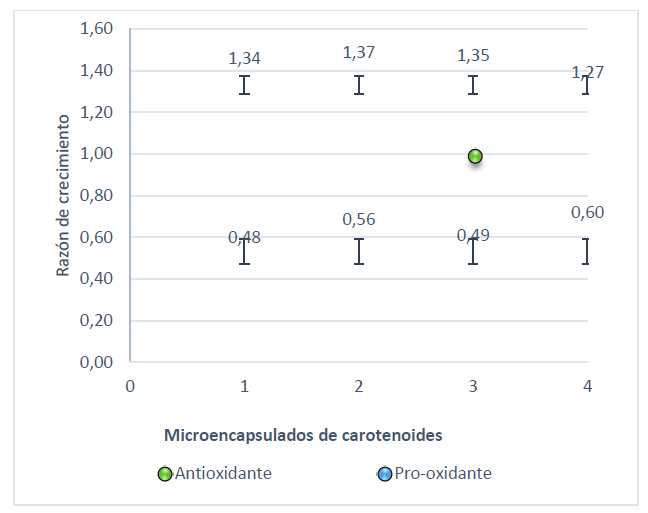
Figura 3. Razón de crecimiento de S. cerevisiae con actividad pro-oxidante y antioxidante a 0,5 mmol/L NaOCl
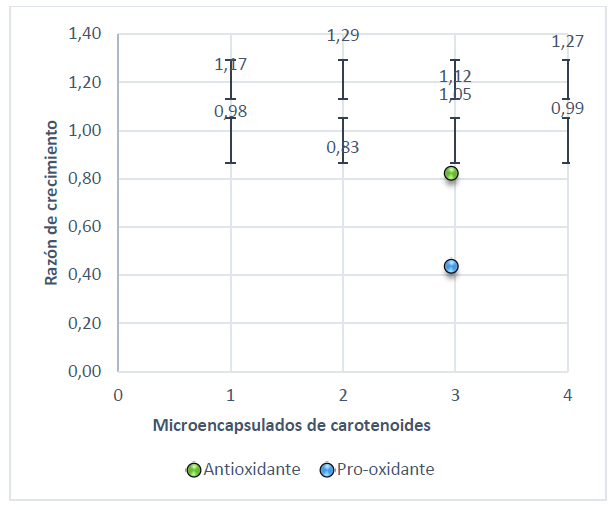
Figura 4. Razón de crecimiento de S. cerevisiae con actividad pro-oxidante y antioxidante a 50 mmol/L NaOCl
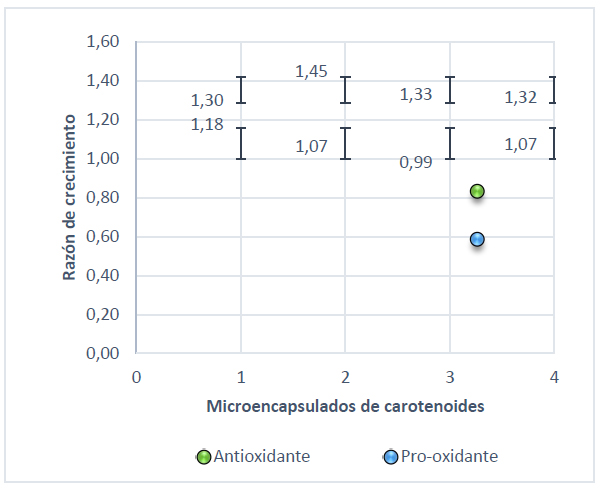
Figura 5. Razón de crecimiento de S. cerevisiae con actividad pro-oxidante y antioxidante a 0,5 mmol/L H2O2
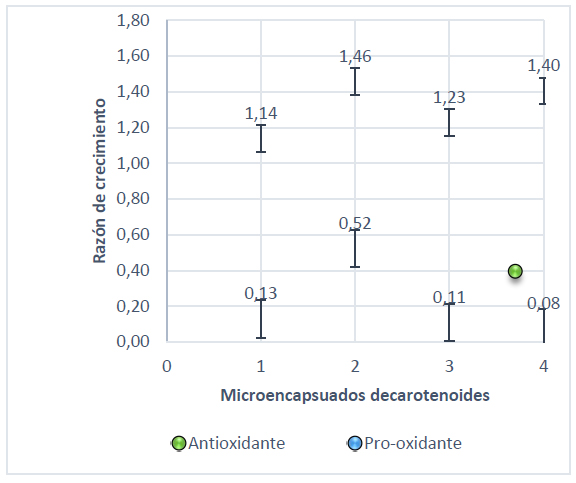
Figura 6. Razón de crecimiento de S. cerevisiae con actividad pro-oxidante y antioxidante a 50 mmol/L H2O2
El pico más alto que muestra la Figura 3 es 1,37 para el microencapsulado 2 seguido del 4 con 1,35 sometidos a un estrés bajo con 0,5 mmol/L de NaOCl, mientras que con peróxido de hidrógeno a 0,5 mmol/L el microencapsulado 2 tomó un valor de 1,45 (Figura 4). En cuanto al estrés alto el punto que sobresale es de 1,46 para el tratamiento con hipoclorito de sodio (Figura 5) y 1,29 con peróxido de hidrógeno (Figura 6).
Comparando cada uno de los valores antes mencionados es importante conocer la respuesta que presenta la levadura frente al estrés, además del mecanismo que presenta el licopeno frente a los radicales con los que interactúa. Por lo que, en el caso del hipoclorito de sodio el licopeno se fragmenta generándose metabolitos que interactúan con los iones (OCl-) donándoles un hidrógeno26 . Con respecto al peróxido de hidrógeno Plasencia27 , menciona que el H2O2 actúa a nivel del citosol activándose la respuesta transcripcional de la levadura. Según Martínez & Estruch28 , la levadura presenta dos tipos de catalasa que transforman los radicales superóxido en agua y oxígeno.
Ensayos realizados por Peláez12 , muestran que extractos etanólicos de cacao presentan una razón de crecimiento superior a 1,5 a 0,5 mmol/L de peróxido de hidrógeno lo que indica una actividad antioxidante similar a la del tomate de árbol. Por otra parte, Mera20 , reporta resultados de 2,5 para liposomas de Greigia mulfordii en condiciones de estrés bajo. En el caso del microencapsulado de licopeno se nota una actividad antioxidante con una razón de crecimiento 1,46 lo que indica que el microencapsulado de carotenos presenta características similares a los extractos de cacao y que los grupos fenólicos que contiene Greigia mulfordii tienen mayor actividad antioxidante.
Los microencapsulados tienen la ventaja de la liberación controlada de compuestos, se ha reportado que la capacidad antioxidante depende del polímero utilizado para su protección e interacción con la membrana plasmática de la célula para asegurar su biodisponibilidad29 . La liberación lenta puede estar asociada a la interacción entre las bicapas lipídicas y el licopeno al ser un compuesto hidrofóbico se acopla fácilmente a las lipoproteínas de la membrana celular30 .
Es importante recalcar que en este trabajo la razón de crecimiento mínima alcanzada por el microencapsulado 2 (30 % licopeno Te/Ts 120 ºC/80 ºC) en la fase pro-oxidativa fue 1,07 y 0,56 mientras que en la actividad antioxidante tomaron valores de 1,45 y 1,37 frente a un estrés de 0,5 mmol/l de H2O2 y NaOCl respectivamente una concentración de 700 mg/mL de microencapsulado de carotenos.
CONCLUSIONES
Se evaluaron las diferentes combinaciones de polímeros en la microencapsulación de licopeno de tomate de árbol (Solanum betaceum) encontrando que la mejor combinación fue la del microencapsulado que contiene 30 % de carga, 35 % goma arábiga y 35 % de maltodextrina a una temperatura de entrada (Te) de 120 ºC y de salida (Ts) de 80 °C que presentó el mayor porcentaje de eficiencia de microencapsulación con un valor de 64,42 %.
Se comparó la actividad antioxidante in vitro de los diferentes microencapsulados y del concentrado de licopeno mediante el método DPPH en el cual se observó que el valor máximo coincidió con las microcápsulas obtenidas con las mismas condiciones (30 % de carga, 35 % goma arábiga y 35 % de maltodextrina a una temperatura de entrada (Te) de 120 ºC y de salida (Ts) de 80 °C) con un porcentaje de inhibición del 81,84 % que representa una concentración equivalente de Trolox de 333,78 ± 4,53 µmol de Trolox/g muestra.
Se evaluó la actividad antioxidante in vivo de los diferentes microencapsulados de licopenos empleando Saccharomyces cerevisiae encontrando que este microencapsulado a una concentración de 700 mg/ml presenta mayor actividad antioxidante tomando valores de 1,37 y 1,45 en la razón de crecimiento sometida a una concentración de 0,5 mmol/L de hipoclorito de sodio y peróxido de hidrógeno respectivamente.
Al someter a la levadura a un estrés alto, es decir, a 50 mmol/L de agentes oxidantes se evidenció que este microncapsulado presentó mayor efecto antioxidante sobre la célula tomando un valor máximo de razón de crecimiento de 1,26 con hipoclorito de sodio, mientras que al utilizar peróxido de hidrógeno esta variable aumentó a 1,46.
REFERENCIAS
1. OMS. OMS | Cada año, las enfermedades no transmisibles provocan 16 millones de defunciones prematuras, por lo que la OMS insta a redoblar esfuerzos. https://www.who.int/mediacentre/news/releases/2015/noncommunicable-diseases/es/ (2018).
2. Instituto Nacional de Estadística y Censos. Estadísticas Vitales. (2016).
3. Arándiga, G. & Díaz, S. Estudio del licopeno del tomate como colorante natural desde la perspectiva analítica e industrial. (2008).
4. Preedy, V. R. Diabetes: Oxidative Stress and Dietary Antioxidantes. 4–20 https://ebookcentral.proquest.com/lib/uta-ebooks/reader.action?docID=1550525&query=oxidative+stress (2013) doi:1550525.
5. Matata, B. M. & Elahi, M. M. Oxidative stress : a focus on cardiovascular disease pathogensis. (Nova Biomedical, 2011).
6. Yamaguchi, M. CAROTENOIDS: PROPIETIES, EFFECTS AND DISEASES. (Nova Science, Inc., 2010).
7. ROSENBERG, M., KOPELMAN, I. J. & TALMON, Y. A Scanning Electron Microscopy Study of Microencapsulation. Journal of Food Science 50, 139–144 (2006).
8. Pérez, C. Extracción y microencapsulación de licopenos provenientes de residuos agroindustriales del tomate de árbol (Solanum betaceum). (2019).
9. Strati, I. F. & Oreopoulou, V. Process optimisation for recovery of carotenoids from tomato waste. Food Chemistry 129, 747–752 (2011).
10. Pastuña-Pullutasig, A. et al. Microencapsulación de aceite de sacha inchi (Plukenetia volubilis L.) mediante secado por aspersión. Rev. Colomb. Cienc. Quím. Farm 45, 422–437 (2016).
11. Lakkis, J. Encapsulation and Controlled Release Technologies in Food Systems. (2016).
12. Peláez, A. Validación funcional de extractos polifenólicos de cacao mediante ensayos in vivo con organismos modelo. (2016).
13. Juscamaita, L. et al. EVALUACIÓN DE LA ESTABILIDAD DE CAROTENOIDES Y ACTIVIDAD ANTIOXIDANTE DE LA FLOR DE MASTUERZO (Tropaeolum majus L.) EN LA MICROENCAPSULACIÓN POR SPRAY-DRYING. (2017).
14. Aust, O. et al. Lycopene oxidation product enhances gap junctional communication. Food and Chemical Toxicology 41, 1399–1407 (2003).
15. Wu, M. J. et al. An antioxidant screening assay based on oxidant-induced growth arrest in Saccharomyces cerevisiae. FEMS Yeast Research 11, 379–387 (2011).
16. Candelas, G. Licopeno y otros carotenoides en tomate y polvo de tomate. (2006).
17. Soto, M. Microencapsulación de licopeno en mezclas de goma xantana, pectina y sacarosa mediante secado por aspersión. (2018).
18. Rocha, G. A., Favaro, C. S. & Grosso, C. R. F. Morphology, Stability, and Application of Lycopene Microcapsules Produced by Complex Coacervation. Journal of Chemistry 2013, 1–7 (2013).
19. Shu, B., Yu, W., Zhao, Y. & Liu, X. Study on microencapsulation of lycopene by spray-drying. Journal of Food Engineering 76, 664–669 (2006).
20. Mera, A. Evaluación de la actividad antioxidante de liposomas obtenidos a partir del extracto etanólico de Greigia mulfordii. III, 39 (2018).
21. Hurtado, P. Evaluación de la actividad antioxidante del extracto hidroalcohólico estandarizado de hojas de Juglans Neotropica Diels (nogal peruano). Revista de la Sociedad Química del Perú vol. 81 (Sociedad Química del Perú, 2015).
22. Moreno, E. Contenido total de fenoles y actividad antioxidante de pulpa de seis frutas tropicales. Rev. Colomb. Quim vol. 43 (2014).
23. Guija, E. Evaluación de la técnica 2,2-Difenil-1-Picrilhidrazilo (DPPH) para determinar capacidad antioidante. (2015).
24. Encina, C. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Revista de la Sociedad Química del Perú vol. 74 (Sociedad Química del Perú, 2008).
25. Folch-Mallol, J., Garay-Arroyo, A., Lledías, F. & Covarrubias Robles, A. A. La respuesta a estrés en la levadura Saccharomyces cerevisiae MICROBIOLOGÍA MICROBIOLOGÍA. (2004).
26. Pennathur, S. et al. Potent antioxidative activity of lycopene: A potential role in scavenging hypochlorous acid. Free Radical Biology and Medicine 49, 205–213 (2010).
27. Plasencia, C. Optimización de la detección de daños oxidativos en la célula viva y en tiempo real. (2014).
28. Martínez Pastor, M. Teresa. & Estruch Ros, F. Regulación transcripcional de la respuesta a estrés de la levadura Saccharomyces cerevisiae papel de los factores transcripcionales MSN2P y MSN4P. TDX (Tesis Doctorals en Xarxa) 28 (2005).
29. Roostaee, M., Barzegar, M., Sahari, M. A. & Rafiee, Z. The enhancement of pistachio green hull extract functionality via nanoliposomal formulation: studying in soybean oil. Journal of Food Science and Technology 54, 3620–3629 (2017).
30. Bavelloni, A., Piazzi, M., Raffini, M., Faenza, I. & Blalock, W. L. Prohibitin 2: At a communications crossroads. IUBMB Life 67, 239–254 (2015).
Received: 1 June 2021 / Accepted: 8 February 2022 / Published:15 May 2022
Citation: Pazmiño D, Fernández D, López OD, Iraizoz A. Evaluación de diferentes combinaciones de polímeros en la microencapsulación de licopenos procedentes de residuos de tomate de árbol (Solanum betaceum).
Revis Bionatura 2022;7(2) 29. http://dx.doi.org/10.21931/RB/2022.07.02.29
