2023.08.03.91
Files > Volume 8 > Vol 8 No 3 2023
Etiología infecciosa de la diarrea aguda pediátrica, un problema de la Salud Pública
Infectious etiology of pediatric acute diarrhea, a public health concern
Anabell del Rocio Urbina-Salazar 1,* , Alberto Renato Inca-Torres 1
, Alberto Renato Inca-Torres 1 , Bryan Anthony Urbina-Salazar 2
, Bryan Anthony Urbina-Salazar 2 , Nallely José Urbina Paucar3
, Nallely José Urbina Paucar3
1 Departamento de Ciencias de la Vida y de la Agricultura, Universidad de las Fuerzas Armadas ESPE, Av. Gral. Rumiñahui s/n, Sangolquí P.O. BOX 171-5-231B, Ecuador
2 Universidad Técnica de Ambato, Facultad de Ciencias de la Salud, Ambato, Ecuador. [email protected]
2 Concordia University, Montreal Qc, Canadá [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.03.91
RESUMEN
La enfermedad diarreica aguda (EDA) es una de las enfermedades con alta mortalidad en pacientes pediátricos se caracteriza por un inicio brusco de signos en el que se destaca diarrea, flatulencias, incluyendo nauseas, emesis, elevación de la temperatura, abdominoalgia entre otras, debido a una infección del aparato gastrointestinal ocasionado por agentes infecciosos patógenos. Esta enfermedad actualmente es uno de los mayores problemas en la salud pública de los países en vías de desarrollo, por su alta repercusión de morbilidad y mortalidad durante la etapa pediátrica, debido a la carencia de ensayos para la detección del agente infeccioso. Se ha reportado que E. coli es uno de los agentes más frecuentes asociada a esta enfermedad, ya que puede encontrarse en varios alimentos contaminados contribuyendo la infección al huésped susceptible. Esta patología al momento es catalogada como autolimitada, considerándose que, en casi la totalidad de los casos será exclusivamente necesario la realización de una historia clínica pediátrica, donde se encuentre todos los acápites necesarios, para posteriormente realizar un examen físico exhaustivo. Es por ello que es necesario abordar más sobre su etiología, mecanismos de transmisión, el manejo y prevención del agente patógeno y principalmente el tratamiento farmacológico de la patología.
Palabras clave: E. coli; diarrea; pediatrica; tratamiento médico.
ABSTRACT
Acute diarrheal disease (ADD) is one of the diseases with the highest mortality amongst pediatric patients as it is characterized by a sudden onset of signs notably diarrhea, and flatulence. In many instances, it can include several episodes of nausea, emesis, fever, abdominal pain among other things, due to an infection of the gastrointestinal tract caused by pathogenic infectious agents. This disease is currently one of the biggest problems in public health in developing countries, due to its high impact on morbidity and mortality during infancy due to the lack of diagnostic tests for the infectious agent. Studies have reported that E. coli is one of the most frequent agents associated with this disease since it can be found in several contaminated foods, contributing to the infection of the susceptible host. This pathology at the moment is classified as self-limited; that is, in almost all cases, it will be exclusively necessary to carry out a pediatric medical history, where all the required sections are found, to perform an exhaustive physical examination later. That is why it is necessary to address its etiology, transmission mechanisms, the management and prevention of the pathogenic agent and mainly the pharmacological treatment of the pathology.
Keywords: E. coli; diarrhea; pediatric; medical treatment.
INTRODUCCIÓN
La diarrea pediátrica aguda es una de las enfermedades con una alta tasa de morbilidad y mortalidad, basándose en términos de definición cuantitativa la diarrea se define como la cantidad de heces blandas o acuosas, y considerando esta definición la diarrea aguda es el aumento de periodicidad y volumen de las deposiciones siendo estas mayor o igual a 3 veces en un periodo de 24 horas, observándose una disminución de la consistencia, y en ocasiones con presencia de moco, sangre o pus; que generalmente pueden durar menos de 14 días, debido a esto se la considera como una patología autolimitada y de evolución benigna. Cuando se presenta deposiciones acuosas con mucosidades y sangre se denomina disentería.1
Los países con mayor muerte infantil causada por diarreas agudas están Nigeria, India, Pakistán, Congo, Etiopía. Varios son los factores de riesgo existentes que se asocian con la prevalencia de diarrea, entre ellos están los contaminantes ambientales, acceso limitado al agua potable, deficiencias higiénico-sanitarias y domésticas, el inadecuado control de calidad en la preparación y almacenamiento de alimentos y factores relacionados al huésped como la desnutrición y las deficiencias inmunológicas.2
En este sentido la diarrea como tal puede ser clasificada cómo: Diarrea aguda cuando los síntomas persisten por menos de 14 días; Diarrea persistente cuando los síntomas persisten por más de 14 días y pueden llegar incluso a los 30 días y Diarrea crónica cuando los síntomas perduran por más de 30 días, que generalmente este último se encuentra asociada con intolerancia a la lactosa, patología celiaca y el síndrome postenteritis.3
Las enfermedades diarreicas representan la causa más importante de morbilidad y mortalidad durante la infancia. En la actualidad se estima aproximadamente que 5,6 millones de niños mueren antes de cumplir los 5 años. Existe alrededor de 525 000 muertes anuales donde el 9% corresponde a niños de menores de 5 años. 3-5.
DESARROLLO
Etiología
La mayor causa de diarrea aguda pediátrica es de origen infeccioso (rotavirus), cabe mencionar que, con la incorporación de la vacuna este ha disminuido significativamente, sin embargo, sigue siendo un agente que se aísla frecuentemente mediante PCR (técnica de reacción en cadena de la polimerasa). A pesar de la disponibilidad de esta vacuna, en la actualidad este virus ha provocado alrededor de 200 000 muertes en niños menores de 5 años a nivel mundial. A partir del año 2009, la Organización Mundial de la Salud amplio su recomendación a dos dosis de vacunas vivas orales y en la actualidad alrededor de 100 países la han incorporado dentro de su esquema de vacunación. Sin embargo, existen ciertas hipótesis que relaciona un bajo rendimiento de esta vacuna en niños con desnutrición y con alteración en la microbiota. 6
Otros virus causantes de diarrea aguda son los enterovirus, los norovirus y adenovirus. Mientras que los agentes bacterianos que frecuentemente se aíslan son E. coli enteropatógeno, E. coli entorotoxigénica, enteroagregativa, enteroinvasiva, Shigella, Campylobacter y Yersinia, siendo E. coli una de las cepas con mayor virulencia y causante de síndromes diarreicos.7-8
Los mecanismos de transmisión son mediante vía fecal-oral o un ciclo largo que corresponde a contaminación de agua y alimentos. Un factor importante que se observa es la predisposición de bacterias enteropatógenas en niños que no recibieron lactancia materna, mientras que en los niños que fueron alimentados con leche materna presentan cuadros leves, por lo que se hace énfasis en el rol fundamental y protector de la madre que conlleva la adecuada lactancia materna.9
Factores de riesgo
Algunos factores de riesgo descritos anteriormente interfieren en el transcurso de la patología, pudiendo estos prolongar o a la vez complicar la enfermedad diarreica aguda en la población pediátrica. Otros factores de riesgo que también pueden estar asociados son los factores ambientales y familiares, en los cuales se destacan la ingesta de agua y alimentos contaminados, el manejo inadecuado de residuos y de excretas, el bajo nivel socioeconómico de los padres y cuidadores y la inexperiencia de padres adolescentes.10
Con referencia a los factores relacionados al niño, destacan la ausencia de la lactancia materna, la cual propicia la presencia de la enfermedad. De igual manera se ha podido evidenciar que en niños de edades muy cortas, existe un mayor riesgo de presentar diarrea y generar deshidratación. Además, se ha documentado que los niños que presentan deficiencias nutricionales cursan periodos más largos de recuperación, son más susceptibles a desarrollar diarreas u otras enfermedades asociadas a patologías cardiacas, inmunodepresoras o inmunodeficientes que complican la enfermedad.11
Fisiopatología
Existen varios organismos patógenos o enteropatógenos causantes de diarrea, mediante uno o más factores de virulencia y en algunos casos por determinantes genéticos que se encuentran localizados en plásmidos, en el material genético, o directamente en los cromosomas y en los bacteriófagos, además de aquellos que pueden causar diarrea acuosa por mecanismos del tipo osmótico, o la denominada disentería causada por mecanismos del tipo invasivo o no invasivo.12
Uno de los mecanismos responsables de la producción de diarrea, es la pérdida de líquidos y electrolitos, mediados por una alteración en el transporte intestinal, este transporte es producido por el movimiento pasivo, y desplazamientos activos y pasivos de solutos, siendo los principales el sodio, cloro y glucosa.13-14
Este tipo de patología es difícil de definir en función de la frecuencia y consistencia de las heces, debido a que estos parámetros podrían variar mucho, se podría evaluar de una manera más confiable tomando en cuenta el peso o el volumen de las heces considerándose una diarrea cuando se presenta un volumen de heces mayor a 20g/kg/día.
La diarrea se presenta inmediatamente después del nacimiento como una respuesta fisiológica, y posteriormente se presenta por causa de infecciones virales, alergias a la proteína de la leche o a otro tipo de proteínas.12
Mecanismos virulentos de las bacterias enteropatógenas
Las bacterias enteropatógenas principalmente Escherichia coli enteropatógena (ECEP), es la responsable de causar diarrea en niños menores de dos años, a menudo provocando brotes epidémicos en lugares cerrados como guarderías y hospitales. La enfermedad puede variar de moderada a grave y ha estado asociada con una alta tasa de mortalidad, especialmente en países en desarrollo, con un rango de mortalidad del 10-40%. En el año 2010, se registraron 121,455 muertes atribuidas a esta bacteria. El período de incubación de la enfermedad es de 3 a 24 horas, y los síntomas incluyen diarrea persistente, fiebre y vómitos.13
Existen dos cepas de ECEP: típicas y atípicas, dependiendo de la presencia o ausencia de un plásmido de virulencia conocido como factor de adherencia de ECEP (EAF: EPEC). Recientemente, se ha prestado más atención a las cepas atípicas debido a su aumento no solo en niños asintomáticos, sino también en aquellos con diarrea. 13
La infección intestinal por ECEP provoca alteraciones en la actividad normal de las células del intestino, incluyendo un aumento en la secreción de electrolitos hacia el espacio extracelular, un aumento en la permeabilidad de las uniones celulares y cambios estructurales en la parte superior de las células intestinales (enterocitos). Estos cambios resultan en una pérdida de la capacidad de absorción y acumulación de solutos en el lumen intestinal, lo que finalmente conduce a la diarrea acuosa.14
Los procesos fisiopatológicos que dan lugar a los síntomas de la diarrea están principalmente vinculados a la perturbación de la célula intestinal, formación del pedestal y la lesión intestinal. Estos procesos fisiopatológicos constan de dos mecanismos, el primero ocurre de forma simultánea y se da en tres etapas: la primera es la adherencia al enterocito; este es un proceso esencial en la infección. La bacteria establece contacto con la célula mediante estructuras como el flagelo y el pili tipo IV, conocido como BFP (bundle-forming pilus). Estas estructuras tienen la función de promover la auto-agregación bacteriana y permitir que la bacteria se adhiera a la célula mediante la formación de microcolonias. El BFP está codificado por un conjunto de 14 genes que son regulados por el operón per (plasmid-encoded regulator) y una proteína llamada DsbA, que forma enlaces disulfuro para garantizar su estabilidad. Estos genes se encuentran ubicados en el plásmido de virulencia EAF, desempeñando un papel clave en el proceso de adherencia bacteriana. 13-15
La segunda corresponde a la translocación de señales intracelulares que es facilitada por el sistema de secreción tipo 3 (T3SS), que permite que diversas proteínas efectoras ingresen al enterocito. Este sistema es codificado en la isla de patogenicidad LEE (locus of enterocyte effacement) y se divide en cinco operones. Los operones LEE1-LEE3 codifican las proteínas Esc, componentes esenciales del T3SS. LEE4 codifica proteínas secretoras (EspA, EspB y EspD) y algunas efectoras (EspF, EspG, EspH, EspZ y Map). LEE5 codifica genes para la adhesina intimina y su receptor Tir. La expresión de estos genes es regulada por proteínas como Per, Ler, GrlA y GrlR.
Las proteínas efectoras desempeñan un papel clave en la infección, causando daño celular mediante la formación de conductos o filamentos, la translocación de proteínas en la membrana del enterocito, cambios en el potencial de la membrana mitocondrial, formación de filopodios, reorganización de la nucleolina y alteración de los microtúbulos en células epiteliales. Además, la proteína efectora EspC, secretada por el sistema de secreción tipo V, está involucrada en la citotoxicidad celular durante la adhesión bacteriana y la formación de pedestales y poros. Estos procesos contribuyen al daño y la patogenicidad en la infección por ECEP. 13-15
La tercera es la adherencia íntima bacteriana durante la infección por (ECEP), simultáneamente a la unión del sistema de secreción tipo 3 (T3SS) al enterocito y a la entrada de proteínas efectoras a través de los poros, la bacteria introduce la proteína Tir (receptor) en la célula hospedera. Esta proteína es esencial para facilitar la adherencia de la bacteria a la intimina bacteriana y es un componente fundamental en la formación del pedestal y la lesión intestinal. Una vez que está dentro de la célula hospedera, la porción de Tir se proyecta en la superficie de la membrana del enterocito, actuando como receptor tanto para la intimina como para la transmisión de señales posteriores a la interacción. Esto contribuye al segundo mecanismo de polimerización de la actina y a la formación de pedestales, lo que desempeña un papel central en la patogenicidad de la infección por ECEP. 13-15
En el segundo mecanismo de patogenicidad de ECEP, conocido como la polimerización de actina, se forman cadenas largas de actina que causan alteraciones en la morfología del citoesqueleto, se dañan las microvellosidades y éstas pierden su función. Para formar el pedestal, la proteína Tir es fosforilada en la tirosina 474 y luego se une a proteínas adaptadoras de la célula hospedera, como Nck (Non-catalytic tyrosine kinase). Nck activa a N-WASP (neural Wiskott-Aldrich-syndrome protein), que a su vez activa el complejo Arp 2/3, mediando la polimerización de actina. Otra proteína adaptadora, Crk (CT10 regulator of kinase), también se une a la tirosina 474, pero en lugar de activar la polimerización de actina, inhibe este proceso, aunque su función exacta como reguladora negativa no se comprende completamente.
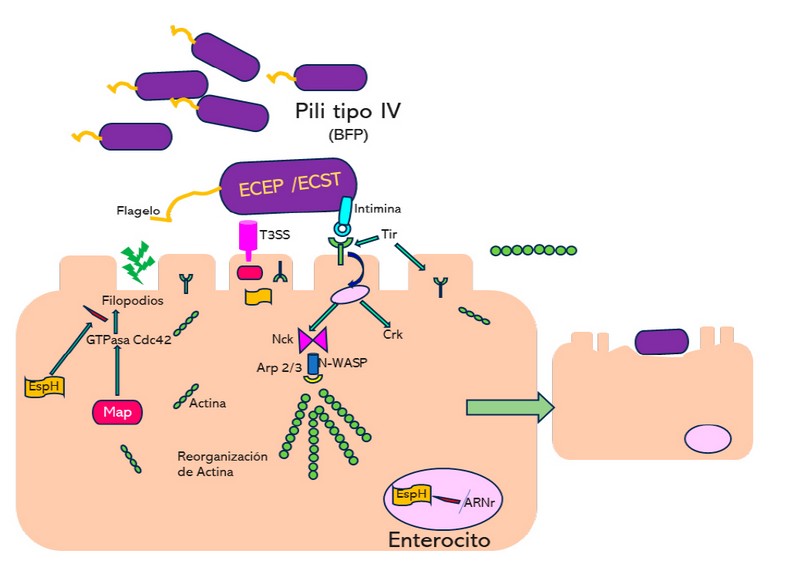
Figura 1. Mecanismos virulentos de las bacterias enteropatógenas.
EPEC utiliza un sistema de adherencia que involucra un flagelo y pili tipo IV (BFP) para unirse a las células, formando microcolonias que les permiten separarse y colonizar más eficazmente. Tanto ECEP como Escherichia coli productora de toxina Shiga (ECST) poseen un sistema de secreción (T3SS) que les permite inyectar proteínas en las células huéspedes. Una de estas proteínas, EspF, se desplaza al nucléolo, donde interrumpe la síntesis de ARNr. Además, la proteína Map induce temporalmente la formación de filopodios al activar la GTPasa Cdc42, pero luego este proceso es interrumpido por EspH. Adicionalmente otra proteína llamada Tir, unida a la intimina (una proteína de la membrana externa de la bacteria), se fosforila en tirosina 474, lo que permite su unión a proteínas adaptadoras como Nck o CrK. Nck activa N-WASP, que, a su vez, activa el complejo Arp 2/3, el cual promueve la polimerización de actina. La unión de Tir-Intimina resulta en la reorganización de la actina, causando cambios en la morfología celular y formando las características lesiones de adhesión y borrado (A/E). Estos procesos son esenciales en la estrategia de ECEP para colonizar e infectar con éxito las células huéspedes. (Figura 1)
En cuanto a los mecanismos tóxicos ya conocidos, las bacterias poseen enterotoxinas que conlleva el daño celular ocasionado por la muerte de los enterocitos a través de las citotoxinas mediante un proceso secretor en las células intestinales. Estas bacterias tienen el poder de invadir y replicarse dentro de las células intestinales, terminando de esta manera con las células después de un tiempo.15-17
E. coli ingresa al organismo por vía fecal-oral, el patógeno enterotoxigénico al ingresar al intestino invade las células y sintetiza dos clases de endotoxinas: las toxinas termolábiles (LT-1 y LTII) y las toxinas termoestables (STa y STb), cabe mencionar que las bacterias presentan mecanismos del tipo virulentos provocando diarrea líquida, con mucosidades, pus acompañada de fiebre, vómito y deshidratación.
La toxina termolábil I LT-I tiene dos subunidades: A y B, cuando se produce la endocitosis la subunidad A ingresa a la membrana de la vacuola y el aparato de Golgi, allí interactúa con la proteína de membrana mediante la actividad de la Adenosina de Difosfato, generando una regulación de la adenil ciclasa aumentando el monofosfato de adenosina cíclico, generando una hipersecreción de cloro, sodio y agua, y disminuyen la absorción produciendo así la diarrea enterotóxica, mientras que la toxina termolábil II, LTII no se relaciona con la patogenia.
La toxina termoestable STa es una toxina que se incorpora al receptor guanilato ciclasa, que provoca un acrecentamiento de las concentraciones de guanosina monofosfato cíclico (GMPc) y la ulterior secreción de líquidos y electrolitos, mientras que la STb no se relaciona con patogenia.16-17
Mecanismo enteroinvasivo de diarrea ocasionada por Shigella
Una de las causas de diarrea aguda, es la contaminación por vía fecal – oral, propiciado por Shigella que produce la patología al colonizar y multiplicarse en las células que recubren el intestino grueso y el íleon terminal.
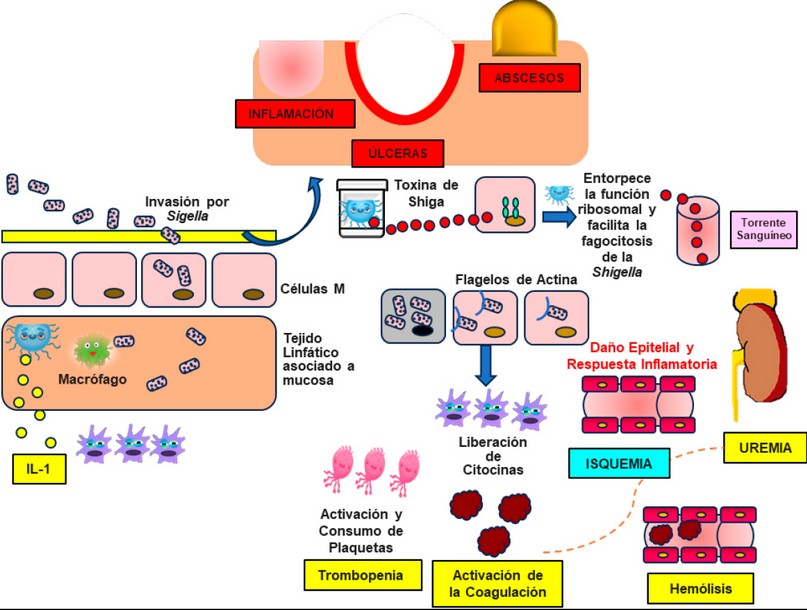
Figura 2. Mecanismo invasivo de Sigella
Sigella ingresa a las células M, permite el paso al tejido subyacente (tejido linfático asociado a mucosa), en este tejido se encuentra con la primera línea de defensa que son los macrófagos, estos tratar de destruirla, sin embargo los lipopolisacáridos que Sigella tiene en la membrana externa hará que sobreviva, se multiplique y destruya al macrófago, la destrucción de este macrófago libera citocinas principalmente IL-1, que es la llamada de defensa esto se da en el intestino provocando inflamación, úlceras y formación de abscesos y a la vez disminuyen las defensas del intestino favoreciendo de esta manera una mayor invasión de Sigella. Cuando Sigella crece en células intestinales esta destruye la célula y genera unos residuos de proteína llamada actina, generando unos flagelos de actina lo cual le permite invadir el tejido adyacente. Adicionalmente si la toxina de Siga invade las células se produce dos eventos: Entorpece la función ribosomal y facilita la fagocitosis de la Sigella provocando la apoptosis. Lo más perjudicial es cuando llega la al torrente sanguíneo y es transportada hacia los demás órganos y uno de los más afectados es el riñón, este al igual que otros órganos tiene pequeños vasos sanguíneos llamados capilares, la toxina daña las células de las paredes de los vasos sanguíneos provocando apoptosis y en respuesta a esto libera citocinas y atraen las células de defensa que compite con la Sigella ocasionando inflamación y daño en el riñón además de la activación y consumo de plaquetas provocando alteraciones en la coagulación sanguínea. (Figura 2)
Estos patógenos al colonizarse en las células M de la placa de Peyer, y replicarse generan una respuesta inmunitaria, activándose el sistema de secreción tipo III, y adicionándose cuatro proteínas (IpaA, IpaB, IpaC e IpaD), que genera la reorganización de los filamentos los cuales permiten el paso de una célula hacia otra. Los patógenos van a sobrevivir a la fagocitosis mediante la apoptosis que se genera en las células de defensa, esto libera IL-1b atrayendo polimorfonucleares que ocasionan inflamación en la pared intestinal.18
La toxina de Sigella tiene la capacidad de inactivar la porción 60s de los ribosomas del enterocito, que inhibe la síntesis de proteínas provocando un efecto citolítico el cual destruye al enterocito, genera úlceras en la mucosa luminal y provoca diarrea de características mucosanguinolentas.19-20
Mecanismo citopático en diarrea ocasionada por rotavirus
La infección causada por el rotavirus se caracteriza por su replicación en las células del intestino delgado, seguida de la lisis celular. Con el tiempo, este proceso provoca daños en las vellosidades intestinales, reduciendo su longitud y la capacidad de absorber líquidos, lo que da lugar a una diarrea osmótica. Posteriormente, la situación se agrava cuando las vellosidades se acortan, lo que estimula la división celular en las criptas intestinales, resultando en hiperplasia. Esto conlleva a una mayor secreción de líquidos y agrava el síndrome, potencialmente llevando a la deshidratación. Sin embargo, es importante destacar que estos cambios ocurren en etapas tardías, generalmente después de 24-36 horas desde el inicio de la infección, cuando la diarrea ya se ha manifestado.
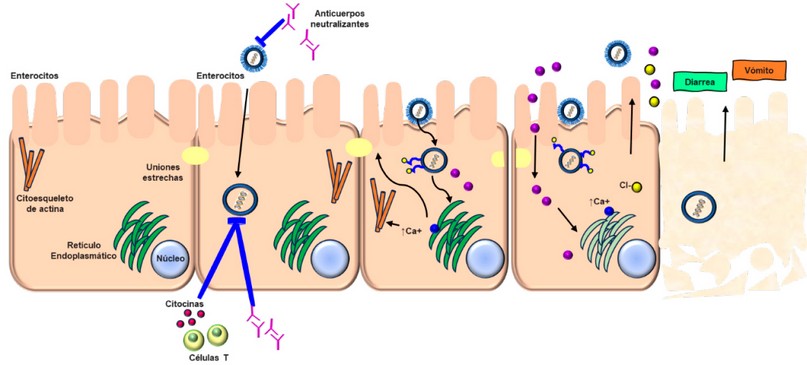
Figura 3. Mecanismo invasivo de Rotavirus
El virus entra al organismo mediante la vía fecal oral, donde invade el tracto intestinal, que después de unirse al epitelio, infecta solo a los extremos superiores de las vellosidades del intestino delgado, el ingreso de los virus hacia las células es mediado por las integrinas a2b1, a4b1, axb2, avb3 y a la proteína hsc70.
La enterotoxina NSP4 genera niveles elevados de Ca intracelular, que ocasiona un desequilibrio en la membrana, con alteración en el citoesqueleto y posterior destrucción enterocítica en el interior de la célula, ocasionando una invasión de las células vecinas y la destrucción celular, por lo que no permitirá que se absorba adecuadamente el agua, las sales y los carbohidratos, como consecuencia se produce una diarrea osmótica/absortiva perdiendo agua de forma excesiva, generando deshidratación celular y hace que la recuperación epitelial se vea enlentecida. Además, provoca una deficiencia de disacaridasas producidas por los enterocitos inmaduros generando intolerancia a la lactosa que va a ser transitoria.21-23 (Figura 3)
A fin de precisar la severidad de la diarrea y su posible causa, es necesario realizar una adecuada anamnesis e indagar diferentes aspectos como: duración de la diarrea, viajes previos, asistencia a guardería, presencia de sangre en las heces, presencia e intensidad del vómito, número de evacuaciones y vómitos, capacidad o no de beber del paciente, clase de alimentos y tipo de líquidos que se le han suministrado, lactancia materna, presencia de diuresis en las últimas seis horas, medicamentos y remedios caseros que se le han administrado en el actual episodio.24-27
Presentación clínica Anamnesis
El paciente o el familiar debe ser evaluado de acuerdo a la duración de los episodios de diarrea, la frecuencia, las características físicas de las deposiciones y también la existencia de moco, sangre, además de evaluar otros síntomas generales que pueden evidenciarse como vómitos, fiebre, anorexia, polidipsia, decaimiento, reducción en el número y volumen de orina.28
Entre las características de la diarrea, se debe observar si es líquida, si no tiene contenido hemorrágico ni purulento, en cuanto a la duración en caso de ser breve, se puede descartar que esta sea ocasionada por un enterovirus y en caso de ser prolongada se debería pensar que puede haber sido ocasionada por un norovirus o adenovirus.29
Los niños pueden presentar complicaciones por algunos factores de riesgo como: niños menores a 1 año, especialmente inferiores a 6 meses, niños que tuvieron bajo peso al momento de nacer, pacientes pediátricos que han presentado más de 5 diarreas en las 24 horas pasadas, vómito por más de dos ocasiones en 24 horas, niños que no soportan la administración de líquidos, niños que han abandonado la lactancia materna por la diarrea, niños con desnutrición.
Otra forma de evaluar es el examen físico encaminado a la búsqueda de signos y síntomas de deshidratación para poder estratificarla y comenzar con una terapia de rehidratación conforme a las necesidades del paciente, cabe recordar que en pacientes lactantes se pueden presentar signos y síntomas diferentes a los niños, y es por ello que se debe tomar especial atención.30-31
Una de las maneras para evaluar la deshidratación es la utilización de escalas para valoración y estratificación de la deshidratación como se muestra en la Tabla 1, tanto de niños como de lactantes, aunque muchos valoran signos vitales como la frecuencia cardiaca, el pulso, la respiración y la tensión arterial.
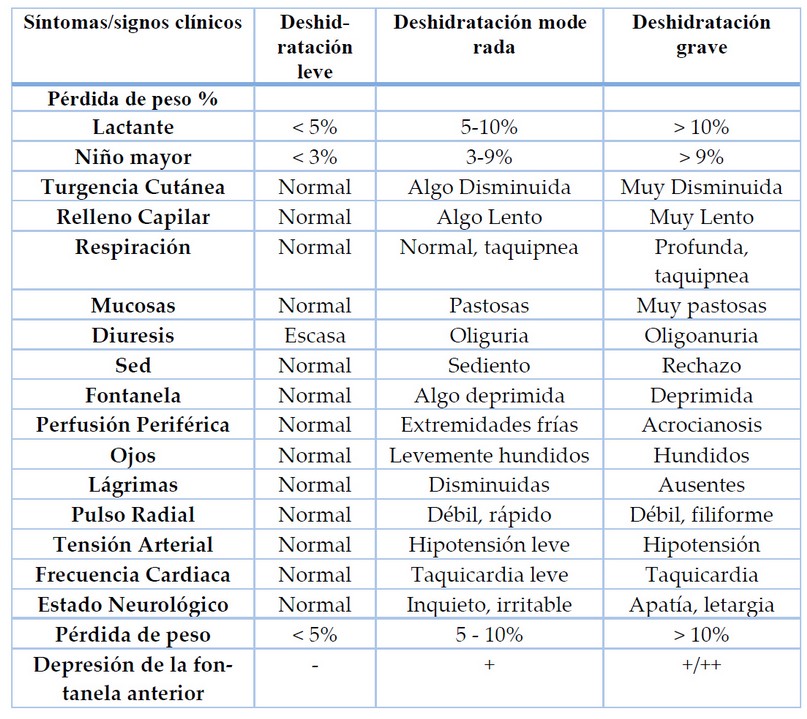
Tabla 1. Síntomas y signos sugestivos de deshidratación
Valoración clínica de la deshidratación en lactantes
Pruebas de laboratorio
En la parte práctica, aquellos niños que presentan diarrea aguda no requieren de estudios etiológicos previos para ser tratados, el tratamiento va a estar enfocado en la rehidratación oral, sin importar el agente causal. La prescripción de antibióticos no está indicada ya que la misma no beneficia ni perjudica el transcurso de la enfermedad.
Estudio macro y microscopio de las heces.
En varios estudios realizados a cerca de la diarrea aguda, se ha podido evidenciar sangre en las heces, además de pus, moco o elevados leucocitos, haciendo notar que es un proceso que conlleva un agente entero invasivo, generalmente ocasionado por el agente Shigella. En este caso si existe la presencia de un aspecto acuoso en heces, que podría estar implicado por un agente toxigénico. Mientras que una coloración amarillenta-dorada con ligero olor a manzana, y adicional con pH inferior a 5 indicaría la presencia de rotavirus.
Electrolitos
En el tema de tratamiento la parte fundamental es la utilización de las sales de rehidratación oral, ya que estas son necesarias para que los niños recuperen los electrolitos que se han perdido por el proceso de la propia enfermedad. Cabe mencionar que únicamente se deben medir los electrolitos en caso de sospechar una descompensación o un desequilibrio.
Diagnóstico diferencial
El Diagnóstico diferencial debe ser realizado tomando en consideración algunos síndromes clínico-quirúrgicos que cursan con una sintomatología parecida especialmente en la edad pediátrica.
Entre los principales síntomas se encuentran el dolor abdominal con componente de hipersensibilidad, infecciones de otro foco como neumonías, infección de vías urinarias, enfermedad de Crohn, apendicitis, diarreas relacionadas a la ingesta de antibióticos, asociadas a diabetes, hipertensión, hipertiroidismo, enfermedad de Addison, entre otras patologías.
Tratamiento no farmacológico Alimentación
En cuanto a la alimentación se ha podido evidenciar que el añadir alimentos luego de haberse administrado sales de rehidratación oral y pasado un tiempo de al menos 4 horas, estos favorecerían la ganancia de peso y disminuirían los episodios de diarrea, a la vez que disminuye la incidencia de intolerancia a la lactosa.
Las recomendaciones en cuanto a la dieta es que deben ser acorde a las necesidades y edad del paciente, teniendo en cuenta que estas no deben interferir con la cantidad de líquido que se utilizó para el tratamiento de rehidratación oral (TRO), y siendo primordial la ingesta de granos, huevos, frutas, carnes y legumbres.
Uno de los puntos interesantes y al mismo tiempo fundamental es que no se debe excluir y retrasar la lactancia materna en caso de niños lactantes.
Tratamiento farmacológico
La prescripción médica inadecuada de fármacos se produce cuando el riesgo de efectos adversos supera los beneficios clínicos, especialmente si existen opciones terapéuticas más seguras y efectivas disponibles.
Existen dos conceptos y situaciones a tomar en cuenta para brindar el tratamiento farmacológico adecuado, en este sentido se debe considerar la deshidratación leve a moderada la cual va a ser tratada por rehidratación oral, mientras que para deshidratación grave donde se puede producir choque hipovolémico se debe considerar el tratamiento por hidratación intravenosa.32
Rehidratación oral
La rehidratación oral es producida mediante la administración de soluciones que ayudarían a corregir el grado de deshidratación producida por la enfermedad.
Cuando el niño presenta diarrea, pero no se evidencia signos de deshidratación, se recomienda la administración de 10 mL/kg cada que se realice una deposición líquida y 2 mL/kg cada que vomite.
En casos de diarrea que exista deshidratación leve, se debe administrar de 30 a 50 mL/kg durante 4 a 6 horas de forma continua, mientras que se debe reponer las perdidas mantenidas administrando 10 mL/kg por cada deposición líquida.
En casos de una diarrea con signos de deshidratación moderada, la dosis de administración será de 75 a 100 mL/kg durante las primeras 4 a 6 horas, sumado a la reposición de perdidas mantenidas más la reposición del déficit.
Una vez administrada la solución de rehidratación por un tiempo de 4 a 6 horas, se evalúa nuevamente al paciente, en casos en los que se produce una mala adherencia al tratamiento se recomienda la toma de líquido de forma fraccionada cada 2 a 3 minutos, en cantidades pequeñas, ya que aplicando este método se ha podido observar que hay una mejor tolerancia. En casos particulares en los que no se encuentre mejoría otra vía de administración es la nasogástrica. A los niños con edades inferiores a 2 años, se los puede administrar mediante cucharitas, una cada 1 a 5 minutos.33
Antieméticos
El medicamento ondansetron actualmente es el antiemético más usado en los servicios pediátricos a nivel mundial, ya que este es un antagonista del receptor de serotonina, lo que permite reducir la actividad del nervio neumogástrico, inhabilitando temporalmente la zona del bulbo raquídeo, este es utilizado en niños con vómitos incoercibles, lo que ha permitido demostrar que no necesitan de hidratación endovenosa y de hospitalización, o al menos reducir la necesidad de las mismas.
Probióticos
Los probióticos han permitido una reducción significativa en los niveles de intensidad y a la vez de duración de la enfermedad, hoy en día se recomienda Lactobacillus GG y el Saccharomyces boulardii que han demostrado eficacia en varios metaanálisis y ensayos clínicos, siendo útiles especialmente cuando se los utilizan durante las primeras 48 horas de aparición de síntomas.33,34,35
Racecadotrilo o acetorfan
Es un inhibidor de la encefalinasa intestinal, es muy utilizada en aquellas diarreas que tienen un importante componente secretor, ya que aumenta la encefalina libre en la membrana basal de los enterocitos.
Antibióticos
No están indicados como tratamiento específico, pero estos son reservados para casos de diarrea severa, especialmente la disentérica y en pacientes inmunocomprometidos. Los antibióticos se recomiendan ser utilizados en pacientes con sospecha de Shigella y Vibrio cholerae siempre y cuando se cursen cuadros severos que no respondan al tratamiento convencional. Sin embargo, uno de los antibióticos más utilizados es la azitromicina lo cual se ha demostrado que disminuye el riesgo de muerte infantil. La prescripción inadecuada de antibióticos es una preocupación de salud pública global, ya que puede provocar la resistencia bacteriana, un problema que afecta a nivel mundial, debido a esto es primordial realizar primero un diagnóstico adecuado antes de la prescripción.36-43.
Zinc
La organización mundial de la salud recomienda que se utilice el tratamiento con zinc, en dosis de 10 mg/día durante periodos de 10 a 14 días para niños menores de 6 meses, y 20 mg/día para niños mayores de 6 meses especialmente en los países desarrollados.43
Vitamina A
Conociendo que la diarrea reduce la absorción de la vitamina A, y que esto conlleva consecuencias oftálmicas sobre todo en lugares donde los niños tienen reservas orgánicas bajas de vitamina A, en los cuales los niños pueden presentar Xeroftalmia. La administración de vitamina A vía oral es de 200 000 unidades en niños de más de 12 meses, de 100 000 en menores de 12 meses y 50 000 unidades en menores de 6 meses, la administración de esta vitamina se ha asociado con una disminución del 30% de la mortalidad ocasionada por la diarrea.44
Esmectita
Permite reducir la duración de la diarrea, aunque aún posee un nivel de evidencia relativamente bajo, y no se ha podido demostrar que reduce la necesidad de hidratación intravenosa, es usada como coadyuvante de la terapia de rehidratación oral.45
Prevención y vacunación
Como recomendación de acuerdo a lo que ya se ha podido observar es que se debería garantizar la promoción a nivel mundial de la lactancia materna, las buenas medidas higiénicas y el buen manejo de residuos. Al día de hoy se encuentran disponibles: 2 vacunas de virus vivo atenuado para rotavirus, 1 vacuna de bacterias inactivadas para Vibrio cholerae y 2 vacunas polisacáridos para Salmonella tiphy .46-52
CONCLUSIONES
A nivel mundial las principales causas de muerte en niños menores de cinco años son debido a posibles complicaciones durante el parto, neumonía, anomalías congénitas, diarrea y el paludismo, todas ellas prevenibles o tratables mediante intervenciones sencillas como la inmunización, la nutrición adecuada, el uso agua potable, condiciones sanitarias adecuadas. Si bien la mayoría de los estudios de brotes son evidenciados por los mecanismos de transmisión de enfermedades las cuales podrían tener una incidencia mayor en ciertas zonas endémicas debido a la alta carga microbiana, generando un problema en la salud pública, en el Ecuador las tasas de enfermedades diarreicas oscilaron entre 2,0 y 2,7 casos por 100 000 habitantes en los últimos años, considerándose como una de las principales enfermedades con alta mortalidad sobre todo en niños menores de 5 años, las zonas rurales las cuales no disponen de agua potable y el manejo inadecuado de desechos favorecen la propagación de enfermedades y su transmisión, además el factor económico también juega un papel importante debido a que la falta de refrigeración de los alimentos, la eliminación inadecuada de las heces y la ineficiente higiene en el hogar genera un problema sanitario. Conociendo la situación problemática y debido a que hay factores donde se podría intervenir, es necesario abordar más sobre la etiología, mecanismos de transmisión, el manejo, la prevención del agente patógeno y principalmente el tratamiento farmacológico de la enfermedad, para poder actuar desde esta perspectiva[TUIR14] .
Contribución de autores: Conceptualización, Bryan Anthony Urbina-Salazar y Nallely José Urbina Paucar; Preparación del borrador original, Anabell del Rocío Urbina-Salazar; Redacción—revisión y edición, Alberto Renato Inca-Torres.
Conflictos de Interés: Los autores declaran no tener conflictos de interés.
REFERENCES
1. Levine, G. A.; Walson, J. L.; Atlas, H. E.; Lamberti, L. M.; & Pavlinac, P. B. Defining pediatric diarrhea in low-resource settings. J Pediatric Infect Dis Soc. 2017;6(3):293-289. https://doi: 10.1093/jpids/pix024.
2. Farfán-García AE; Imdad A; Zhang C; Arias-Guerrero MY; Sánchez-Álvarez NT; Iqbal J; Hernández-Gamboa AE; Slaughter JC; Gómez-Duarte OG. Etiology of acute gastroenteritis among children less than 5 years of age in Bucaramanga, Colombia: A case-control study. PLoS Negl Trop Dis. 2020;14(6):e0008375. https://doi: 10.1371/journal.pntd.0008375. PMID: 32603324; PMCID: PMC7357789.
3. Kabir F; Iqbal J; Jamil Z; Iqbal NT; Mallawaarachchi I; Aziz F; Kalam A; Muneer S; Hotwani A; Ahmed S; Umrani F; Syed S; Sadiq K; Ma JZ; Moore SR; Ali A. Impact of enteropathogens on faltering growth in a resource-limited setting. Front Nutr. 2023 Jan 10;9:1081833. doi: 10.3389/fnut.2022.1081833. PMID: 36704796; PMCID: PMC9871909. }
4. Hossain MJ; Powell H; Sow SO; Omore R; Roose A; Jones JCM; Zaman SMA; Badji H; Sarwar G; Kasumba IN; Onwuchekwa U; Doh S; Awuor AO; Ochieng JB; Verani JR; Liu J; Tennant SM; Nasrin D; Jamka LP; Liang Y; Howie SRC; Antonio M; Houpt ER; Kotloff KL. Clinical and Epidemiologic Features of Cryptosporidium-Associated Diarrheal Disease Among Young Children Living in Sub-Saharan Africa: The Vaccine Impact on Diarrhea in Africa (VIDA) Study. Clin Infect Dis. 2023 Apr 19;76(76 Suppl1):S97-S105. doi: 10.1093/cid/ciad044. PMID: 37074443; PMCID: PMC10116562.
5. World Health Organization. Integrated management of childhood illness. Accessed October 8, 2020.https://apps.who.int/iris/bitstream/handle/10665/43993/9789241597289_eng.pdf?sequence=1
6. Burnett, E.; Parashar, U. D.; & Tate, J. E. Rotavirus Infection, Illness, and Vaccine Performance in Malnourished Children: A Review of the Literature. Pediatr Infect Dis J. 2021;40(10):936-930. https://doi.org/10.1097/INF.0000000000003206
7. Budge S; Barnett M; Hutchings P; Parker A; Tyrrel S; Hassard F; Garbutt C; Moges M; Woldemedhin F; Jemal M. Risk factors and transmission pathways associated with infant Campylobacter spp. prevalence and malnutrition: A formative study in rural Ethiopia. PLoS One. 2020 May 8;15(5):e0232541. doi: 10.1371/journal.pone.0232541. PMID: 32384130; PMCID: PMC7209302.
8. Manjate, F.; João, E. D.; Chirinda, P.; Garrine, M.; Vubil, D.; Nobela, N.; Kotloff, K.; et al. Molecular Epidemiology of Rotavirus Strains in Symptomatic and Asymptomatic Children in Manhiça District, Southern Mozambique 2008-2019. Viruses. 2022;14:134. https://doi.org/10.3390/v14010134
9. Burnett, E.; Parashar, U. D.; & Tate, J. E. Global impact of rotavirus vaccination on diarrhea hospitalizations and deaths among children< 5 years old: 2006-2019. J Infect Dis. 2020; 222(10):1739-1731. https://doi.org/10.1093/infdis/jiaa081
10. Troeger, C.; Khalil, I. A.; Rao, P. C.; Cao, S.; Blacker, B. F.; Ahmed, T.; Tahmeed A; et al. Rotavirus vaccination and the global burden of rotavirus diarrhea among children younger than 5 years. JAMA Pediatr. 2018;172(10):965-958. https://doi:10.1001/jamapediatrics.2018.1960
11. Baker JM; Hasso-Agopsowicz M; Pitzer VE; Platts-Mills JA; Peralta-Santos A; Troja C; Archer H; Guo B; Sheahan W; Lingappa J; Jit M; Lopman BA. Association of enteropathogen detection with diarrhoea by age and high versus low child mortality settings: a systematic review and meta-analysis. Lancet Glob Health. 2021 Oct;9(10):e1402-e1410. doi: 10.1016/S2214-109X(21)00316-8. PMID: 34534487; PMCID: PMC8456779.
12. Acácio S.; Mandomando I.; Nhampossa T.; Quintó L.; Vubil D.; Sacoor C.; Kotloff K.; Farag T.; Nasrin D.; Macete E.; et al. Risk factors for death among children 0-59 months of age with moderate-to-severe diarrhea in Manhiça district, southern Mozambique. BMC Infect. Dis. 2019;19:322. https://doi: 10.1186/s12879-019-3948-9.
13. Thiagarajah, JR; Kamin, DS; Acra, S.; Goldsmith, JD; Roland, JT; Lencer, WI; Muise, AM; Goldenring, JR; Avitzur, Y.; Martín, MG y PediCODE Consortium. Advances in evaluation of chronic diarrhea in infants. Gastroenterology. 2018;154(8):2059-2045. https://doi.org/10.1053/j.gastro.2018.03.067
14. Das R; Palit P; Haque MA; Mahfuz M; Faruque ASG; Ahmed T. Site specific incidence rate of genomic subtypes of enteropathogenic Escherichia coli and association with enteric inflammation and child growth. Sci Rep. 2022 Apr 6;12(1):5724. doi: 10.1038/s41598-022-09730-8. PMID: 35388098; PMCID: PMC8986875.
15. Ledwaba, S. E.; Costa, D.; Bolick, D. T.; Giallourou, N.; Medeiros, P.; Swann, J. R.; Traore, A. N.; Potgieter, N.; Nataro, J. P.; & Guerrant, R. L. Enteropathogenic Escherichia coli Infection Induces Diarrhea, Intestinal Damage, Metabolic Alterations, and Increased Intestinal Permeability in a Murine Model. Front Cell Infect Microbiol. 2020;10:595266. https://doi.org/10.3389/fcimb.2020.595266
16. Duan, Q.; Xia, P.; Nandre, R.; Zhang, W.; & Zhu, G. Review of newly identified functions associated with the heat-labile toxin of enterotoxigenic Escherichia coli. Front Cell Infect Microbiol. 2019;9:292. https://doi.org/10.3389/fcimb.2019.00292
17. Ahmadi Rouzbahani, H.; Mousavi Gargari, S. L.; Nazarian, S.; & Abdollahi, S. Protective Immunity Against Enterotoxigenic Escherichia coli by Oral Vaccination of Engineered Lactococcus lactis. Curr Microbiol. 2021;78(9):3473-3464. https://doi.org/10.1007/s00284-021-02601-x
18. Tickell, K. D.; Brander, R. L.; Atlas, H. E.; Pernica, J. M.; Walson, J. L.; Pavlinac, P. B.; Simwaka J; Seheri M; Mulundu G; Kaonga P; Mwenda JM; Chilengi R; Mpabalwani E; Munsaka S. Rotavirus breakthrough infections responsible for gastroenteritis in vaccinated infants who presented with acute diarrhoea at University Teaching Hospitals, Children's Hospital in 2016, in Lusaka Zambia. PLoS One. 2021 Feb 4;16(2):e0246025. doi: 10.1371/journal.pone.0246025. PMID: 33539399; PMCID: PMC7861525.
19. Vubil, D.; Acácio, S.; Quintò, L.; Ballesté-Delpierre, C.; Nhampossa, T.; Kotloff, K.; Levine M.; et al. Clinical features, risk factors, and impact of antibiotic treatment of diarrhea caused by Shigella in children less than 5 years in Manhiça District, rural Mozambique. Infect Drug Resist. 2018;11:2095. https://doi.org/10.2147/IDR.S177579
20. McClung, R. P.; Karwowski, M.; Castillo, C.; McFadden, J.; Collier, S.; Collins, J.; Soehnlen M.; et al. Shigella sonnei outbreak investigation during a municipal water crisis-Genesee and Saginaw counties, Michigan, 2016. Am J Public Health. 2020;110(6):849-842https://doi.org/10.2105/AJPH.2020.305577
21. Azagra-Boronat, I., Massot-Cladera, M., Knipping, K., Garssen, J., Ben Amor, K., Knol, J., Franch A., et al. Strain-specific probiotic properties of bifidobacteria and lactobacilli for the prevention of diarrhea caused by rotavirus in a preclinical model. Nutrients. 2020;12(2):498. https://doi.org/10.3390/nu12020498
22. Saha, S., Santosham, M., Hussain, M., Black, R. E., & Saha, S. K. Rotavirus vaccine will improve child survival by more than just preventing diarrhea: evidence from Bangladesh. Am J Trop Med Hyg. 2018; 98(2):360. https://doi.org/10.4269/ajtmh.17-0586
23. Iflah M, Kassem E, Rubinstein U, Goren S, Ephros M, Cohen D, Muhsen K. Convulsions in children hospitalized for acute gastroenteritis. Sci Rep. 2021; 5;11(1):15874. https://doi: 10.1038/s41598-021-95202-4.
24. Hammer, H. F. Management of chronic diarrhea in primary care: the gastroenterologists advice. Digestive Diseases. 2021; 39(6):621-615. https://doi.org/10.1159/000515219
25. Patel JM. Multisystem Inflammatory Syndrome in Children (MIS-C). Curr Allergy Asthma Rep. 2022 May;22(5):53-60. doi: 10.1007/s11882-022-01031-4. Epub 2022 Mar 22. PMID: 35314921; PMCID: PMC8938222.
26. Platts-Mills JA, Liu J, Rogawski ET, et al; MAL-ED Network Investigators. Use of quantitative molecular diagnostic methods to assess the aetiology, burden, and clinical characteristics of diarrhoea in children in low-resource settings: a reanalysis of the MAL-ED cohort study. Lancet Glob Health. 2018;6(12):e1318-e1309. https://doi.org/10.1016/S2214-109X(18)30349-8
27. Bawankule, R., Shetye, S., Singh, A., Singh, A., & Kumar, K. Epidemiological investigation and management of bloody diarrhea among children in India. PloS one. 2019;14(9):e0222208. https://doi.org/10.1371/journal.pone.0222208
28. Yang, B., Lu, P., Li, M. X., Cai, X. L., Xiong, W. Y., Hou, H. J., & Ha, X. Q. A meta-analysis of the effects of probiotics and synbiotics in children with acute diarrhea. Medicine. 2019; 98(37): e16618. https://doi.org/10.1097/MD.0000000000016618
29. Guarino, A., Vecchio, A. L., Dias, J. A., Berkley, J. A., Boey, C., Bruzzese, D., et al. Universal recommendations for the management of acute diarrhea in nonmalnourished children. J Pediatr Gastroenterol Nutr. 2018;67(5):586. https://doi.org/10.1097/MPG.0000000000002053
30. Gouveia, M. A. D. C., Lins, M. T. C., & Silva, G. A. P. D. Acute diarrhea with blood: diagnosis and drug treatment. J. Pediatr. 2020;96:28-20. https://doi.org/10.1016/j.jped.2019.08.006
31. Baye, A., Adane, M., Sisay, T., & Hailemeskel, H. S. Priorities for intervention to prevent diarrhea among children aged 0-23 months in northeastern Ethiopia: a matched case-control study. BMC pediatrics. 2021;21(1),11-1. https://doi.org/10.1186/s12887-021-02592-5
32. Collinson, S., Deans, A., Padua-Zamora, A., Gregorio, G. V., Li, C., Dans, L. F., & Allen, S. J. Probiotics for treating acute infectious diarrhoea. Cochrane Database Syst Rev. 2020;(12). https://doi.org/10.1002/14651858.CD003048.pub4
33. Gawronska J, Koyanagi A, López Sánchez GF, Veronese N, Ilie PC, Carrie A, Smith L, Soysal P. The Prevalence and Indications of Intravenous Rehydration Therapy in Hospital Settings: A Systematic Review. Epidemiologia (Basel). 2022 Dec 31;4(1):18-32. doi: 10.3390/epidemiologia4010002. PMID: 36648776; PMCID: PMC9844368.
34. Lanyero, H., Ocan, M., Obua, C., Stålsby Lundborg, C., Nanzigu, S., Katureebe, A, et al., Antibiotic use among children under five years with diarrhea in rural communities of Gulu, northern Uganda: a cross-sectional study. BMC Public Health. 2021; 21(1):9-1. https://doi.org/10.1186/s12889-021-11254-1
35. Ling BJ, Wan YM. The application of probiotic after antibiotics treatment promotes the recovery of pediatric bronchopneumonia infection. Eur Rev Med Pharmacol Sci. 2023 May;27(9):4103-4107. doi: 10.26355/eurrev_202305_32318. PMID: 37203836.
36. Săsăran MO, Mărginean CO, Adumitrăchioaiei H, Meliț LE. Pathogen-Specific Benefits of Probiotic and Synbiotic Use in Childhood Acute Gastroenteritis: An Updated Review of the Literature. Nutrients. 2023 Jan 27;15(3):643. doi: 10.3390/nu15030643. PMID: 36771350; PMCID: PMC9919199.
37. Ahmed, T., Chisti, M. J., Rahman, M. W., Alam, T., Ahmed, D., Parvin, I., Farhad K. Effect of 3 days of oral azithromycin on young children with acute diarrhea in low-resource settings: a randomized clinical trial. JAMA Netw Open. 2021;4(12):e2136726- https://doi.org/10.1001/jamanetworkopen.2021.36726
38. Keenan JD, Bailey RL, West SK, et al; MORDOR Study Group. Azithromycin to reduce childhood mortality in sub-Saharan Africa. N Engl J Med. 2018;378(17):1592-1583. https://doi.org/10.1056/NEJMoa1715474
39. Hart JD, Kalua K, Keenan JD, Lietman TM, Bailey RL. Effect of mass treatment with azithromycin on causes of death in children in Malawi: secondary analysis from the MORDOR trial. Am J Trop Med Hyg. 2020;103(3):1328-1319. https://doi.org/10.4269/ajtmh.19-0613
40. Mathew MM, Kaimal RS, Goodwill J. Acute Diarrhoeal Disease in Children Aged 6 Months to 24 Months: An In-Hospital Cross-Sectional Study. J Family Med Prim Care. 2021 Jul;10(7):2498-2494. https://doi.org/10.4103/jfmpc.jfmpc_1443_20. Epub 2021 Jul 30. PMID: 34568125; PMCID: PMC8415679.
41. Fu H, Li J, Xu X, Xia C, Pan Y. Effectiveness and Safety of Saccharomyces Boulardii for the Treatment of Acute Gastroenteritis in the Pediatric Population: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Comput Math Methods Med. 2022 Sep 20;2022:6234858. Doi: 10.1155/2022/6234858. PMID: 36176742; PMCID: PMC9514928.
42. Awuor AO, Ogwel B, Powell H, Verani JR, Sow SO, Hossain MJ, Ochieng JB, Juma J, Jamka LP, Roose A, Doh S, Deichsel EL, Onwuchekwa U, Keita AM, Antonio M, Jones JCM, Zaman SMA, Badji H, Kasumba IN, Nasrin D, Platts-Mills JA, Houpt ER, Berendes DM, Sugerman CE, Widdowson MA, Tennant SM, Mintz ED, Omore R, Kotloff KL. Antibiotic-Prescribing Practices for Management of Childhood Diarrhea in 3 Sub-Saharan African Countries: Findings From the Vaccine Impact on Diarrhea in Africa (VIDA) Study, 2015-2018. Clin Infect Dis. 2023 Apr 19;76(76 Suppl1):S32-S40. doi: 10.1093/cid/ciac980. PMID: 37074427; PMCID: PMC10116514.
43. Rhee C, Aol G, Ouma A, Audi A, Muema S, Auko J, Omore R, Odongo G, Wiegand RE, Montgomery JM, Widdowson MA, O'Reilly CE, Bigogo G, Verani JR. Inappropriate use of antibiotics for childhood diarrhea case management - Kenya, 2009-2016. BMC Public Health. 2019 May 10;19(Suppl 3):468. doi: 10.1186/s12889-019-6771-8. PMID: 32326936; PMCID: PMC6696675.
44. Nemeth V, Pfleghaar N. Diarrhea. 2022 Nov 21. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2023 Jan–. PMID: 28846339.
45. Altcheh J, Carosella MV, Ceballos A, D'Andrea U, Jofre SM, Marotta C, Mugeri D, Sabbaj L, Soto A, Josse C, Montestruc F, McFarland LV. Randomized, direct comparison study of Saccharomyces boulardii CNCM I-745 versus multi-strained Bacillus clausii probiotics for the treatment of pediatric acute gastroenteritis. Medicine (Baltimore). 2022 Sep 9;101(36):e30500. doi: 10.1097/MD.0000000000030500. PMID: 36086703; PMCID: PMC9646502.
46. Chugá, Z. R. N., Jaramillo, M. E. N., & Hernández, C. E. P. (2022). Factores que influyen en el abandono del esquema de vacunación en los menores de cinco años en el centro de salud “San Antonio”, Ibarra. Estudios del Desarrollo Social: Cuba y América Latina, 10(especial 1).
47. Avcı D, Kuş C, Gümüştakim RŞ, Ayhan Başer D, Eryilmaz ME. Knowledge, attitudes and behaviors of family physicians about childhood vaccinations that are not in the routine vaccination schedule: a cross-sectional study. Prim Health Care Res Dev. 2023 Jan 9;24:e2. doi: 10.1017/S1463423622000688. PMID: 36617853; PMCID: PMC9884530.
48. Deichsel EL, Powell H, Troeger C, Hossain MJ, Sow SO, Omore R, Jasseh M, Onwuchekwa U, Obor D, Sanogo D, Jones JCM, Nasrin D, Tapia MD, Kotloff KL. Drivers of Decline in Diarrhea Mortality Between GEMS and VIDA Studies. Clin Infect Dis. 2023 Apr 19;76(76 Suppl1):S58-S65. Doi: 10.1093/cid/ciad015. PMID: 37074431; PMCID: PMC10116520.
49. Manjate F, Quintó L, Chirinda P, Acácio S, Garrine M, Vubil D, Nhampossa T, João ED, Nhacolo A, Cossa A, Massora S, Bambo G, Bassat Q, Kotloff K, Levine M, Alonso PL, Tate JE, Parashar U, Mwenda JM, Mandomando I. Impact of rotavirus vaccination on diarrheal hospitalizations in children younger than 5 years of age in a rural southern Mozambique. Vaccine. 2022 Oct 19;40(44):6422-6430. doi: 10.1016/j.vaccine.2022.09.050. Epub 2022 Oct 1. PMID: 36192272; PMCID: PMC9589241.
50. Musabaev E, Ismailov U, Ibadullaeva N, Khikmatullaeva A, Norbaev I, Primov U, Ahrarova D, Sharapov S, Yusupov U, Latipov R. Assessment of the Impact of the Rotavirus Vaccine Against Severe Rotaviral Diarrhea in Uzbekistan. J Epidemiol Glob Health. 2023 Sep;13(3):476-484. Doi: 10.1007/s44197-023-00126-z. Epub 2023 Jun 10. PMID: 37300641; PMCID: PMC10257161.
51. Keita AM, Doh S, Sow SO, Powell H, Omore R, Jahangir Hossain M, Ogwel B, Ochieng JB, Jones JCM, Zaman SMA, Awuor AO, Juma J, Nasrin D, Liu J, Traoré A, Onwuchekwa U, Badji H, Sarwar G, Antonio M, Houpt ER, Tennant SM, Kasumba IN, Jamka LP, Roose A, Platts-Mills JA, Verani JR, Tate JE, Parashar UD, Neuzil KM, Kotloff KL. Prevalence, Clinical Severity, and Seasonality of Adenovirus 40/41, Astrovirus, Sapovirus, and Rotavirus Among Young Children With Moderate-to-Severe Diarrhea: Results From the Vaccine Impact on Diarrhea in Africa (VIDA) Study. Clin Infect Dis. 2023 Apr 19;76(76 Suppl1):S123-S131. doi: 10.1093/cid/ciad060. PMID: 37074439; PMCID: PMC10116545.
52. Kabayiza JC, Nilsson S, Andersson M. Rotavirus infections and their genotype distribution in Rwanda before and after the introduction of rotavirus vaccination. PLoS One. 2023 Apr 25;18(4):e0284934. doi: 10.1371/journal.pone.0284934. PMID: 37098095; PMCID: PMC10128998.
Received: 25 June 2023/ Accepted: 26 August 2023 / Published:15 September 2023
Citation: Urbina-Salazar A R, Inca-Torres A R , Urbina-Salazar B A, Urbina Paucar N J. Etiología infecciosa de la diarrea aguda pediátrica, un problema de la Salud Pública.Revis Bionatura 2023;8 (3) 91http://dx.doi.org/10.21931/RB/2023.08.03.91
