Revision/Review
Files > Volume 1 > Vol 1 No 2 2016 > Revisiones
Compuestos bioactivos aislados de cianobacterias y microalgas: propiedades y aplicaciones potenciales en la biomedicina
Active compounds from cyanobacteria and microalgae: properties and potential applications in biomedicine
Available from: http://dx.doi.org/10.21931/RB/2016.01.02.8Alexey Llopiz
Resumen
Las cianobacterias y microalgas son fuentes de productos con aplicaciones potenciales en la industria biofarmacéutica. Entre las estructuras extraídas de estos microorganimos se encuentran: péptidos, proteínas, carbohidratos, terpenoides, ácidos grasos insaturados, flavonoides, compuestos fenólicos, vitaminas, porfirinas, y otros compuestos orgánicos. La naturaleza estructural de estos productos es muy diversa, además la composición química de las microalgas está en concordancia con sus hábitats. Entre las principales propiedades farmacológicas caracterizadas en estos micro-organismos se encuentran las relacionadas con las actividades bactericidas, inmunomoduladoras, antioxidantes, citoprotectoras, fungicidas y antivirales en el contexto de diferentes patógenos. Esto posibilita su posible empleo en el tratamiento de enfermedades autoinmunes, tumorales así como en procesos infecciosos. En esta revisión se presentan las estructuras químicas y las actividades biológicas de algunos de los compuestos aislados de microalgas, los que pudieran tener aplicaciones potenciales en la industria biofarmacéutica.
Palabras clave: Antibióticos, antivirales, cianobacterias, algas, biofarmacéutico, nutracéutico, ficobiliproteínas.
Abstract
Cyanobacteria and microalgae are source of many chemicals substances with potential applications on biopharmaceutical industry. Many structures have been characterized in these organism, such as: peptides, proteins, carbohydrates, terpenoids, polyinsatured fatty acids, flavonoids, phenolic compounds, vitamins, porfirins and other organic substances. Chemicals structures of isolated compounds are diverse and it depends of microalgae habitats. Pharmacological activities located in microalgae are bactericides, immunomodulatory, antioxidants, cytoprotective, fungicides and antivirals. These properties may possible the potential treatment of many diseases including autoimmunes disorders, tumoral, and infectious process. In this review are presented and discussed some elements associated to chemical structure and biological activities around of compounds with potential uses as biopharmaceuticals.
Keywords: Antibiotics, antivirals, cyanobacteria, algae, biopharmaceuticals, nutraceuticals, phycobiliproteins.
Introducción
Las microalgas son microorganismos fotosintéticos, polifiléticos y eucariotas que pueden crecer de manera autotrófica o heterotrófica. Las cianobacterias son procariontes Gram-negativos que aunque originalmente estaban incluidos dentro de las algas posteriormente pasaron a formar parte del dominio de las bacterias. En estos organismos se han identificado compuestos bioactivos con diversos usos potenciales, fundamentalmente en biomedicina, agropecuaria, cosmética y en investigaciones básicas1,2. Estos microorganismos también han sido empleados en la producción de dihidrógeno y etanol para la obtención de fuentes alternativas de combustibles3, así como en la industria alimenticia por sus propiedades colorantes y nutricionales 4.
Las actividades farmacológicas reportadas en compuestos procedentes de cianobacterias y microalgas incluyen antiprotozoos, bactericidas, antivirales, citotóxicas, inhibidores de proteasas o de los canales de calcio, inmunomoduladoras y antioxidantes5. Uno de los elementos asociados a la gran diversidad de actividades encontradas es el amplio espectro de metabolitos secundarios presentes en estos organismos3, entre los que se encuentran lipopéptidos, aminoácidos, proteínas, ácidos grasos, macrólidos, amidas, fenoles, alcaloides, compuestos orgánicos de bajo peso molecular y carbohidratos6.Adicionalmente la diversidad estructural y funcional de estos sistemas biológicos se incrementa debido a que la composición química de los extractos de estos microrganismos depende de la localización geográfica y de los métodos de extracción empleados 7.Sin embargo se debe tener en cuenta que estos microorganismos también pueden contener sustancias tóxicas, las cuales deben ser identificadas y eliminadas de estos sistemas cuando van a ser empleados con fines biofarmacéuticos, nutricionales, etc. 8.
En esta revisión se presentará una panorámica general desde el punto de vista estructural y funcional de algunos de los principales metabolitos encontrados en cianobacterias y microalgas, que se caracterizan por actividades biológicas que los hacen productos potenciales en la industria biofarmacéutica.
Métodos
Las estructuras químicas fueron dibujadas con el programa Chem Draw9y la visualización de las estructuras 3D se realizó con el programa UCSF Chimera10.
Compuestos activos aislados de microalgas
Carbohidratos
Entre los metabolitos bioactivos que se han identificado en varias microalgas se encuentran los polisacáridos sulfatados, los que están asociados a actividades antivirales, antibacterianas, antitumorales, antinflamatorias11y probióticas12,13.También se han identificado propiedades antioxidantes en varios de estos polisacáridos sulfatados, los que están constituidos fundamentalmente por galactosa, azúcares metilados y anhídridos. Las estructuras sacarídicas más importantes que se encuentran en los extractos de estos organismos son los fucoidanos, las laminarinas, los galactanos y los alginatos14.
Los fucoidanos son polisacáridos sulfatados extraídos fundamentalmente de algas marinas de color marrón. Estas sustancias están asociadas a la modulación del sistema inmune, inhibición de la proliferación celular 15, actividad anti y proangiogénica 16 y actividad antiviral 17. Un total de ocho estudios realizados en humanos que implican a estos carbohidratos han sido reportados, los que implican la evaluación del efecto anticoagulante 18, inmunomodulador19así como las potencialidades para el tratamiento de síndromes metabólicos 20.
La estructura química de estos carbohidrato simplican a la L-fucosa sulfatada, las que se unen mediante enlaces glicosídicos del tipo α-1,3 (Fig.1A). Este tipo de compuestos generalmente pueden ser identificadas en Laminaria saccharina, L. digitata, Analipusjaponicus, Cladosiphonokamuranus y Chordafilum.Otra disposición que se ha caracterizado implica que se alternen enlaces glicosídicosα-1,3 y α-1,4 (Fig.1B), las que pueden ser encontradas en especies como Ascophyllumnodosum y Fucus 21. Adicionalmente se han identificado en estos polisacáridos otros monosacáridos como glucosa, manosa, galactosa, xilosa, ácido urónico así como derivados acetilados, los que también se pueden encontrar unidos con una estereoquímica del tipo β en el contexto del enlace O-glicosídico22.
Los fucoidanos pueden tener diferentes tamaños en función del grado de repetición de la unidad básica estructural, la cual modula las propiedades biológicas de estas estructuras15.La acción de estos compuestos también está asociada a las diferencias en el estado de carga superficial, las que están determinadas en gran medida por la exposición de los ésteres de sulfato presentes en estos productos naturales23.
La sustitución de los hidrógenos por grupos sulfatos (SO3-) o grupos acetilos (CH3CO-) puede ser en las posiciones C2 o C4, y en muy pocas ocasiones en C3 (Fig.1).Aunque esta estructura se encuentra relativamente conservada en varios fucanos extraídos de algas, puede diferir entre microrganismos incluso de la misma especie24.
Las laminarinas son otra familia de polisacáridos sulfatados que pueden actuar como componentes de la fibra dietética, probióticos, bactericidas, antivirales, antitumorales, sustancias anti-apoptóticas, anti-inflamatorios, anticoagulantes y antioxidantes 25. En estos compuestos la estructura repetitiva está constituida por unidades de D-glucosa con uniones del tipo β-1,3en las cadenas principales y con β-1,6 en las cadenas laterales (Fig. 2). Aunque la relación entre los enlaces del tipo 1-3 y 1-6 varía entre diferentes especies, la relación generalmente se encuentra entre 2-3:1 y los pesos moleculares alrededor de los 5 kDa. Los dos tipos de laminarinas más frecuentes son: M y G (Fig.2), en dependencia de la estructura del extremo reductor presente en el polisacárido26.
La relación entre cada una de las especies M y G de las laminarinas varía en dependencia del medio del que se extraigan las algas. La salinidad del medio, el nivel de exposición a la luz y la temperatura son algunos de los factores que determinan la estructura de estos polisacáridos así como la potencia de sus propiedades biológicas 27. Las modificaciones químicas de estos compuestos (oxidación, reducción y sulfatación)pudieran estar asociada a la potenciación de las actividades biológicas de esta familia de carbohidratos, fundamentalmente asociado a la ruptura de la cadena original con la formación de estructuras de menor peso molecular28.
Otra de la familia de carbohidratos extraída de algas son los alginatos. Estos polímeros lineales están conformados por dos tipos de ácidos hexurónicos: ácido β-D-manurónico (M) y ácido α-L-gulurónico (G), unidos por enlaces del tipo1,4. Estas estructuras están formadas por bloques del tipo GGGGGG seguidos de bloques MMMMMM y alternado con bloques del tipo GMGMGM (Fig.3). Aunque en dependencia de la fuente de la que se extraiga este tipo de compuestos varía el contenido de cada uno de los monosacáridos y las dimensiones de cada uno de los bloques, las masas moleculares de estos carbohidratos se encuentra en el rango entre 32 y 400 kDa29.Estos polisacáridos pueden formar estructuras coloidales y además tener propiedades antinflamatorias y antibacterianas. Entre las aplicaciones de los alginatos se encuentra la liberación controlada de fármacos, sobre todo en formulaciones que implican la vía oral, debido a la presencia de nanoporos de alrededor de 5 nm en las cápsulas formadas por estos carbohidratos30. Adicionalmente, estas estructuras también han encontrado amplia aplicación en la ingeniería de tejidos29.
El Spirulan cálcico (Ca-Spirulan) es otro carbohidrato sulfatado extraído de la cianobacteria verde-azul Arthrospiraplatensis. Este compuesto es un inhibidor de la reverso-transcriptasa de HIV-1, HIV-2, HSV e influenza. Está formado por unidades deramnosa que se encuentran unidas por enlaces del tipo 1,3 y unidades de 3-O-metilramnosa unidas con una configuración del tipo 1,2.La relación entre estos tipos de enlaces glicosídicos es aproximadamente de 5:331. Adicionalmente en la estructura del Ca-Spirulan se han identificado otros componentes estructurales entre los que se encuentran: manosa, ribosa, fructosa, glucosa, xilosa, galactosa, ácido galacturónico, ácido glucurónico, iones calcio y sulfato 24.
También ha sido extraído de la cianobacteria N. flagilliformeel polisacárido Nostoflan, el cual tiene propiedades antivirales contra HSV-1 (HF), HSV-2 (UW-268), HCMV (Towne), Influenza (NWS), Adeno (tipo 2) y Coxsackie (Conn-5). La estructura de este compuesto tiene dos secuencias con la forma (-4)-β-D-Glcp-(1,4)-D-Xylp-(1 y 4)-[β-D-GlcAp-(1,6)-]-β-D-Glcp-(1,4)-D-Galp-(1-) (Fig.4)32.
Otras estructuras con actividades inhibitorias de la reverso transcriptasa y la DNA polimerasa de HIV-1 son los sulfoglicolípidos libres de fósforo encontrados en Scytonemasp.33.Estos compuestos están conformados por un monosacárido sulfatado en la posición 6, que forma un enlace acetálico (C1) con uno de los grupos hidroxilos distales del glicerol. Los sustituyentes de los otros hidroxilos de este alcohol trihidroxílico son dos ácidos grasos (Fig.5). En el estudio con sulfoquinovosildiacilgliceroles (SQDGs) (1,2-di- O-acil-3-O-(6-deoxi-6-sulfo-α-D-glucopiranosil)-sn-glicerol) de cinco especies de Chlorophyta (algas verdes-azules), 13 del tipo Rhodophyta (algas rojas), y tres de la familia Heterokontophyta (algas marronas) se identificaron fundamentalmente los siguientes ácidos grasos: ácido palmítico (C16:0), 33,3%; EPA (C20:5), 30,0%; ácido araquidónico (C20:4); 12,7%; ácido oleico (C18:1); 7,52%; y ácido esteárico (C18:0); 6,83%.
Estos sulfoglicolípidos aislados por Tsai y Sun33inhibieron el crecimiento de la línea celular de carcinoma hepatocelular HepG2, con una IC50 de 126 μg/mL. En cierta medida este efecto pudiera estar asociado a los SQDGs específicos de estas preparaciones, ya que el control empleado (SQDGs aislados de espinaca) tuvo una IC50 dos veces mayor (255 μg/mL). Presumiblemente esta diferencia pudiera estar asociada a las distintas relaciones n6/n3 que caracterizan a cada una de las preparaciones evaluadas. A pesar de las potencialidades farmacéuticas de estos compuestos no se han reportado ensayos clínicos en los que ellos estén implicados.
Compuestos orgánicos que actúan como metabolitos secundarios
Entre los compuestos aislados de cianobacterias que tienen actividad anticancerígena se encuentra las criptoficinas de Nostocsp. Estos macrólidos han demostrado tener actividades citotóxicas por lo que han sido candidatos para quimioterapias por sus propiedades anti-proliferativas. Para el compuesto análogo criptoficina 52 (LY355703) se han realizado ensayos clínicos fase I y fase 2en pacientes de cáncer que reciben quimioterapia34. Estas sustancias químicas están formados por dos unidades de hidroxiácidos y dos aminoacídicas; adicionalmente en estas estructuras están contenidos dos núcleos aromáticos. También pueden estar presentes las funciones químicas epóxido (éter) y halógenos como sustituyentes (Fig.6).
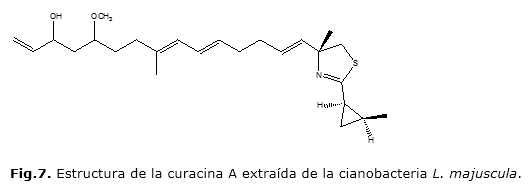
También se ha identificado la curacina A en las preparaciones de L. majuscula35, la que contiene una cadena hidrocarbonada que presenta múltiples insaturaciones, las funciones éter y alcohol, además de un heterociclo de cinco miembros que contiene azufre y nitrógeno, así como un ciclo de tres miembros altamente tensionado (Fig.7).La curacina A o D han sido estructuras en las que la actividad fundamental adjudicada está relacionada con su acción antimitótica mediante la unión a estructuras como las tubulinas35.
La dolastatina 10 extraída de Symplocasp. y la dolastatina 15 obtenida a partir de Lyngbyasp.(Fig.8) son compuestos formadas por residuos de aminoácidos y heterociclos que contienen azufre y nitrógeno que también han mostrado potencialidades para el tratamiento del cáncer36. La somocistinamida A (L. majuscula/Schizothrixsp./Assemblage), una tetramida insaturada también ha demostrado ser un posible fármaco por propiedades anticancerígenas37.
De acuerdo al sitio de registro de ensayos clínicos del NCBI38, para la dolastatina 10 se han realizado alrededor de siete ensayos clínicos para el tratamiento de afecciones como cáncer pancreático, de hígado, próstata, leucemia, y sarcoma metastásico recurrente. A pesar de las actividades biológicas demostradas en la dolastatina 10, existen diferentes estrategias que implican la obtención de otros derivados en los que se potencien estas propiedades citotóxicas36.
En las microalgas también se han detectado otros compuestos que tienen propiedades como antibióticos. Entre ellos se encuentran la noscomina (Fig.9), la cual es extraída de Nostoccommune. Este compuesto es un sistema formado por un núcleo de tres ciclohexanos en la misma disposición que se presentan en el hidrocarburo aromático fenantreno; adicionalmente contiene un grupo fenólico en el que también se encuentra un ácido carboxílico, los que están unidos al sistema tricíclico por un grupo metileno37.
El norbietano (diterpenoide, Fig.9) extraído de Microcoleuslacustris39 y el ambigol C (compuesto aromático policlorado, Fig.10) de Fischerella ambigua40 son otros productos naturales con usos potenciales como antibióticos.
Lípidos
Las cianobacterias y microalgas son organismos en los que también se han caracterizado elevadas cantidades de ácidos grasos poliinsaturados, fundamentalmente en las especies que se encuentran en zonas de temperaturas bajas 41. En especial son de gran interés los ácidos grasos de cadena larga con insaturaciones en las posiciones omega-3 y omega-6, los que en Enteromorpha spp. pueden llegar a constituir hasta el 10,38 % del total de estas biomoléculas42. Entre los lípidos más representados se encuentran el β-caroteno (36-4500 mg/kg), la fucoxantina (hasta el 70 % del contenido total de carotenos) y el tocoferol.
Otros ácidos grasos identificados incluyen el ácido láurico (C12:0), ácido palmítico (C16:0), ácido linolénico (18:3n3), ácido oleico (18 :1) y ácido esteárico (C18:0), los que tienen usos potenciales como antibióticos y como agentes antifúngicos43. También se han podido extraer varios terpenos (algunos halogenados) con propiedades bactericidas, antioxidantes, antimaláricas, insecticidas y citotóxicas a partir del alga Laurenciaokamurai44.
Polifenoles
En varias especies de microalgas se han extraído compuestos polifenólicos, los que tienen propiedades antioxidantes, aunque el contenido de estos está relacionado con el método empleado para la extracción. También los compuestos fenólicos de N. muscorum B. tienen aplicaciones potenciales debido a sus propiedades como antibióticos 45.
Péptidos y proteínas
Las cianobacterias y microalgas contienen niveles elevados de proteínas entre las que se encuentran las que conforman los aparatos fotosintéticos de estos organismos 6. Cada una de las ficobiliproteínas de los fotosistemas está conformada por una cadena polipeptídica y un grupo prostético. Para varias de estas ficobiliproteínas se han reportado propiedades antioxidantes, inmunomoduladoras, antivirales y neuroprotectoras, así como propiedades anticancerígenas asociadas a la inhibición de la proliferación celular y la inducción apoptótica3.
La aloficocianina (APC) (Fig.11A) y C-ficocianina (CPC) (Fig.11B) de varias algas verde-azules, contienen el pigmento ficocianobilina (PCB) (Fig. 13) en proporciones que son diferentes en cada caso. La APC contiene un grupo prostético por cada una de las cadenas que la conforman mientras que la CPC tiene unido un cromóforo en la cadena alfa y dos en la beta.
En estas ficobiliproteínas la PCB se encuentra unida mediante un enlace tioéter a cisteínas específicas de la secuencia aminoacídica. La ubicación de forma general es en el contexto de una cavidad presente en la estructura de estas cadenas polipeptídicas (Fig.11C).
En el contexto de los sistemas biológicos y de las preparaciones obtenidas de estas proteínas se debe tener en cuenta que las estructuras predominantes pudieran corresponder con especies agregadas. En el caso de la CPC el monómero formado por las dos cadenas que conforman esta proteína se pudieran encontrar también en forma de trímero, hexámero o dodecámero. La relación entre estas especies está directamente relacionada con la concentración de proteína en la preparación y con las condiciones del medio entre las que se pueden citar la temperatura, la fuerza iónica y el pH. Sin embargo las formas más representadas son la trimérica y hexamérica 46.
Debido a la naturaleza de la PCB se han adjudicado a este sistema tetrapirrólico varias de las propiedades biológicas encontradas en estas ficobiliproteínas, entre las que se pueden citar los efectos citoprotectores, inmunomoduladores y antioxidantes 47. Sin embargo existen también evidencias que las propiedades anticancerígenas, antioxidantes y apoptóticas pudieran estar relacionadas con las cadenaspolipeptídicas48.
La ficoeritrina es otro de los componentes de los fotosistemas que contiene el tetrapirroleritrina, aunque también puede estar presente el grupo prostético ficourobilina (Fig. 12).
Las estructuras de estos dos pigmentos que contienen insaturaciones conjugadas también son semejantes a la PCB (Fig.12C/D), por lo que sería posible que algunas de las propiedades de las ficobiliproteínas sean comunes debido a la semejanza existente en los grupos prostéticos.
La ficoeritrocianinaes también otro de los componentes de los ficobilisomas2. La estructura está formada por dos cadenas polipeptídicas que tienen unidos grupos prostéticos que contienen insaturaciones conjugadas (Fig.13).
La cianovirina-N (Fig.14A)extraída de N. ellipsosporum, tiene actividad antiviral contra HIV-1, HIV-2, HSV-6, Mesles, SIV y FIV.Otro compuesto con propiedades antivirales contra HIV-1 es la escitovirina N, compuesto químico que es aislado de Scytonemavarium. Esta estructura presenta determinadas semejanzas con la cianovirina-N, pero de forma general los elementos de estructura secundaria (hoja beta) están menos representados en la escitovirina N (Fig.14B).También se han identificado varios inhibidores de proteasas como la quimotripsina, tripsina, elastasa. Entre estos moduladores de la actividad proteolítica se pueden citar a Cianopeptolina 963 A (Microcystis), Cianopeptolina 954 (Microcystisaeruginosa), Lingbiastatina 5-7 (Lyngbyasp.), Lingbiastatina 4 (Lyngbyaconfervoides), Simplocamida A ( Symplocasp.) y Planktociclina (Planktothrixrubescens) 37.
La inhibición por Lingbiastatina 7 de la elastasa porcina presumiblemente está asociada a un mecanismo que no implica el centro activo de la enzima, ya que la unión del inhibidor ocurre en una región que se encuentra en una posición contraria a los grupos de la enzima involucrados en la acción catalítica (Fig.15).
Pigmentos de naturaleza no proteica
Estos compuestos se pueden dividir en dos grupos fundamentales: (1) clorofilas y (2) carotenoides 49.Las clorofilas son sustancias químicas de color verde que se pueden encontrar en varias especies de cianobacterias, así como en los cloroplastos de algas y plantas.Están formadas por un sistema tetrapirrólico en el que se identifican insaturaciones conjugadas. Este sistema puede complejar un metal como los iones magnesio. También aparecen otros grupos funcionales como pueden ser los ésteres de ácidos carboxílicos (Fig.16A).Aunque una de las formas más comunes de la clorofila es la Clorofila a también se pueden encontrar otras variantes estructurales como la Clorofila b, Clorofila c1, Clorofila c2, Clorofila d y Clorofila f.Los carotenoides son compuestos orgánicos hidrofóbicos e insaturados que se encuentran fundamentalmente en los cloroplastos y los cromoplastos de las microalgas. Estas sustancias tienen propiedades oxidantes, que dependen de su estructura así como de la fuente de donde son extraídos50. Estos lípidos son estructuras del tipo tetraterpenoide, con una disposición del esqueleto hidrocarbonado semejante a la encontrada en el alfa-caroteno (Fig.16B).
En conclusión, las microalgas y cianobacterias son sistemas biológicos en los que se pueden caracterizar productos con actividades biológicas que los hacen candidatos terapéuticos para el tratamiento de diferentes enfermedades asociadas a procesos infecciosos, inmunes, etc. Por otra parte son fuentes de sustancias con elevado valor en otras industrias entre la que se incluye la alimenticia, debido a los valores nutricionales de los componentes que se encuentran en estos sistemas biológicos, los que pueden variar en función de la especie de la microalga, así como de la localización y las condiciones en las que se desarrollan estos microorganismos. Debido a las potencialidades de estos productos para varios de ellos se han realizado ensayos en líneas celulares, en modelos animales e incluso ensayos clínicos. Sin embargo los estudios realizados con algunas de estas sustancias extraídas de estas fuentes naturales deben seguir su desarrollo hasta la obtención de un producto que pueda ser comercializado.
Referencias bibliográficas
1. Colla, L. M., Oliveira Reinehr, C., Reichert, C. & Costa, J. A. V. Production of biomass and nutraceutical compounds by Spirulina platensis under different temperature and nitrogen regimes. Bioresour. Technol.98, 1489-1493 (2007).
2. Sekar, S. & Chandramohan, M. Phycobiliproteins as a commodity: trends in applied research, patents and commercialization. J. Appl. Phycol.20, 113-136 (2008).
3. Singh, R. K., Tiwari, S. P., Rai, A. K. & Mohapatra, T. M. Cyanobacteria: an emerging source for drug discovery. J. Antibiot. (Tokyo).64, 401-412 (2011).
4. Spolaore, P. & Joannis-Cassan, C. Commercial applications of microalgae. J. Biosci. …101, 87-96 (2006).
5. Volk, R.-B. & Furkert, F. H. Antialgal, antibacterial and antifungal activity of two metabolites produced and excreted by cyanobacteria during growth. Microbiol. Res.161, 180-186 (2006).
6. Babadzhanov, a. S. et al. Chemical Composition of Spirulina platensis Cultivated in Uzbekistan. Chem. Nat. Compd.40, 276-279 (2004).
7. Rohani-Ghadikolaei, K., Abdulalian, E. & Ng, W.-K. Evaluation of the proximate, fatty acid and mineral composition of representative green, brown and red seaweeds from the Persian Gulf of Iran as potential food and feed resources. J. Food Sci. Technol.49, 774-80 (2012).
8. Chojnacka, K. Biologically Active Compounds in Seaweed Extracts - the Prospects for the Application. Open Conf. Proc. J.3, 20-28 (2012).
9. Chem Draw. No Title. at <www.cambridgesoft.com/software/ChemDraw/>
10. Pettersen, E. F. et al. UCSF Chimera--a visualization system for exploratory research and analysis. J. Comput. Chem. 25, 1605-12 (2004).
11. Leonard, S. G. et al. The effects of supplementing the diet of the sow with seaweed extracts and fish oil on aspects of gastrointestinal health and performance of the weaned piglet. Livest. Sci.134, 135-138 (2010).
12. Ghosh, T. et al. Focus on antivirally active sulfated polysaccharides: From structure-activity analysis to clinical evaluation. Glycobiology19, 2-15 (2008).
13. Vidanarachchi, J. K., Iji, P. A., Mikkelsen, L. L., Sims, I. & Choct, M. Isolation and characterization of water-soluble prebiotic compounds from Australian and New Zealand plants. Carbohydr. Polym.77, 670-676 (2009).
14. Ferreira, L. G. et al. Chemical structure of the complex pyruvylated and sulfated agaran from the red seaweed Palisada flagellifera (Ceramiales, Rhodophyta). Carbohydr. Res.347, 83-94 (2012).
15. Fitton, J. H., Stringer, D. N. & Karpiniec, S. S. Therapies from Fucoidan: An Update. Mar. Drugs13, 5920-46 (2015).
16. Ustyuzhanina, N. E. et al. Fucoidans: pro- or antiangiogenic agents? Glycobiology24, 1265-74 (2014).
17. Wang, W., Wang, S.-X. & Guan, H.-S. The antiviral activities and mechanisms of marine polysaccharides: an overview. Mar. Drugs10, 2795-816 (2012).
18. Irhimeh, M. R., Fitton, J. H. & Lowenthal, R. M. Pilot clinical study to evaluate the anticoagulant activity of fucoidan. Blood Coagul. Fibrinolysis20, 607-10 (2009).
19. Irhimeh, M. R., Fitton, J. H. & Lowenthal, R. M. Fucoidan ingestion increases the expression of CXCR4 on human CD34+ cells. Exp. Hematol.35, 989-94 (2007).
20. Hernández-Corona, D. M., Martínez-Abundis, E. & González-Ortiz, M. Effect of fucoidan administration on insulin secretion and insulin resistance in overweight or obese adults. J. Med. Food17, 830-2 (2014).
21. Jiao, G., Yu, G., Zhang, J. & Ewart, H. S. Chemical structures and bioactivities of sulfated polysaccharides from marine algae. Mar. Drugs9, 196-233 (2011).
22. Rocha, H. a O. et al. Structural and hemostatic activities of a sulfated galactofucan from the brown alga Spagtoglossum schroederi: An ideal antithrombotic agent? J. Biol. Chem.280, 41278-41288 (2005).
23. Synytsya, A. et al. Structure and antitumour activity of fucoidan isolated from sporophyll of Korean brown seaweed Undaria pinnatifida. Carbohydr. Polym.81, 41-48 (2010).
24. Ahmadi, A., Zorofchian Moghadamtousi, S., Abubakar, S. & Zandi, K. Antiviral Potential of Algae Polysaccharides Isolated from Marine Sources: A Review. Biomed Res. Int.2015, 1-10 (2015).
25. Kadam, S. U., Tiwari, B. K. & O'Donnell, C. P. Extraction, structure and biofunctional activities of laminarin from brown algae. Int. J. Food Sci. Technol.50, 24-31 (2015).
26. Kadam, S. U., Tiwari, B. K. & O'Donnell, C. P. Extraction, structure and biofunctional activities of laminarin from brown algae. Int. J. Food Sci. Technol.50, 24-31 (2015).
27. Rioux, L.-E., Turgeon, S. L. & Beaulieu, M. Structural characterization of laminaran and galactofucan extracted from the brown seaweed Saccharina longicruris. Phytochemistry71, 1586-95 (2010).
28. Choi, J., Kim, H.-J. & Lee, J.-W. Structural feature and antioxidant activity of low molecular weight laminarin degraded by gamma irradiation. Food Chem.129, 520-523 (2011).
29. Lee, K. Y. & Mooney, D. J. Alginate: Properties and biomedical applications. Prog. Polym. Sci.37, 106-126 (2012).
30. Aliste, A. J., Vieira, F. F. & Del Mastro, N. L. Radiation effects on agar, alginates and carrageenan to be used as food additives. Radiat. Phys. Chem.57, 305-308 (2000).
31. LEE, J.-B. et al. Effects of Structural Modification of Calcium Spirulan, a Sulfated Polysaccharide from Spirulina Platensis, on Antiviral Activity. Chem. Pharm. Bull. (Tokyo).49, 108-110 (2001).
32. Kanekiyo, K. et al. Isolation of an antiviral polysaccharide, nostoflan, from a terrestrial cyanobacterium, Nostoc flagelliforme. J. Nat. Prod.68, 1037-41 (2005).
33. Tsai, C.-J. & Sun Pan, B. Identification of sulfoglycolipid bioactivities and characteristic fatty acids of marine macroalgae. J. Agric. Food Chem.60, 8404-10 (2012).
34. D'Agostino, G. et al. A multicenter phase II study of the cryptophycin analog LY355703 in patients with platinum-resistant ovarian cancer. Int. J. Gynecol. Cancer16, 71-6
35. Wipf, P., Reeves, J. T. & Day, B. W. Chemistry and biology of curacin A. Curr. Pharm. Des.10, 1417-37 (2004).
36. Maderna, A. et al. Discovery of cytotoxic dolastatin 10 analogues with N-terminal modifications. J. Med. Chem. 57, 10527-43 (2014).
37. Singh, S., Kate, B. N. & Banerjee, U. C. Bioactive compounds from cyanobacteria and microalgae: an overview. Crit. Rev. Biotechnol.25, 73-95 (2005).
38. Ensayos Clínicos del NCBI. Disponible en: https://clinicaltrials.gov
39. Bui, H. T. N., Jansen, R., Pham, H. T. L. & Mundt, S. Carbamidocyclophanes A-E, chlorinated paracyclophanes with cytotoxic and antibiotic activity from the Vietnamese cyanobacterium Nostoc sp. J. Nat. Prod.70, 499-503 (2007).
40. Lal, P. et al. Biofilm formation by Candida albicans isolated from intrauterine devices. Indian J. Microbiol.48, 438-44 (2008).
41. Holdt, S. L. & Kraan, S. Bioactive compounds in seaweed: functional food applications and legislation. J. Appl. Phycol. 23, 543-597 (2011).
42. Aguilera-Morales, M., Casas-Valdez, M., Carrillo-Domı́nguez, S., González-Acosta, B. & Pérez-Gil, F. Chemical composition and microbiological assays of marine algae Enteromorpha spp. as a potential food source. J. Food Compos. Anal.18, 79-88 (2005).
43. Bhagavathy, S., Sumathi, P. & Jancy Sherene Bell, I. Green algae Chlorococcum humicola-a new source of bioactive compounds with antimicrobial activity. Asian Pac. J. Trop. Biomed.1, S1-S7 (2011).
44. MAO, S.-C. & GUO, Y.-W. Sesquiterpenes from Chinese Red Alga Laurencia okamurai. Chin. J. Nat. Med.8, 321-325 (2010).
45. El-Sheekh, M. M., Osman, M. E. H., Dyab, M. A. & Amer, M. S. Production and characterization of antimicrobial active substance from the cyanobacterium Nostoc muscorum. Environ. Toxicol. Pharmacol.21, 42-50 (2006).
46. MacColl, R., Lee, J. J. & Berns, D. S. Protein aggregation in C-phycocyanin. Studies at very low concentrations with the photoelectric scanner of the ultracentrifuge. Biochem. J.122, 421-6 (1971).
47. Marín-Prida, J. et al. Phycocyanobilin promotes PC12 cell survival and modulates immune and inflammatory genes and oxidative stress markers in acute cerebral hypoperfusion in rats. Toxicol. Appl. Pharmacol.272, 49-60 (2013).
48. Wang, H., Liu, Y., Gao, X., Carter, C. L. & Liu, Z.-R. The recombinant beta subunit of C-phycocyanin inhibits cell proliferation and induces apoptosis. Cancer Lett.247, 150-8 (2007).
49. Chojnacka, K. Biologically Active Compounds in Seaweed Extracts - the Prospects for the Application. Open Conf. Proc. J. 3, 20-28 (2012).
50. Li, Y.-X. & Kim, S.-K. Utilization of seaweed derived ingredients as potential antioxidants and functional ingredients in the food industry: An overview. Food Sci. Biotechnol.20, 1461-1466 (2011).
Recibido: 20 de diciembre de 2015.
Aprobado: 17 de febrero de 2016.
Aprobado: 17 de febrero de 2016.
Licenciado en Bioquímica. Máster en Biotecnología Mención Investigación de nuevos productos. Quito, Ecuador.
Facultad de Ingeniería y Ciencias Agropecuarias. Universidad de Las Américas. Quito, Ecuador.
Autor de correspondencia: AlexeyLlopiz. Email: [email protected].