2023.08.01.48
Files > Volume 8 > Vol 8 No 1 2023
Farmacovigilancia de los efectos asociados a la vacunación contra el SARS-CoV-2 en el personal sanitario de un hospital de atención exclusiva de pacientes con COVID-19
Pharmacovigilance of the effects associated with vaccination against SARS-CoV-2 in the health personnel of a hospital for the exclusive care of patients with COVID-19
Jorge Luis Vélez-Páez1,2 , Yuan Kuonqui-Vera1,3
, Yuan Kuonqui-Vera1,3 , Juan-Pablo Castelo1,4
, Juan-Pablo Castelo1,4 , Gabriela Rivadeneira-Bonifaz1,4, Cristina Chango-Salas1,5, Jhoana Parreño1,3, Cristina Barriga1,5.
, Gabriela Rivadeneira-Bonifaz1,4, Cristina Chango-Salas1,5, Jhoana Parreño1,3, Cristina Barriga1,5.
1. Hospital Pablo Arturo Suárez, Comisión Técnica de Farmacovigilancia, Quito-Ecuador.
2. Unidad de Cuidado Crítico, Hospital Pablo Arturo Suárez, Quito-Ecuador.
3. Departamento de Medicina Interna, Hospital Pablo Arturo Suárez, Quito-Ecuador.
4. Departamento de Farmacia Institucional, Hospital Pablo Arturo Suárez, Quito-Ecuador.
5. Enfermeras de Hospital Pablo Arturo Suárez, Quito-Ecuador.
Autor corresponsal: Dr. Jorge Luis Vélez Páez. Medical Science School – Central University of Ecuador Iquique N14-121 y Sodiro – Itchimbía, El Dorado. Telephone: (593-02) 2528 690 E-mail: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.01.48
RESUMEN
El Hospital Pablo Arturo Suárez, ubicado en Quito, la capital de Ecuador, se convirtió en un hospital de atención exclusiva para pacientes COVID-19 desde marzo de 2020, y fue uno de los primeros centros en inmunizar a su personal con un solo tipo de vacuna, la de Pfizer-BioNTech.
Se realizó un estudio de farmacovigilancia en 1304 trabajadores sanitarios de este centro que fueron inmunizados entre enero y marzo del 2021. Los vacunados tuvieron una media de edad de 38,7 años y predominó el sexo femenino (63%). Reportaron efectos adversos 81 (6%) inmunizados, su media de edad fue de 38,8 años y predominaron las mujeres (69%), similar a la población total. Se reportaron 305 efectos adversos relacionados a las vacunas, de ellos, solo 1 (0,3%) fue grave y requirió hospitalización, el resto (23%) fueron no graves. La cefalea, el malestar general, el dolor en el sitio de inyección fueron los efectos más reportados.
Los resultados obtenidos muestran un paralelismo de lo reportado a nivel mundial sobre la seguridad de las vacunas contra el COVID-19 en general y la Pfizer-BioNTech en particular. La relevancia de nuestro trabajo radica en que es uno de los primeros reportes de reactogenicidad de esta vacuna en una ciudad de altitud a inicios de la pandemia, en una corte de personal sanitario directamente dedicado a la atención de este tipo de pacientes.
Palabras clave: Farmacovigilancia, virus del SARS, vacunación masiva. (Fuente: DeCS-BIREME)
ABSTRACT
The Pablo Arturo Suárez Hospital, located in Quito, the capital of Ecuador, became an exclusive care hospital for COVID-19 patients in March 2020. It was one of the first centers to immunize its staff with a single type of vaccine, that of Pfizer-BioNTech. A pharmacovigilance study was conducted on 1304 health workers from this center who were immunized between January and March 2021. The vaccinated had an average age of 38.7 years, and the female sex predominated (63%). 81 (6%) immunized reported adverse effects, and their mean age was 38.8 years; women (69%) predominated, similar to the total population. Three hundred five adverse effects related to vaccines were reported; of them, only 1 (0.3%) was severe and required hospitalization, and the rest (23%) were non-serious. The most reported effects were headache, malaise, and pain at the injection site. The results show a parallel with what has been said worldwide on the safety of vaccines against COVID-19 in general and Pfizer-BioNTech in particular. The relevance of our work lies in the fact that it is one of the first reports of the reactogenicity of this vaccine in a high-altitude city at the beginning of the pandemic, in a court of health personnel directly dedicated to the care of this type of patient.
Keywords: Pharmacovigilance, SARS virus, mass vaccination. (Source: MeSH-NLM)
INTRODUCCIÓN
El 31 de diciembre de 2019 en Wuhan-China se reportó algunos casos de una neumonía atípica que no fue causada por ningún agente etiológico usual1. Se descubrió un nuevo agente viral, un coronavirus beta, que se designó como coronavirus del síndrome respiratorio agudo severo tipo 2 (SARS-CoV-2)2. La OMS lo proclamó pandemia el 11 de marzo de 2020, y la enfermedad provocada por este virus se denominó COVID-193. Las tasas de mortalidad por COVID-19 fueron considerablemente altas en América Latina, una región con niveles notables de desigualdad socioeconómica, especialmente entre los pobres4. Los recursos financieros limitados en los sistemas de salud y las pruebas de diagnóstico insuficientes hicieron que el control de los brotes de enfermedades a nivel comunitario fuera una tarea ardua, lo que resultó en un alto número de ingresos hospitalarios a las unidades de cuidados intensivos5.
La creación de una vacuna avanzó de manera vertiginosa y la aprobación para el inicio de la fase 4 de las vacunas candidatas contra el SARS-CoV-2 por parte de agencias nacionales e internacionales de regulación, masificó la distribución y administración de las mismas a nivel mundial, con la aparición de efectos adversos no observados en las fases previas. Trombosis autoinmune, síndrome de Guillain-Barré, entre otros, fueron eventos notificados4,5.
La farmacovigilancia, es una rama de la farmacología que estudia las relaciones causales de los eventos adversos asociados a fármacos y vacunas, que ha tomado importancia fundamental notificando e investigando las reacciones presentadas posvacunales en tiempos de inmunizaciones contra el COVID-19 a gran escala6.
El Hospital Pablo Arturo Suárez, ubicado en Quito, la capital de Ecuador se convirtió en un hospital de atención exclusiva para pacientes COVID-19 desde marzo de 20207, y fue uno de los primeros centros en inmunizar a su personal con un solo tipo de vacuna, la de Pfizer-BioNTech.
En el presente trabajo, mostramos las características epidemiológicas y la incidencia basada en el reporte de efectos adversos relacionados con la vacuna de Pfizer-BioNTech contra el SRAS-CoV-2, en el personal sanitario de este centro, hasta dónde sabemos éste es uno de los primeros reportes de reactogenicidad de esta vacuna, en una ciudad e altitud, a inicios de la pandemia, en una corte de personal sanitario directamente dedicado a la atención de éste tipo de pacientes.
MATERIALES Y METODOS
Lugar
El estudio se realizó en el Hospital Pablo Arturo Suárez, exclusivo para la atención de COVID-19 en Quito-Ecuador.
Diseño del estudio
Estudio de cohorte retrospectivo, con datos secundarios tomados de una base de datos de vigilancia clínica epidemiológica de las personas inmunizadas en el hospital.
Población y tamaño de la muestra
Se incluyó en el estudio a todos los pacientes adultos que fueron inmunizados con la vacuna de Pfizer-BioNTech (única vacuna administrada), desde el 21 de enero hasta el 19 de marzo del 2021.
Criterios de inclusión
Se incluyó en el estudio a todos los pacientes adultos que recibieron las dos dosis completas de la vacuna Pfizer-BioNTech.
Criterio de exclusión
Se excluyeron a los pacientes no inmunizados.
Variables y medidas
Nuestro equipo revisó los registros electrónicos de todos los pacientes vacunados y las fichas de reportes de eventos adversos relacionados con la inmunización y se obtuvo las variables edad, sexo, comorbilidades, efectos adversos reportados.
Análisis estadístico
Realizamos un análisis estadístico descriptivo completo, valores absolutos y relativos de cada variable cualitativa y medidas de tendencia central para las variables cuantitativas.
Consideraciones éticas
De acuerdo con los principios bioéticos locales de la investigación en humanos, los datos anonimizados y no identificables de los registros clínicos, excluidos los informes de casos, no requieren la aprobación de las juntas de revisión internas.
RESULTADOS
Se analizó a 1304 pacientes que fueron inmunizados, tuvieron una media de edad de 38,7 años y predominó el sexo femenino (63%). Reportaron efectos adversos 81 (6%) inmunizados, su media de edad fue de 38,8 años y predominaron las mujeres (69%), similar a la población total. (Tabla 1)
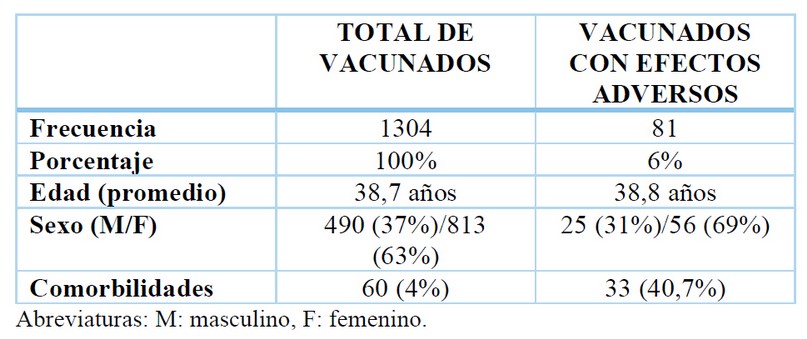
Tabla 1. Características básicas de la población vacunada y que reportó efectos adversos.
En cuanto a las comorbilidades, 60 pacientes (4%) del total de inmunizados declararon enfermedades preexistentes, la hipertensión arterial fue la más prevalente, seguida de la diabetes y trastornos tiroideos. (Tabla 2)
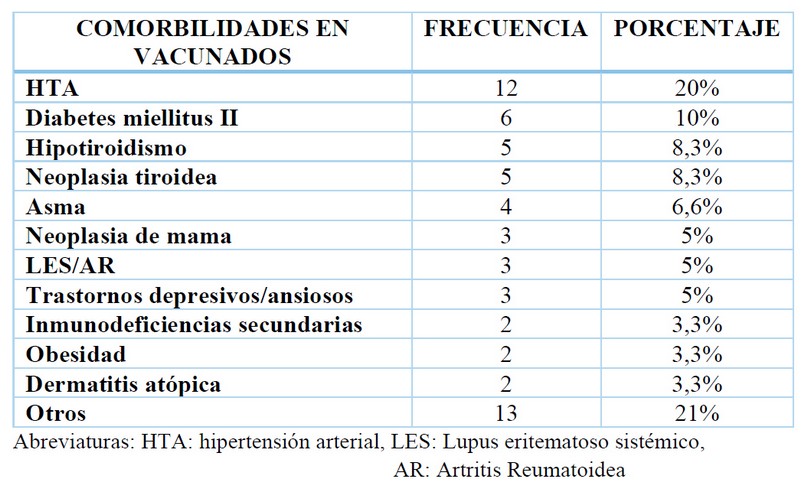
Tabla 2. Comorbilidades en pacientes vacunados
En los pacientes vacunados que reportaron efectos adversos, cuatro de cada 10 (40%) tenían comorbilidades, la HTA, la patología tiroidea como el hipotiroidismo y las neoplasias tiroideas; el lupus eritematoso sistémico y la diabetes fueron las enfermedades preexistentes más frecuentes.
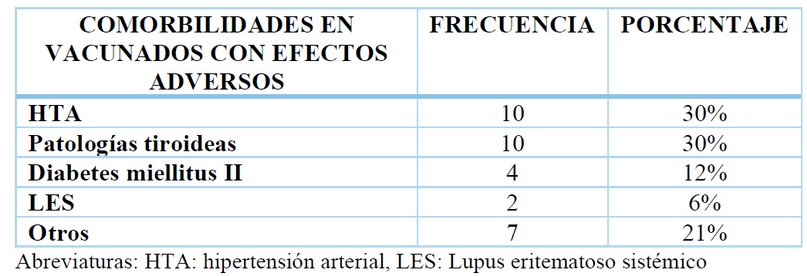
Tabla 3. Comorbilidades en los pacientes vacunados que reportaron efectos adversos.
Se reportaron 305 efectos adversos relacionados a las vacunas en 81 pacientes, de ellos, solo 1 (0,3%) fue grave y requirió hospitalización, el resto (23%) fueron no graves. La cefalea, el malestar general, el dolor en el sitio de inyección, la fiebre y las artralgias fueron los más frecuentes reportados. (Tabla 4)
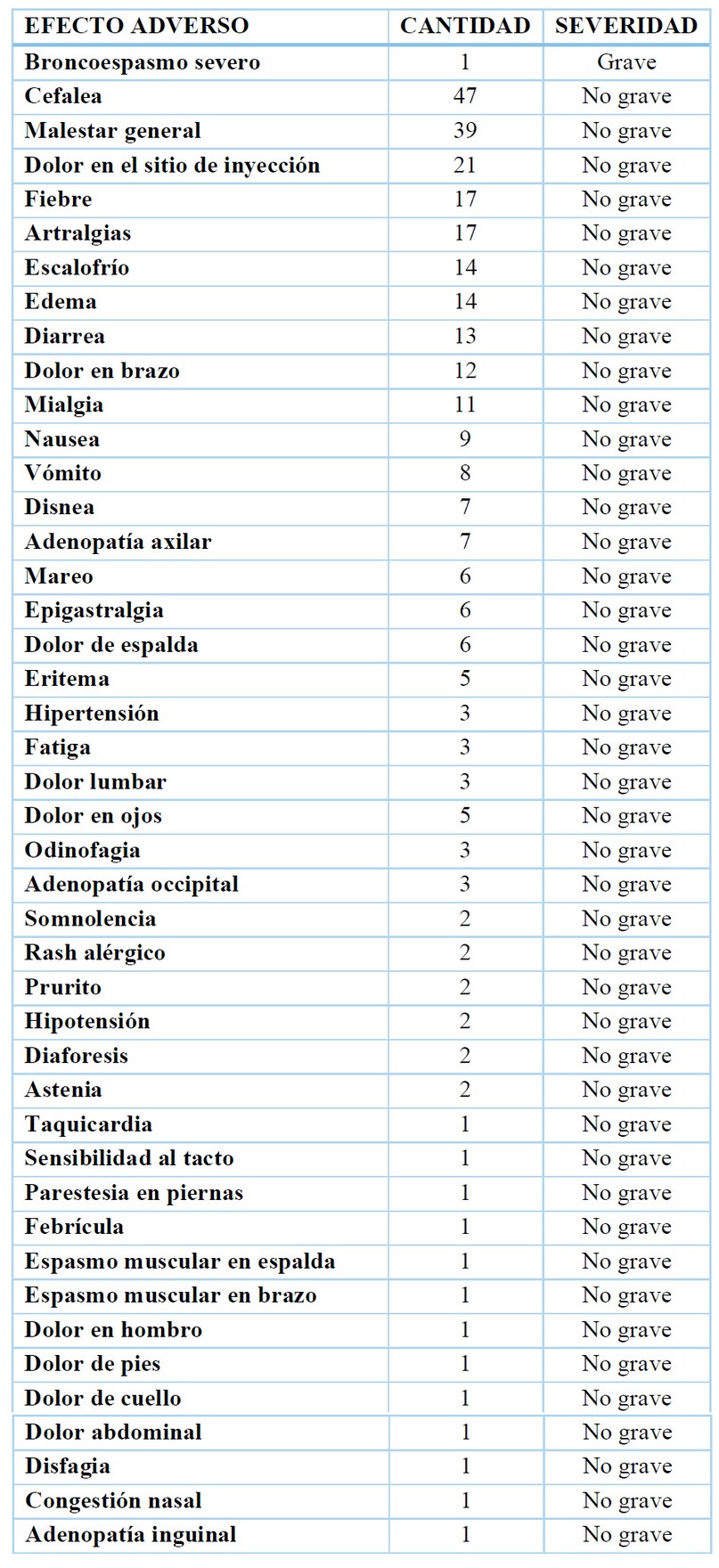
Tabla 4. Frecuencia y gravedad de los efectos adversos reportados en los pacientes vacunados.
DISCUSIÓN
El personal sanitario inmunizado del Hospital Pablo Arturo Suárez es en promedio adulto joven, con predominio del sexo femenino similar a reportes de Argentina donde el promedio de edad fue de 40 años y de igual manera predominó el sexo femenino con 68%8, difiere de un gran estudió israelí realizado en población general sobre seguridad de la vacuna donde de 1,736,832 personas fueron inmunizadas con una edad promedio de 38 años, con ligero predominio del sexo masculino9.
Las comorbilidades en el presente estudio fueron bastante bajas (4%), en comparación con otros estudios realizados en población general en las que se encontró una condición mórbida preexistente entre el 23 hasta el 44%8–12. Sin embargo, la presencia de enfermedades preexistentes en los inmunizados que reportaron efectos adversos en nuestra serie fue alta (40%), aunque no podemos afirmar una relación causal.
Ochenta y un pacientes reportaron efectos adversos (6%), un porcentaje bajo comparado con Israel, dónde se notificó 70% de reacciones9 o si comparamos con otras vacunas como la Novavax que llegó hasta el 79%11; pero alto, al compararlo con el reporte de farmacovigilancia realizado en Estados Unidos con la vacuna Pfizer en la población general en casi dos millones de receptores, en dónde, solo 4393 (0,2%) reportaron dichos eventos al VAERS (Vaccine Event Report System)13. La posibilidad de un subregistro de notificaciones en nuestro estudio existe, ya que, al tratarse de personal sanitario, es posible, que se hayan automedicado sin buscar otro tipo de atención.
Los efectos adversos más frecuentes en nuestra serie fueron cefalea, malestar general, dolor en el sitio de la inyección, fiebre y artralgias, similares a los indicados por el fabricante, pero diferentes a otras series como la estudiada en Israel, en dónde, se observó frecuentemente linfadenopatías, parestesias, síncope e infección por herpes zóster9; por otro lado, se encuentran coincidencias con los reportes de la vacuna Novavax, en dónde, los eventos más frecuentes fueron dolor en el sitio de la inyección, cefalea, mialgias y fatiga12. Consideramos que la heterogeneidad de los reportes tiene casusas multifactoriales como la vacuna utilizada, la etnia, el tipo de población y la no notificación de los mismos, entre otros.
Solo un evento adverso grave fue reportado en nuestro estudio (0,07%), un episodio de broncoespamo severo, que requirió hospitalización. A diferencia de otras series, como la de Estados Unidos con las vacunas de ARN, en dónde las reacciones alérgicas eran lo más notificado, reportándose 22 casos de anafilaxia en casi 2 millones de vacunados y ninguno requirió hospitalización13, y la de Israel, en donde el evento adverso grave más frecuente fue la miocarditis13 que tuvo hasta el triple de riesgo de presentar esta complicación en el grupo vacunado. En nuestra población no fue reportado ninguna complicación cardiaca, los autores de dicha publicación israelí sugieren que se presentó con más frecuencia en hombres jóvenes, en nuestro estudio el rango de edad fue bastante similar, sin embargo, no se registró dicha complicación; existió una persona en nuestra serie que presentó taquicardia que se resolvió espontáneamente, pero no tenemos datos si existió evaluación médica para descartar asociación con miocarditis.
CONCLUSIÓN
Hay varios estudios que se han publicado sobre factores de riesgo y biomarcadores de mortalidad en pacientes con COVID-19 que habitan en altitud 14-20; sin embargo, éste estudio es relevante ya que es uno de los primeros reportes sobre la reactogenicidad de la vacuna de Pfizer-Biontech, en una población específica que habita en elevada altitud a inicios de la pandemia por SARS-CoV-2. La farmacovigilancia de la inmunización con esta vacuna en nuestro centro de atención COVID-19 exclusivo, arrojó un porcentaje de 6% de eventos adversos, la mayoría leves y sin ningún evento fatal lo que habla de la seguridad de las vacunas de ARN mensajero.
REFERENCIAS
1. International Society for Infectious Diseases. PRO/AH/EDR> COVID-19 update (59): global, cruise ship. WHO [Internet]. 2020 [cited 2022 Jun 13]. Available from: https://promedmail.org/promed-post/?id=20200813.7673720
2. Coronavirus disease (COVID-19) [Internet]. [cited 2022 Jun 13]. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-2019/question-and-answers-hub/q-a-detail/coronavirus-disease-covid-19
3. COVID-19: cronología de la actuación de la OMS [Internet]. [cited 2022 Jun 13]. Available from: https://www.who.int/es/news/item/27-04-2020-who-timeline---covid-19
4. Ortiz-Prado E, Cevallos-Sierra G, Henriquez-Trujillo A, Lowe R, Lister A. COVID-19 in Latin America [Internet]. 2020. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-
5. Decerf B, Ferreira FHG, Mahler DG, Sterck O. Lives and livelihoods: Estimates of the global mortality and poverty effects of the Covid-19 pandemic. World Development. 2021 Oct 1;146.
6. Sáenz-López J, Sierra Rodríguez M, García Salcedo J. Predictores se Mortalidad en Pacientes con COVID-19Mortality Predictors in Patients with COVID-19. Archivos de Medicina [Internet]. 2020 May 20;16(2):6. Available from: www.archivosdemedicina.com
7. Ecuador, El Comercio. «Dos hospitales atienden casos de covid-19 en Quito». El Comercio Ecuador. Consultado el 31 de marzo de 2020.
8. Tortosa F, Parodi V, Carrasco G, et al. Estudio de seroprevalencia en personal de salud: Relación de la vacunación con la presencia de infección previa por SARS- COV-2 en el contexto de la campaña nacional de vacunación para coronavirus luego de la primera dosis Gam-COVID-VAc (Sputnik-V). Scielo pre-prints. Published online 2021. https://doi.org/10.1590/SciELOPreprints.1790
9. Barda N, Dagan N, Ben-Shlomo Y, et al. Safety of the BNT162b2 mRNA Covid-19 Vaccine in a Nationwide Setting. N Engl J Med. 2021;385(12):1078-1090. doi:10.1056/nejmoa2110475
10. Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383(27):2603-2615. doi:10.1056/nejmoa2034577
11. Heath PT, Galiza EP, Baxter DN, et al. Safety and Efficacy of NVX-CoV2373 Covid-19 Vaccine. N Engl J Med. 2021;385(13):1172-1183. doi:10.1056/nejmoa2107659
12. Luzuriaga JP, Marsico F, Garcia E, et al. Impacto de la aplicación de vacunas contra COVID-19 sobre la incidencia de nuevas infecciones por SARS-COV-2 en PS de la Provincia de Buenos Aires. Scielo. Published online 2021:1-13. https://preprints.scielo.org/index.php/scielo/preprint/view/2068/3406
13. Shimabukuro T, Nair N. Allergic Reactions including Anaphylaxis after Receipt of the First Dose of Pfizer-BioNTech COVID-19 Vaccine. JAMA - J Am Med Assoc. 2021;325(8):780-781. doi:10.1001/jama.2021.0600
14. Campos A, Scheveck B, Parikh J, Hernandez-Bojorge S, Terán E, Izurieta R. Effect of altitude on COVID-19 mortality in Ecuador: an ecological study. BMC Public Health. 2021 Dec 1;21(1).
15. Simbaña-Rivera K, Morocho Jaramillo PR, Velastegui Silva J v., Gómez-Barreno L, Ventimilla Campoverde AB, Novillo Cevallos JF, et al. High-altitude is associated with better short-term survival in critically ill COVID-19 patients admitted to the ICU. PLoS ONE. 2022 Mar 1;17(3 March).
16. Jibaja M, Roldan-Vasquez E, Rello J, Shen H, Maldonado N, Grunauer M, et al. Effect of High Altitude on the Survival of COVID-19 Patients in Intensive Care Unit: A Cohort Study. Journal of Intensive Care Medicine. 2022 May 9;088506662210998. Ç
17. Vélez-Paez, J.L.; Montalvo, M.P.; Jara, F.E.; Aguayo-Moscoso, S.; Tercero-Martínez, W.; Saltos, L.S.; Jiménez-Alulima, G.; Irigoyen-Mogro, E.; Castro-Reyes, E.; Mora-Coello, C.; et al. Predicting Mortality in Critically Ill Patients with COVID-19 in the ICU from a Secondary-Level Hospital in Ecuador. Revista Bionatura 2022.
18. Ortiz-Prado E, Cevallos-Sierra G, Henriquez-Trujillo A, Lowe R, Lister A. COVID-19 in Latin America [Internet]. 2020. Available from: https://www.who.int/emergencies/diseases/novel-coronavirus-
19. Ortiz-Prado E, Fernandez Naranjo RP, Vasconez E, Simbaña-Rivera K, Correa-Sancho T, Lister A, et al. Analysis of Excess Mortality Data at Different Altitudes during the COVID-19 Outbreak in Ecuador. High Altitude Medicine and Biology. 2021 Dec 1;22(4):406–16.
20. Vélez-Páez JL, Tercero-Martínez W, Jiménez-Alulima G, Navarrete-Domínguez J, Cornejo-Loor L, Castro-Bustamante C, Cabanillas-Lazo M, Barboza JJ, Rodriguez-Morales AJ. Neutrophil-to-lymphocyte ratio and mean platelet volume in the diagnosis of bacterial infections in COVID-19 patients. A preliminary analysis from Ecuador. Infez Med 2021; 29(4):530-537. https://doi.org/10.53854/liim-2904-5 PMID: 35146361
Received: December 23, 2022 / Accepted: January 30, 2023 / Published:15 February 2023
Citation: Vélez-Páez J L, Kuonqui-Vera Y, Castelo J P, Rivadeneira-Bonifaz G, Chango-Salas C, Parreño J, Barriga C. Farmacovigilancia de los efectos asociados a la vacunación contra el SARS-CoV-2 en el personal sanitario de un hospital de atención exclusiva de pacientes con COVID-19. Revis Bionatura 2023;8 (1) 48. http://dx.doi.org/10.21931/RB/2023.08.01.48
