2023.08.01.13
Files > Volume 8 > Vol 8 No 1 2023
Estudio de la variabilidad en el tiempo y espacio de la actividad antioxidante y composición bioquímica de Kappaphycus alvarezii en diferentes densidades de siembra
Study of the variability in time and space of the antioxidant activity and biochemical composition of Kappaphycus alvarezii at different stocking densities
Estefany Lema Ch 1* , Iván Chóez-Guaranda 2
, Iván Chóez-Guaranda 2 , Omar Ruíz-Barzola 3
, Omar Ruíz-Barzola 3 , Lorena I. Jaramillo 4, Ángela Pacheco Flores de Valgaz1,5
, Lorena I. Jaramillo 4, Ángela Pacheco Flores de Valgaz1,5 , Sofie Van Den Hende 6
, Sofie Van Den Hende 6 and Patricia Manzano Santana1, 2, 3
and Patricia Manzano Santana1, 2, 3
1 Facultad de Ciencias de la Vida (FCV); Campus Gustavo Galindo; Escuela Superior Politécnica del Litoral; Km. 30.5 vía Perimetral; Guayaquil P.O. Box 09-01-5863; Ecuador; [email protected]. ; [email protected].
2 Centro de Investigaciones Biotecnológicas del Ecuador (CIBE), Campus Gustavo Galindo; Km 30.5 vía Perimetral; Guayaquil P.O. Box 09-01-5863; Ecuador; [email protected].; [email protected],ec.
3 Facultad de Ciencias Naturales y Matemáticas (FCNM); Campus Gustavo Galindo; Escuela Superior Politécnica del Litoral (ESPOL), Km. 30.5 vía Perimetral; Guayaquil P.O. Box 09-01-5863; Ecuador; [email protected].
4 Departamento de Ingeniería Química y Agroindustria; Facultad de Ingeniería Química y Agroindustria; Ladrón de Guevara E11-253; Quito 170525 ; Ecuador;
5 Laboratorio de Instrumental; Ingeniería en Biotecnología; Facultad de Ciencias de la Vida; Campus María Auxiliadora; Universidad Politécnica Salesiana (UPS); Km 19.5 vía a la Costa; Guayaquil P.O. Box 09-01-2074, Ecuador. [email protected].
6 Centro Nacional de Acuicultura e Investigaciones Marinas (CENAIM), Escuela Superior Politécnica del Litoral (ESPOL), San Pedro de Manglaralto, P.O. Box 09-01-5863, Santa Elena, Ecuador. [email protected].
* Corresponding author: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.01.13
RESUMEN
Kappaphycus alvarezii es una de las especies de algas más cultivadas en el mundo, debido a su alto contenido de compuestos bioactivos con reportes antioxidantes y bioestimulantes. El presente estudio evaluó el efecto de las densidades de plantación sobre la composición bioquímica y antioxidante de K. alvarezii cultivada en un sistema de línea larga durante las estaciones seca y húmeda, con el fin de proporcionar una base científica para una cosecha óptima. Se midieron el contenido de humedad, cenizas, grasa, fibra, auxinas, fenoles, flavonoides, DPPH y ABTS. Los datos se analizaron mediante pruebas t, Wilcoxon, Kruskal-Wallis y ANOVA unidireccional. Los resultados mostraron un mayor contenido de grasa (2,01 % P.s), fibra bruta (5,21% P.s), contenido total de fenoles (324,09 μg GAE/g P.s) y ABTS (9,32 μg GAE/g P.s) durante la estación seca. Con respecto a la densidad de plantación, se produjo un aumento significativo del contenido en cenizas, fenoles totales y ABTS con una densidad de 10 líneas.célula-1 al mismo tiempo. Los contenidos de flavonoides, DPPH y auxina mostraron una tendencia estacional opuesta, alcanzando los niveles máximos en la estación húmeda. Este estudio aporta nueva información sobre las condiciones ambientales que pueden provocar cambios en la actividad antioxidante y la composición bioquímica de esta especie con vistas al desarrollo de bioproductos para diferentes sectores industriales como el alimentario, el farmacéutico y el de los fertilizantes en Ecuador.
Palabras claves: Alga roja; Fenoles; Flavonoides; Antioxidante; Composición bioquímica; Variación estacional; densidad de siembra.
ABSTRACT
Kappaphycus alvarezii is a species of algae most cultivated in the world, due to its high content of bioactive compounds with reported antioxidant and biostimulant activities. The present study evaluated the effect of stocking densities on the biochemical and antioxidant composition of K. alvarezii cultivated in a long-line system, during the dry and wet seasons to provide a scientific basis for optimal harvesting. Moisture content, ash, fat, fiber, auxins, phenols, flavonoids, DPPH, and ABTS were measured. Data were analyzed using t-tests, Wilcoxon, Kruskal-Wallis, and one-way ANOVA. The results showed a higher fat content (2.01% P.s), crude fiber (5.21% P.s), total phenol content (324.09 μg GAE/g P.s), and ABTS (9.32 μg GAE/g P.s) during the dry season. Concerning the stocking density, a significant increase in the content of ash, total phenols, and ABTS was evidenced in the density of 10 lines.cell-1 at the same time. On the other hand, the content of flavonoids, DPPH, and auxins showed an opposite seasonal trend, reaching maximum levels in the wet season. This study provides new information on the environmental conditions that can lead to changes in the antioxidant activity and biochemical composition of this species to develop bioproducts for different industrial sectors such as food, pharmaceutical, and fertilizer in Ecuador.
Keywords: Red algae; Phenols; Flavonoids; antioxidants; Biochemical composition; Seasonal variation; stocking density.
INTRODUCCIÓN
En los últimas décadas, se ha incrementado el interés por la búsqueda de nuevos compuestos naturales con actividades potenciales para la alimentación y aplicaciones tanto biomédica como agrícola por parte de las industrias dedicadas al desarrollo de nuevos alimentos funcionales, fármacos y fertilizantes 1,2. Algunas excelentes candidatas son las macroalgas que han sido utilizadas para la alimentación humana en los países asiáticos durante siglos, mientras que en América constituyen un recurso infraexplotado, empleado especialmente como materia prima para la industria de los ficoloides 3,4. En el 2019, las algas marinas alcanzaron los 34,7 millones de toneladas en peso fresco que representan el 28,9 % de la producción acuícola mundial del total de todas las especies5. Como resultado de la creciente demanda, las especies de macroalgas comestibles se han producido con éxito en los sistema agrícolas como las macroalgas pardas a mencionar: Saccharina japónica, Undaria pinnatifda y las macroalgas rojas Porphyra capensis, Kappaphycus alvarezii y Gracilaria fusiforme 6.
K. alvarezii (Doty) Doty ex P.C. Silva. conocida como “cottonii”, es una especie de macroalgas roja originaria de Filipinas, que ha sido cultivada con éxito en más de 20 países desde que la demanda de materias primas de carragenina aumentó rápidamente por parte de una industria que dependía de la explotación de lechos naturales7. Esta especie contiene un alto contenido de proteínas, minerales, fibra dietética, ácidos grasos poliinsaturados 8,9, reguladores de crecimiento como giberelinas, auxinas y citoquininas 10,11, así como otros metabolitos secundarios que han reportado propiedades antioxidantes, antibacterianas 12,13, antiabéticas y antihiperlipidémicas 14 entre otras.
En particular, los antioxidantes se han asociado con la prevención o el tratamiento de enfermedades de origen cardiaco e inmunológico, debido a su capacidad para mitigar el envejecimiento celular en el organismo cuando se exponen a condiciones de estrés oxidativos 2,15. Se ha informado que los compuestos antioxidantes extraídos de las algas son muy utilizados como materiales biodegradable de empaque de alimentos por su propiedades formadoras de películas 16. Asimismo han sido usados como estabilizadores o conservantes en productos alimenticios enriquecidos con lípidos para atenuar el deterioro de su calidad y prolongar su vida de anaquel, sustituyendo el uso indiscriminado de antioxidantes artificiales, los cuales se han vuelto controversiales, debido a su toxicidad sobre la salud 17,18,19. También se ha descrito en la literatura la eficacia de la savia de K. alvarezii como bioestimulante o fuentes de potasio empleados en diversos cultivos, fomentando su aplicación en las industrias alimenticias, farmacéuticas y de fertilizantes 20,21,22 .
Considerando una mejor utilización de esta especie es importante comprender las variaciones en el contenido y la diversidad de los metabolitos de las algas como producto de varios factores tales como la temporada, calidad de agua,estado reproductivo, período de cultivo, densidad de siembra, profundidad de cultivo y la zona geográfica que pueden estimular o inhibir la biosíntesis de varios nutrientes 23,24,25.
Se han informado cambios estacionales en el perfil químico y de antioxidantes en K.alvarezii y de otras especies de macroalgas cultivadas en diferentes partes del mundo 8,26,27,28. Del mismo modo, se ha indicado que el contenido de polifenoles, proteínas, lípidos, fibras y carbohidratos se ven afectados por los niveles de irradiación UV, temperatura del agua, precipitación, salinidad y nutrientes 29,30,31,32.
Dentro de la información resultante de varias investigaciones que abarca la caracterización de compuestos bioactivos de diversas algas marinas 33, no se ha reportado estudios en Ecuador sobre la influencia que ejerce la variación estacional y la densidad de siembra sobre la composición bioquímica y la actividad antioxidante en K. alvarezii.
Por lo que el presente proyecto de investigación tiene como objetivo evaluar los efectos de la época humeda, época seca y la densidad de siembra sobre el perfil bioquímico y las propiedades antioxidantes de K.alvarezii cultivada en las zonas costeras del Ecuador, a fin de proporcionar una base científica para una recolección óptima.
Los resultados sugieren que K. alvarezii es una fuente sustentable de compuestos bioactivos para su aplicación comercial como antioxidante y bioestimulante natural en productos alimenticios, nutracéuticos y fertilizantes.
MATERIALES Y MÉTODOS
Ubicación, recolección y procesamiento
Kappapycus alvarezii fue recolectada en las cosechas de enero y agosto del 2021, que representa la época húmeda y seca en el cantón Santa Rosa (S2°13'34.39"O80°51'31.43"), de la provincia de Santa Elena, Ecuador, durante la marea baja. La determinación del estudio de las densidades de siembra sólo se realizó en la época seca (agosto) debido a las restricciones de movilidad por pandemia, las cuales impidieron que se realice el cultivo en diferentes densidades en la época húmeda (enero). La siembra y la cosecha en diferentes densidades de población se realizó de la siguiente manera (fig.1 y 2): En la balsa flotante (long-line) se cultivaron bajo tres diferentes densidades de siembra (6,8 y 10 líneas.celda -1) que constituye el número de líneas que está conformada una celda. En cada celda de 3x5 m, se colocaron cada una de las redes tubulares inoculadas con las plántulas previamente libres de impurezas a lo largo de cada cuerda de polipropileno (líneas), luego de 45 días se procedió a tomar 1,5kg de muestra fresca de cada línea correspondiente a las tres densidades de siembra (n = 24). Todas las muestras se lavaron minuciosamente con agua potable para la eliminación total de epífitas,congeladas a -80 °C y liofilizadas (Labconco). Las muestras secas se trituraron en un molino de café a un tamaño de partícula de 250 μm y se almacenaron en un desecador hasta su posterior análisis.

Figura 1. Método de siembra por red tubular. A-B)Inoculación de plántulas de algas en malla tubular a través de un tubo PVC de 75 mm con 1 m de longitud. C)Atamiento de cada una de las redes tubulares con algas en el sistema de cultivo long-line.
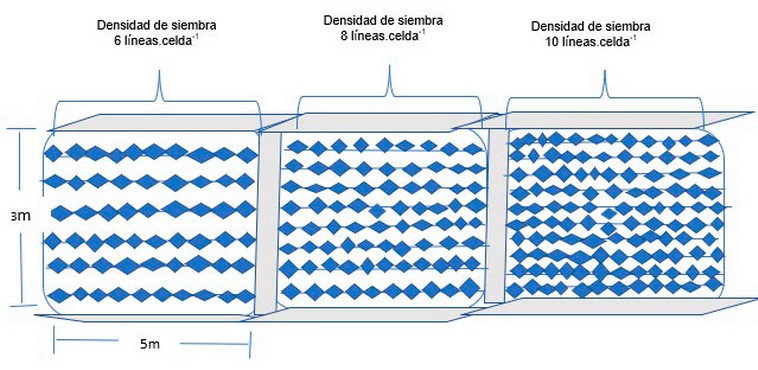
Figura 2. Esquema que conforma la balsa utilizadas para el cultivo de Kappaphycus alvarezii, con las líneas de cultivo que representan cada densidad de siembra.
Disolvente y reactivo
Todos los reactivos químicos y solventes utilizados se obtuvieron de Sigma-Aldrich.
Composición proximal
Los contenidos de humedad, cenizas, lípidos y fibra en las algas marinas se analizaron de acuerdo al método estándar oficial de la AOAC (2003) 34 con algunas modificaciones.
La humedad se analizó utilizando muestras frescas, pesadas y secadas en una estufa a 105°C durante 2 horas hasta obtener un peso constante. El contenido de humedad se expresó como porcentaje de peso fresco.
La ceniza total se obtuvo por calcinación de la biomasa seca en una mufla a 750°C por 4 horas y los resultados se expresaron como porcentaje del peso seco.
Los lípidos del polvo de alga fueron (aprox.4g) extraídos durante 4 horas en un extractor de Soxhlet empleando hexano como disolvente.
La fibra cruda se cuantificó en muestras desgrasadas de 2g previamente hervidas con 200 ml de H2SO4 al 1,25 %. La mezcla se filtró y se lavó con agua hirviendo hasta un pH 7. El residuo obtenido se volvió a extraer con 200 ml de NaOH al 1,25 %, luego se lavó con agua destilada hirviendo y finalmente se secó a 105°C hasta peso constante. El residuo seco se incineró a 600°C durante 1 hora y los resultados se expresaron como porcentaje del peso seco.
Extracción y purificación de auxinas
La extracción y purificación de auxinas se basó de acuerdo con la metodología adoptada por Díaz et al.35 y Prasad et al.36 con algunas modificaciones. Cada gramo de muestra seca se combinó con 10 ml de etanol. La mezcla se digestó utilizando una plancha de calentamiento (Fisher Scientific) a 47°C a 48 minutos. El sobrenadante obtenido se rotavaporó hasta sequedad y se mezclaron 400 uL de agua acidificada de pH 3 con 1,2 ml de acetato de etilo formandose dos fases. Se procedió a extraer, rotavaporar hasta sequedad la fase de acetato y después se resuspendió en metanol.
Extracción de antioxidante
El proceso de extracción de los antioxidantes se basó de acuerdo con la metodología adoptada por Diyana et al.37. El polvo liofilizado del alga fue extraído con etanol al 50 %, se maceraron en agitador rotatorio durante 72 horas a temperatura ambiente, luego los extractos se filtraron y se almacenaron en frascos ambar de 10 ml a -17 °C hasta su análisis.
Análisis espectrométricos
Detección y cuantificación de auxinas
La determinación de auxinas totales se realizó con el reactivo de Salkowsky según lo descrito por Weber et al.38 con algunas modificaciones. Para la preparación del reactivo se basó de acuerdo con Gang et al. 39. Se hizo reaccionar 50 µL de muestra con 100 µL de la solución del reactivo de Salkowsky (v/v) en una placa de 96 pocillos y se incubó durante 30 minutos en la oscuridad a temperatura ambiente. La absorbancia se midió a una longitud de onda de 540 nm mediante un espectrofotómetro UV-VIS. El contenido auxinas totales se expresó en mg equivalente de ácido indolacético por gramo de peso seco de la muestra (mg AIA/g P.s).
Contenido de fenoles totales
La estimación de fenoles totales en los extractos se realizó con el reactivo de Folin-Ciocalteu por el método colorimétrico descrito por Zhon et al.37. Se mezcló 25 µL de extracto con 25 µL de la solución del reactivo de Folin y 200 µL de agua destilada en una placa de 96 pocillos y se dejó reposar a temperatura ambiente durante 5 minutos. Se añadio a la mezcla, 25 µL de una solución de Na2CO3 al 10 % y se incubó en la oscuridad durante 60 minutos. La absorbancia se midió a 765 nm en un espectrofotómetro UV-Vis (Synergy™ 5, BioTek). El contenido fenólico se expresó como mg equivalente de ácido gálico por gramo de peso seco de la muestra (mg GAE/g Ps).
Contenido de flavonoides totales
El contenido de flavonoides se estimó según el método de Avramova et al.40. Se hicieron reaccionar 20 µL de muestra con 200 μl de la mezcla de reactivos preparado por separado con etanol absoluto, cloruro de aluminio al 10 %, acetato de potasio 1 M y agua destilada en una microplaca de 96 pocillos durante 30 minutos a temperatura ambiente lejos de la luz. La absorbancia se midió a 415 nm en un espectrofotómetro UV-Vis (Synergy™ 5, BioTek). Los resultados se expresaron como mg equivalente de quercetina por gramo de peso seco de la muestra (mg QE/g P.s).
Actividad de eliminación de radicales DPPH
La actividad secuestrante de radicales DPPH se analizó con el método descrito por Viteris et al.41 con ligeras modificación. A 50 μL de muestra se añadio 150 μL de una solución de DPPH etanólico (0,15 mM) en una microplaca de 96 pocillos. La mezcla se incubó a temperatura ambiente durante 30 minutos y se midió la absorbancia a 517 nm en un espectrofotómetro UV-Vis (Synergy™ 5, BioTek). La actividad antioxidante se expresó en mg equivalente de trolox por gramo de peso seco de la muestra (mg TE/g P.s).
Actividad de eliminación de radicales ABTS
El método utilizado fue descrito por Viteris et al.41 con ligeras variaciones. La solución de ABTS•+ se preparó mezclando ABTS (7 mM) y persulfato de potasio (3,6 mM) en agua destilada, luego la solución se agitó y se mantuvo en reposo en la oscuridad a 4°C,durante 18 horas para permitir la generación de radicales libres. Se diluyó 610 μL de la solución ABTS•+ en 25 ml de etanol absoluto. Se agregó 50 μL de muestra o las soluciones estándar diluidas en cada pocillo de la microplaca por triplicado y se añadió 150 μL de ABTS. La mezcla de la reacción se incubó durante 30 minutos en la oscuridad a temperatura ambiente y se midió la absorbancia a 732 nm en un espectrofotómetro UV-Vis (Synergy™ 5, BioTek). Los resultados se expresaron en mg equivalente de trolox por gramo de peso seco de la muestra (mg TE/g P.s).
.
Análisis estadístico
El contenido de humedad, cenizas y fibras, al igual que las auxinas totales fueron analizados con la prueba paramétrica t, después de comprobar la normalidad de los datos. Los compuestos fenólicos y antioxidantes (DPPH y ABTS) fueron analizados a través de la prueba no paramétrica de Wilcoxon, debido a que no se cumplieron los supuestos estadísticos; considerando dos momentos de cosechas (enero y agosto). En cuanto al estudio de densidades de siembra, los datos del contenido de humedad, cenizas, lípidos y fibras, así como los compuestos antioxidantes se analizaron mediante la prueba de Kruskal-Wallis debido a la heterogeneidad de las varianzas. Por otro lado, el contenido de auxinas se determinó mediante ANOVA unidireccional utilizando Tukey para determinar la diferencia entre los tratamientos. Todas las pruebas estadísticas fueron realizadas con un nivel de significación del 5%. Los análisis estadísticos se realizaron utilizando el software R versión 4.2.0.
RESULTADOS
Composición química de K. alvarezii
La Tabla 1 muestra el contenido de humedad, cenizas, lípidos y fibras de K. alvarezii, recolectada en Santa Rosa, Ecuador en los meses de enero y agosto del 2021. Los contenidos de humedad y cenizas no fueron muy diferentes entre las dos estaciones. Según las pruebas t y Tukey mostraron que ambos parámetros no se vieron afectados significativamente por la estacionalidad . Por lo general, las algas marinas contienen concentraciones más altas de fibras. Sin embargo, el contenido de fibra de está rodófita fueron relativamente bajos entre las dos épocas. Los niveles de fibras y lípidos mostraron diferencias estadísticamente significativas.
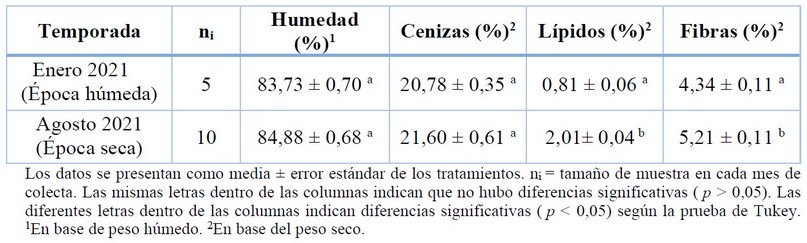
Tabla 1. Variación estacional del contenido de humedad, cenizas, lípidos y fibras en K.alvarezii correspondiente en la densidad 10 líneas.celda-1.
La variación de las diferentes densidades de siembra sobre los contenidos de humedad, cenizas, grasas y fibras en K. alvarezii se presentan en la tabla 2.
Las pruebas de Mann-Whitney y Kruskal-Wallis que el contenido de humedad, lípidos y fibras no mostraron diferencias significativas entre las tres densidades de siembra mientras que el contenido de cenizas tuvo hubo un efecto significativo.
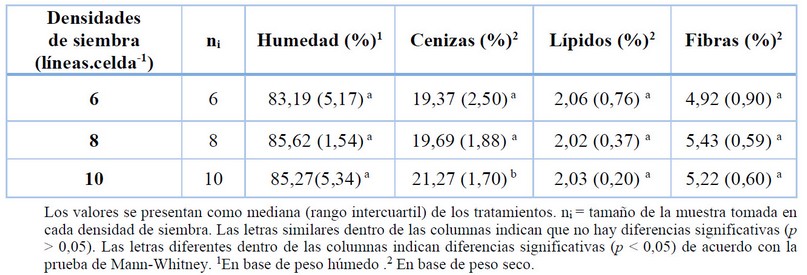
Tabla 2. Composición química de K. alvarezii cultivada en diferentes densidades de siembra correspondiente al mes de agosto (época seca).
Contenido de auxinas totales en K. alvarezii
La variación estacional sobre el contenido endógeno de auxinas en K. alvarezii se muestran en la Tabla 3 y bajo tres diferentes densidades de siembra en la tabla 4.
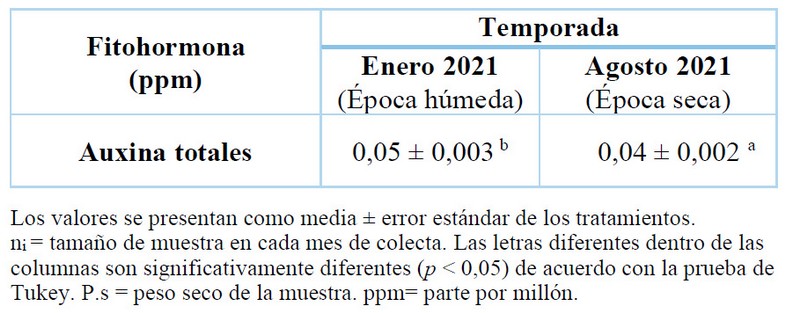
Tabla 3. Variación estacional del contenido de auxinas de K. alvarezii correspondiente a la densidad 10 líneas.celda-1.

Tabla 4. Auxinas totales en K. alvarezii cultivada en diferentes densidades de siembra correspondiente al mes de agosto (época seca).
Contenido fenólico y antioxidante en K. alvarezii
Se prepararon ABTS y DPPH para estimar las actividades antioxidantes en extractos etanólico al 50%. El uso de solventes orgánicos combinados con agua puede producir un medio moderadamente polar que aumentará la extracción de antioxidantes 42, 43. Los altos valores de actividad antioxidante en extractos acuosos con 50% de solvente se deben al alto contenido de moléculas fenólicas presentes en los tejidos vegetales, puesto que al adicionar agua al disolvente orgánico facilita la extracción de químicos que son solubles en agua y/o solvente orgánico. Se empleo del etanol al 50% para extracción de compuestos fenólicos y antioxidantes por considerarse dentro de los grupos de solventes no tóxicos, se ha informado que la mezcla etanol-agua, particularmente 50% de etanol, es la más idónea para mantener una alta actividad antioxidante en algas marinas 44,45. La variación estacional sobre la composición fenólica y antioxidante de K. alvarezii se resume en la tabla 5 y su contenido en tres diferentes densidades de siembra en el mes de agosto (época seca) en la tabla 6.
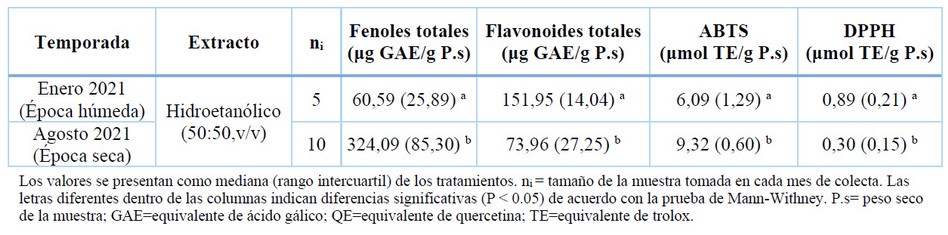
Table 5. Variación estacional del contenido fenólico y antioxidante en K. alvarezii correspondiente a la densidad 10 línea.celda-1.
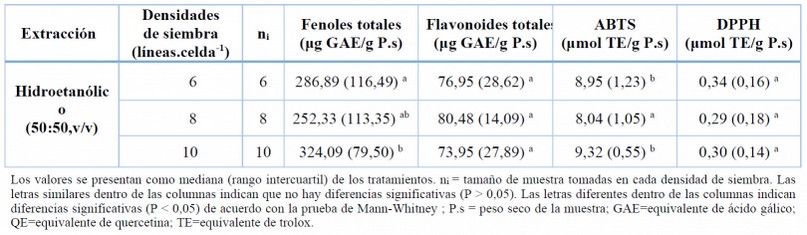
Tabla 6. Composición fenólica y antioxidante de K.alvarezii cultivada en diferentes densidades de siembra en el mes de agosto (época seca).
DISCUSIÓN
Composición química de Kappaphycus alvarezii
En general, las algas frescas exhiben un alto contenido de humedad que oscila entre 70 y 90% 46,47,48, rango que encajan perfectamente con los valores encontrados en este estudio (Tabla 1). Aun cuando, tuvo un mayor contenido de humedad en agosto (84,88 %) que en enero (83,73 %), la diferencia no fue significativa (p > 0,05) entre las dos épocas de estudio. Aroyehun et al.49 informaron un patrón similar al no hallar diferencias significativas entre las estaciones y el contenido de humedad en la macroalga roja G. manilaensis. Alternativamente, Schiener et al.50 reportaron un mayor contenido de humedad en 4 especies de macroalgas pardas Laminaria digitata , Laminaria hyperborea , Saccharina latissima y Alaria esculenta durante los meses de invierno y menor en los meses de otoño. Los resultados difieren con el estudio de las macroalgas pardas, debido a las distintas especies, ubicación de muestreo, ya que las muestras fueron cultivadas y no se recolectadas en zonas intermareales en donde frecuentemente están expuestas a ciclos de desecación y rehidratación del mar 51.
Los resultados también mostraron un alto contenido de cenizas en ambos períodos (Tabla 1) lo cual puede deberse a la presencia de sal en los talos (tejido vegetativo de las algas), como resultado de una alta salinidad en el sitio de muestreo52,53. En este sentido, el alto porcentaje de cenizas refleja su riqueza considerable de minerales, especialmente potasio y sodio encontrados en está alga 8. El contenido de cenizas de K. alvarezii se ubica dentro del amplio rango descrito en la literatura para macroalgas rojas (5,8-46,2 % P.s) 51. A pesar de que los valores de cenizas aumentaron ligeramente de enero a agosto, esto no fue estadísticamente significativo (p > 0,05), por lo que los cambios estacionales no parecieron afectar este parámetro. Sin embargo, esto se debería confirmar ampliando el número de períodos de muestreo. Kumar et al.8 informó una tendencia opuesta para la variación de cenizas de K.alvarezii recolectada en la costa noroeste de India, con altos niveles de cenizas registrado en verano y los más bajos en invierno. De manera similar, Araujo et al.26 registraron un mayor porcentaje de cenizas en esta misma especie de alga durante el verano en la costa de San Paulo, Brazil. Estas diferencias se deben a las flutuaciones meterológicas y ambientales.
En cuando al contenido de lípidos, en las dos estaciones fueron relativamente bajos, alcanzando un mayor contenido en agosto (época seca) en comparación con enero (época húmeda) cuyo contenido se reduce en menos de la mitad (Tabla 1). De acuerdo con los análisis estadísticos mostraron diferencias estacionales significativos en el contenido de lípido (p < 0,05). Se ha evidenciado que la mayoría de las algas rojas contiene un bajo porcentaje de lípido que varía entre 0,3 y 3,8 % P.s, lo que indica un bajo contenido calórico, en comparación con los vegetales terrestres 54. Khairy et al.55 informaron un patrón similar en el que reportaron una mayor concentración de lípidos durante la temporada de baja temperatura, así como otros autores al determinar el contenido de lípido en las macroalgas del género Ulva sp 56,57,58. En contraste a los resultados presentados en este estudio, otros autores han registrado un mayor contenido de lípidos en Fucus sp. durante el verano en diferentes localidades del continente europeo, donde las temperaturas son muy altas 47,59. Aunque estos resultados puedan parecer discordante con los casos anteriores, es presumible que estos variaciones en los niveles de lípidos no solo dependieron de la temperatura, sino que puedan deberse a la etapa del ciclo de vida, como factores fisiológicos o incluso biológicos 60,61.
El contenido de fibra cruda varió en menor grado, pero con significativas (p < 0,05) diferencias entre los meses de estudio (Tabla 1). Estos resultados coinciden con los niveles de fibras reportados previamente para otras especies de macroalgas incluida K.alvarezii recolectadas en la zona costera de Ecuador (0,9-5 % P.s) 33 entre los meses de marzo y mayo del 2017, pero inferior a los valores informado para K. alvarezii, la cual fluctuó entre 9,68 y 18,57 % P.s, durante el transcurso de tres años en Okha, noroeste de India. Por otro lado, se encontró un mayor contenido de fibra para diferentes especies de macroalgas durante el invierno (42,5 % P.s) y un menor contenido durante el verano y otoño (33,1 % P.s) en las costa del Mar Rojo 62. Esto puede suscitarse debido a factores como: la etapa de crecimiento, la actividad fotosintética y la absorción de nutrientes, como señalan Rajauria et al.63 respecto al contenido de fibra en las algas marinas.
El contenido de humedad presentó un incremento a medida que la densidad de siembra aumentó, pero sin significación estadística (p > 0,05) (Tabla 2). Este hecho pudo deberse a que las muestras estuvieron expuestas a las mismas condiciones ambientales. Cabe señalar, que estos datos no pudieron ser comparables con otros trabajos, ya que, no hay información disponible en la literatura donde evalúen la variabilidad de humedad en K.alvarezii, ni en otras especies de algas semejantes en función a la densidad de siembra, por lo que este es el primer informe que evalúa este parámetro en condiciones naturales de cultivo.
En lo concerniente al contenido de cenizas, se evidenció un mayor porcentaje a medida que la densidad de siembra aumentaba (Tabla 2), encontrándose diferencias significativas (p < 0,05). Esta tendencia es diferente con lo reportado por otros estudios, donde se registró un mayor contenido de cenizas en otra alga del género Ulva cuando la densidad de cultivo disminuyó 64,65. Estos investigadores alegan que el contenido de ceniza está influenciado por la densidad de siembra debido a que al existir una menor población la tasa de competencia disminuye, por lo tanto, hay una mayor exposición de la luz solar y absorción de nutrientes sobre las poblaciones de algas, lo que deriva a un aumento sustancial de cenizas en las mismas. Sin embargo, esta teoría no concuerda con este estudio, por lo que se especula que podría estar más asociado a factores geográficos y ambientales como la temperatura, salinidad y los nutrientes. Se sugiere corroborar tal hipótesis extendiendo el muestreo por varios meses del año en diferentes densidades, considerando estos parámetros ambientes.
En cuanto a los niveles de lípidos entre las tres densidades, fueron relativamente similares; alrededor de 2,00 % P.s (Tabla 2), análogos con el rango reportado para K.alvarezii cultivada en la zona costera de Indonesia 66 (0,73-2,08 % P.s) pero superiores para los especímenes cosechados en diferentes sitios de la zona costera del continente asiático (0,03-1,0 % P.s) 32,67,89. Es posible que las diferencias del contenido de lípidos en la misma especie se deban a la variedad de cepas, regiones geográficas y las estaciones 68, 61 . Según los resultados estadísticos, la interacción entre las densidades de siembra y los niveles de lípidos no fue estadísticamente diferente (p > 0,05). Se registró un comportamiento similar en los niveles de lípidos para la macroalga D.tenuissima, puesto que, no tuvieron un efecto significativo en las cinco diferentes densidades de siembra probadas 69. Por el contrario, otro estudio 64 observaron un aumento sustancial en el contenido de lípidos en Ulva rigida cuando se exponían a un déficit de nitrógeno y a una alta densidad de población, condiciones que favorecieron al mecanismo de almacenamiento de energía y la síntesis de lípidos en donde el exceso de carbono en vez de transformarse en proteína se almacena en forma de grasa59. En complemento, Khotimchenko et al.70 indicaron que las condiciones subóptima de luz, favorecen al aumento de lípidos en las membranas fotosintéticas de las macroalgas como consecuencia de la acumulación de glicolípidos en las mismas. Factores como la condición fisiológicas de los talos, etapa de vida o incluso los procedimientos de extracción pudieron haber contribuido en estos resultados71.
En el contenido de fibra cruda no se encontró diferencias significativas entre las tres densidades de siembra (p > 0,05) (Tabla 2). Se ha informado valores similares a los obtenidos para K.alvarezii cultivada en diferentes sitios de Indonesia (4,3–6,6 % P.s)72 , y particularmente superior a lo registrado para las muestras de Gorontalo, Indonesia (0,40-0,87% P.s)32. Marinho et al23. y Denis et al.73 reportaron un alto porcentaje fibra en las rodófitas Gracilaria cervicornis (56,54 % P.s) de Brazil y Grateloupia turuturu (60 % P.s) de Francia. De acuerdo con estos hallazgos, el contenido de fibra en algas rojas puede diferir según los taxones, ubicación geográfica, madurez y los factores abióticos51. No se encontraron en la literatura revisada una evaluación comparable sobre la influencia de la densidad de siembra sobre el contenido de fibra en K.alvarezii. Este enfoque solo ha sido planteado previamente por Queiros et al.64, quienes evaluaron los cambios en la composición de polisacáridos de U. rigida en función a la densidad de siembra. En su estudio los autores no detectaron ninguna diferencia entre los niveles de fibras y la densidad de siembra, aunque varios investigadores han manifestado que el contenido de fibra está asociado con la limitación de nutrientes en el medio como el nitrógeno, etapa de crecimiento y la actividad fotosintética entre las especies de algas74.
Contenido de auxinas totales en K. alvarezii
El contenido endógeno de auxinas totales de esta especie, mostraron un ligero aumento durante enero con un 0,05 ppm en comparación con agosto que tuvo un valor de 0,04 ppm (Tabla 3). La variación estacional de auxinas totales fue estadísticamente significativa (p < 0,05). Como sabemos no hay trabajos publicados que evaluén la influencia de la estacionalidad en el contenido de auxinas de K.alvarezii, ni otros especímenes de macroalgas. A pesar de sus diferencias taxonómicas, siguió la misma tendencia reportada por Sivaci y Yalcin et al.75quienes registraron una mayor concentracción de AIA en diferentes variedades manzanas (Malus syvestris Miller) durante la primavera como resultado de una mayor actividad fotosintética producida durante este período. Cabe indicar que las algas como las plantas terrestres realizan las mismas funciones metabólicas, puesto que ambas son organismos fotosintéticos. Los datos de este estudio podrían atribuirse al período de crecimiento como consecuencia de las condiciones ambientales a las que estuvieron expuestas durante su ciclo de reproducción10, dado que las auxinas intervienen en el crecimiento, desarrollo y metabolismo de las algas marinas76,77,78, siendo este el primer estudio en determinar el efecto de la estacionalidad sobre la concentración auxinas.
Como se evidenció en la tabla 4, las tres densidades obtuvieron similares concentraciones de auxinas, sin encontrarse diferencias significativas entre ellas (p > 0,05). Se cree que el rango de valores de densidad de siembra puede tratarse de un rango no influyente sobre el contenido de auxinas totales a las condiciones ambientales (temperatura del agua, salinidad y nutrientes) correspondientes al sitio de cultivo y cosecha. Sin embargo, se necesitarían más datos relacionados con este tema para confirmar está presunción. Otros estudios también han encontrado valores más altos de auxinas en distintas especies de macroalgas como Caulerpa racemosa (10 ppm), Hipnea corona (6,70 ppm) y Ulva lacinulata (2,30 ppm) 79,80 pero hay que tener en cuenta que los autores no efectuaron ensayos de densidades en su investigación, lo cual pudiera ser debido a factores como la densidad de siembra y los procedimientos de análisis utilizados, ya que las muestras del presente estudio se determinaron por espectofotometría UV-visible, en lugar del análisis por cromatografía de alta resolución que fueron empleados por los estudios mencionados anteriormente. La escasez de investigaciones orientadas a estos parámetros dificulta el aprovechamiento de este tipo de biomoléculas de interés biotecnológico de una fuente comercial explotable como el cultivo de K. alvarezzii.
Contenido fenólico y antioxidante en K. alvarezii
El contenido fenólico de los extractos hidroetanólicos (50:50,v/v) de K. alvarezii reflejaron variaciones estacionalmente significativas. El contenido se quintuplica en la época seca en comparación con la época húmeda (Tabla 5). Estos resultados fueron mayores a los reportado previamente para los extractos de etanólico al 50% (173,2 μg GAE g−1 P.s) 37 y menor para los extractos metanólicos al 50% (1.150 μg GAE g−1 P.s) 12 para la misma especie recolectada en Malasia, aunque los investigadores no mencionan el mes de cosecha. Lo más probable, es que estas diferencias se deban a la polaridad de los disolventes aplicados (el metanol es un disolvente más polar que el etanol) y la solubilidad de los compuestos antioxidantes presentes en las algas. Por otro lado, Araújo et al.26 informaron alto contenido fenólico en K. alvarezii durante el otoño (101,39 mg GAE g−1 P.s) y más bajos en verano (46,26 mg GAE g−1 P.s) en donde la temperatura alcanza los 30°C. En otras algas rojas también se han reportado el efecto de la estacionalidad y el solvente empleado81 registrando un mayor contenido fenólico durante el otoño, época que se caracteriza por temperaturas suaves y lluvias escasas.
El contenido de flavonoides varió estacionalmente, reduciéndose su contenido a la mitad en agosto en comparación a enero (Tabla 5). Una tendencia similar fue encontrada en los extractos metanólicos del alga parda F. spiralis4 y S. latissima3, los cuales presentaron niveles superiores de flavonoides durante la temporada de verano en comparación con el invierno. Esto se puede atribuir a los diferentes factores ecológicos, como la temperatura, precipitaciones y la duración e intensidad de la luz solar42, y que a medida que avanzamos de enero a agosto, el clima se vuelve gradualmente más cálido en el transcurso del día82. Es decir, las algas marinas están expuestas a una luz solar más intensa durante varias horas al día, lo que induce una biosíntesis mejorada de flavonoides que, al ser antioxidantes, juegan un papel importante en el sistema de defensa de las algas para resistir a los depredadores y a los desafíos ambientales 83, 84 ,85.
Con respecto al DPPH, se ha registrado cerca del triple de actividad en enero en comparación con agosto (Tabla 5). Es decir, hubo una reducción en su contenido entre ambas estaciones, lo cual representa una diferencia significativa en el contenido antioxidante de K.alvarezii (p < 0,05) respecto a la temporada. Esta observación está de acuerdo con Araujo et al.26 quienes obtuvieron un alto nivel de inhibición de DPPH de K. alvarezii durante el verano período que coincide con un aumento notable en la temperatura en las costas de San Paulo, Brazil, y que en general, son calurosos y secos. Según Pedro et al.86, quienes registran una mayor actividad depurativa de DPPH en extractos etanólicos del alga verde Codium sp. durante el verano, este aumento podría estar relacionado a al mecanismo fotoprotector, para resistir el estrés lumínico en respuesta a la radiación UV intensificada87. Otros autores han reportado valores superiores de DPPH en diferentes extractos de K.alvarezii, aunque no informaron datos de la fecha de cosecha 88,89, lo que puede estar asociado a la participación de otros parámetros, tales como los diferentes métodos de extracción, los solventes aplicados y las diferentes cepas existentes de K.alvarezii.
Con lo concerniente al ABTS, los resultados reflejaron variaciones estacionales significativas, registrándose un aumento del 30% en su actividad en agosto en comparación a enero (Tabla 5). Pese a las diferencias taxonómicas y geográficas, estos resultados se asemejan con lo reportado por Pedro et al.86 quienes registraron un mayor contenido de actividad antioxidante ABTS en los extractos etanólicos del alga Codium sp. durante el invierno (11,0 μmol TE g–1 P.s) y menor en el verano (8,9 μmol TE g–1 P.s), lo que se presume que estos resultados obtenidos, guardan una relación con el momento de la cosecha y los solventes empleados para su extracción 44. Esta fue la única referencia que se asocia el contenido de ABTS con relación a la estacionalidad en especies de macroalgas.
El contenido fenólico presenta su valor máximo en la densidad 10 líneas.celda-1 , mientras que los más bajos se registraron en la densidad 8 líneas.celda-1, seguido de la densidad 6 líneas.celda-1. Estos resultados no fueron directamente comparables con los de la literatura, puesto que, hasta la fecha, no hay información reportada sobre la influencia que ejerce la densidad de siembra en el contenido de compuestos fenólico de K. alvarezii, incluso en otras especies de macroalgas cultivadas en el mar. Sin embargo, esta tendencia concuerda con la reportada por estudios en otros organismos fotosintéticos, observándose un aumento sustancial en los niveles de ácidos fenólicos a medida que aumentaba la densidad de siembra de hortalizas como: coliflor 90, alcachofas globo 85 y la col rizada 91. Pese a las diferencias taxonómicas las hortalizas y las algas guardan una similitud debido a que ambas dependen del proceso de la fotosíntesis para su sobrevivencia. En estos estudios de hortalizas los investigadores plantearon la hipótesis de que los altos niveles de compuestos fenólicos podrían estar relacionado con la respuesta bioquímica de las plantas como resultado de la competencia intraespecífica por los recursos fotosintéticos 92.
El contenido de flavonoides totales presenta una diferencia no estadísticamente significativa (p >0,05), denotando un efecto nulo sobre el contenido de flavonoides dentro de ese rango de densidad de siembra (Tabla 6). Un estudio comparó la composición química de los brotes de otro organismo fotosintético bajo cinco densidades de siembra diferentes93 obteniendo un mayor contenido de flavonoide a una baja densidad. Cheng et al.94 han informado que el anabolismo de los flavonoides puede estar estrechamente relacionado con el proceso fotosintético. Por este motivo, no son aconsejables las sobrepoblaciones de siembra, ya que cuando la densidad de cultivo se multiplica se genera mayor competencia por iluminación y ventilación entre la población95. Esto podría causar una disminución sustancial de producción.
En cuanto al DPPH tampoco presentó diferencias significativas (p > 0,05) (Tabla 6). Magnusson et al.96 reportó resultados afines en la macroalga Derbesia tenuissima cultivada en un sistema terrestre. Las algas han desarrollado mecanismos de defensa como respuesta a estreses abióticos como la intensidad de luz solar en el ambiente que están expuestas durante la fotosíntesis y el transporte de electrones, por lo que se especula que cuando la densidad de población es baja, mayor es la incidencia de la luz sobre los cultivos, lo que desencadena una mayor proliferación de los compuestos antioxidantes 97. Sin embargo, es meritorio más investigaciones que comparen y contrasten estos valores reportados en K. alvarezii en las condiciones dadas de las costas ecuatorianas.
El contenido de ABTS se encuentra dentro del rango reportado en la literatura para algas pardas y rojas recolectadas en la isla de Faial, Portugal (5 y 60 μmol TE g–1 P.s)98. En este estudio se detectó diferencias entre las densidades de siembra, alcanzando una mayor actividad de 9,32 μmol TE g–1 P.s en la densidad de siembra 10 líneas.celda-1 (Tabla 6). Sin embargo, es difícil determinar que factor ambiental incidió en las variaciones evidenciadas en este estudio, ya que los cambios son pequeños e irregulares, teniendo en cuenta que la macroalga K.alvarezii fue recolectada en condiciones naturales, por lo que no es fácil separar los efectos de los factores individuales de la influencia multifactorial del medio ambiente. Por esta razón, se recomienda realizar más ensayos experimentaciones con otras densidades de siembra considerando otras condiciones ecológicas como la irradiación UV, corriente del mar, puesto que estos factores podrían influir en gran medida en la actividad antioxidante de ABTS.
CONCLUSIÓN
El contenido de grasas, fibras, fenoles totales y ABTS reflejaron cambios estacionales, obteniéndose un mayor contenido en la época seca (agosto), mientras que en la época húmeda (enero) se registró una alta concentración de flavonoides, auxinas totales y DPPH. La presencia de cada uno de estos componentes hace de K. alvarezii un alga muy prometedora para el desarrollo de nuevas industrias mediante el aprovechamiento de sus distintos componentes.
Con respecto a la densidad de siembra, se evidenció un aumento significativo de cenizas, fenoles totales y ABTS en la medida que la densidad aumentó dentro del rango estudiado. En base a estos resultados obtenidos se concluye que la composición bioquímica, así como los valores de bioactividad funcional mostrado en el extracto etanólico de K. alvarezii en dos épocas del año, proporcionaron información valiosa sobre el efecto de tres densidades de siembra y dos épocas de cosecha para la recolectar esta alga con perspectiva de desarrollar nuevos bioproductos funcionales en diferentes sectores industriales.
Estos parámetros deben estudiarse en mayores rangos de densidades de siembra y en períodos más largos de tiempo, ya que dependiendo del fin comercial que se le dé al alga, se podrá climatizar las condiciones de cultivo a fin de promover el desarrollo del metabolito de interés. Esta información sobre el efecto de la estacionalidad sobre el contenido de DPPH, compuestos fenólicos, flavonoides, fibras, ABTS es parte de los primeros acercamientos hacia el aprovechamiento comercial de los distintos metabolitos que contiene K. alvarezii en países neófitos en su cultivo y en vía desarrollo, ya sea para su uso en condiciones aclimatadas en piscinas o a mar abierto.
Contribuciones de autores
ELC y ICG realizaron el trabajo experimental; ELC redactó el artículo, ELC y ORB realizaron el análisis y la interpretación de los datos; SVDH fue responsable de coordinar la recolección y proporcionar la materia prima; PM, LJ, DV, APFdV y ORB revisaron y editaron el manustrito. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Fondos
Este estudio fue financiado por el programa VLIR-ESPOL otorgado a través del proyecto SIRENA.
Expresiones de gratitud
Extendemos nuestros más sincero agradecimiento al Centro de Agua y Desarrollo Sustentable (CADS-ESPOL ), especialmente al docente Luis Domínguez por permitir su autorización en sus instalaciones y hacer uso de equipos utilizados en este estudio. A la Cooperativa de pescadores de Santa Rosa de Salinas (CPPASRS) por su colaboración al proporcionar de materia prima K.alvarezii para la realización de este proyecto de investigación. Los autores también agradecen a los docentes Stanislaous Sonnenholzner y Julio Bonilla por su ayuda incondicional. ELC realizó el estudio como parte de su tesis de maestría, para el programa de postgrado conjunto red VLIR NETWORK Ecuador y fue apoyada por una beca de la Secretaría Nacional de Educación Superior, Ciencia, Tecnología e Innovación (SENESCYT).
Conflictos de interés
Los autores declaran no tener conflicto de intereses.
REFERENCIAS
1. Mekinić, I. G. et al. Phenolic content of brown algae (Pheophyceae) species: Extraction, identification, and quantification. Biomolecules 9, (2019).
2. Choudhary, B., Chauhan, O. P. & Mishra, A. Edible Seaweeds: A Potential Novel Source of Bioactive Metabolites and Nutraceuticals With Human Health Benefits. Front. Mar. Sci. 8, (2021).
3. Marinho, G. S., Sørensen, A. D. M., Safafar, H., Pedersen, A. H. & Holdt, S. L. Antioxidant content and activity of the seaweed Saccharina latissima: a seasonal perspective. J. Appl. Phycol. 31, 1343-1354 (2019).
4. Alemañ, A. E., Robledo, D. & Hayashi, L. Development of seaweed cultivation in Latin America: current trends and future prospects. Phycologia 58, 462-471 (2019).
5. F A O. Seaweeds and microalgae: an overview for unlocking their potential in global aquaculture development. vol. 1229 (2021).
6. Buschmann, A. H. et al. emerging research activity Seaweed production : overview of the global state of exploitation , farming and emerging research activity. Eur. J. Phycol. 52, 391-406 (2017).
7. Hurtado, A. Q., Gerung, G. S., Yasir, S. & Critchley, A. T. Cultivation of tropical red seaweeds in the BIMP-EAGA region. 707-718 (2014) doi:10.1007/s10811-013-0116-2.
8. Kumar, K. S., Ganesan, K. & Rao, P. V. S. Seasonal variation in nutritional composition of Kappaphycus alvarezii ( Doty ) Doty — an edible seaweed. 52, 2751-2760 (2015).
9. Aminah, A. & Xiren, G. K. Proximate composition and total amino acid composition of Kappaphycus alvarezii found in the waters of Langkawi and Sabah, Malaysia. Int. Food Res. J. 24, 1255-1260 (2017).
10. Fadilah, S., Alimuddin, Pong-Masak, P. R., Santoso, J. & Parenrengi, A. Growth, Morphology and Growth Related Hormone Level in Kappaphycus alvarezii Produced by Mass Selection in Gorontalo Waters, Indonesia. HAYATI J. Biosci. 23, 29-34 (2016).
11. Mondal, D. et al. Elimination of gibberellin from Kappaphycus alvarezii seaweed sap foliar spray enhances corn stover production without compromising the grain yield advantage. Plant Growth Regul. 75, 657-666 (2015).
12. Chew, Y. L., Lim, Y. Y., Omar, M. & Khoo, K. S. Antioxidant activity of three edible seaweeds from two areas in South East Asia. LWT - Food Sci. Technol. 41, 1067-1072 (2008).
13. Bhuyar, P., Rahim, M. H., Sundararaju, S., Maniam, G. P. & Govindan, N. Antioxidant and antibacterial activity of red seaweed; Kappaphycus alvarezii against pathogenic bacteria. Glob. J. Environ. Sci. Manag. 6, 47-58 (2020).
14. Matanjun, P. & Muhammad, K. Functional Food Laboratory, Faculty of Food Science and Technology and 2 School of Food Science and Nutrition, University of Malaysia Sabah, Kota Kinabalu, Sabah; and 3 Faculty of Veterinary Medicine, University of Putra Malaysia, Serdang, Selangor, Malay. J. Med. Food 13, 1-10 (2010).
15. Karimzadeh, K. & Zahmatkesh, A. Phytochemical screening, antioxidant potential, and cytotoxic effects of different extracts of red algae (Laurencia snyderiae) on HT29 cells. Res. Pharm. Sci. 16, 400-413 (2021).
16. R. Kanatt, S., Lahare, P., P. Chawla, S. & Sharma, A. Kappaphycus alvarezii : Its antioxidant potential and use in bioactive packaging films. J. Microbiol. Biotechnol. food Sci. 5, 1-6 (2015).
17. Shahidi, F. & Zhong, Y. Novel antioxidants in food quality preservation and health promotion. Eur. J. Lipid Sci. Technol. 112, 930-940 (2010).
18. Jerez-Martel, I. et al. Phenolic profile and antioxidant activity of crude extracts from microalgae and Cyanobacteria strains. J. Food Qual. 2017, (2017).
19. Liu, R. & Mabury, S. A. Synthetic Phenolic Antioxidants: A Review of Environmental Occurrence, Fate, Human Exposure, and Toxicity. Environ. Sci. Technol. 54, 11706-11719 (2020).
20. Singh, S., Singh, M. K., Singh, A. K. & Singh, C. S. Application of Seaweed Sap (Kappaphycusalvarezii and Gracilariaedulis) for Higher Productivity of Maize (Zea mays L.). Res. Pap. Res. J. Agric. Sci. 6, 232-234 (2015).
21. Matheus, A. da C. et al. Kappaphycus alvarezii extract used for the seed treatment of soybean culture. African J. Agric. Res. 12, 1054-1058 (2017).
22. Garai, S. et al. Impact of seaweed sap foliar application on growth, yield, and tuber quality of potato (Solanum tuberosum L.). J. Appl. Phycol. 33, 1893-1904 (2021).
23. Marinho-Soriano, E., Fonseca, P. C., Carneiro, M. A. A. & Moreira, W. S. C. Seasonal variation in the chemical composition of two tropical seaweeds. Bioresour. Technol. 97, 2402-2406 (2006).
24. Tirtawijaya, G. et al. Neurotrophic activity of the carrageenophyte Kappaphycus alvarezii cultivated at different depths and for different growth periods in various areas of Indonesia. Evidence-based Complement. Altern. Med. 2018, (2018).
25. Cotas, J. et al. Seaweed phenolics: From extraction to applications. Mar. Drugs 18, (2020).
26. Araújo, P. G. et al. Seasonal variation of nutritional and antioxidant properties of different Kappaphycus alvarezii strains (Rhodophyta) farmed in Brazil. J. Appl. Phycol. 34, 1677-1691 (2022).
27. Francavilla, M., Franchi, M., Monteleone, M. & Caroppo, C. The red seaweed gracilaria gracilis as a multi products source. Mar. Drugs 11, 3754-3776 (2013).
28. Sampath-Wiley, P., Neefus, C. D. & Jahnke, L. S. Seasonal effects of sun exposure and emersion on intertidal seaweed physiology: Fluctuations in antioxidant contents, photosynthetic pigments and photosynthetic efficiency in the red alga Porphyra umbilicalis Kützing (Rhodophyta, Bangiales). J. Exp. Mar. Bio. Ecol. 361, 83-91 (2008).
29. Khairy, H. M. & El-Sheikh, M. A. Antioxidant activity and mineral composition of three Mediterranean common seaweeds from Abu-Qir Bay, Egypt. Saudi J. Biol. Sci. 22, 623-630 (2015).
30. Parys, S. et al. Seasonal variation of polyphenolics in Ascophyllum nodosum (Phaeophyceae). Eur. J. Phycol. 44, 331-338 (2009).
31. Mannino, A. M., Vaglica, V. & Oddo, E. Seasonal variation in total phenolic content of Dictyopteris polypodioides (Dictyotaceae) and Cystoseira amentacea (Sargassaceae) from the Sicilian coast. Flora Mediterr. 24, 39-50 (2014).
32. Adharini, R. I., Setyawan, A. R., Suadi & Jayanti, A. D. Comparison of Nutritional Composition in Red and Green Strains of Kappaphycus Alvarezii Cultivated in Gorontalo Province, Indonesia. E3S Web Conf. 147, 3-7 (2020).
33. D’Armas, H., Jaramillo, C., D’Armas, M., Echavarría, A. & Valverde, P. Proximate composition of several green, brown and red seaweeds from the coast of Ecuador. Rev. Biol. Trop. 67, 61-68 (2019).
34. AOAC Official Metods of Analysis. Association of Official Analytical Chemists, Washington DC. en (ed. Helrich, K.) vol. 1 73-80 (2003).
35. Sisalema, Á. C. D. Evaluación de la actividad fitorreguladora de auxinas obtenidas a partir de un extracto de tallos de fréjol común (Phaseolus vulgaris L.) en cultivos de plantas in vitro. vol. 10 (Universidad Técnica de Ambato, 2018).
36. Prasad, K. et al. Detection and quantification of some plant growth regulators in a seaweed-based foliar spray employing a mass spectrometric technique sans chromatographic separation. J. Agric. Food Chem. 58, 4594-4601 (2010).
37. Diyana, F., Hisham, S., Chan, K. . & Abdullah, A. Antioxidant activity of red algae Kappaphycus alvarezii and Kappaphycus striatum. Int. Food Res. J. 22, 1977-1984 (2015).
38. Gordon, S. A. & Weber, R. P. Colorimetric estimation of indoleacetic acid. 192-195 (1951).
39. Gang, S., Sharma, S., Saraf, M., Buck, M. & Schumacher, J. Analysis of indole-3-acetic acid (IAA) production in Klebsiella by LC-MS/MS and the Salkowski method. Bio-Protocol 9, 1-9 (2019).
40. Avramova, V. et al. High antioxidant activity facilitates maintenance of cell division in leaves of drought tolerant maize hybrids. Front. Plant Sci. 8, (2017).
41. Viteri, R., Giordano, A., Montenegro, G. & Zacconi, F. Extractos de Eucryphia cordifolia : Cribado fitoquímico , actividades antibacterianas y antioxidantes. 5-8 (2022).
42. Čagalj, M., Skroza, D., Tabanelli, G., Özogul, F. & Šimat, V. Maximizing the antioxidant capacity of Padina pavonica by Choosing the Right drying and extraction methods. Processes 9, 1-15 (2021).
43. Musa, K. H. & Abdullah, A. Antioxidant Activity of Pink-Flesh Guava ( Psidium guajava L .): Effect of Extraction Techniques and Solvents. 100-107 (2011) doi:10.1007/s12161-010-9139-3.
44. Almeida, B. et al. Seasonal evaluation of phlorotannin-enriched extracts from brown macroalgae fucus spiralis. Molecules 26, 1-21 (2021).
45. Getachew, A. T., Jacobsen, C. & Holdt, S. L. Emerging technologies for the extraction of marine phenolics: Opportunities and challenges. Mar. Drugs 18, 1-22 (2020).
46. del Olmo, A., Picon, A. & Nuñez, M. Preservation of five edible seaweeds by high pressure processing: effect on microbiota, shelf life, colour, texture and antioxidant capacity. Algal Res. 49, (2020).
47. Paiva, L., Lima, E., Neto, A. I. & Baptista, J. Seasonal variability of the biochemical composition and antioxidant properties of fucus spiralis at two Azorean Islands. Mar. Drugs 16, (2018).
48. Ito, K. & Hori, K. Seaweed: Chemical composmon and potential food uses. Food Rev. Int. 5, 101-144 (1989).
49. Aroyehun, A. Q., Planieveloo, K. & Farid Ghazali, M. R.-I. and A. R. Effects of seasonal variability on the physicochemical,biochemical,and nutritional composition of Western Peninsular Malaysia Gracilaria manilaensis. molecules (2019).
50. Schiener, P., Black, K. D., Stanley, M. S. & Green, D. H. The seasonal variation in the chemical composition of the kelp species Laminaria digitata, Laminaria hyperborea, Saccharina latissima and Alaria esculenta. J. Appl. Phycol. 27, 363-373 (2015).
51. Afonso, C. et al. Seasonal changes in the nutritional composition of agarophyton vermiculophyllum (Rhodophyta, gracilariales) from the center of Portugal. Foods 10, (2021).
52. Wahidatul Husna Zuldin, R. S. Performance of red seaweed (Kappaphycus sp.)cultivates using tank culture system. J. Fish. Aquat. Sci. 8, 80-86 (2015).
53. Msuya, F. E. Effects of stocking density and additional nutrients on growth of the commercially farmed seaweeds Eucheuma denticulatum and Kappaphycus alvarezii in Zanzibar Tanzania. Tanzania J. Nat. Appl. Sci. 4, 605-612 (2013).
54. Makkar, H. P. S. et al. Seaweeds for livestock diets: A review. Anim. Feed Sci. Technol. 212, 1-17 (2016).
55. Khairy, H. M. & El-Shafay, S. M. Seasonal variations in the biochemical composition of some common seaweed species from the coast of Abu Qir Bay, Alexandria, Egypt. Oceanologia 55, 435-452 (2013).
56. Floreto, E. A. T., Hirata, H., Yamasaki, S. & Castro, S. C. Effect of Salinity on the Growth and Fatty Acid Composition of Ulva pertusa Kjellman (Chlorophyta). Bot. Mar. 37, 151-156 (1994).
57. Moreira, A. S. P. et al. Seasonal plasticity of the polar lipidome of Ulva rigida cultivated in a sustainable integrated multi-trophic aquaculture. Algal Res. 49, 101958 (2020).
58. El Maghraby, D. M. & Fakhry, E. M. Lipid content and fatty acid composition of Mediterranean macro-algae as dynamic factors for biodiesel production. Oceanologia 57, 86-92 (2015).
59. Kim, M. K., Dubacq, J. P., Thomas, J. C. & Giraud, G. Seasonal variations of triacylglycerols and fatty acids in Fucus serratus. Phytochemistry 43, 49-55 (1996).
60. Madden, M., Mitra, M., Ruby, D. & Schwarz, J. Seasonality of selected nutritional constituents of edible delmarva seaweeds. J. Phycol. 48, 1289-1298 (2012).
61. Moreira, A. S. P. et al. Polar Lipids of Commercial Ulva spp . of Different Origins : Profiling and Relevance for Seaweed Valorization. mdpi J. food (2021).
62. El-Manawy, I., Nassar, M. & Rashedy, S. Spatial and temporal variations in the nutritional composition of some seaweeds from the Red Sea, Egypt. Egypt. J. Phycol. 20, 29-50 (2019).
63. Rajauria, G., Cornish, L., Ometto, F., Msuya, F. E. & Villa, R. Identification and selection of algae for food, feed, and fuel applications. en Seaweed Sustainability 315-346 (Elsevier Inc., 2015). doi:10.1016/B978-0-12-418697-2/00012-X.
64. Queirós, A. S. et al. Valuable nutrients from ulva rigida: Modulation by seasonal and cultivation factors. Appl. Sci. 11, (2021).
65. Masaló, I.; Oca, J.; Ferrer, J.; Cremades, J.; Pintado, J.; Jiménez, P. Influence of Growing Conditions on Ulva Ohnoi Composition Cultivated in an IMTA-RAS System. 6-8 (2016).
66. Dewi, E. N., Darmanto, D. & Ambariyanto, A. Nutrition of Edible Seaweed Kappaphycus alvarezii Related to Different Environmental Coastal Water Condition. Omni-Akuatika 14, 59-65 (2018).
67. Abirami, R. G. & Kowsalya, S. Nutrient and nutraceutical potentials of seaweed biomass Ulva lactuca and Kappaphycus alvarezii. Agric. Sci. Technol. 5, 1-7 (2011).
68. Hurtado, A. Q., Reis, R. P. & Loureiro, R. Kappaphycus ( Rhodophyta ) Cultivation : Problems and the Impacts of Acadian Marine Plant Extract Powder. (2014) doi:10.1201/b17540-9.
69. Magnusson, M., Mata, L., de Nys, R. & Paul, N. A. Biomass, Lipid and Fatty Acid Production in Large-Scale Cultures of the Marine Macroalga Derbesia tenuissima (Chlorophyta). Mar. Biotechnol. 16, 456-464 (2014).
70. Khotimchenko, S. V. & Yakovleva, I. M. Lipid composition of the red alga Tichocarpus crinitus exposed to different levels of photon irradiance. Phytochemistry 66, 73-79 (2005).
71. Schmid, M., Guihéneuf, F. & Stengel, D. B. Plasticity and remodelling of lipids support acclimation potential in two species of low-intertidal macroalgae, Fucus serratus (Phaeophyceae) and Palmaria palmata (Rhodophyta). Algal Res. 26, 104-114 (2017).
72. Simatupang, N. F. et al. Growth and product quality of the seaweed Kappaphycus alvarezii from different farming locations in Indonesia. Aquac. Reports 20, 100685 (2021).
73. Denis, C. et al. Study of the chemical composition of edible red macroalgae Grateloupia turuturu from Brittany (France). Food Chem. 119, 913-917 (2010).
74. Lahaye, M., Jimenez, M. & Garcia-reina, G. Natural Decoloration , Composition and Increase in Dietary Fibre & tent of an Edible Marine Algae , Ulva rigida ( Chlorophyta ), Grown under Different Nitrogen Conditions. 99-104 (1995).
75. Yalcin, A. S. and I. The seasonal changes in endogenous levels of Iindole-3-Acetic acid,Gibberellic Acid,Zeatin and Abscisic Acid in Stems of some apple varieties(Malus sylvestris Miller).pdf. Asian J. Plant Sci. (2008).
76. Layek, J. et al. Seaweed extract as organic bio-stimulant improves productivity and quality of rice in eastern Himalayas. J. Appl. Phycol. 30, 547-558 (2018).
77. Pan, X. et al. Effects of gibberellin A 3 on growth and microcystin production in Microcystis aeruginosa ( cyanophyta ). 165, (2008).
78. Agarwal, P., Patel, K., Das, A. K., Ghosh, A. & Agarwal, P. K. Insights into the role of seaweed Kappaphycus alvarezii sap towards phytohormone signalling and regulating defence responsive genes in Lycopersicon esculentum. J. Appl. Phycol. 28, 2529-2537 (2016).
79. Dumale, J. V., Gamoso, G. R., Manangkil, J. M. & Divina, C. C. Detection and quantification of auxin and gibberellic acid in Caulerpa racemosa. Int. J. Agric. Technol. 14, 653-660 (2018).
80. Spagnuolo, D. et al. Screening on the Presence of Plant Growth Regulators in High Biomass Forming Seaweeds from the Ionian Sea (Mediterranean Sea). Sustain. 14, (2022).
81. Fellah, F., Louaileche, H., Dehbi-Zebboudj, A. & Touati, N. Seasonal variations in the phenolic compound content and antioxidant activities of three selected species of seaweeds from Tiskerth islet, Bejaia, Algeria. J. Mater. Environ. Sci. 8, 4451-4456 (2017).
82. Siatka, T. & Kašparová, M. Seasonal variation in total phenolic and flavonoid contents and DPPH scavenging activity of Bellis perennis L. flowers. Molecules 15, 9450-9461 (2010).
83. Ahmed, D., Baig, H. & Zara, S. Seasonal variation of phenolics, flavonoids, antioxidant and lipid peroxidation inhibitory activity of methanolic extract of Melilotus indicus and its sub-fractions in different solvents. Int. J. Phytomedicine 4, 326-332 (2012).
84. Farasat, M., Khavari-Nejad, R. A., Nabavi, S. M. B. & Namjooyan, F. Antioxidant activity, total phenolics and flavonoid contents of some edible green seaweeds from northern coasts of the Persian gulf. Iran. J. Pharm. Res. 13, 163-170 (2014).
85. Lombardo, S., Pandino, G., Mauro, R. & Mauromicale, G. Variation of phenolic content in globe artichoke in relation to biological, technical and environmental factors. Ital. J. Agron. 4, 181-189 (2009).
86. Pedro, J., Cardoso, C., Afonso, F. & Bandarra, N. M. Season affects three insufficiently studied seaweed species ( Bifurcaria bifurcata , Codium sp ., Ericaria selaginoides ): bioactivity alterations. Appl. Phycol. 3, 98-108 (2022).
87. Nenadis, N. et al. Interactive effects of UV radiation and reduced precipitation on the seasonal leaf phenolic content/composition and the antioxidant activity of naturally growing Arbutus unedo plants. J. Photochem. Photobiol. B Biol. 153, 435-444 (2015).
88. Mohamed, N. & Abdullah, A. Comparison of total phenolic content and antioxidant activity of Kappaphycus alvarezii from Langkawi and Semporna. AIP Conf. Proc. 1784, (2016).
89. Sobuj, M. K. A. et al. Effect of solvents on bioactive compounds and antioxidant activity of Padina tetrastromatica and Gracilaria tenuistipitata seaweeds collected from Bangladesh. Sci. Rep. 11, 1-13 (2021).
90. Kałużewicz, A. et al. The effects of plant density and irrigation on phenolic content in cauliflower. Hortic. Sci. 44, 178-185 (2017).
91. Danesi, F., Valli, V., Elementi, S. & D’Antuono, L. F. The Agronomic Techniques as Determinants of the Phenolic Content and the Biological Antioxidant Effect of Palm-Tree Kale. Food Nutr. Sci. 05, 1-7 (2014).
92. Björkman, M. et al. Phytochemicals of Brassicaceae in plant protection and human health - Influences of climate, environment and agronomic practice. Phytochemistry 72, 538-556 (2011).
93. Wu, L., Deng, Z., Cao, L. & Meng, L. Effect of plant density on yield and Quality of Perilla sprouts. Sci. Rep. 10, 1-8 (2020).
94. Cheng, S. Y., Xu, F. & Wang, Y. Advances in the study of flavonoids in Ginkgo biloba leaves. J. Med. Plants Res. 3, 1248-1252 (2009).
95. Ball, R. A., Purcell, L. C. & Vories, E. D. Short-season soybean yield compensation in response to population and water regime. Crop Sci. 40, 1070-1078 (2000).
96. Magnusson, M. et al. Manipulating antioxidant content in macroalgae in intensive land-based cultivation systems for functional food applications. Algal Res. 8, 153-160 (2015).
97. Tretiak, S. et al. Optimizing antioxidant activity in Agarophyton vermiculophyllum for functional packaging. Algal Res. 54, 102232 (2021).
98. Campos, A. M. et al. Azorean macroalgae (Petalonia binghamiae, Halopteris scoparia and Osmundea pinnatifida) bioprospection: a study of fatty acid profiles and bioactivity. Int. J. Food Sci. Technol. 54, 880-890 (2019).
Received: September 26, 2022 / Accepted: October 15, 2022 / Published:15 February 2023
Citation: Lema, E.; Choéz I; Ruíz O.; Jaramillo, L.; Pacheco, A.; Van Der Hende, S.; Manzano, P. Estudio de la variabilidad en el tiempo y espacio de la actividad antioxidante y composición bioquímico de Kappaphycus alvarezii en diferentes densidades de siembra. Revis Bionatura 2023;8 (1) 13. http://dx.doi.org/10.21931/RB/2023.08.01.13
