2022.07.03.57
Files > Volume 7 > Vol 7 No 3 2022
Extracción asistida por ultrasonidos de licopenos con capacidad antioxidante provenientes de residuos agroindustriales de tomate de árbol (Solanum betaceum CAV.).
Ultrasound-assisted extracting lycopene with antioxidant capacity from tree tomato (solanum betaceum cav.) agroindustrial wastes.
1, 2, 3 Facultad de Ciencia e Ingeniería en Alimentos y Biotecnología, Universidad Técnica de Ambato, Ecuador.
4 Instituto de Farmacia y Alimentos, Universidad de la Habana, Cuba
Autor de correspondencia: Fernández, Danae [email protected]
Available from: http://dx.doi.org/10.21931/RB/2022.07.03.57
RESUMEN
El presente trabajo de investigación tuvo como objetivo la extracción de licopenos con capacidad antioxidante por medio de ultrasonidos, utilizando los residuos agroindustriales del tomate de árbol (Solanum betaceum Cav.). Se realizó la extracción a partir de los residuos vegetales previamente secos y molidos utilizando como disolvente etanol y se aplicó un diseño experimental 33. Se estudió la influencia de los factores relación material vegetal/volumen de disolvente (1/2.5; 1/5; 1/10), temperatura de extracción (20, 30 y 40 oC) y tiempo de extracción (15, 30 y 60 minutos) sobre el porcentaje de eficiencia de extracción. Loa resultados óptimos se alcanzaron con una relación de material vegetal/volumen de disolvente de 1/10, una temperatura de extracción de 40 oC y un tiempo de extracción de 60 minutos. Se realizaron pruebas in vitro a través de la técnica de DPPH (2,2-diphenil-1-1picrylhydrazyl) e in vivo utilizando Saccharomyces cerevisiae como modelo, para verificar la actividad antioxidante del extracto de licopenos. Se obtuvo mediante la prueba in vitro un porcentaje de inhibición de radicales libres de 60,23 % lo que representa 693,81 μmol/l de Trolox. La célula logró superar el estrés oxidativo en presencia del extracto de licopenos al ser expuesta a una concentración de 3 mmol/l de peróxido de hidrógeno presentando valores de crecimiento celular muy similares a los obtenidos con la vitamina C.
Palabras claves: Extracción, método no convencional, carotenoides, actividad antioxidante, DPPH, Saccharomyces cerevisiae.
ABSTRACT
This research work's objective was to extract lycopene with antioxidant capacity using ultrasound, using the agro-industrial residues of the tree tomato (Solanum betaceum Cav.). The extraction was carried out from the plant residues previously dried, and ground using ethanol as a solvent and an experimental design 33 was applied. The influence of the factors concerning plant material/solvent volume (1/2.5; 1/5; 1 /10), extraction temperature (20, 30 and 40 oC) and extraction time (15, 30 and 60 minutes) on the percentage of extraction efficiency. Optimum results were achieved with a ratio of plant material/solvent volume of 1/10, an extraction temperature of 40 °C and an extraction time of 60 minutes. In vitro tests were performed through the DPPH (2,2-diphenyl-1-1picrylhydrazyl) technique and in vivo using Saccharomyces cerevisiae as a model to verify the antioxidant activity of the lycopene extract. Through the in vitro test, a free radical inhibition percentage of 60.23% was obtained, which represents
693.81 μmol/l of Trolox. The cell overcame oxidative stress in the presence of the lycopene extract when exposed to a concentration of 3 mmol/l of hydrogen peroxide, presenting cell growth values very similar to those obtained with vitamin C.
Keywords: Extraction, unconventional method, carotenoids, antioxidant activity, DPPH, Saccharomyces cerevisiae.
INTRODUCCIÓN
El tomate de árbol (Solanum betaceum Cav.) es una de las frutas con mayor interés comercial tanto nacional como internacional en países como España, Holanda, Suecia, Alemania y Francia. Por sus altos niveles de comercialización y sus excelentes características sensoriales es clasificado como un fruto de alta exportación. En Ecuador la mayor parte de cultivos se basan en los frutales andinos, tomando en cuenta que el más importante es el cultivo del tomate de árbol en las zonas con un clima frío templado. En el país la producción agrícola es uno de los pilares fundamentales para avanzar con el progreso de sus provincias1. Se ha determinado que el cultivo del tomate de árbol genera ingresos que alcanzan los 20 000 dólares al año2. Es una excelente fuente de sustancias nutricionales como: pro-vitamina A, vitamina B6, vitamina E, ácido ascórbico, licopenos, y flavonoides. Presenta baja concentración en carbohidratos de alto peso molecular3.
El licopeno se considera como un pigmento vegetal que se encuentra en el grupo de los carotenoides con alta actividad antioxidante. El tomate de árbol (Solanum betaceum Cav.) contiene un 82 % de licopeno en su composición. Presenta propiedades que son desconocidas por la población lo cual hace que la piel del tomate sea descartada como abonos en terrenos4.
Se han extraído compuestos bioactivos del tomate de árbol, obteniendo 36,5 mg de carotenoides por kg de residuos secos utilizando como disolventes acetato de etilo y hexano, mientras que al utilizar etanol se logró obtener 6,1 mg/kg5.
Los desechos generados por las industrias alcanzan alrededor de 2 074 toneladas por día, representando un 53,81 % los de origen orgánico6. Los residuos que se obtienen de los procesos industriales son una gran fuente de licopenos, estos se encuentran en cantidades entre 600 – 800 μg de carotenos/100 g de cáscara en el tomate de árbol4, por lo que en esta investigación se plantea una alternativa para aprovechar los residuos agroindustriales producidos en la industria alimentaria.
MATERIALES Y MÉTODOS
Tratamiento del material vegetal
Los residuos agroindustriales del tomate de árbol se recolectaron de la planta Hortifrutícola Ambato Compañía Anónima (Planhofa C.A), y posteriormente se trasladaron a los laboratorios de la Unidad Operativa de la Dirección de Investigación y Desarrollo (UODIDE) en la Facultad de Ciencia e Ingeniería en Alimentos y Biotecnología (FCIAB), de la Universidad Técnica de Ambato. El material vegetal fue sometido a un proceso de secado convectivo por 24 horas a una temperatura de 50 °C en el horno con circulación forzada de aire marca GANDER MTN, seguido de un proceso de reducción de tamaño de partículas utilizando un molino de cuchillas marca INOX-EQUIP7.
Obtención de los extractos vegetales
Los residuos secos y pulverizados fueron sometidos a una extracción utilizando un baño ultrasónico marca BRANSON 2800 y como disolvente orgánico etanol al 96 % de pureza. Se analizó la influencia de los factores: temperatura (20, 30 y 40 °C), tiempo de extracción (15, 20 y 60 min) y relación material vegetal/volumen de disolvente (1/2.5; 1/5; 1/10) sobre la variable respuesta: porcentaje de eficiencia de la extracción (% E/E).
Análisis de los extractos vegetales
Determinación de la concentración de licopenos
Se determinó la absorbancia de cada extracto (A) a una longitud de onda de 471 nm, utilizando el espectrofotómetro UV-VIS Multiskan GO (Thermo Scientific, Dinamarca). Se calculó la concentración de licopenos (C) mediante la Ecuación I, considerando una absortividad para el etanol de 3450 (E)5.
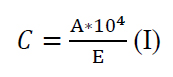
Determinación del porcentaje de eficiencia de la extracción
La eficiencia de la extracción se determinó en porcentaje a través de la relación entre la masa de licopenos extraídos (ML) y el material vegetal (MV) utilizado para la extracción (II)
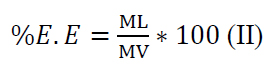
Determinación de la actividad antioxidante in vitro con el método del radical 2,2-diphenil-1-1picrylhydrazyl (DPPH)
Se determinó la capacidad que tienen los extractos para capturar radicales libres utilizando el método de DPPH en una placa de 96 pocillos. Se utilizó 20 μl del extracto obtenido con la mejor variante de los factores estudiados, diluido en una solución estándar de 180 μl de DPPH (Sigma-Aldrich, USA) de concentración de 150 μmol/l disueltos en metanol-agua (80:20) con una agitación durante 60 segundos. Se incubó la placa durante 40 minutos en la oscuridad a temperatura ambiente, y posteriormente se determinó la absorbancia a 515 nm (Abs muestra) a una temperatura de 25 °C en el lector multiplaca (Fisher Scientific, Finlandia)8.
Se elaboró una curva de calibración con soluciones estándar de Trolox (Sigma Aldrich, Alemania), con concentraciones de 50, 100, 200, 300, 400 y 500 μmol/l.
La actividad antioxidante se expresó como porcentaje de inhibición de DPPH (% de inhibición DPPH), que correspondió a la cantidad de radical DPPH neutralizado por los licopenos presentes en el extracto; de acuerdo con la siguiente ecuación:
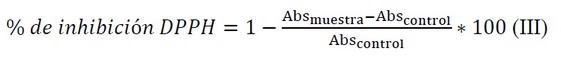
La absorbancia control (Abs control) está representada por la solución de metanol y agua en una proporción 80:20.
Determinación de la actividad antioxidante in vivo con Saccharomyces cerevisiae
Para evaluar la capacidad antioxidante del extracto obtenido se evaluó el crecimiento de la levadura Saccharomyces cerevisiae sometida a estrés oxidativo con peróxido de hidrógeno. Se utilizaron levaduras de un sobre comercial de panadería (Levapan, Ecuador), las cuales se aislaron mediante estría compuesta en medio PDA, con incubación a 28 °C por 72 horas y posteriormente conservadas en refrigeración a 4 °C9. Se comparó el crecimiento de la levadura en estrés, al estar expuestas a la vitamina C y al extracto de licopenos, utilizando como control la levadura sin someterse a estrés oxidativo.
Análisis estadístico
En el análisis estadístico se utilizó el software Statgraphics Centurion XVI.I. Se elaboró un diseño factorial 33 para determinar la influencia de los factores temperatura, tiempo de extracción, y relación material vegetal/volumen de disolvente en tres niveles cada uno, así como sus interacciones sobre la variable respuesta: porcentaje de eficiencia de la extracción (% E.E). Se consideraron diferencias significativas un valor-p < 0,05.
RESULTADOS
Obtención de los extractos vegetales
Se realizó un análisis de varianzas para la determinación de la influencia de los factores: temperatura de extracción, tiempo de extracción y relación material vegetal/volumen de disolvente sobre el porcentaje de eficiencia de la extracción, evidenciando diferencias significativas para el tiempo de extracción y la relación material vegetal/volumen de disolvente (Tabla 1). La interacción cuadrática de la temperatura de extracción (AA), la interacción cuadrática del tiempo de extracción (BB) y la interacción cuadrática entre el tiempo y la relación material vegetal/volumen de disolvente (BC) tienen también influencia significativa sobre el porcentaje de eficiencia de extracción. A diferencia de la interacción cuadrática entre la temperatura de extracción y la relación material vegetal/volumen de extracción (AC) que presentó un valor-P muy cercano a 0,05, influyendo en la extracción y teniendo gran influencia en el porcentaje de eficiencia de extracción de licopeno al emplear ultrasonido7. Cuando se realiza una extracción y se somete a altas temperaturas, los principios activos pueden degradarse, por lo que la temperatura es un factor de gran importancia en la extracción10.
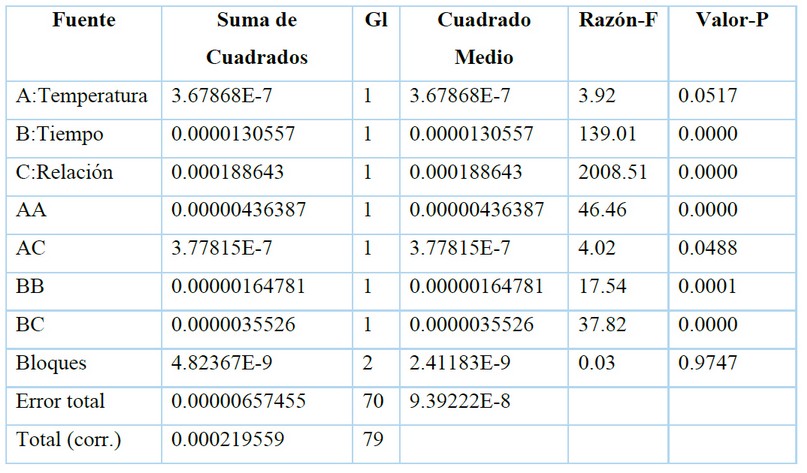
Tabla 1. Análisis de varianza para el porcentaje de eficiencia de extracción
El diagrama de Pareto (Figura 1) muestra que la relación material vegetal/volumen de disolvente ha influido de manera positiva en la extracción, mientras mayor es esta relación, el porcentaje de extracción fue mayor, debido a que la masa de material vegetal es menor evitando que el etanol se sature.
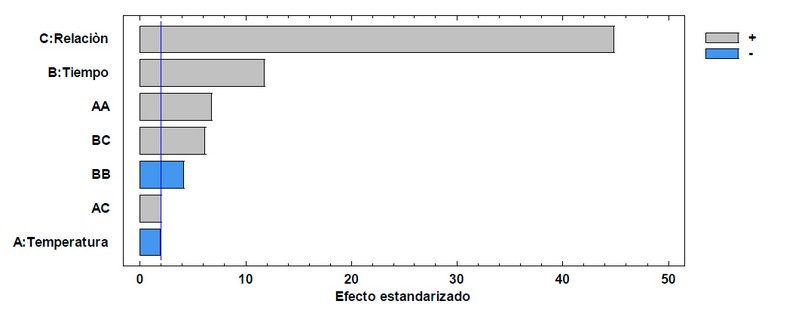
Figura 1. Diagrama de Pareto estandarizado para el porcentaje de eficiencia de la extracción.
En el gráfico de efectos principales (Figura 2) se corroboró que a medida que aumenta el tiempo de extracción y la relación material vegetal/volumen de disolvente, aumenta el porcentaje de eficiencia de extracción, mientras que, al aumentar la temperatura, disminuye este, hasta una temperatura de 30 oC y después aumenta hasta los 40 oC.
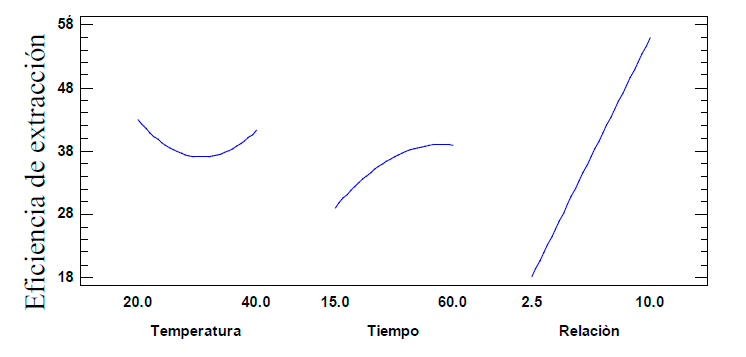
Figura 2. Gráfica de efectos principales para el porcentaje de la eficiencia de extracción.
En la Figura 3 se muestra el Diagrama de Superficie de Respuesta donde se presenta un punto máximo con la temperatura de extracción de 40 °C, un tiempo de extracción de 60 minutos y la relación material vegetal/volumen de disolvente 1:10, optimizando estos factores se obtiene un porcentaje de eficiencia de extracción de 0,00076 % (Tabla 2). Este valor representa 220,22 mg de licopeno en 100 gramos de sólidos extraídos, comparándolos con estudios previamente realizados de extracción con disolventes orgánicos se obtuvo 121,3 mg/100 g de sólidos, por lo que en el proceso de extracción asistida con ultrasonidos se alcanzó mayor eficiencia, lo que se atribuye a la ruptura que estas ondas ultrasónicas producen en las células vegetales11. El contenido de licopenos en 1 g de material de desecho agroindustrial seco para la cáscara de tomate de árbol está entre 165,11 – 179,56 μg12; comparándolo con el porcentaje de eficiencia de extracción obtenido en este estudio, corresponde a 7,6 μg por gramo de residuo, lo que evidencia que con la tecnología aplicada se pudo extraer aproximadamente el 24 % de los licopenos presentes en los residuos13.
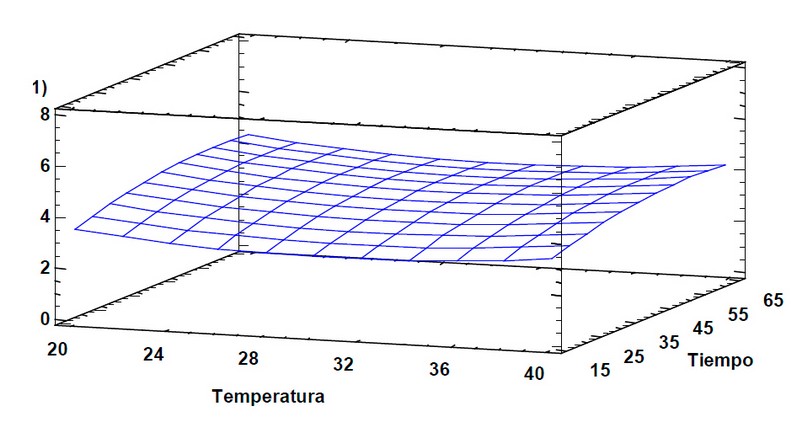
Figura 3. Diagrama de Superficie de Respuesta estimada para el porcentaje de la eficiencia de la extracción.
Determinación in vitro actividad antioxidante por el método del radical 2,2-diphenil-1-1-picrylhydrazil (DPPH)
En la Figura 4 se muestra la curva de calibración estándar con Trolox obteniendo siguiente ecuación de la recta: y =0,1983x – 3,3764 y un coeficiente de determinación ajustado de R² = 0,9992, en la ecuación se consideró como “x” a la concentración de Trolox e “y” como el porcentaje de inhibición.
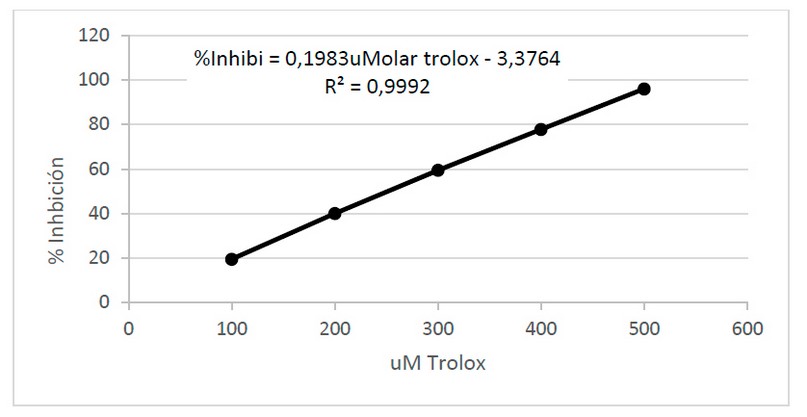
Figura 4. Curva de calibración para calcular el porcentaje de inhibición utilizando Trolox.
El extracto obtenido con los factores optimizados presentó un valor de inhibición de 60,23 %, lo que equivale a una concentración de 693,81 μmol/l de Trolox y 207,11 μmol/g de muestra. En estudios realizados con la tuna anaranjada (41,65 μmol trolox/g muestra), tuna verde (34,20 μmol trolox/g muestra), naranjilla (62,45 ± 13,22 μmol trolox/g muestra) y el taxo (55,47 ± 7,42 μmol trolox/g muestra) mostraron valores menores a los obtenidos en el extracto de licopenos14, 15.
Determinación in vivo de la actividad antioxidante con Saccharomyces cerevisiae
En las cinco curvas obtenidas en la Figura 5, donde se muestra la relación entre la absorbancia y el tiempo del cultivo, se observa que la curva de control negativo (Levadura con peróxido 3 mmol/l) fue la que menor crecimiento obtuvo como consecuencia de la oxidación a la que fue expuesta; presentó una fase de latencia de alrededor de 14 horas que comparado con la curva de crecimiento de Saccharomyces cerevisiae sin tratamiento se considera largo, esto se debió a que se requirió de un mayor tiempo de la célula para adaptarse al estrés expuesto.
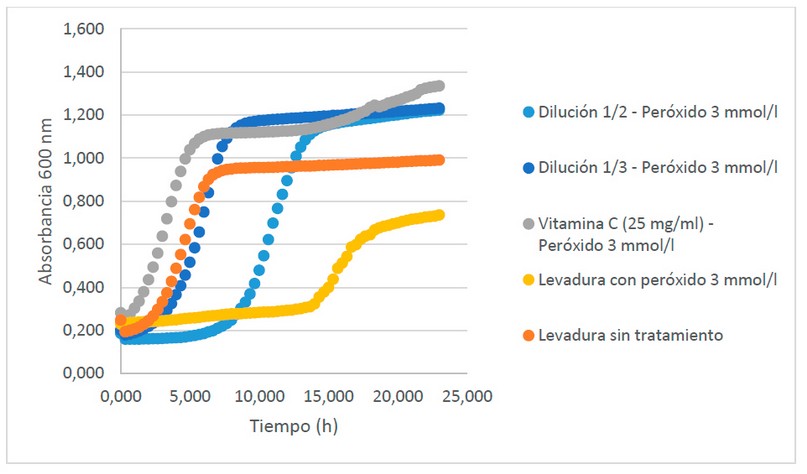
Figura 5. Actividad antioxidante del extracto rico en licopeno (Diluciones 1/2 y1/3) in vivo con Saccharomyces cerevisiae.
El peróxido de hidrógeno es conocido por formar especies reactivas de oxígeno (ROS) lo cual expone a las células a un considerable estrés16, es considerado como un agente oxidante altamente reactivo. Cuando este agente es aplicado a levaduras es considerado como un tóxico por lo que reacciona con las macromoléculas del microorganismo para modificar la estructura y función, producir un desbalance en la célula ocasionando estrés oxidativo y desencadenando la muerte celular17. La biomasa del caldo de cultivo se relaciona con la turbidez que se evidencia en el medio por esta razón se determinó su crecimiento máximo con un valor de absorbancia de 0,736 en medio YPD18 comparado con el valor del estudio de 0,991, este fue superior.
La fase de latencia de la curva de control positivo (Vitamina C (25 mg/ml) – Peróxido 3mmol/l) fue de 4 horas aproximadamente, debido a la presencia de la vitamina C que es considerada como un antioxidante altamente efectivo que contrarresta los efectos que produce el peróxido de hidrógeno en la levadura. Se considera como un antioxidante a un elemento que tiene la capacidad de donar electrones al radical libre inestable para evitar la oxidación de otros compuestos19.
Para el tratamiento de las diluciones 1/2 (Dilución 1/2 - Peróxido 3mmol/l) y 1/3 (Dilución 1/3 - Peróxido 3mmol/l) del extracto rico en licopenos de las cáscaras de tomate de árbol (Solanum betaceum Cav.) las fases de latencia duraron 7 y 2 horas respectivamente, obteniendo valores de absorbancias máximas superiores a la de los otros tratamientos, por lo que se logró comprobar que el extracto de licopenos presentó capacidad antioxidante ya las células lograron superar los efectos que causa en su estructura celular la exposición al peróxido de hidrógeno.
CONCLUSIONES
Se extrajeron licopenos con capacidad antioxidante por medio de la asistencia de ultrasonidos, utilizando los residuos agroindustriales de tomate de árbol (Solanum betaceum Cav.).
Se desarrolló una tecnología de extracción asistida por ultrasonidos para la extracción de licopenos, a partir de los residuos agroindustriales de tomate de árbol (Solanum betaceum Cav.), se optimizó el proceso con un tiempo de 60 minutos, temperatura de 40 °C y relación material vegetal/volumen de disolvente de 1:10 para un porcentaje de eficiencia de extracción de 0,00076%.
Se determinó la capacidad antioxidante in vitro del extracto rico en licopenos aplicando el método químico de DPPH, obteniendo un porcentaje de inhibición del 60,23 %, lo que equivale a una concentración equivalente de Trolox de 693,81 μmol/l.
Se determinó la capacidad antioxidante in vivo del extracto rico en licopenos utilizando Saccharomyces cerevisiae como modelo, evidenciando que la célula logró superar el estrés oxidativo al ser expuesta a una concentración de 3 mmol/l de peróxido de hidrógeno presentando valores de crecimiento celular muy similares a los obtenidos con la vitamina C.
REFERENCIAS
1. La Hora. Pelileo pionero en la producción de tomate de árbol : Noticias Tungurahua : La Hora Noticias de Ecuador, sus provincias y el mundo. (2017). Available at: https://lahora.com.ec/noticia/1102091907/pelileo-pionero-en-la-produccion-de-tomate-de-arbol. (Accessed: 12th April 2021)
2. Maita, S. Todo el año hay tomate de árbol | El Comercio. (2011). Available at: https://www.elcomercio.com/actualidad/negocios/ano-hay-tomate-de-arbol.html. (Accessed: 12th April 2021)
3. Ordóñez, A. L., Balanza, M. E., Martín, F. R. & Flores, C. A. Estabilidad del Carotenoide Licopeno en Tomates en Conserva. Inf. tecnológica 20, 31–37 (2009).
4. Yamaguchi, M. Carotenoids: Food Sources, Production and Health Benefits – Nova Science Publishers. (2010). Available at: https://ebookcentral.proquest.com/lib/utaebooks/reader.action?docID=3021582&query=lycopene. (Accessed: 12th April 2021)
5. Strati, I. F. & Oreopoulou, V. Process optimisation for recovery of carotenoids from tomato waste. Food Chem. 129, 747–752 (2011).
6. INEC. Encuesta de Superficie y Producción Agropecuaria Continua-2018 |. (2018). Available at: https://www.ecuadorencifras.gob.ec/encuesta-de-superficie-y-produccion-agropecuaria-continua-2018/. (Accessed: 12th April 2021)
7. Cardona, E. M., Ríos, L. A., Restrepo V, G. M. & La Facultad De Química Farmacéutica, R. DE. EXTRACCIÓN DEL CAROTENOIDE LICOPENO DEL TOMATE CHONTO (Lycopersicum esculentum) EXTRACTION OF THE CAROTENOID LYCOPENE FROM CHONTO TOMATO (Lycopersicum esculentum). (2016).
8. Bobo-García, G. et al. Intra-laboratory validation of microplate methods for total phenolic content and antioxidant activity on polyphenolic extracts, and comparison with conventional spectrophotometric methods. J. Sci. Food Agric. 95, 204–209 (2015).
9. Peláez, A. UNIVERSITAT DE VALÈNCIA VALIDACIÓN FUNCIONAL DE EXTRACTOS POLIFENÓLICOS DE CACAO MEDIANTE ENSAYOS IN VIVO CON ORGANISMOS MODELO Tesis Doctoral. (2016).
10. Paar, A. Extracción por microondas. (2016). Available at: https://www.antonpaar.com/?eID=documentsDownload&document=57570&L=1. (Accessed: 12th April 2021)
11. Fernández, D. López, O.D. and Pérez, C. . 1 st International Congress of Food Science and Biotechnology. (2018).
12. Rubashvili, I. et al. Extraction and analysis of the major carotenoids of agro-industrial waste materials using sequential extraction techniques and high performance liquid chromatography. Eurasian J. Anal. Chem. 13, (2018).
13. Torres, A. Caracterización física, química y compuestos bioactivos de pulpa madura de tomate de árbol (Cyphomandra betacea) (Cav.) Sendtn. (2013). Available at: http://ve.scielo.org/scielo.php?pid=S0004-06222012000400010&script=sci_abstract. (Accessed: 12th April 2021)
14. Hurtado, P., Jurado, B., Ramos, E. & Calixto, M. Evaluación de la actividad antioxidante del extracto hidroalcohólico estandarizado de hojas de Juglans Neotropica Diels (nogal peruano). Revista de la Sociedad Química del Perú (Vol. 81) (2015). Available at: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1810-634X2015000300010. (Accessed: 12th April 2021)
15. Encina, C. & Repo, R. Determinación de la capacidad antioxidante y compuestos bioactivos de frutas nativas peruanas. Revista de la Sociedad Química del Perú (Vol. 74) (2008). Available at: http://www.scielo.org.pe/scielo.php?script=sci_arttext&pid=S1810-634X2008000200004. (Accessed: 12th April 2021)
16. Liu, Y. S., Wu, J. Y. & Ho, K. P. Characterization of oxygen transfer conditions and their effects on Phaffia rhodozyma growth and carotenoid production in shake-flask cultures. Biochem. Eng. J. 27, 331–335 (2006).
17. Luis Folch-Mallol, J., Garay-Arroyo, A., Lledías, F. & Covarrubias Robles, A. A. edigraphic.com La respuesta a estrés en la levadura Saccharomyces cerevisiae MICROBIOLOGÍA MICROBIOLOGÍA.
18. Camacho, L. N. & Sáenz, R. T. Vista de IMPLEMENTACIÓN DE DIFERENTES TÉCNICAS ANALÍTICAS PARA LA DETERMINACIÓN DE BIOMASA BACTERIANA DE CEPAS Pseudomonas putida BIODEGRADADORAS DE FENOL. (2010). Available at: https://revistas.uis.edu.co/index.php/revistaion/article/view/954/1317. (Accessed: 12th April 2021)
19. Katsube, N., Iwashita, K., Tsushida, T., Yamaki, K. & Kobori, M. Induction of apoptosis in cancer cells by bilberry (Vaccinium myrtillus) and the anthocyanins. J. Agric. Food Chem. 51, 68–75 (2003).
Received: 21 April 2022 / Accepted: 28 June 2022 / Published:15 August 2022
Citation: Proaño J K; Fernández D, López O D, Iraizoz A. Extracción asistida por ultrasonidos de licopenos con capacidad antioxidante provenientes de residuos agroindustriales de tomate de árbol (Solanum betaceum CAV.). Revis Bionatura 2022;7(3) 57. http://dx.doi.org/10.21931/RB/2022.07.03.57
