2017.02.04.7
Files > Volume 2 > Vol 2 No 4 2017
INVESTIGATION / RESEARCH
Estandarización de un ensayo inmunoenzimático para la cuantificación de anticuerpos IgG contra el antígeno de superficie recombinante del virus de la Hepatitis B inducidos en conejos New Zealand.
Standardization of an immunoenzymatic assay for the quantification of IgG antibodies against the recombinant surface antigen of Hepatitis B virus induced in New Zealand rabbits
Yosbany Pérez-Barrios*, Yisabel Aranguren-Mazorra, Caridad Zayas-Vignier, Mabel Hernández-Cedeño, Carlos Espinosa-Viñals, Yanely Tirado-Hernández, Abel Fajardo-Sánchez, Maylín Álvarez-Tito, Alex Quintero-Pérez, Dagmar Garcia-Rivera, Reinaldo Acevedo Grogues+.
http://dx.doi.org/10.21931/RB/2017.02.04.7
_______________________________________________________________________________________________________________________
RESUMEN
La infección por el virus de la Hepatitis B está extendida por todo el mundo. Actualmente, miles de personas mueren a causa de este virus, por lo que es una necesidad desarrollar vacunas que protejan contra este patógeno. Existen vacunas basadas en el antígeno recombinante de superficie del virus de la Hepatitis B donde la eficacia protectora de la vacunación contra el virus está directamente relacionada con la inducción de anticuerpos contra el antígeno de superficie. Por tal razón, es muy importante de contar con una técnica sensible, específica y precisa que sea capaz de detectar niveles de anticuerpos en sueros. En este trabajo se representan los resultados del proceso de estandarización de un ELISA indirecto de cuantificación que se desarrolló con sueros de conejos New Zealand inmunizados con la vacuna comercial Heberpenta-L y una vacuna experimental combinada. En los cuales se determinó la concentración óptima de recubrimiento, el intervalo y linealidad de la curva, la precisión intra e interensayo, la especificidad y el límite de detección. La curva de calibración, generada con un estándar interno, presentó un buen ajuste lineal y un intervalo entre las diluciones 1/200 a 1/12800. Los coeficientes de variación en los ensayos de precisión estuvieron en los intervalos establecidos para cada uno (≤10%, ≤20% respectivamente). El ensayo presentó una especificidad óptima y se determinó el valor de corte que fue de 18,086 UA/mL. Estos resultados avalan el empleo de esta técnica en los laboratorios del Instituto Finlay de vacunas para la evaluación preclínica de nuevos candidatos vacunales combinados que protejan contra la Hepatitis B.
Palabras claves: Estandarización, ELISA, HBsAg, Hepatitis B
_______________________________________________________________________________________________________________________
SUMMARY
Hepatitis B virus infection is widely spread all over the world. Currently, thousands of people die from this virus, so effective vaccines need to be developed to protect against this pathogen. The most important vaccines are based on the recombinant surface antigen of Hepatitis B virus. The protective efficacy of vaccination against Hepatitis B is directly related to the induction of antibodies against this antigen, hence the need for a sensitive, specific and accurate technique to be able to detect levels of antibodies in sera. In this work we present the results of the standardization process of an indirect quantization ELISA, where determine the optimum coating concentration, the range and linearity of the curve, the intra and interassay precision, the specificity and the detection limit. The calibration curve was obtained with an internal standard. This showed a good linear fit and in a range of dilutions between 1/200 to 1/12800. The coefficients of variation in the precision tests were within the intervals established for each (≤10%, ≤20% respectively). The assay presented an optimum specificity and the cutoff value was determined to be 18.086 AU / mL. These results support the use of this technique in the Laboratory of Preclinical Immunology of the Finlay Institute of Vaccines for the evaluation of new combined vaccine candidates to protect against Hepatitis B.
Key words: Standardization, ELISA, HBsAg, Hepatitis B
_______________________________________________________________________________________________________________________
INTRODUCCIÓN
El virus de la hepatitis B (VHB), descrito en 1963, pertenece a la familia Hepadnaviridae. Cuenta con una nucleocápside icosaédrica y una envoltura lipídica. El genoma consiste en una molécula circular de ADN bicatenario de 3,2 kb, cuya cadena positiva está parcialmente incompleta en su extremo 3′.1
La infección por VHB es una de las infecciones virales crónicas más frecuente en el mundo. Un estimado de 2 mil millones de personas han sido infectadas y más de 350 millones son portadores crónicos del virus. En el 2010, la infección por VHB clasificó entre las principales prioridades de salud del mundo, y fue la décima causa principal de muerte (786 000 muertes al año). 2
La prevención mediante vacunación es la única estrategia eficaz para evitar la enfermedad. Desde 1987, vacunas recombinantes derivadas de levaduras han sido licenciadas. Estas contienen la proteína de superficie del virus de la hepatitis (proteína S, HBsAg). 3 La producción de vacunas por técnicas de ADN recombinante ha posibilitado expresar el gen S del antígeno de superficie del virus en varios hospederos. 4 El antígeno se produce actualmente en levaduras como Saccharomyces cerevisiae, Hansenula polymorpha y Pichia pastoris y también en células de mamíferos. Estos antígenos recombinantes forman parte de vacunas preventivas establecidas en el mercado. 5, 6
En la actualidad, el HBsAg se encuentra formando parte también de nuevas formulaciones combinadas, que han permitido la inmunización simultánea contra múltiples enfermedades. 7
La eficacia protectora de la vacunación contra la Hepatitis B está directamente relacionada con la inducción de anticuerpos anti-HBsAg. 8 Existen varios modelos animales en estudios preclínicos que pueden ser utilizados para evaluar la inducción de anticuerpos anti HBsAg, entre ellos ratones, curieles y conejos. 6
A partir de la necesidad actual de desarrollar vacunas que protejan contra varios antígenos, en el Instituto Finlay de Vacunas de Cuba existe un proyecto para la obtención de una vacuna combinada. Esta nueva formulación contendrá el HBsAg, con variaciones en la composición antigénica y del sistema de adyuvante.
Para determinar la respuesta humoral inducida contra el HBsAg en la nueva formulación combinada, es necesario contar con una técnica inmunoenzimática de tipo ELISA. Por tal razón, se planteó como objetivo principal la estandarización de dicha técnica, utilizando conejos como modelo preclínico experimental.
MATERIALES Y MÉTODOS
Selección del soporte sólido
Se utilizaron placas de poliestireno de 96 pocillos Maxi Sorp (Nunc Dinamarca) de alta captación. Este material fue seleccionado dada su excelente cualidad óptica, por facilitar enlaces estables y su dureza mecánica.
Muestras empleadas
Antígeno
Como antígeno de captura se empleó el HBsAg, lote (02/IFA/c4185) con una concentración inicial de 0,7 mg/mL. Este antígeno fue producido y gentilmente donado por el Centro de Ingeniería Genética y Biotecnología de La Habana, Cuba.
Vacuna combinada: Se emplearon 4 lotes de una vacuna experimental combinada, los cuales fueron elaborados por el grupo de formulación del Laboratorio de Inmunología Preclínica, perteneciente al departamento de Evaluación de Biológicos del Instituto Finlay de Vacunas. Este nuevo candidato vacunal contiene en su formulación el antígeno de interés en combinación con otros inmunógenos absorbidos en fosfato de aluminio. Todos los antígenos constituyentes se encuentran formando parte de vacunas licenciadas en la actualidad.
Vacuna Heberpenta- L: Esta vacuna fue gentilmente donada por el Centro Ingeniería Genética y Biotecnología, La Habana, Cuba. El lote comercial utilizado fue 4AA1406/0. Esta vacuna en su formulación está constituida por varios ingredientes antigénicos activos purificados, entre las que se encuentra la proteína recombinante de superficie de Hepatitis B.
Placebo: Solución de fosfato de aluminio (AlPO4) a la misma concentración de la formulación de la vacuna combinada.
Animales de experimentación
Se emplearon conejos machos de la raza New Zealand, con un peso aproximado entre 1,5 y 1,8 Kg provenientes del Centro Nacional de Producción de Animales de Laboratorio (CENPALAB), Cuba. Los animales fueron alojados y adaptados según las normas establecidas para el trabajo con animales de laboratorio. Se mantuvieron 7 días en cuarentena antes de iniciar los experimentos, con libre acceso al agua y a la comida. Los experimentos realizados fueron aprobados por el Comité de Ética del Instituto, siguiendo las normas nacionales e internacionales para el trabajo con animales (EEC Council Directive 86/609. Guide for the Care and Use of Laboratory Animals 2010). 9
Preparación de los materiales de referencias de trabajo
Esquema de inmunización
El esquema de inmunización contó con cuatro lotes de la vacuna combinada, un placebo y un grupo control positivo del experimento inmunizado con la vacuna comercial Heberpenta- L. Se inmunizaron con cada vacuna a 5 conejos y el placebo a 10 conejos por vía intramuscular para un total de 35 animales. Se empleó un esquema de tres dosis de 0,25 mL con un intervalo de 21 días entre dosis.
Suero hiperinmune
Se seleccionaron los sueros de animales con densidades ópticas superiores a 1 provenientes de los grupos inmunizados con las vacunas experimentales y se les dio una dosis de refuerzo de la vacuna experimental. Luego de 21 días, los animales fueron desangrados para recolectar la mayor cantidad de sangre posible. Posteriormente, se preparó la mezcla de sueros que se utilizó para la obtención del suero estándar interno.
Obtención del estándar
Para la realización del estándar interno de calibración, el suero hiperinmune de conejo fue purificado por un método cromatográfico, en este caso una cromatografía de afinidad empleando una matriz de proteína A Sepharose 4 Fast Flow. Se siguió el método descrito por Ulloa M et al., 2003 10, con modificaciones respecto a los tampones de unión (PBS 1x pH 7,4) y elución (ácido cítrico 0,1 M pH 3). Luego se le realizó a la fracción específica (AcP de conejo) un desalado contra PBS 1X.
Determinación de proteínas totales
Para la determinación de proteínas totales del suero purificado, se utilizó un método colorimétrico empleando el estuche comercial BCATM Protein Assay Kit según las recomendaciones descritas por el fabricante. Los resultados de la determinación de proteínas fueron leídos y procesados empleando un lector de microplacas Multiskan, a una longitud de onda de 540 nm y el software de cuantificación para Multiskan (Ascent 2.6®), respectivamente.
Pureza
La pureza del suero purificado se evaluó mediante SDS-PAGE al 12,5% en condiciones reductoras. Las imágenes del gel realizado fueron capturadas y procesadas utilizando el software ImageJ v1.50.
Estandarización de los ensayos inmunoenzimáticos
Recubrimiento: Se emplearon sueros positivos con títulos de anticuerpos contra el HBsAg, sueros negativos (placebo) y el blanco reactivo (EDTA- BSA 1%- PBS-Tween 20 al 0,05%). Se evaluaron concentraciones entre 0 y 40 µg/mL. Se definió como la concentración óptima de recubrimiento a una temperatura, tiempo y amortiguador definido, aquella en la que el suero estándar o el control positivo alcanzó la mayor señal, generalmente mantenida a concentraciones superiores (“meseta”), y la menor señal para el control negativo y el blanco reactivo.
Titulación del conjugado: Se utilizaron los mismos sueros descritos en el punto anterior. El conjugado se tituló en diluciones entre 1:6000 y 1:16000, con incrementos en 2000. Se seleccionó como dilución óptima aquella donde la señal del suero positivo fue mayor, y las del suero negativo y el blanco reactivo, menor.
Evaluación del rango lineal de la curva: El intervalo de la curva se determinó mediante tres ensayos en los que se evaluaron 12 diluciones seriadas con factor dos del suero hiperinmune purificado, comenzando en 1/50. En cada ensayo se procesaron seis réplicas del suero, para un total de 18 réplicas. Se promediaron las réplicas y se seleccionó el rango de la curva compuesta por siete puntos, en la que se alcanzó un coeficiente de determinación (R2) ≥ 0,98, un coeficiente de correlación (r) ≥ 0,99. Para cada ensayo, el coeficiente de variación (CV) debe ser menor del 10% entre las concentraciones de cada punto, una vez corregidas por el factor de dilución. El CV debe ser menor del 20% entre los tres ensayos realizados. El ajuste se determinó mediante un análisis de regresión lineal.
Paralelismo
Esta prueba fue empleada para avalar la linealidad y estimar la exactitud del método. Se procesaron en el mismo ensayo dos réplicas de cada punto de la curva de calibración. Se incluyeron al menos dos réplicas de siete diluciones de suero, desde 1/100 hasta 1/6400, de cuatro muestras procedentes de los animales inmunizados con la vacuna combinada. Se calculó el R2 de cada curva obtenida (R2≥0,98), así como el CV entre las concentraciones de cada muestra, una vez corregidas por el factor de dilución, que debe ser inferior al 10%.
Precisión
Intraensayo: La variabilidad intrínseca del ELISA se determinó mediante la precisión intraensayo. Se evaluó la repetibilidad a través del análisis de cinco réplicas, de cuatro sueros de concentraciones que estuvieran en el rango de la curva de calibración. Se determinaron el promedio, la desviación estándar y el coeficiente de variación. Este último parámetro estadístico no debía superar el 10% para considerar la precisión intraensayo como óptima. 11
Interensayo: Para su determinación se seleccionaron tres sueros de diferentes concentraciones y se evaluaron por triplicado en cuatro diluciones seriadas. La precisión interensayo se evaluó bajo tres condiciones diferentes: tres analistas un mismo día, un mismo analista mediante ensayos en paralelo y en días diferentes. El criterio de aceptación fue que el CV no supera el 20%. 12
Especificidad. Se evaluó a través de dos metodologías:
Se evaluaron individualmente los sueros de los 5 conejos inoculados con placebo mediante el ELISA. En la placa se aplicó la curva de calibración correspondiente como control positivo. Se estableció como criterio de aceptación que la respuesta del placebo debía ser inferior al primer punto de la curva de calibración.
La segunda metodología seguida para determinar la especificidad del ELISA de cuantificación estuvo encaminada a demostrar que los sueros de conejos inmunizados con diferentes inmunógenos polisacarídicos y proteicos no producen señal contra el antígeno de recubrimiento. Se incluyó además un suero de conejo de HBsAg como muestra francamente positiva.
Valores de corte: Para establecer los valores de corte que permitan discriminar los animales que respondieron adecuadamente de aquellos que no, se procesaron los resultados de la respuesta generada por los animales inmunizados con el control negativo (placebo). Los límites de corte se estimaron a partir del cálculo de la media de la respuesta de anticuerpos en unidades arbitrarias por mililitros (UA/mL) más dos desviaciones estándar (DE), para un 95% de confianza.
Descripción de los ELISA
En todos los casos se utilizó un ensayo inmunoenzimático en fase sólida, cuantitativo, de tipo indirecto.
Para la sensibilización de las placas de 96 pocillos Maxi Sorp (Nunc Denmark) se aplicaron 100 µL del HBsAg como antígeno de captura a la concentración óptima de recubrimiento escogida. Se empleó como solución de recubrimiento, buffer fosfato salino (PBS) 1X pH 7,2. Las placas se incubaron durante 12–18 h a 4 0C en cámara húmeda. Después, fueron lavadas tres veces con 300 µL por pocillos en un lavador de placas de ELISA (SUMA) con solución de lavado (H2O (d)-Tween 20 al 0,05%). Las muestras de sueros y el suero estándar se diluyeron con solución amortiguadora (EDTA-BSA 1% -PBS-Tween 20 al 0,05%). Las muestras y el control se aplicaron en 100 µL por pocillo y por duplicado; se realizaron diluciones seriadas, en base 2.
Las placas se incubaron 1 h a 37 0C en cámara húmeda y más tarde se lavaron de la forma descrita. Se adicionaron 100 µL por pocillo del conjugado en solución amortiguadora (EDTA-BSA 1% -PBS-Tween 20 al 0,05%). Se usó un anticuerpo anti-IgG de conejo conjugado a peroxidasa de rábano picante (SIGMA, USA). Se incubaron nuevamente 1 h a 37 0C en cámara húmeda y se aplicaron 100 µL por pocillo de disolución sustrato (H2O2 como sustrato, 3,3',5,5‘- tetrametilbenzidina como cromógeno, buffer citrato pH 5). Las placas se incubaron 25 min en la oscuridad y se detuvo la reacción con 50 µL por pocillo de solución de NaOH 2,5 N. Se leyeron las placas a 450 nm en un lector de placas de ELISA (Thermo Scientific).
Análisis Estadístico.
Las concentraciones de anticuerpos IgG contra HBsAg se determinaron mediante el programa computacional ELISA for Windows, del Centro para Enfermedades Infecciosas, desarrollado por Plikaytis y Carlone, 2005. 13
La desviación estándar (DE), el coeficiente de variación (CV) y el coeficiente de determinación (R2) se calcularon mediante el programa Microsoft Office Excel 2013. Los gráficos y tablas se construyeron en este mismo programa.
La prueba no paramétrica de Kruskal-Wallis se empleó para la comparación estadística de los tratamientos experimentales, con un nivel de significación del 95%. De existir diferencias, se aplicó la prueba no paramétrica de Dunnett de comparación múltiple. Se utilizó el programa GraphPad Prism 6.0. para graficar y analizar los datos experimentales.
RESULTADOS Y DISCUSIÓN
El desarrollo de vacunas combinadas se ha convertido en un tema de gran expectativa para la prevención de diferentes enfermedades mediante la vacunación. Este tipo de vacunas presenta múltiples ventajas como la reducción del costo de administración, la inmunización y protección contra diferentes enfermedades y el aumento de la aceptación de los programas de inmunización por la población y el personal médico en general. 14
Las exigencias legales para la introducción de una nueva vacuna combinada incluyen ensayos preclínicos y clínicos que demuestren una apropiada respuesta inmunológica frente a cada antígeno incluido. Además que no ocurran interferencias en las respuestas inmunes que ellos inducen, y principalmente que la eficacia protectora, así como los efectos secundarios, no superen en número y gravedad a los que las vacunas monovalentes o no combinadas inducen por separado. Las vacunas contra las infecciones causadas por el VHB, obtenidas por ingeniería genética, han conseguido superar todos estos requisitos cuando se han presentado en forma monovalente o combinada con otros antígenos. 15
A partir de la necesidad de desarrollar vacunas que combinen un mayor número de antígenos en una sola formulación y que protejan contra varios patógenos, se ha propuesto un nuevo proyecto de vacuna combinada para la infancia que contiene HBsAg como uno de los componentes antigénicos de esa formulación.
La cuantificación de anticuerpos frente a HBsAg se puede determinar mediante ELISA, con el empleo de un estándar previamente calibrado. En la actualidad existen ELISAs para dicha cuantificación, pero la gran mayoría de estos inmunoensayos son de tipo sándwich o inhibición, particularmente por la necesidad de una mayor sensibilidad que se requiere en la cuantificación de anticuerpos anti- HBsAg en muestras humanas. En este trabajo se reportan los resultados que se obtuvieron durante la estandarización de un ELISA de tipo indirecto que demostró ser suficiente para cuantificar la respuesta anti- HBsAg en suero de conejos New Zealand inmunizados con una combinación de antígenos donde se incluyó el mencionado antígeno de hepatitis B. Este trabajo permitirá no solo contar con un método y estándares para la evaluación de respuestas contra hepatitis B sino que permitirá el estudio preclínico de formulaciones vacunales combinadas.
Debido a que no existía un trabajo previo en el Instituto Finlay de Vacunas para detectar y cuantificar anticuerpos contra este antígeno, se decidió estandarizar un ELISA de cuantificación de tipo indirecto y obtener un estándar interno para la evaluación de los candidatos vacunales combinados en fase de investigación preclínica.
La concentración óptima de recubrimiento escogida fue aquella donde el control positivo alcanzó la mayor señal y el control negativo y el blanco reactivo la menor, a una temperatura, tiempo y amortiguador definido. 16
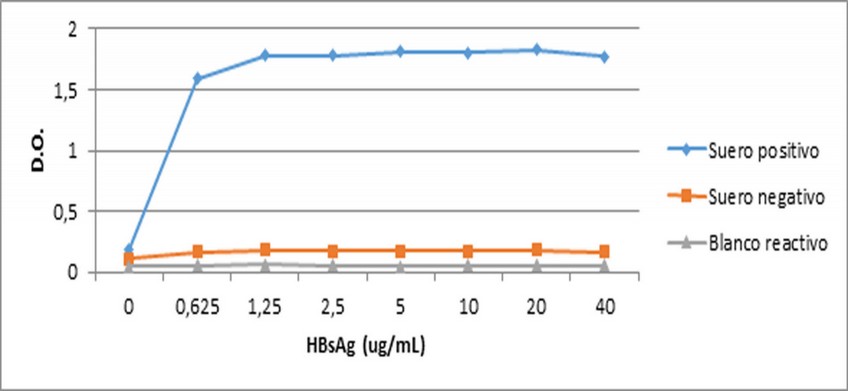
Figura 1. Evaluación de la concentración óptima de recubrimiento.
En la figura 1 se puede observar la concentración de recubrimiento óptima para este ensayo, la cual resulto ser 1,25 µg/mL, primera concentración en la que se alcanzó la meseta. Para este ensayo se decidió escoger un punto mayor de recubrimiento, en este caso 2,5 µg/mL. Este criterio se basó en lo planteado por Ochoa R et al., 2000 16, el cual expresa que en la práctica se prefiere recubrir con un ligero exceso de material biológico siempre y cuando se cumplan las condiciones.
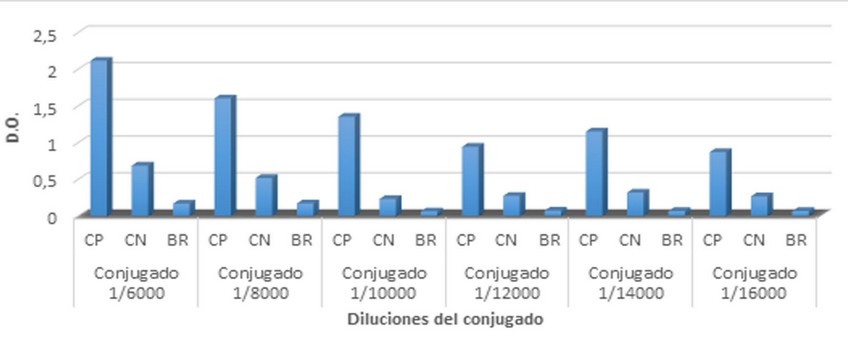
Figura 2. Evaluación de la dilución óptima del conjugado. Diluciones del conjugado a partir de 1/6000 hasta 1/16000. Control positivo (CP, mezcla de sueros respondedores contra el HBsAg), Control negativo (CN, mezcla de sueros de animales inmunizados con placebo), Blanco reactivo (BR, disolución de dilución).
En la figura 2 se muestran los resultados del estudio para determinar la dilución óptima del conjugado empleado. Se observó que la mayor relación del suero positivo con respecto al suero negativo y el blanco reactivo se obtuvo en la dilución 1:10 000. A esta dilución, se alcanzaron densidades ópticas para el suero positivo de 1,3 y 0,2 para el suero negativo. Como se pudo observar, diluciones inferiores a 1/10 000 generaron valores más altos del suero positivo, pero también para el suero negativo y el blanco reactivo. Además se prefiere utilizar diluciones de trabajo de conjugado lo más diluidas posibles, siempre y cuando cumpla los parámetros establecidos.
La curva de calibración se realizó a partir de un estándar interno, el cual se generó a partir de la mezcla de varios sueros respondedores y su posterior purificación. La purificación se realizó mediante cromatografía de afinidad con proteína A, seguida del desalado de la fracción de interés utilizando la columna Sephadex G-25. Los cromatogramas de cada etapa de purificación se muestran en la figura 3.
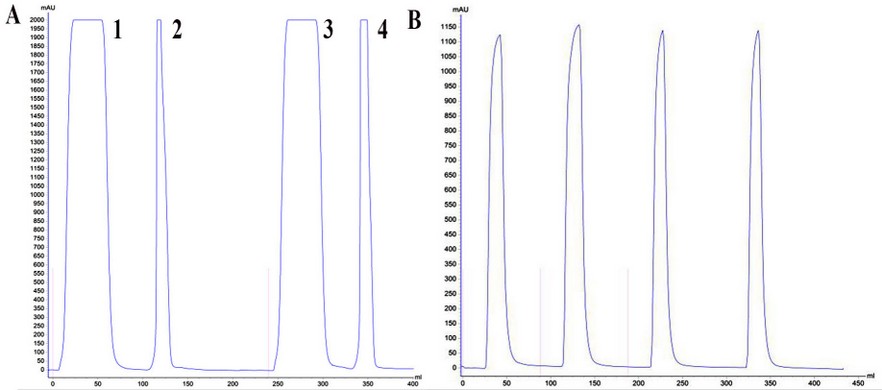
Figura 3. A) Cromatografía de afinidad utilizando una matriz de proteína A. Se realizaron dos corridas de 32 mL cada una. Los picos 1 y 3 corresponden a la fracción inespecífica y pico 2 y 4, a la fracción especifica. B) Cromatografía de exclusión molecular (desalado) a la fracción específica, empleando una matriz Sephadex G-25. Los cuatro picos mostrados se corresponden con cuatro corridas de 18 mL cada una.
En la figura 3A se observan dos picos que sobrepasan el valor máximo de absorbancia del equipo (2000 mAbs), lo que indica la presencia de grandes cantidades de proteínas en ambos. El primer pico corresponde a la fracción que no se une a la matriz de proteína A (fracción inespecífica) y que por tanto eluye en presencia del tampón de unión. Esta fracción está compuesta de todos aquellos contaminantes de origen proteico que se encuentran en altas concentraciones en sangre como albúmina, transferrina, alfa-2-macroglobulina, etc. El segundo pico, por su parte, correspondiente a la fracción específica (que contiene a la molécula de interés y que eluye al aplicar el tampón de elución), también satura la señal máxima del equipo. Posteriormente se neutralizó el pH de dicha fracción antes del desalado contra PBS (Figura 3 B).
La concentración final de proteínas del AcP (anticuerpo policlonal) de conejo, fue de 3,45 mg/mL. El recobrado del proceso de purificación fue estimado en 10,78 mg de AcP por mililitro de suero.
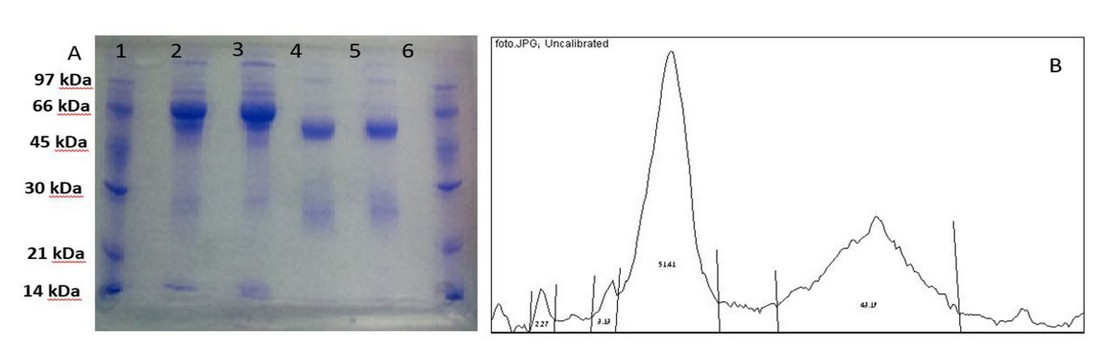
Figura 4. SDS-PAGE en condiciones reductoras. A) Corridas de las fracciones obtenidas. Los carriles 1 y 6 corresponden al patrón molecular. Los carriles 2 y 3 pertenecen al suero y fracción inespecífica con dilución 1/20 y 1/10 respectivamente. Los carril 4 y 5 pertenecen a la fracción específica antes y después del desalado. Por carril se aplicaron 10 µL de muestra. B) Electroforetograma del carril 5. Cada pico, de izquierda a derecha, se corresponde con las bandas que aparecen de arriba hacia abajo en dicho carril.
La pureza de los anticuerpos purificados se evaluó mediante una electroforesis condiciones reductoras en presencia de SDS. Los resultados obtenidos se muestran en la figura 4A. En la misma se observan 6 carriles de izquierda a derecha, donde en 1 y 6 se corrió el patrón de peso molecular. Los carriles 2, 3, 4 y 5 pertenecen al suero sin purificar, fracción inespecífica, fracción específica sin desalar y luego de desalar, respectivamente. Se puede constatar que el proceso de purificación fue eficiente pues a medida que avanzó, se eliminaron la mayoría de los contaminantes presentes en el suero. Esto se puede apreciar al contrastar los carriles 2 y 3, que muestran las bandas correspondientes al AcP y otras proteínas contaminantes; y los carriles 4 y 5. En estos últimos, los pesos moleculares de las bandas de mayor intensidad son de 50kDa y 25kDa aproximadamente lo que se corresponde a la cadena pesada y ligera de los AcP, respectivamente. También en estos carriles se observa la disminución de algunos contaminantes. El valor de pureza obtenido para el AcP purificado fue de 95% (análisis densitométrico con programa el ImageJ v1.50), que puede ser considerado de alta calidad y por tanto permite el empleo del AcP en técnicas inmunoquímicas. 17
Luego de la purificación del suero hiperinmune, se determinó el comportamiento de la curva, la cual mostró el típico comportamiento sigmoidal (figura 5).
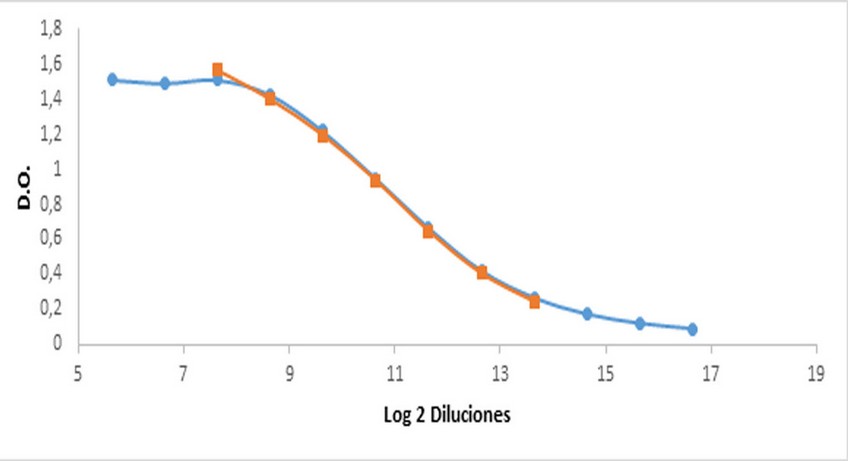
Figura 5. Exploración del rango lineal de la curva. Diluciones entre 1/50 a 1/102 400. Rango lineal de la curva (en rojo). Diluciones entre 1/200 a 1/12800. R2 = 0,9939; r = 0,9983.
Se seleccionaron las sietes diluciones con las que se alcanzó el coeficiente de determinación y correlación con valores por encima a los establecidos, según lo descrito en Materiales y Métodos. Las diluciones seleccionadas para la construcción de la curva de calibración fueron desde 1/200 a 1/12 800 (figura 5), alcanzando un coeficiente de determinación (R2) de 0,9939 y un coeficiente de correlación (r) de 0,9983. El estándar interno recibió una asignación arbitraria de 1000 (UA/mL), para su empleo como curva de calibración. La obtención de un estándar interno permitió suplir la carencia de un suero de referencia internacional de conejo en nuestro laboratorio. A pesar de que existen dos sueros estándar de referencia internacional para ser usado en ensayos diseñados para cuantificar anticuerpos contra HBsAg en suero humano 6, no se pueden emplear en este ensayo al no ser generado en la misma especie.
Para la determinación del paralelismo de la curva, se evaluaron muestras de alta, mediana y baja concentraciones. La curva se montó en las siete diluciones seleccionadas y las muestras se aplicaron en seis diluciones. En todos los casos los R2 obtenidos fueron superiores a 0,98 y el CV entre las concentraciones de cada muestra fue inferior al 10%, Estos resultados avalan la linealidad de la respuesta y permitieron seleccionar las diluciones que mantenían el paralelismo con la curva para ser usadas en los ensayos posteriores.
En la tabla 1 se muestran los resultados de la precisión intraensayo. En todos los casos se alcanzaron valores de variación inferiores al 6%. Se pudo garantizar la repetibilidad del ELISA para la cuantificación de anticuerpos IgG.
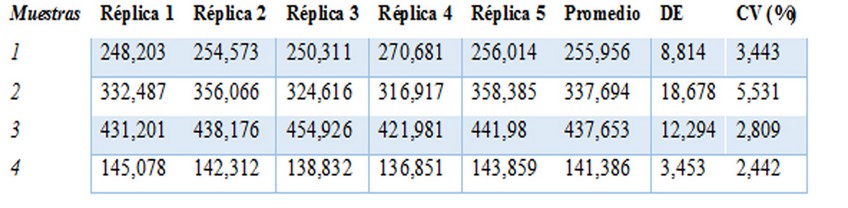
Tabla 1: Precisión intraensayo
Se presentan las concentraciones (UA/mL) calculadas por quintuplicado de cuatro sueros y el promedio, desviación estándar (DE) y el coeficiente de variación (CV).
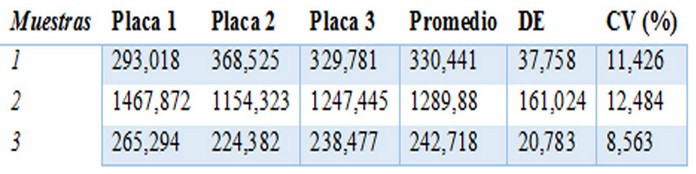
Tabla 2: Precisión interensayo por placa
Concentraciones (UA/mL) de IgG contra HBsAg de tres sueros determinadas por un mismo analista en un mismo día. DE: Desviación estándar. CV: Coeficiente de variación.
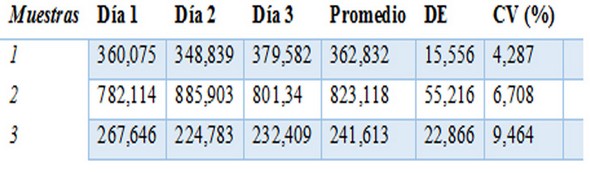
Tabla 3: Precisión interensayo realizada por el mismo analista en tres días diferentes
Se presentan las concentraciones (UA/mL) calculadas de tres sueros, el promedio, desviación estándar (DE) y el coeficiente de variación (CV).
En la tabla 2 y 3 se muestran los resultados obtenidos de la precisión interensayo realizados por un mismo analista en ensayos en paralelo y en tres días diferentes. En ambos casos se obtuvieron coeficientes de variación por debajo del 13%.
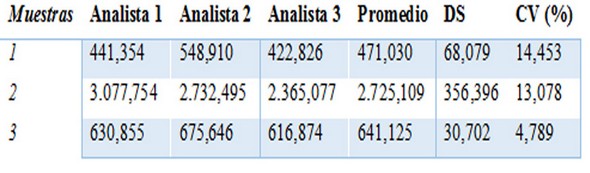
Tabla 4: Precisión interensayo por analista en un mismo día.
Se presentan las concentraciones (UA/mL) calculadas de tres sueros por tres analistas en un mismo día, el promedio, desviación estándar (DE) y el coeficiente de variación (CV).
En la tabla 4 se muestran los resultados de la precisión interensayo por analista, la cual se corresponde con la reproducibilidad del ELISA. En este caso se llevó a cabo por tres analistas diferentes en el mismo laboratorio. Se obtuvieron valores de variación inferiores al 15%. Teniendo en cuenta que el máximo establecido para este ensayo era del 20%, podemos afirmar que se lograron resultados favorables que demuestran la reproducibilidad del ELISA.
El indicador precisión evalúa la propiedad del método de brindar resultados similares en momentos diferentes y en condiciones distintas, ya sea de analistas, reactivos, e instrumentos. Los resultados obtenidos en el ensayo de precisión estuvieron dentro del intervalo establecido como óptimo para ese parámetro. 18
En relación a la primera metodología descrita en los materiales y métodos para evaluar la especificidad del ELISA, se determinó que la respuesta del placebo era inferior al primer punto de la curva de calibración correspondiente. Esto corrobora que los componentes utilizados en la formulación inmunizada al grupo placebo, o sea el adyuvante fosfato de aluminio y el tampón de fosfato no interfirieron con la respuesta inducida al antígeno de interés.
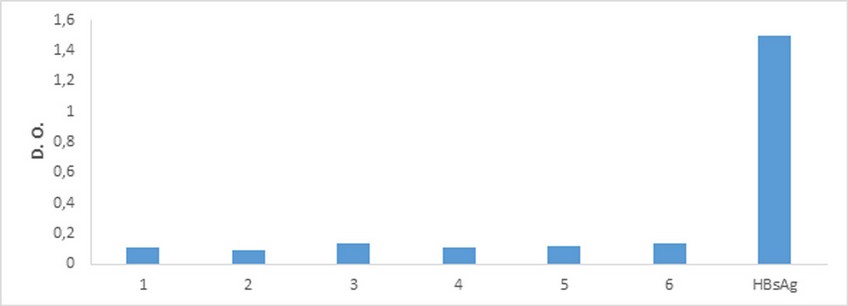
Figura. 6. Especificidad. Se observan las densidades ópticas de un suero positivo contra HBsAg y 6 sueros de conejos inmunizados con conjugados de S. pneumoniae 19A-TT (suero 1) y PsC 6A-TT (suero 2), mezcla de conjugados neumococos 1-TT, 5-TT, 6B-TT, 14-TT, 18C-TT, 19F-TT, 23 F-TT (suero 3), toxoide tetánico (suero 4), toxoide diftérico (suero 5), PsC Vi de Salmonella Typhi (suero 6), HBsAg (suero 7). DO: Densidad óptica.
En la figura 6 se muestran los resultados de la especificidad del ELlSA correspondientes a la segunda metodología descrita. Se evaluaron sueros de conejos inmunizados con polisacáridos de neumococo conjugados a toxoide tetánico como proteína portadora, toxoide tetánico, toxoide diftérico y polisacárido Vi. Se incluyó una mezcla de sueros inmunizados con el HBsAg como control positivo. Como se puede observar, los seis sueros inmunizados presentaron respuestas inferiores a 0,2 de densidades ópticas en todos los casos. La absorbancia de la mezcla de los sueros positivos fue muy superior a los sueros control negativo. Por lo que se demostró que la respuesta generada se debió solo al antígeno de interés y no a señales inespecíficas generadas por los otros inmunógenos.
La demostración de la especificidad constituye una fortaleza del ensayo. Los sueros de los animales contienen, además de los anticuerpos específicos contra el antígeno de interés, otros anticuerpos no específicos. Por esto es deseable que el ensayo de cuantificación posea una especificidad tal, que detecte solamente el analito para el cual se diseñó, sin interferencia de contaminantes de la matriz. 12 Por lo que los resultados obtenidos confirman la especificidad del ensayo para detectar anticuerpos IgG contra el HBsAg.
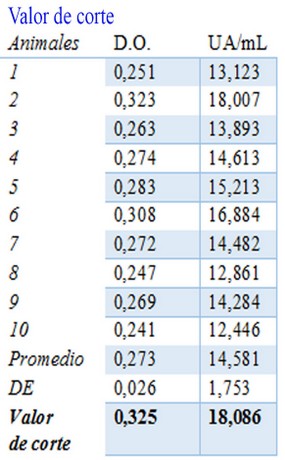
Tabla 5. Valor de corte establecido para esta técnica. En esta tabla se muestran las D.O. de los sueros de 10 animales inmunizados con placebo y los valores de concentración en UA/mL de cada animal. Además, se presentan el promedio, la desviación estándar (DE) y el valor de corte para esta técnica en UA/mL.
En la Tabla 5 se representa las densidades ópticas y las unidades arbitrarias por mililitros de cada animal. Además, se incluyen el promedio, la desviación estándar y el valor de corte. Este parámetro se definió como el promedio de los valores de UA/mL del control negativo más dos desviaciones estándar. Para este ensayo, el valor de corte fue 18,086 UA/mL correspondiente a un valor de densidad óptica de 0,325. Este valor permite discriminar entre los animales respondedores de los no respondedores, por lo que cualquier animal que genere un valor de respuesta mayor a 18,086 UA/mL se considera un animal respondedor.
En la Figura 7 se muestran las medias de las concentraciones calculadas para el grupo experimental y los controles en UA/mL. Las DE de cada grupo se muestran como barras de error.
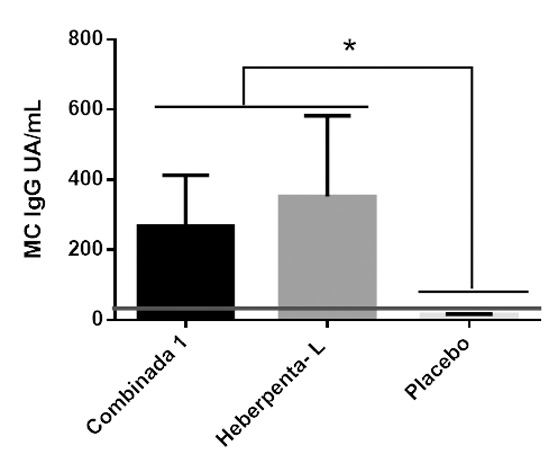
Figura 7. Se observan las medias de las concentraciones (MC) de los sueros procedentes del ensayo de inmunogenicidad. Las barras de error corresponden a las DE calculadas. La línea horizontal representa el valor de corte establecido para esta técnica.
Como se puede apreciar en la figura 7 no existieron diferencias estadísticas significativas (p<0,05) entre las respuestas generadas por el candidato experimental combinado con respecto a la vacuna Heberpenta- L (control positivo), pero sí con el grupo placebo. Además, ambas vacunas generaron concentraciones de anticuerpos muy superiores al valor de corte establecido para este ensayo. En el caso de la vacuna combinada, se generó una respuesta de IgG de 267,89 UA/mL y la vacuna Heberpenta- L indujo niveles de 351,62 UA/mL. La formulación del grupo control negativo, por otro lado, no indujo respuesta de anticuerpos contra el HBsAg.
Estos resultados avalan el empleo del ELISA en la cuantificación de anticuerpos IgG anti-HBsAg para la evaluación de la inmunogenicidad de nuevos candidatos vacunales que posean este antígeno en su formulación.
CONCLUSIONES
El ELISA de cuantificación que se desarrolló es preciso y específico. Este cumple con los parámetros necesarios que demuestran su aplicabilidad para la evaluación de la respuesta humoral generada por el HBsAg en sueros de conejos. Además, se obtuvo un estándar interno para la construcción de la curva de calibración, lo que nos permitió cuantificar los niveles de anticuerpos IgG (UA/mL) contra el HBsAg.
Agradecimientos.
Agradecemos al Profesor Rolando Ochoa por la detallada revisión del tema y sus sugerencias que contribuyeron en la realización y mejoramiento de este trabajo.
REFERENCIAS
1. Alonso R, Aguilera A, Córdoba J, Fuertes A. Diagnóstico microbiológico de las hepatitis virales. Enferm Infecc Microbiol Clin. 2015;33(9):e53–e62.
2. Trépo C, Chan HLY, Lok A. Hepatitis B virus infection Lancet. 2014;384:2053-63.
3. Ioshimoto LM, Rissato ML, Bonilha VSJ, Miyaki C, Raw I, Granovski N. Safety and immunogenicity of hepatitis b vaccine butang in adults. Rev Inst Med trop S Paulo. 1999;41 (3):191-3.
4. Leyva A, Sánchez JC, López L, Font M, González T, Pérez B, et al. Desarrollo, validación y aplicación de un nuevo ELISA para el control del proceso del antígeno de superficie del virus de la hepatitis B recombinante. Biotecnología Aplicada 2011;Vol.28, No.4:221-7.
5. Aguilar JC. Efecto adyuvante de los antígenos de la superficie y la nucleocápsida del virus de la hepatitis B y su utilidad en el desarrollo de candidatos vacunales [Doctorado]: Centro de Ingienería Genética y Biotecnología. División de Vacunas; 2007.
6. WHO. Recommendations to Assure the Quality, Safety and Efficacy of Recombinant Hepatitis B Vaccines. WHO Technical Report Series. 2010 (Proposed replacement of: TRS 786, Annex 2 and TRS 889, Annex 4.).
7. Aristegui J, Usonis V, Coovadia H, Riedemann S, Win K, Gatchalian S, et al. Facilitating the WHO expanded program of immunization: the clinical profile of a combined diphtheria, tetanus, pertussis, hepatitis B and Haemophilus influenzae type b vaccine. Int J Infect Dis 2003;7:143-51.
8. OMS. Vacunas contra la hepatitis B. Documento de posición de la OMS. wwwwhoint/immunization/wer7928HepB_July04_position_paper_SPpdf. 2004.
9. Directive 2010/63/eu of the european parliament and of the council on the protection of animals used for scientific purposes. http://eur-lexeuropaeu/legal-content/EN/TXT/?uri=CELEX:32010L0063. 2010.
10. Ulloa M, Crus B, Guilarte E, Fernández T, Escalona L. Purificacion de IgG de conejo por cromatografía de Intercambio iónico y afinidad. Cocmed. 2003;7(1).
11. Mandiarote A, Gutiérrez N, Valmaseda T, Sosa R, Ontivero I, Talavera A, et al. Estandarización de ensayos inmunoenzimáticos (ELISA) para la cuantificación de anticuerpos IgG inducidos por una vacuna de vesículas de membrana externa de los serogrupos A y W135 de Neisseria meningitidis. VacciMonitor. 2012;21(2):16-23.
12. Espinosa-Viñals C, Soroa-Millán Y, Martin-García Y, Pérez-Baños A, Nicot-Valenciano M, Rodríguez-Noda L, et al. Validación y aplicación de un ELISA para la cuantificación de anticuerpos IgG contra polisacárido capsular Vi de Salmonella Typhi VacciMonitor. 2015;24(1):21-32.
13. Plikaytis B, Carlone G. Program ELISA for Windows User’s Manual, version 2. Centers for Desease Control and Prevention, Atlanta: CDC. 2005.
14. Izquierdo M, Vega JL, Cortés MdlÁ, Expósito N, Vega M, Rodríguez O, et al. Comportamiento inmunológico del antígeno de superficie del virus de la hepatitis B como componente de una vacuna combinada DPTc-HB. Biotecnología Aplicada. 2000;Vol.17, No.2:112-4.
15. Asensi F, Otero MC, Pérez D, Miguel MJS. Protección frente a hepatitis B en vacunas combinadas. An Pediatr 2003;58(5):27-32.
16. Ochoa R, Martínez JC, Ferriol X, Estrada E, García AM, Blanco R, et al. Guía para la estandarización de técnicas inmunoenzimáticas en ensayos de vacunas. VacciMonitor. 2000;9 No. 3.
17. Protein Purification Handbook: GE Healthcare Bio-Sciences AB; 2007.
18. Rodríguez CV, Martínez G, Torres B, Zúñiga Y, Alles A, Martínez A. Estandarización y validación de un ELISA para la cuantificación de antitoxina tetánica en suero humano. Revista Habanera de Ciencias Médicas 2013;12(4):534-41.
Recibido: 23 agosto 2017
Aprobado: 11 noviembre 2017
Aprobado: 11 noviembre 2017
Yosbany Pérez-Barrios*, Yisabel Aranguren-Mazorra, Caridad Zayas-Vignier, Mabel Hernández-Cedeño, Carlos Espinosa-Viñals, Yanely Tirado-Hernández, Abel Fajardo-Sánchez, Maylín Álvarez-Tito, Alex Quintero-Pérez, Dagmar Garcia-Rivera, Reinaldo Acevedo Grogues+.
1Instituto Finlay de Vacunas. Departamento de Evaluación de Biológicos. Ave 17, esq 198, Siboney, Playa, La Habana, Cuba
*Licenciado en Microbiología
E-mail: *[email protected]; +[email protected]