2016.01.04.3
Files > Volume 1 > Vol 1 No 4 2016 > Investigaciones
INVESTIGACIÓN
Nimotuzumab en el tratamiento de pacientes con glioma maligno. Comparación entre estudios pre-registro y pos-aprobación.
Nimotuzumab for the treatment of patients with malignant glioma. Comparison between pre-registration and post-approved studies.
Mabel Alvarez*, Giselle Saurez*, Carmen Viada, Patricia Luaces, Aliuska Frías, Yuliannis Santiesteban,
Lazara Garcia, Yanela Santiesteban, Amparo Macias, Tania Crombet
* Mabel Alvarez and Giselle Saurez contributed equally to this work.
_______________________________________________________________________________________________________________________
Resumen
Nimotuzumab es un anticuerpo monoclonal dirigido contra el receptor del factor de crecimiento epidérmico aprobado para el tratamiento de Gliomas malignos de alto grado en combinación con radioterapia. Los estudios pre y pos –registro han demostrado resultados de seguridad y eficacia equivalentes; no obstante, la magnitud de dichas semejanzas se desconoce. El presente trabajo compara la supervivencia y el perfil de seguridad de los estudios pre y pos- aprobación. Se diseñó una base de datas integrada, correspondiente a cuatro estudios clínicos, que incluyó 262 pacientes adultos con glioma de alto grado de malignidad de nuevo diagnóstico, expuestos a nimotuzumab (61 pacientes de estudios pre-registro y 201 de estudios pos-aprobación). Las medianas de supervivencia para pacientes con Glioblastoma fueron 14.2 y 11.9 meses; mientras que para Astrocitoma anaplásico fueron 43.9 y 21.4 respectivamente, sin diferencias estadísticamente significativas.
Nimotuzumab fue seguro en ambas poblaciones estudiadas, con una baja frecuencia de eventos relacionados. La aparición de reacciones dermatológicas fue mínima y de grado ligero. Nimotuzumab combinado con radioterapia en pacientes con tumores gliales de alto grado de malignidad confirma su eficacia clínica en términos de supervivencia, tanto en los estudios pre-registro como en condiciones reales. El perfil de seguridad de nimotuzumab es consistente para ambas poblaciones estudiadas. Este tratamiento multimodal puede ser recomendado en pacientes con gliomas malignos de alto grado.
Palabras claves: Estudios clínicos controlados, estudios pos aprobación, terapias dirigidas, nimotuzumab, gliomas de alto grado de malignidad.
_______________________________________________________________________________________________________________________
Abstract
Nimotuzumab is a monoclonal antibody targeted against the epidermal growth factor receptor approved for the High-Grade Gliomas in combination with radiotherapy. Those studies pre and post-marketing have shown results of safety and efficacy equivalent; but the magnitude of such similarities is unknown. This paper compares the survival and the safety profile form pre and post-approval studies. We designed a database, corresponding to four clinical trials, which involved 262 adult patients with high-grade glioma, exposed to nimotuzumab (61 patients from pre-registration and 201 from post-approval studies). The median survivals for patients with Glioblastoma were 14.2 and 11.9 months; while for Anaplastic astrocytoma were 43.9 and 21.4 respectively, without differences statistically significant. Nimotuzumab was safe in both populations studied, with a low frequency of events. The appearance of dermatological reactions was negligible and mild. Nimotuzumab combined with radiotherapy in patients with High grade glioma tumors confirms clinical efficacy in terms of survival, in real conditions as pre-registration studies. The safety profile for both populations studied of nimotuzumab is consistent. This multimodal treatment can be recommended in patients with High-grade malignant gliomas.
Key words: Controlled clinical studies, postmarking studies, target therapies, nimotuzumab, and High- grade glioma.
_______________________________________________________________________________________________________________________
INTRODUCCIÓN
El glioma maligno es el tumor cerebral primario más común en los adultos. Según la clasificación de la Organización Mundial de la Salud, los gliomas de alto grado de malignidad, definidos como Astrocitoma Anaplásico (AA), grado III y Glioblastoma Multiforme (GBM), grado IV representan entre un 45 y 60 % de todos los tumores cerebrales y son los que exhiben mayor agresividad.1
Los gliomas de alto grado de malignidad tienen una elevada morbilidad y mortalidad entre todas las malignidades; incluso con un óptimo tratamiento de cirugía, radioterapia (RTP) y quimioterapia (QT), la supervivencia esperada no sobrepasa los dos años al diagnóstico, principalmente cuando se asocian a factores de mal pronóstico, como el subtipo histológico, la edad avanzada (mayores de 50 años) y la capacidad funcional, según índice de Karnofsky (KPS) menor de 70 % entre otros.1
Estos últimos factores dependientes del paciente se asocian comúnmente a los que se enfrentan la comunidad médica en la práctica y son generalmente, criterios de exclusión de los estudios clínicos controlados, de alto rigor estadístico, pero con esas limitaciones en su validez externa, por no ser representativos de la población real.
Aunque los ensayos controlados son el prototipo de la investigación clínica para evidenciar la seguridad y la eficacia de un fármaco, los estudios clínicos pos-aprobación (EPA), de no intervención, complementan y amplían la información sobre el perfil de seguridad y la eficacia en la práctica habitual del nuevo fármaco, además contribuyen a la mejor comprensión de su beneficio clínico.2
En el caso de las terapias dirigidas a blancos tumorales han tenido un ritmo acelerado de aprobación sanitaria en los últimos 30 años; lo cual ha promovido su rápida introducción en la práctica médica. Dentro de los más representativos, se encuentran: Trastuzumab para cáncer mamario que sobre expresa el oncogén cERB-2 positivo, Rituximab para Linfoma no Hodgkin con expresión de linfocitos CD 20 positivo, Cetuximab par cáncer colo-rectal con expresión de KRAS genotipo salvaje, Imatinib para la leucemia mieloide crónica con alteraciones del gen BCR-ABL y para adenocarcinoma de pulmón con mutaciones de receptor del factor de crecimiento epidérmico (EGFR, siglas en inglés) el erlotinib y gefitinib.3
Nimotuzumab es un anticuerpo monoclonal humanizado que reconoce el receptor del EGFR, con una afinidad intermedia (10-9M)4, capaz de bloquear al EGFR en su dominio extracelular e inhibir la proliferación celular tumoral; además promueve la apoptosis, limita la neo-angiogénesis tumoral5 y tiene acción radiosensibilizante.6
Actualmente nimotuzumab está aprobado para el tratamiento de tumores avanzados escamosos de cabeza y cuello, adenocarcinoma de esófago y páncreas y tumores gliales malignos en adultos y niños.7
Particularmente en la indicación de glioma maligno en adulto existen resultados de estudios controlados pre-registro 8-10 y estudios pos-registro11, 12 que demuestran un perfil de seguridad y resultados de eficacia en términos de supervivencia comparables. No obstante, se desconoce en qué magnitud son reproducibles los resultados de los estudios conjuntos en condiciones controladas en relación con los de la práctica médica.
El presente trabajo analiza el perfil de seguridad y eficacia en términos supervivencia entre los estudios pre-registro y pos- aprobación.
Materiales y Métodos
Se concibió una base de datos integrada de pacientes adultos con glioma de alto grado de malignidad de nuevo diagnóstico, que participaron de cuatro estudios clínicos terminados (2 estudios pre- registro y 2 estudios pos- autorización). Todos ellos expuestos a nimotuzumab en esquemas de combinación con radioterapia, quimio-radioterapia o monoterapia (Tabla 1).
Tabla 1. Estudios clínicos de evaluación de nimotuzumab en pacientes adultos con glioma de alto grado de malignidad de nuevo diagnóstico.

Se realizó un análisis de los datos demográficos según edad y sexo y de las características de la enfermedad como KPS, subtipo histológico y tratamiento recibido.
Se compararon los tiempos de supervivencia de los estudios agrupados en ensayos pre-registro y estudios pos-aprobación, según subtipo histológico GBM y AA; seleccionando aquellos pacientes expuestos al tratamiento de nimotuzumab en combinación con radioterapia o quimio- radioterapia. Se estimó como tiempo de supervivencia desde la fecha de inclusión en el estudio hasta la fecha de muerte o de últimas noticias.
Para evaluar la seguridad se seleccionaron todos los pacientes que al menos recibieron una dosis de nimotuzumab. Se analizaron las proporciones de eventos reportados según clasificación de la CTCAE versión 313 y se compararon las frecuencias de esos eventos adversos según intensidad, gravedad y relación causal con nimotuzumab entre los estudios pre registro y EPA.
Se aplicaron estadísticas descriptivas de proporción en porcentajes y rangos con un índice de confianza del 95 %, prueba Chi-cuadrado de Pearson y la prueba exacta de Fisher. Para el análisis de supervivencia se usaron las curvas de Kaplan Meier y test de Log Rank, procesados en el paquete estadístico SPSS, versión 19.0 para Windows.14
Resultados y Discusión
El presente trabajo comprueba la validez externa entre los estudios clínicos pre y pos-aprobación según las características demográficas y clínicas (Tabla 2). Existe correspondencia entre las variables demográficas edad y sexo, lo que es coherente con el comportamiento epidemiológico de esta enfermedad, más frecuente en mayores de 50 años y en hombres que en mujeres.1
En cuanto a la capacidad funcional existe un comportamiento semejante entre los estudios pre y pos aprobación, sin embargo, en los EPA existe un mayor rango de esta condición, dado por la flexibilidad de los criterios de inclusión, menos estrictos que los estudios controlados, pero más parecidos a la población real. Además, pudieran estar asociados a morbilidades propias de la enfermedad de base, de la cirugía previa incluso a enfermedades cardiovasculares y metabólicas. 2, 11, 12
En referencia a la histología la población de pacientes con Glioblastoma multiforme en los EPA fue mayoritariamente significativa en contraste con la de los estudios pre registro de igual diagnóstico. Esto es de esperar dado que en una población real el GBM es más frecuente que el AA.1
Por otro lado, en relación con los tratamientos recibidos, la mayoría de los pacientes se expusieron a la combinación del nimotuzumab y radioterapia; sin embargo, en la práctica (EPA) aunque en una frecuencia menor, se identificaron otras modalidades terapéuticas como la combinación con quimio-radioterapia y como simple terapia.
Ciertamente la quimioradioterapia basada en temozolamida es el estándar internacional para los gliomas malignos de alto grado,15 pero no es la generalidad en nuestro medio por restricciones internacionales para acceder a la temozolamida. 11, 12 La combinación de nimotuzumab y quimio-radioterapia se ha evaluado en estudios controlados, pero no tenemos estudios pos autorización para compararlos,10 pero no tenemos estudios pos autorización para compararlos en nuestro medio. Los pacientes que recibieron nimotuzumab como simple terapia, suceden como consecuencia de asuntos organizativos de la práctica habitual, tales como distanciamiento del local de la radioterapia y del destinado para recibir nimotuzumab, el tiempo de espera para recibir radioterapia, entre otras. 11, 12 Toda vez identificada esta desviación se propusieron estrategias administrativas para minimizarla.
Tabla 2: Características demográficas y clínicas entre los estudios pre-registro y pos-registro.
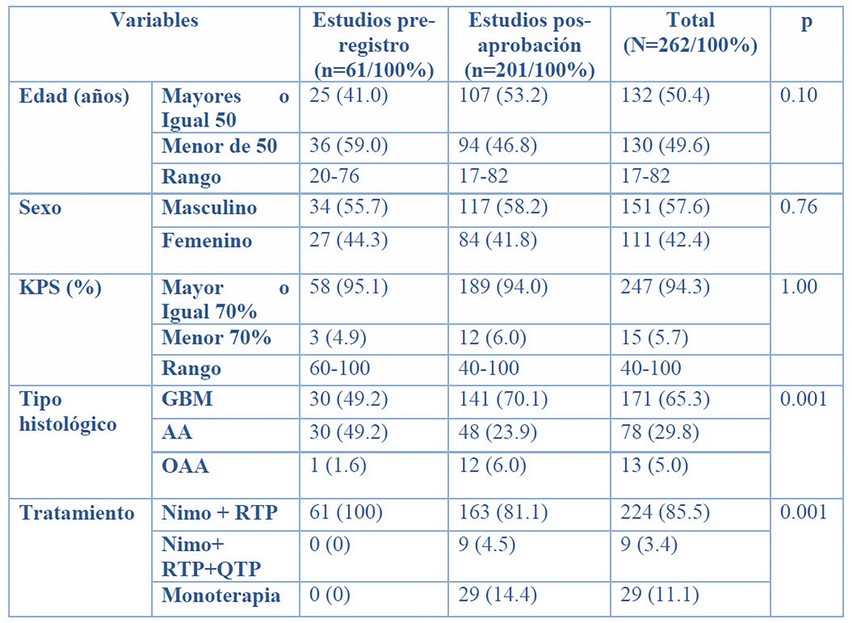
QRT: Nimotuzumab+ Quimio-radioterapia; Nimo+ RTP: Nimotuzumab+ Radioterapia.
OAA: Oligoastrocitoma anaplásico.
Análisis de la supervivencia
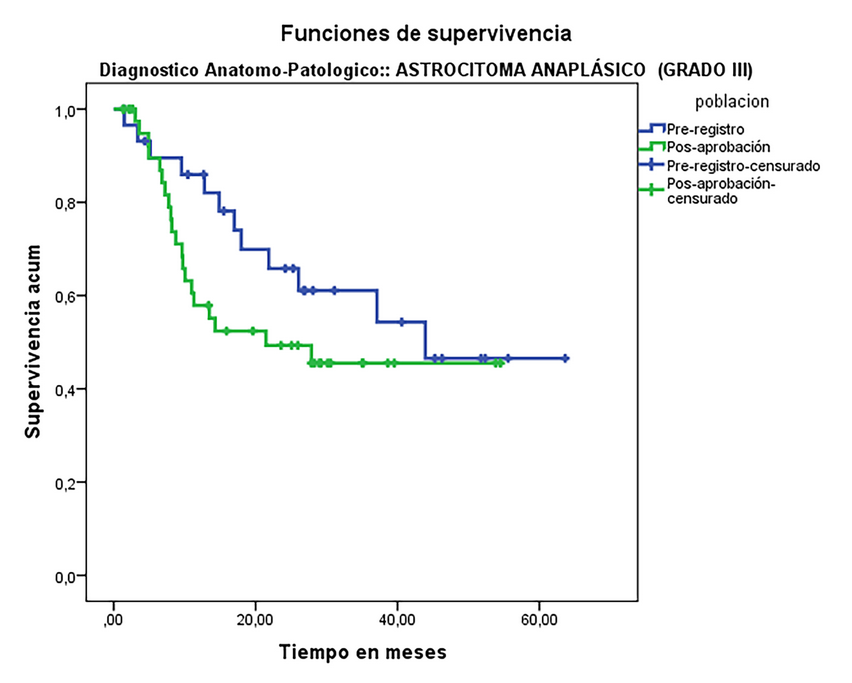
La mediana de supervivencia global para los pacientes expuestos a nimotuzumab y radioterapia con diagnóstico de GBM fue de 12.3 meses, mientras que para los diagnosticados con AA fue de 37 meses. No se observaron diferencias significativas entre los estudios pre y pos registro en ninguno de los grupos histológicos, a pesar de que las medianas en los EPA fueron inferiores entre 2 y 22 meses para GBM y AA respectivamente (Tabla 3).
Si bien para GBM esta diferencia en la supervivencia fue pequeña, el resultado para AA es paradójico. Probablemente esta discrepancia se explique porque aun siendo el grado histológico el de mayor relevancia pronóstica, otros factores de naturaleza genética tumoral, propias del paciente como la edad, el KPS, morbilidades asociadas y del tratamiento recibido como la resección tumoral, la radioterapia, la quimioterapia y sobre el cumplimiento del tratamiento planificado influyen también en la supervivencia.1, 2 Esos factores no se analizaron en este trabajo y constituyen una limitante del mismo.
Tabla 3: Análisis de la Supervivencia entre estudios pre-registro y pos- registro.
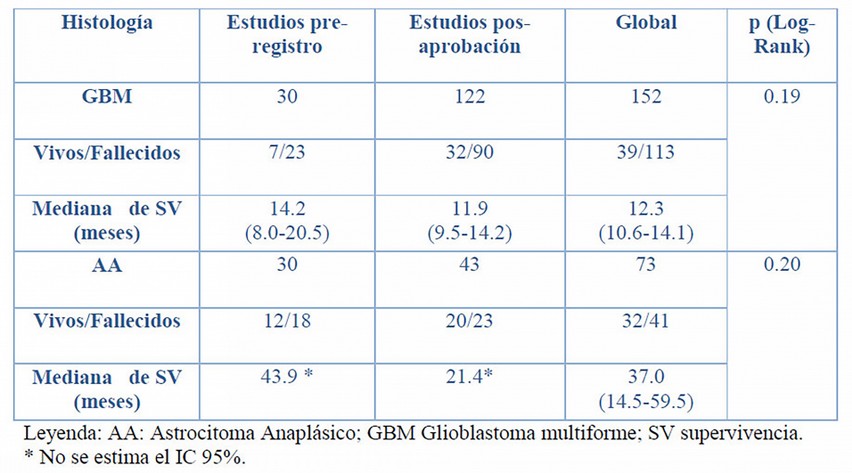
Figura1: Supervivencia en pacientes con Glioblastoma multiforme tratados con nimotuzumab en estudios pre y pos aprobación.
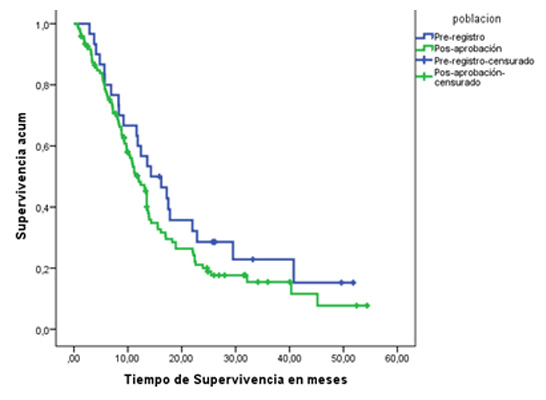
Figura 2: Supervivencia en pacientes con Astrocitoma anaplásico tratados con nimotuzumab en estudios pre y pos aprobación.
Análisis de seguridad:
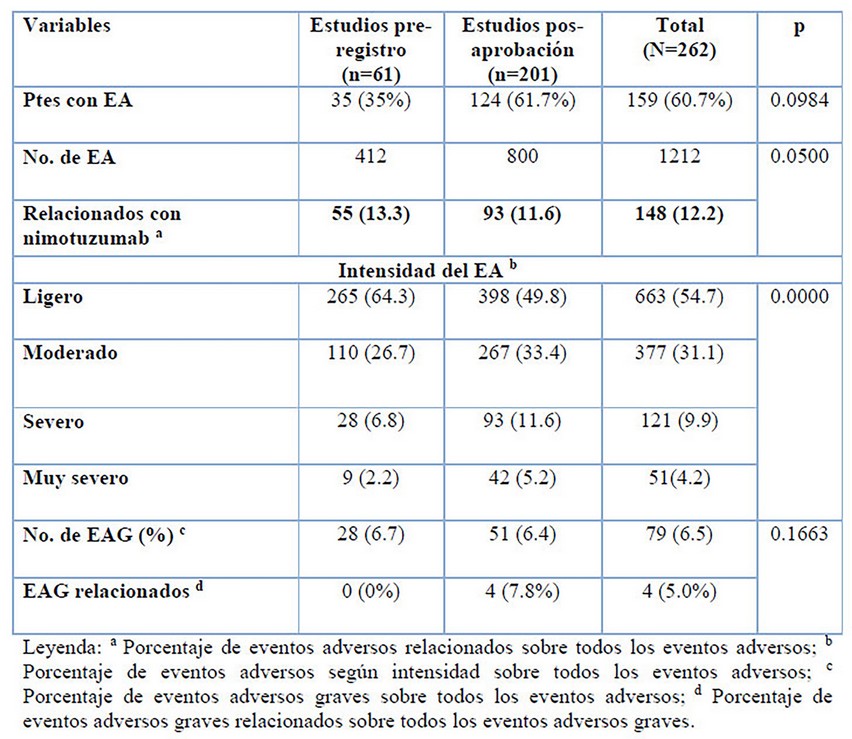
Nimotuzumab fue seguro y bien tolerado en ambas poblaciones estudiadas (Tabla 4). De la misma manera los eventos relacionados se mantuvieron en una baja frecuencia a pesar de que en los EPA más de la mitad de los pacientes presentó algún evento adverso. En cuanto a la intensidad de los eventos adversos predominaron los ligeros, pero este hallazgo no influyó en la relación causal con nimotuzumab en los diferentes tipos de estudios. Es de señalar que solo en los EPA se identificaron eventos graves relacionados, pero una vez más, en mínima proporción, todos recuperados.12
Estos hallazgos son coherentes con lo que puede esperarse en una mayor cantidad de pacientes expuestos a un fármaco y en condiciones de la práctica médica como sucede en los EPA.2 Interesantemente los eventos adversos relacionados y graves relacionados en la población real (EPA) fueron eventos previamente descritos para el fármaco en estudios bajo condiciones controladas 7-9. La cefalea, la fiebre y las alteraciones de las enzimas hepáticas fueron los eventos más comunes tanto en los estudios pre-registro8, 9 como en los EPA.11, 12
En cuanto a la aparición de eventos dermatológicos del tipo rash o eritema cutáneo solo de notificaron en los estudios EPA, pero en escasa frecuencia11, 12; lo que persiste como distintivo en el perfil de seguridad del nimotuzumab, en contraste con otros monoclonales dirigidos al mismo blanco tumoral del EGFR16 y por consiguiente, una ventaja para el manejo de un fármaco, que garantiza una mejor adherencia al tratamiento.
Estudios publicados previamente revelan que esta diferencia se debe a que nimotuzumab posee una afinidad intermedia, más sensible a unirse a aquellas células de mayor densidad de EGFR, como las células tumorales, que en las células con expresión de EGFR normal como se caracterizan los tejidos epiteliales no tumorales.17
Tabla 4: Eventos adversos en pacientes expuestos a nimotuzumab.
Conclusiones
La combinación de radioterapia y nimotuzumab confirma su eficacia clínica en términos de supervivencia para pacientes con tumores gliales de alto grado de malignidad, tanto en los estudios pre-registro como en condiciones reales. El perfil de seguridad de nimotuzumab es consistente para ambas poblaciones estudiadas.
Nimotuzumab puede ser recomendado como parte del tratamiento multimodal en gliomas de alto grado de malignidad.
Para optimizar su beneficio clínico será necesario profundizar en la caracterización del paciente más allá de su clasificación histológica, que incluye el análisis y la validación de marcadores biológicos predictores de respuesta a esta terapia dirigida.
Códigos de referencia de los ensayos clínicos analizados en este manuscrito. Registro Público Cubano de Ensayos Clínicos (RPCEC). De los 4 estudios, 2 están publicados en el RPCEC, que cuenta como registro primario de la Organización Mundial de la Salud.

RPCEC00000012. http://registroclinico.sld.cu/ensayos/RPCEC00000012-Sp
RPCEC00000087. http://registroclinico.sld.cu/ensayos/RPCEC00000087-Sp
Referencias Bibliográficas
1. Ostrom QT, Bauchet L, Davis FG, Deltour I, Fisher JL, Langer CE, et al. The epidemiology of glioma in adults: A "state of the science" review. Neuro Oncol. 2014;16:896-913
2. Suvarna V. Phase iv of drug development. Perspectives in clinical research. 2010;1:57-60
3. Gerber DE. Targeted therapies: A new generation of cancer treatments. Am Fam Physician. 2008;77:311-319
4. Diaz Miqueli A, Blanco R, Garcia B, Badia T, Batista AE, Alonso R, et al. Biological activity in vitro of anti-epidermal growth factor receptor monoclonal antibodies with different affinities. Hybridoma (Larchmt). 2007;26:423-431
5. Crombet-Ramos T, Rak J, Perez R, Viloria-Petit A. Antiproliferative, antiangiogenic and proapoptotic activity of h-r3: A humanized anti-egfr antibody. Int J Cancer. 2002;101:567-575
6. Diaz-Miqueli A, Martinez GS. Nimotuzumab as a radiosensitizing agent in the treatment of high grade glioma: Challenges and opportunities. Onco Targets Ther. 2013;6:931-942
7. Centro para el Control Estatal de Medicamentos EyDMC. Resumen de las características del producto 2015:6
8. Ramos TC, Figueredo J, Catala M, Gonzalez S, Selva JC, Cruz TM, et al. Treatment of high-grade glioma patients with the humanized anti-epidermal growth factor receptor (egfr) antibody h-r3: Report from a phase i/ii trial. Cancer Biol Ther. 2006;5:375-379
9. Solomon MT, Selva JC, Figueredo J, Vaquer J, Toledo C, Quintanal N, et al. Radiotherapy plus nimotuzumab or placebo in the treatment of high grade glioma patients: Results from a randomized, double blind trial. BMC Cancer. 2013;13:299
10. Westphal M, Heese O, Steinbach JP, Schnell O, Schackert G, Mehdorn M, et al. A randomised, open label phase iii trial with nimotuzumab, an anti-epidermal growth factor receptor monoclonal antibody in the treatment of newly diagnosed adult glioblastoma. Eur J Cancer. 2015;51:522-532
11. Martínez GS, Camaño SNS, Sierra PP, Iglesias B, Castillo CTJ, Cardona MTS, et al. Seguridad y efectividad del nimotuzumab en los pacientes con tumores gliales malignos. Revista Cubana de Neurología y Neurocirugía. 2015;5:123–132
12. Saurez G, Salva S, Uranga R, Piedra P, Anoceto JA, Iglesias B, et al. Safety and effectiveness of nimotuzumab in high grade glioma patients. Phase iv study results International Journal Of Current Medical And Pharmaceutical Research. 2016;2:657-664
13. Trotti A, Colevas AD, Setser A, Rusch V, Jaques D, Budach V, et al. Ctcae v3.0: Development of a comprehensive grading system for the adverse effects of cancer treatment. Semin Radiat Oncol. 2003;13:176-181
14. Arbuckle JL. Ibm spss amos 19 user’s guide. Crawfordville, FL: Amos Development Corporation. 2010;635
15. Stupp R, Brada M, van den Bent MJ, Tonn JC, Pentheroudakis G. High-grade glioma: Esmo clinical practice guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2014;25 Suppl 3:iii93-101
16. Ocvirk J, Heeger S, McCloud P, Hofheinz RD. A review of the treatment options for skin rash induced by egfr-targeted therapies: Evidence from randomized clinical trials and a meta-analysis. Radiol Oncol. 2013;47:166-175
17. Perez R, Moreno E, Garrido G, Crombet T. Egfr-targeting as a biological therapy: Understanding nimotuzumab’s clinical effects. Cancers Journal 2011; 3:2014-2031
Recibido: 28 septiembre 2016
Aprobado: 20 noviembre 2016
Centro de Inmunología Molecular. La Habana. Cuba
Mabel Alvarez*, Giselle Saurez*, Carmen Viada, Patricia Luaces, Aliuska Frías, Yuliannis Santiesteban, Lazara Garcia, Yanela Santiesteban, Amparo Macias, Tania Crombet.
*igual por ciento de participación en el artículo.
Autor de correspondencia: [email protected]

