2021.06.02.29
Files > Volume 6 > Vol 6 No 4 2021 > Vol 6 No 2 2021
INVESTIGATION / RESEARCH
¿Cómo el Lactato tiene un efecto inmunosupresor en la sepsis?
How does Lactate have an immunosuppressor effect on sepsis?

Santiago Xavier Aguayo-Moscoso1Laisa Micaela Lascano-Cañas2, Mario Montalvo-Villagómez1, Fernando Jara González1, Pablo Andrés Vélez-Paez, Gustavo Velarde-Montero1, Pedro Torres-Cabezas4,5, Jorge Luis Vélez-Paez1,3
Available from: http://dx.doi.org/10.21931/RB/2021.06.02.29
RESUMEN
El sistema inmunitario es nuestro medio de defensa contra la sepsis, el cual mantiene la homeostasis a través de diversas funciones que requieren un control preciso de las vías celulares y metabólicas. Tal es así, que se han definido mejor estas vías metabólicas: las células inmunes dependen de la β-oxidación y la fosforilación oxidativa como fuentes de energía para la producción de ATP para conservar el equilibrio celular.
Sin embargo, una vez estimulados, los leucocitos cambian su metabolismo a través del efecto Warburg, por lo que hay aumento en la glucólisis aeróbica seguido de la producción de lactato. Se ha determinado, como el lactato puede tener un efecto inmunosupresor en el microambiente y como estos cambios metabólicos conllevan a la supresión inmune y la progresión de la infección. Comprender los factores que intervienen en esta relación entre el sistema inmunitario y el lactato aportará nuevos conocimientos para modular la inflamación, la inmunidad celular, recuperación en los procesos sépticos y avances en la terapéutica.
Sin embargo, una vez estimulados, los leucocitos cambian su metabolismo a través del efecto Warburg, por lo que hay aumento en la glucólisis aeróbica seguido de la producción de lactato. Se ha determinado, como el lactato puede tener un efecto inmunosupresor en el microambiente y como estos cambios metabólicos conllevan a la supresión inmune y la progresión de la infección. Comprender los factores que intervienen en esta relación entre el sistema inmunitario y el lactato aportará nuevos conocimientos para modular la inflamación, la inmunidad celular, recuperación en los procesos sépticos y avances en la terapéutica.
Palabras clave: Lactato, inmunosupresión, sepsis, efecto Warburg. (DeCS-BIREME)
ABSTRACT
The immune system is our means of defense against sepsis, which maintains homeostasis through various functions that require precise control of cellular and metabolic pathways. So much so, that these metabolic pathways have been better defined: Immune cells depend on β-oxidation and oxidative phosphorylation as sources of energy for ATP production to preserve cell balance.
However, once stimulated, leukocytes change their metabolism through the Warburg effect, so there is an increase in aerobic glycolysis followed by lactate production. It has been determined how lactate can have an immunosuppressive effect on the microenvironment and how these metabolic changes lead to immune suppression and the progression of infection. Understanding the factors involved in this relationship between the immune system and lactate will provide new insights to modulate inflammation, cellular immunity, recovery in septic processes, and advances in therapy.
Keywords: Lactate, immunosuppression, sepsis, Warburg effect. (MeSH-NIH)
INTRODUCCIÓN
La sepsis es un problema clínico en donde su condición más grave, el shock séptico, conduce a una morbimortalidad alta a pesar de los tratamientos implementados. La sepsis se identifica por una respuesta inflamatoria sistémica no controlada del sistema inmune, como resultado de interacciones entre el huésped y los agentes infecciosos, por ello es esencial comprender los mecanismos moleculares asociados con el desarrollo de la sepsis. 1–3
En los pacientes con sepsis existe una fase inmunosupresora, en la cual contribuyen algunos factores: apoptosis, disminución de los progenitores linfoides y reducción de la producción de la médula ósea; uno de los puntos a destacar es el metabolismo de la glucólisis aeróbica y su relación con la activación del sistema inmune. Además, un grupo etario que merece atención, son los adultos mayores, debido a que poseen una inmunidad disminuida como resultado de la inmunosenescencia. 4–8
En los siguientes párrafos escribiremos los resultados de una búsqueda estructurada con las palabras clave lactato, inmunidad y sepsis en inglés y en español, en las bases medline, scopus, WoS, LILACS y LATINDEX. Antes de eso, veremos brevemente en qué consisten estos componentes
Lactato
Medir el lactato es parte del manejo diario en la Unidad de Cuidados Intensivos, de manera particular en casos de sepsis, donde se evalúa: gravedad de la enfermedad, respuesta al tratamiento y el pronóstico. 9,10
El lactato se sintetiza como producto de la glucólisis anaeróbica una vez que la demanda de oxígeno se reduce hasta un punto crítico y no es viable la síntesis de ATP por la vía aerobia, esto se lleva a cabo debido a que el piruvato se reduce a lactato, gracias a la reacción por la enzima L-lactato deshidrogenasa, de esta manera se regenera el NAD+ y la glucólisis continúa. La hiperlactacidemia se da cuando la tasa de producción supera la tasa de eliminación, lo que ocasiona disfunción celular dando la acidosis láctica. 7,11–14
Sistema inmune
El sistema inmune es la defensa natural del cuerpo, donde su principal función actuar contra microorganismos, pero además cumple su papel en procesos tumorales, alérgicos o autoinmunes. Se lo clasifica en sistema innato y adquirido, pero hay que tomar en cuenta que ambos trabajan en conjunto, ya que el sistema inmune innato impulsa al sistema inmune adquirido en respuesta a las infecciones y por otro lado el sistema inmune adquirido utiliza los mecanismos efectores de la inmunidad innata para eliminar los patógenos.15
El sistema innato es la primera línea de defensa del huésped, cuyos principales componentes son: barreras físicas y químicas (epitelios, enzimas), células fagocíticas (neutrófilos macrófagos), células Natural Killer (NK), sistema del complemento, citoquinas y receptores tipo Toll (TLRs).15
El sistema adaptivo se caracteriza por mejorar la capacidad defensiva frente exposiciones sucesivas. Los principales elementos son los linfocitos B y T que se activan frente a los antígenos, además posee dos tipos de respuestas inmunes: inmunidad humoral e inmunidad celular.15
Las células inmunes, al llegar un agente externo requieren activar sus mecanismos, y en este contexto, también se ha estudiado como estas células producen lactato a través del metabolismo glucolítico aeróbico. Revisemos en que consiste la glucólisis aeróbica.
Glucólisis aeróbica
La molécula clave que proporciona energía para los procesos celulares es el ATP, ya que esta mantiene los niveles de ATP celular esenciales para la homeostasis y supervivencia de todas las células. La glucólisis y la fosforilación oxidativa (OxPhos) son las vías que convierten a la glucosa, en la principal fuente de energía: el ATP7(Figura 1).
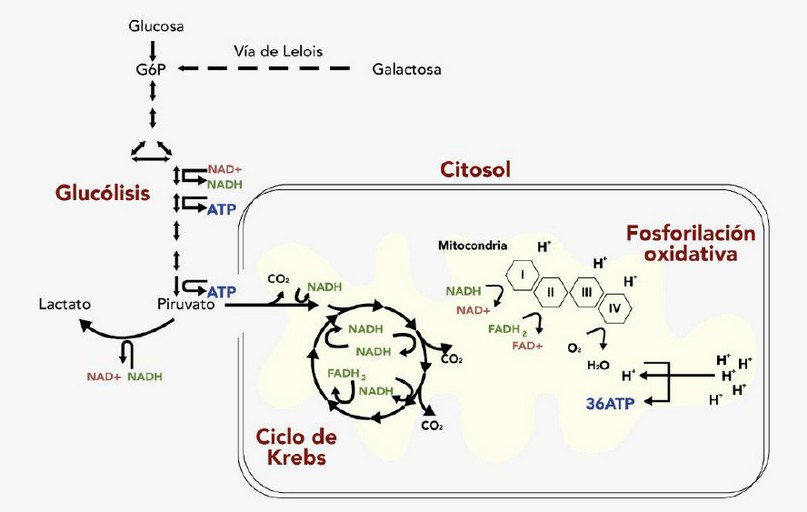
Figura 1. Producción de ATP por glucólisis y fosforilación oxidativa.
Otto Warburg reconoció que el metabolismo de las células cancerosas era distinto al de los tejidos normales, ya que facilita el crecimiento y la proliferación de estas células. Las células malignas absorben grandes cantidades de glucosa que metabolizan al piruvato por una vía glucolítica altamente activa. Además, determinó que las células tumorales no tienen altas tasas de OxPhos y que el piruvato generado por la glucólisis se convierte en lactato, el cual es secretado por la célula.16
Este es el tipo de metabolismo de la glucosa que adoptan las células en condiciones anaeróbicas donde no hay oxígeno disponible para facilitar la OxPhos. Sin embargo, las células cancerosas y otras células metabólicamente activas y proliferativas, también metabolizan la glucosa a lactato incluso en presencia de abundante oxígeno, esto se conoce como glucólisis aeróbica. Warburg también observó que los linfocitos activados se vuelven altamente glucolíticos produciendo grandes cantidades de lactato.17, 18(Figura 2)

Figura 2. La glucólisis como base metabólica para la inmunidad.
En nuestro sistema inmune, las células T naïve tienen poca demanda de procesos biosintéticos. Sin embargo, los linfocitos efectores tienen demandas bioenergéticas y biosintéticas completamente diferentes por lo que adoptan una característica metabólica distinta. En respuesta a un agente patógeno, pequeñas cantidades de células T específicas deben experimentar una expansión clonal masiva para generar el conjunto de células T efectoras necesarias para combatir la infección. De manera que existe una gran carga biosintética en estas células y una demanda significativa de moléculas precursoras, por esto las células T efectoras activadas participan en la glucólisis aeróbica.19, 20
Inmunosupresión en sepsis
Durante la sepsis, se ha propuesto que puede existir una fase de inmunosupresión, porque tanto las respuestas proinflamatorias como las antiinflamatorias ocurren temprano y simultáneamente.21La demostración de inmunosupresión incluye el agotamiento de las células inmunes (células T más afectadas), funciones efectoras de las células T comprometidas, presentación de antígenos deteriorada, susceptibilidad a infecciones nosocomiales y reactivación de virus latentes. 22
En el estudio realizado por Boomer, se analizó las células inmunes esplénicas y pulmonares de pacientes con sepsis dentro de los 30 a 180 minutos del fallecimiento, se evidenció una producción disminuida de citocinas, expresión aumentada de receptores inhibitorios, expansión de células T reguladoras, poblaciones de células supresoras derivadas de mieloides y disminución de las vías de activación mediadas por CD28 y HLA-DR. 23
¿Cómo el lactato modula la respuesta inmune?
Leite realizó un estudio en donde examinó los efectos del lactato sobre la actividad enzimática de la piruvato quinasa (PK), fosfofructoquinasa (PFK) y hexoquinasa (HK) en diversos tejidos de ratones. Los resultados mostraron que el lactato inhibía tanto la actividad de PFK como de la HK, mientras que la actividad de la PK no se vio afectada por el lactato. La actividad de HK y PFK está directamente relacionada con el metabolismo de la glucosa, por lo tanto, es razonable que la exposición al lactato pueda inducir la inhibición del consumo de glucosa en los tejidos.24
Es necesario retomar el ejemplo de las células cancerosas, y recordar que derivan la energía de la glucosa a través de la glucólisis al ácido láctico, incluso en condiciones altamente aeróbicas. 16
Al tener un metabolismo energético alterado puede mejorar el crecimiento de los cánceres al promover la evasión tumoral de la destrucción inmune. Una célula inmunogénica transformada solo puede convertirse en un tumor si tiene la capacidad de evadir la respuesta inmune citotóxica que evoca. La respuesta inmune anticancerígena, está mediada por células T efectoras, las cuales son altamente dependientes de los componentes del microambiente y de igual manera está influenciado por el pH: un pH ácido dificulta la función de las células inmunes normales. Reducir el pH a 6.0-6.5, como se puede encontrar en las masas tumorales, conduce a la pérdida de la función de las células T en tumores humanos y murinos. (Figura 3) 25–27
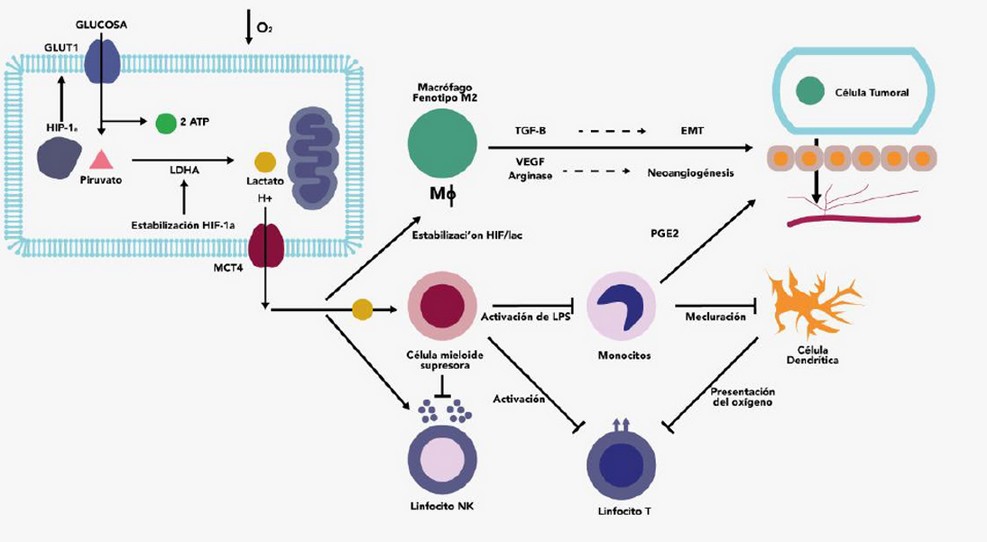
Figura 3. Descripción de los efectos inmunosupresores del lactato en el microambiente tumoral.
La causa principal responsable del pH ácido y del efecto supresor de la función de las células T dependientes del pH en un microambiente tumoral es secundaria al ácido láctico. Por lo tanto, durante la glucólisis aeróbica se evidencia una retroalimentación negativa que ajusta el pH pericelular en los tumores hacia un medio ácido mediante la producción y secreción de ácido láctico. Al inhibir la respuesta inmune, las células cancerosas pueden mejorar su supervivencia contra el cáncer al mantener un microambiente ligeramente ácido. Aparentemente pueden hacer esto alterando su metabolismo energético para regular su producción/secreción de ácido láctico. 28–30
Es evidente que los estudios se han enfocado en el ámbito de la oncología. De una manera más detallada veremos como el lactato interviene en la inmunidad innata y adaptativa.
Inmunidad innata y lactato
Las investigaciones se han enfocado en los efectos inmunomoduladores del lactato en las células inmunes innatas, principalmente las células dendríticas y macrófagos. Un papel importante en la respuesta tanto inmune innata como adaptativa es a través de las células dendríticas (DC). Las DC se originan a partir de células progenitoras hematopoyéticas y contribuyen a la inmunidad mediante el reconocimiento de señales patogénicas por medio de receptores de reconocimiento de patrones (PRRs) que son proteínas capaces de reconocer moléculas frecuentemente asociadas con patógenos (patrones moleculares asociados a patógenos, PAMP). La participación de PRRs en las células inmunes innatas induce señales coestimuladoras para las células inmunes adaptativas (particularmente los linfocitos T). De destacar, la "Teoría del peligro" planteada por Matzinger quien sugirió que, durante el estrés o daño tisular, las moléculas endógenas se liberan o activan e inician la respuesta inflamatoria, que capacita a las células presentadoras de antígeno para activar la respuesta inmune adaptativa. Estas moléculas se conocen como alarminas o DAMP (patrones moleculares asociados al daño). 31–34
Las DC presentan antígenos al exponer al complejo mayor de histocompatibilidad moléculas a las células T específicas de antígeno que luego eliminan los patógenos, esta defensa contra los microorganismos es importante, pero también es esencial que el sistema inmunitario no responda a sí mismo, lo que se conoce como tolerancia. Las células dendríticas tolerogénicas son esenciales en la tolerancia central y periférica. Las células dendríticas junto con las células epiteliales tímicas medulares tienen un papel crítico en la inducción de tolerancia central en el timo mediante la eliminación de los timocitos autorreactivos con antígenos y la generación de células T reguladoras (Tregs). Aunque la selección tímica elimina eficazmente la mayoría de las células T autorreactivas, algunas permanecen y migran hacia la periferia. Por lo tanto, la tolerancia periférica es decisiva para el mantenimiento de la homeostasis inmune durante toda la vida. 31,32,35
En el ámbito de la sepsis, una característica destacada es el desarrollo inadecuado de la tolerancia inmunológica hacia los patógenos. Por ejemplo, las DC pasan a un fenotipo progresivamente tolerogénico y promueven la diferenciación de células Tregs inmunosupresoras. Las DC tolerogénicas muestran la expresión de moléculas inmunomoduladoras y producen factores inmunosupresores como IL-10, TGF-β, IL-35 e indoleamina 2,3-dioxigenasa, lo que produce anergia y apoptosis de células T e inducción de Tregs. 31,32,35,36
Por otro lado, tenemos a los macrófagos, los cuales pueden activarse por varios desencadenantes y diferenciarse en subtipos funcionalmente diferentes. Existen dos tipos funcionales de macrófagos: los M1 y los M2. Mientras los M1 fagocitan, atacan a células tumorales y presentan antígenos, los M2 son estimulados por complejos inmunitarios e interleucinas de carácter antiinflamatorio, además que son macrófagos asociados a tumores, ya que muestran patrones oncogénicos, facilitando la supervivencia, la proliferación y la diseminación de las células malignas. 37
El metabolismo es distinto en cada uno de estos macrófagos: mientras los M1 aumentan su metabolismo de la glucosa y la producción de lactato a través de la glucólisis, los M2 lo realizan a través de OxPhos y la β-oxidación por la absorción de ácidos grasos.38
Pero, ¿qué sucede en la sepsis? En etapas tardías de la sepsis, los macrófagos tienen un fenotipo M2 predominantemente inmunosupresor que puede tener un papel en la patogénesis de la disfunción del sistema inmune. El lactato puede servir como responsable de promover la diferenciación inhibitoria M2. En experimentos in vitro con macrófagos derivados de la médula ósea, se ha determinado que el lactato es capaz de inducir una diferenciación de macrófagos similar a M2 mediante un mecanismo dependiente de la subunidad alfa del factor 1 inducible por hipoxia (HIF-1a). También se ha demostrado que cuando se coloca lactato al medio de crecimiento antes de la inducción de la diferenciación de las células madre de médula ósea da como resultado una producción mayor de células supresoras derivadas de mieloides (MDSC) en comparación con el control. Las MDSC son un grupo heterogéneo de células que tienen efectos inmunosupresores e intervienen en el desarrollo del cáncer y las enfermedades infecciosas crónicas. Además, el aumento de MDSC en la sepsis se vio implicado en la patogénesis de la disfunción inmune prolongada.38–41
Los efectos supresores del lactato en los macrófagos se extienden más allá del ambiente del tumor, ya que la inducción de la glucólisis aeróbica durante la eferocitosis, un proceso principalmente inmunosupresor, da como resultado la liberación de lactato. El lactato inducido por eferocitosis actúa de manera parácrina y contribuye a un ambiente antiinflamatorio al aumentar la expresión de genes antiinflamatorios. 42
Inmunidad adaptativa y lactato
Ahora continuemos de la manera en que interviene el lactato en el sistema inmune adaptativo. La inmunidad adaptativa o adquirida es la segunda línea de defensa del sistema inmune contra los patógenos no propios, también conocida como inmunidad específica. Está mediado por linfocitos T y B y su función es reconocer y eliminar los antígenos no propios durante el proceso de presentación del antígeno, y desarrollar memoria inmunológica. Las células T tienen dos subconjuntos principales: CD4 (helper) y CD8 (citotóxicos).15
Las células T desempeñan un papel clave mediante sus actividades citolíticas y la producción de citocinas pro y antiinflamatorias. Tras el reconocimiento del antígeno por el receptor de células T, células naïve a través de señales conducen a la diferenciación en células T efectoras. Para mantener un suministro adecuado de macromoléculas durante el crecimiento, las células T experimentan un cambio metabólico de la OxPhos a la glucólisis aeróbica, lo que lleva a un aumento en el flujo glucolítico y la producción concomitante de lactato.44
Dentro de las investigaciones realizadas, se ha determinado que el lactato se acumula en la sinovia de los pacientes con artritis reumatoide. El lactato de sodio extracelular y el ácido láctico inhiben la motilidad de las células CD4 y CD8. En las células CD4 el lactato de sodio también induce un cambio hacia el subconjunto Th17 que produce grandes cantidades de la citocina proinflamatoria IL-17, mientras que en las células CD8, el ácido láctico causa la pérdida de su función citolítica.44
Es probable que las células T reguladoras sean menos dependientes de la glucólisis aeróbica y utilicen principalmente la OxPhos para su producción de energía. Por lo tanto, teóricamente pueden no ser susceptibles a este tipo de regulación metabólica.45
UTILIDAD CLÍNICA ACTUAL
La función de las células inmunológicas se afecta de una u otra manera por la sepsis. En este contexto, se han investigado varios biomarcadores para ayudar a comprender si el paciente está en la fase hiperinflamatoria o hipoinflamatoria del trastorno, por lo tanto, se podrían usar para identificar pacientes inmunodeprimidos y beneficiarse de las inmunoterapias. Se los clasificará de acuerdo al tipo de inmunidad que queremos buscar (Tabla 1):

Tabla 1. Biomarcadores y hallazgos clínicos de laboratorio aplicado a la sepsis.21
ENFOQUE TRASLACIONAL
La sepsis mantiene una alta morbilidad que se ve intensificada por microorganismos multirresistentes, la cual induce numerosos defectos en la inmunidad innata y adaptativa del huésped de tal manera que, si los organismos invasores no se eliminan rápidamente, el huésped se vuelve más susceptible a la infección o a infecciones secundarias, por lo que es importante implementar terapéuticas guiadas para combatir a la infección, uso de antibióticos, soporte hemodinámico etc. Podemos dividir en dos grupos los fármacos en esta sección, por un lado los que actúan en la glucólisis y por otro los inmunomoduladores. 46
Se han realizado algunas investigaciones dentro del primer grupo:
Hay que recordar que la estimulación de macrófagos con LPS aumenta la expresión de piruvato quinasa M2 (PKM2), un modulador de la producción de IL-1b. Además, la activación de PKM2 atenúa el fenotipo de macrófago M1 proinflamatorio inducido por LPS y promueve al macrófago M2. La glucólisis mediada por PKM2 inicia la activación del inflamasoma y modula la fosforilación de EIF1AK2 en los macrófagos. En este contexto, en el estudio realizado por Xie, determinó que la inhibición farmacológica de la vía PKM2-EIF2AK2 protegió a los ratones de la endotoxemia letal y la sepsis polimicrobiana. 47
● La inhibición de la glucólisis aeróbica por el inhibidor de 2-desoxi-D-glucosa (2-DG) o inhibidor PKM2 mejoró la supervivencia en la sepsis polimicrobiana, y redujo los niveles de lactato sérico y la liberación de HMGB1.48
● Se reportó de que la inhibición de la glucólisis aeróbica por 2-DG mejoró la supervivencia en la sepsis bacteriana y también hubo reducción de la inflamación inducida por LPS in vivo. 49,50
● Por último, y no menos importante, Zheng destacó que la glucólisis aumentada por sepsis contribuyó a la miocardiopatía y mortalidad. Al inhibir la glucólisis con 2-DG ayudó a la función cardíaca y supervivencia, al mejorar la función mitocondrial y la respuesta inflamatoria. 51
Por otro lado, existen estrategias para aumentar la inmunidad del huésped. Los agentes inmunomoduladores tienen como objetivo mejorar las funciones inmunitarias durante la sepsis. Veamos a continuación algunos de estos:
Interleucina-7 humana recombinante (IL-7)
La IL-7 tiene efecto estimulante en las células B y T. En estas últimas tiene potencial para mejorar la homeostasis durante la sepsis. Las células estromales producen la IL-7 a través de los órganos linfoides periféricos, timo, piel, intestino y el hígado. Se considera que la IL-7 es una citocina pluripotente que es necesaria para el desarrollo de células T humanas. Se ha determinado que aumenta la producción de células T naïve, promueve la proliferación de células T, así como la activación y la diversidad de receptores de células T, disminuye la apoptosis de células T, incrementa células T que recluta neutrófilos al sitio de infección, aumenta la expresión de la molécula de adhesión en las células T. 21,22
Interleucina-15 (IL-15)
La glicoproteína IL-15 es producida por macrófagos, monocitos, células dendríticas, células endoteliales, células del estroma y células epiteliales renales. De igual forma, se han determinado algunos mecanismos de acción: estimula las células NK, NKT, CD8, prolifera y activa las células dendríticas; disminuye la apoptosis de células dendríticas y neutrófilos NK, T; provoca la secreción de citocinas de macrófagos y la fagocitosis; en las células NK y T aumenta la secreción de IFNγ. 21,2
Anticuerpo anti-PD-1 y anti-PD-L1
La expresión de receptores inhibitorios como PD-1 en células T y PD-L1 en células presentadoras de antígeno y células parenquimatosas disminuye las funciones de las células T durante la sepsis. De las funciones se destacan las siguientes: se une a los receptores PD-1 en las células T, bloquea la interacción PD-1 con PD-L1 y PD-L2, previene la inhibición de las células T a través de la vía PD-1 / PD-L.21,22
Interferón gamma (IFN-γ)
Las células T CD4 y CD8 activadas, junto con las células NK, son la principal fuente de IFNγ. IFN-γ aumenta la expresión de HLA-DR en monocitos y es una de las citocinas clave responsables de la activación de monocitos y macrófagos, que son esenciales para la eliminación microbiana durante la sepsis. Se ha determinado que la producción de IFN-γ de células T disminuye durante la sepsis, además se ha demostrado que las terapias que restauran la producción de IFN-γ de células T mejoran la supervivencia en modelos animales de sepsis.21,22
CONCLUSIONES
El efecto Warburg también se ha demostrado en las células inmunes como los monocitos, macrófagos, células dendríticas y células T que utilizan un mecanismo similar para su activación.
Los monocitos/macrófagos activados cambian su metabolismo de la fosforilación oxidativa a la glucólisis, porque las células inmunes activadas necesitan una fuente de energía disponible para la fagocitosis y precursores biosintéticos para dividirse y producir citocinas.
La elevación del lactato es secundaria a una perfusión deficiente o trastornos microcirculatorios, pero probablemente indica un cambio fundamental en el metabolismo hacia una glucólisis más proinflamatoria.
La función general del lactato parece ser cambiar el equilibrio de la activación de los macrófagos de un fenotipo inflamatorio a un fenotipo reparador.
Identificar pacientes inmunosuprimidos con la ayuda de biomarcadores y administrar inmunomoduladores específicos tiene un potencial significativo para la terapia de sepsis en el futuro.
La inmunoterapia podría representar el próximo gran avance en el tratamiento de enfermedades infecciosas y sepsis.
Fuente de financiamiento:
Autofinanciado.
Conflicto de interés:
Los autores declaran no tener conflictos de interés con la publicación de este artículo.
REFERENCIAS
1. Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, et al. Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Intensive Care Med. marzo de 2017;43(3):304-77.
2. Oberholzer A, Oberholzer C, Moldawer LL. Sepsis syndromes: understanding the role of innate and acquired immunity. Shock Augusta Ga. agosto de 2001;16(2):83-96.
3. Browne EP. Regulation of B-cell responses by Toll-like receptors. Immunology. agosto de 2012;136(4):370-9.
4. Martin GS, Mannino DM, Moss M. The effect of age on the development and outcome of adult sepsis. Crit Care Med. enero de 2006;34(1):15-21.
5. Ono S, Tsujimoto H, Hiraki S, Aosasa S. Mechanisms of sepsis-induced immunosuppression and immunological modification therapies for sepsis. Ann Gastroenterol Surg. septiembre de 2018;2(5):351-8.
6. Hotchkiss RS, Monneret G, Payen D. Immunosuppression in sepsis: a novel understanding of the disorder and a new therapeutic approach. Lancet Infect Dis. marzo de 2013;13(3):260-8.
7. Donnelly RP, Finlay DK. Glucose, glycolysis and lymphocyte responses. Mol Immunol. diciembre de 2015;68(2 Pt C):513-9.
8. Ventura MT, Casciaro M, Gangemi S, Buquicchio R. Immunosenescence in aging: between immune cells depletion and cytokines up-regulation. Clin Mol Allergy CMA [Internet]. 14 de diciembre de 2017 [citado 31 de mayo de 2020];15. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5731094/
9. Nguyen HB, Rivers EP, Knoblich BP, Jacobsen G, Muzzin A, Ressler JA, et al. Early lactate clearance is associated with improved outcome in severe sepsis and septic shock. Crit Care Med. agosto de 2004;32(8):1637-42.
10. Suetrong B, Walley KR. Lactic Acidosis in Sepsis: It’s Not All Anaerobic: Implications for Diagnosis and Management. Chest. enero de 2016;149(1):252-61.
11. Vásquez-Tirado GA, García-Tello AV, Evangelista Montoya FE. Utilidad del lactato sérico elevado como factor pronóstico de muerte en sepsis severa. HorizMéd Lima. abril de 2015;15(2):35-40.
12. Jl Á-V, Ac G-G, Ej D-G, Fl W. Índices estáticos y dinámicos de la hiperlactatemia. Med Interna México. 2016;7.
13. Ramírez PG, García RD, Ortega AG, Campuzano EG, Malumbres S, Soria JLM, et al. Sociedad Española de Bioquímica Clínica y Patología Molecular Comité Científico Comisión Magnitudes Biológicas relacionadas con la Urgencia Médica1 Documento N. Fase 3. Versión 3. :5.
14. Srivastava A, Mannam P. Warburg revisited: lessons for innate immunity and sepsis. Front Physiol. 2015;6:70.
15. Paola TP. Visión panorámica del sistema inmune. Rev Médica Clínica Las Condes. julio de 2012;23(4):446-57.
16. Warburg O. On the Origin of Cancer Cells. Science. 24 de febrero de 1956;123(3191):309-14.
17. Vander Heiden MG, Cantley LC, Thompson CB. Understanding the Warburg effect: the metabolic requirements of cell proliferation. Science. 22 de mayo de 2009;324(5930):1029-33.
18. Warburg O, Gawehn K, Geissler AW. [Metabolism of leukocytes]. Z Naturforsch B. agosto de 1958;13B(8):515-6.
19. Pearce EL, Pearce EJ. Metabolic pathways in immune cell activation and quiescence. Immunity. 18 de abril de 2013;38(4):633-43.
20. Wang R, Dillon CP, Shi LZ, Milasta S, Carter R, Finkelstein D, et al. The transcription factor Myc controls metabolic reprogramming upon T lymphocyte activation. Immunity. 23 de diciembre de 2011;35(6):871-82.
21. Hotchkiss RS, Monneret G, Payen D. Sepsis-induced immunosuppression: from cellular dysfunctions to immunotherapy. Nat Rev Immunol. diciembre de 2013;13(12):862-74.
22. Patil NK, Bohannon JK, Sherwood ER. Immunotherapy: A promising approach to reverse sepsis-induced immunosuppression. Pharmacol Res. 2016;111:688-702.
23. Boomer JS, To K, Chang KC, Takasu O, Osborne DF, Walton AH, et al. Immunosuppression in patients who die of sepsis and multiple organ failure. JAMA. 21 de diciembre de 2011;306(23):2594-605.
24. Leite TC, Coelho RG, Da Silva D, Coelho WS, Marinho-Carvalho MM, Sola-Penna M. Lactate downregulates the glycolytic enzymes hexokinase and phosphofructokinase in diverse tissues from mice. FEBS Lett. 3 de enero de 2011;585(1):92-8.
25. Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 4 de marzo de 2011;144(5):646-74.
26. Kellum JA. Metabolic acidosis in patients with sepsis: epiphenomenon or part of the pathophysiology? CritCareResusc J Australas Acad CritCareMed. septiembre de 2004;6(3):197-203.
27. Calcinotto A, Filipazzi P, Grioni M, Iero M, De Milito A, Ricupito A, et al. Modulation of microenvironment acidity reverses anergy in human and murine tumor-infiltrating T lymphocytes. Cancer Res. 1 de junio de 2012;72(11):2746-56.
28. Kellum JA, Song M, Li J. Lactic and hydrochloric acids induce different patterns of inflammatory response in LPS-stimulated RAW 264.7 cells. Am J PhysiolRegulIntegr Comp Physiol. abril de 2004;286(4):R686-692.
29. Goetze K, Walenta S, Ksiazkiewicz M, Kunz-Schughart LA, Mueller-Klieser W. Lactate enhances motility of tumor cells and inhibits monocyte migration and cytokine release. Int J Oncol. agosto de 2011;39(2):453-63.
30. Mazzio EA, Boukli N, Rivera N, Soliman KFA. Pericellular pH homeostasis is a primary function of the Warburg effect: inversion of metabolic systems to control lactate steady state in tumor cells. CancerSci. marzo de 2012;103(3):422-32.
31. Ueno H, Klechevsky E, Morita R, Aspord C, Cao T, Matsui T, et al. Dendritic cell subsets in health and disease. Immunol Rev. octubre de 2007;219:118-42.
32. Hasegawa H, Matsumoto T. Mechanisms of Tolerance Induction by Dendritic Cells In Vivo. Front Immunol. 2018;9:350.
33. Amarante-Mendes GP, Adjemian S, Branco LM, Zanetti LC, Weinlich R, Bortoluci KR. Pattern Recognition Receptors and the Host Cell Death Molecular Machinery. Front Immunol [Internet]. 16 de octubre de 2018 [citado 7 de junio de 2020];9. Disponible en: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6232773/
34. Matzinger P. Tolerance, danger, and the extended family. Annu Rev Immunol. 1994;12:991-1045.
35. Sim WJ, Ahl PJ, Connolly JE. Metabolism Is Central to Tolerogenic Dendritic Cell Function. Mediators Inflamm. 2016;2016:2636701.
36. Xing Y, Hogquist KA. T-Cell tolerance: Central and peripheral. Cold Spring HarbPerspect Biol. 1 de junio de 2012;4(6):1-15.
37. Macrófagos: ¿Aliados o enemigos del cáncer? | MiSistemaInmune [Internet]. [citado 31 de mayo de 2020]. Disponible en: https://www.misistemainmune.es/macrofagos-aliados-o-enemigos-del-cancer/
38. Arts RJW, Gresnigt MS, Joosten LAB, Netea MG. Cellular metabolism of myeloid cells in sepsis. J Leukoc Biol. 2017;101(1):151-64.
39. Pena OM, Pistolic J, Raj D, Fjell CD, Hancock REW. Endotoxin tolerance represents a distinctive state of alternative polarization (M2) in human mononuclear cells. J ImmunolBaltim Md 1950. 15 de junio de 2011;186(12):7243-54.
40. Colegio OR, Chu N-Q, Szabo AL, Chu T, Rhebergen AM, Jairam V, et al. Functional polarization of tumour-associated macrophages by tumour-derived lactic acid. Nature. 25 de septiembre de 2014;513(7519):559-63.
41. Husain Z, Huang Y, Seth P, Sukhatme VP. Tumor-derived lactate modifies antitumor immune response: effect on myeloid-derived suppressor cells and NK cells. J Immunol Baltim Md 1950. 1 de agosto de 2013;191(3):1486-95.
42. Ivashkiv LB. The hypoxia–lactate axis tempers inflammation. Nat Rev Immunol. febrero de 2020;20(2):85-6.
43. Haas R, Smith J, Rocher-Ros V, Nadkarni S, Montero-Melendez T, D’Acquisto F, et al. Lactate Regulates Metabolic and Pro-inflammatory Circuits in Control of T Cell Migration and Effector Functions. PLoS Biol. julio de 2015;13(7):e1002202.
44. Santos N, Pereira-Nunes A, Baltazar F, Granja S. Lactate as a Regulator of Cancer Inflammation and Immunity. Immunometabolism [Internet]. 16 de octubre de 2019 [citado 31 de mayo de 2020];1(2). Disponible en: https://ij.hapres.com/htmls/IJ_1118_Detail.html
45. Michalek RD, Gerriets VA, Jacobs SR, Macintyre AN, MacIver NJ, Mason EF, et al. Cutting edge: distinct glycolytic and lipid oxidative metabolic programs are essential for effector and regulatory CD4+ T cell subsets. J Immunol Baltim Md 1950. 15 de marzo de 2011;186(6):3299-303.
46. Palsson-McDermott EM, Curtis AM, Goel G, Lauterbach MAR, Sheedy FJ, Gleeson LE, et al. Pyruvate kinase M2 regulates Hif-1α activity and IL-1β induction and is a critical determinant of the warburg effect in LPS-activated macrophages. Cell Metab. 6 de enero de 2015;21(1):65-80.
47. Xie M, Yu Y, Kang R, Zhu S, Yang L, Zeng L, et al. PKM2-dependent glycolysis promotes NLRP3 and AIM2 inflammasome activation. Nat Commun. 25 de 2016;7:13280.
48. Yang L, Xie M, Yang M, Yu Y, Zhu S, Hou W, et al. PKM2 regulates the Warburg effect and promotes HMGB1 release in sepsis. Nat Commun. 14 de julio de 2014;5:4436.
49. Wang A, Huen SC, Luan HH, Yu S, Zhang C, Gallezot J-D, et al. Opposing Effects of Fasting Metabolism on Tissue Tolerance in Bacterial and Viral Inflammation. Cell. 8 de septiembre de 2016;166(6):1512-1525.e12.
50. Liu L, Lu Y, Martinez J, Bi Y, Lian G, Wang T, et al. Proinflammatory signal suppresses proliferation and shifts macrophage metabolism from Myc-dependent to HIF1α-dependent. ProcNatl Acad Sci U S A. 9 de febrero de 2016;113(6):1564-9.
51. Zheng Z, Ma H, Zhang X, Tu F, Wang X, Ha T, et al. Enhanced Glycolytic Metabolism Contributes to Cardiac Dysfunction in Polymicrobial Sepsis. J InfectDis. 01 de 2017;215(9):1396-406.
Recibido: 20 febrero 2021
Aceptado: 27 abril 2021
Santiago Xavier Aguayo-Moscoso1 Laisa Micaela Lascano-Cañas2, Mario Montalvo-Villagómez1, Fernando Jara González1, Pablo Andrés Vélez-Paez, Gustavo Velarde-Montero1, Pedro Torres-Cabezas4,5, Jorge Luis Vélez-Paez1,3.
Afiliación institucional:
1. Hospital Pablo Arturo Suárez
2. Facultad de Medicina, Universidad de las Américas.
3. Facultad de Ciencias Médicas – Universidad Central del Ecuador.
4. Facultad de Ciencias de la Salud – Universidad Técnica del Norte.
5. Hospital General Ibarra – Instituto Ecuatoriana de Seguridad Social.
Correspondencia: Dr. Jorge Luis Vélez Páez Facultad de Ciencias Médicas – Universidad Central del Ecuador Iquique N14-121 y Sodiro – Itchimbía, El Dorado. Teléfonos: (593-02) 2528 690 Correo electrónico: [email protected]
Jorge Luis Vélez Paez. Universidad Central del Ecuador-Hospital Pablo Arturo Suárez. (ORCID https://orcid.org/0000-0002-6956-4475) mail: [email protected]
Mario Montalvo Villagómez. Hospital Pablo Arturo Suárez. (ORCID: https://orcid.org/0000-0003-2987-7095), mail: [email protected]
Santiago Aguayo Hospital Pablo Arturo Suárez. (ORCID: https://orcid.org/0000-0003-4919-5497), mail: [email protected]
Pablo Andrés Vélez Universidad Central del Ecuador. (ORCID: https://orcid.org/0000-0002-6392-3895), mail: [email protected]
Gustavo Velarde Montero. Pontificia Universidad Católica del Ecuador. (ORCID: https://orcid.org/0000-0002-6530-1280), mail: [email protected]
Fernando E. Jara González. Hospital Pablo Arturo Suárez. (ORCID: https://orcid.org/0000-0003-2132-7187), mail: [email protected]
Pedro Torres Cabezas. Hospital General Ibarra – Instituto Ecuatoriana de Seguridad Social. (ORCID: https://orcid.org/0000-0003-0554-2135),mail: [email protected]