2023.08.04.35
Files > Volume 8 > Vol 8 no 4 2023
Caracterización microbiológica de biofertilizantes inoculados con microorganismos de montaña en el departamento de Copán Honduras
Microbiological characterization of biofertilizers inoculated with mountain microorganisms in the department of Copán Honduras
Juan Manuel López Guevara 1*, Kevin
Javier Estévez Ramírez 1, Elena Mejía Arita 1, Elyn
Antonieta Romero Zepeda 1, Francis Abel Díaz Chacón 1
1 Universidad
Nacional Autónoma de Honduras (UNAH), Centro Universitario Regional de
Occidente, Santa Rosa de Copán, Honduras.
Available from. http://dx.doi.org/10.21931/RB/2023.08.04.35
RESUMEN
Se analizaron las características
microbiológicas de diferentes tipos de biofertilizantes durante el proceso de
fermentación, elaborados con diferentes sustratos orgánicos e inoculados con
microorganismos de montaña (MM), obtenidos de una zona montañosa del
departamento de Copán, Honduras. Se planteó un diseño experimental, cuyos
tratamientos estaban constituidos por biofertilizantes formulados con MM en
medio líquido más diferentes sustratos orgánicos (estiércol de ganado bovino,
de porcino, gallinaza y un grupo de control sin inoculación de MM). Luego, se
observaron y midieron las poblaciones de hongos, bacterias, bacterias
productoras de ácido láctico, actinomicetos y levaduras de los
biofertilizantes. Los resultados del análisis muestran que no se presentan
diferencias estadísticas significativas (α = 0.05) entre las medias de las
poblaciones, en ninguno de los tratamientos. No se presentan diferencias
estadísticas (α = 0.05) durante el tiempo de fermentación (TF), excepto para
las poblaciones de actinomicetos, manifestadas en una reducción en los primeros
días de fermentación, y una ligera elevación en las últimas semanas,
probablemente atribuible a su lenta velocidad de crecimiento. Los resultados obtenidos podrán
contribuir a los conocimientos actuales y a las prácticas que los
productores agrícolas realizan en los sistemas de producción, al utilizar
alternativas orgánicas de fertilización.
Palabras claves. microorganismos de montaña, biofertilizantes,
características microbiológicas, proceso de fermentación, estiércol bovino,
estiércol porcino, gallinaza.
ABSTRACT
The study was
focused on analyzing the chemical characteristics of different types of
bio-fertilizers during the fermentation process, made with various organic
substrates and inoculated with mountain microorganisms (MM) collected from a
mountainous zone in the department of Copán, Honduras. A completely randomized
design was outlined, with treatments constituted by bio-fertilizers formulated
with MM in a liquid medium plus different organic substrates (bovine, porcine
and poultry manure and a control group without inoculation of MM). Then, fungi,
bacteria, lactic acid-producing bacteria, actinomycetes, and yeast populations
of the obtained bio-fertilizers were analyzed and measured. The analysis
results show no significant statistical differences (α = 0.05) among the population means in any treatment. There were
no statistically significant differences during the fermentation time (α = 0.05), except for the
actinomycetes populations, expressed in a reduction during the first fermentation
days and a slight increase during the last weeks, probably attributable to
their slow growth speed. Results achieved could contribute to current knowledge
and to practices that farm producers implement in their production systems,
using organic fertilization alternatives.
Keywords: mountain microorganisms, bio-fertilizers,
microbiological characteristics, fermentation process, bovine manure, porcine
manure, poultry manure
Los microorganismos eficientes (ME) son una
combinación de microorganismos, constituidos por levaduras, bacterias
(productoras de ácido láctico, fotosintéticas) y hongos de fermentación1,2,
considerados beneficiosos, por su contribución a incrementar la diversidad
microbiana de los suelos3. Se les conoce como ME, por su eficiencia
en la fijación de nitrógeno atmosférico, la descomposición de residuos
orgánicos o la promoción del reciclaje de nutrientes4.
Se trata de microorganismos presentes en ecosistemas
naturales, fisiológicamente compatibles unos con otros y capaces de coexistir
en un cultivo líquido5, aunque pueden presentarse interacciones
antagónicas que pueden causar la desaparición o disminución significativa de
algún organismo de interés6. Los MM se reconocen como un consorcio
particular de microorganismos, compuesto principalmente por hongos y bacterias
que representan habitantes naturales de sistemas edáficos alrededor del mundo7.
La utilización de MM se ha promovido en los
últimos años para la formulación de biofertilizantes, que contienen
microorganismos provenientes de cepas eficientes que aceleran los procesos
microbianos del suelo mejorando la asimilación de nutrientes por parte de las
plantas8,9. Diversos estudios se han realizado sobre la
caracterización de MM en biofertilizantes10, 11 y sobre la medición
de efectos en cultivos1, 7.
Se desarrolló la presente investigación con
el objetivo de analizar las características microbiológicas de diferentes tipos
de biofertilizantes, elaborados con diferentes sustratos orgánicos e inoculados
con MM, provenientes de la zona de protección forestal Cocoyagua en el
departamento de Copán, buscando contribuir al conocimiento de la potencialidad
que los MM ofrecen y la viabilidad de su utilización en productos formulados a
partir de éstos.
El bioinsumo que se estudia es un biofertilizante líquido artesanal
elaborado con estiércoles de bovino, porcino y gallinaza e inoculado con MM. La importancia del estudio se
relaciona con la búsqueda de alternativas de fertilización de los cultivos que
sean amigables ambientalmente, que utilicen insumos locales y que contribuyan a
contrarrestar el alto costo de los insumos agrícolas.
Diseño
Se presenta un diseño experimental
completamente al azar (DCA) con 4 tratamientos y 3 repeticiones cada uno (12
unidades experimentales), constituidos por biofertilizante multimineral
inoculado con MM: 1) más estiércol de bovino (T1), 2) más estiércol de porcino
(T2), 3) más gallinaza (T3), 4) sin adición de estiércol o grupo de control
(C). Se analizó de manera independiente la composición microbiológica del
compuesto elaborado en el tiempo de fermentación (TF): a los 15, 30, 45, 60 y
75 días.
Entorno
El área de recolección y fermentación de
los MM, conocida como Cocoyagua, se localiza en el departamento de Copán, en el
occidente de Honduras. Es una zona montañosa
y de relieve irregular, con una altitud entre 900 y 1500 msnm, una
precipitación entre 1300 y 1500 mm de agua por año y una temperatura entre 20 y
30º C12.
Las pruebas
microbiológicas se realizaron en el Laboratorio de Ensayos Microbiológicos del
Centro Universitario Regional de Occidente (CUROC).
Intervenciones
Para la formulación de los MM en medio
sólido, se realizó la limpieza manual y desmenuzado de 220 libras de hojarasca,
adicionando 200 libras de salvado de trigo, 4 galones de melaza y 26 galones de
agua, mezclándolos
hasta obtener un compuesto uniforme, y
compactándolo dentro de un barril para empezar el proceso de fermentación por
15 días.
El proceso de formulación de los MM en
medio líquido consiste en colocar 120 libras de MM en medio sólido en sacos de
manta, se sumerge en un barril con una mezcla de 6 galones de melaza y 206
galones de agua y se deja en reposo protegido de la luz solar y la lluvia por
15 días.
Se formularon los biofertilizantes de forma
separada con 15 libras de cada uno de los estiércoles y otros insumos como la
melaza (1/3 de galón), ceniza (2 libras), suero de leche (2.6 galones), miel de
café (2.6 galones), cal hidratada (2 libras) y MM en su fase líquida. El
proceso de adaptó a partir de formulaciones orgánicas artesanales desarrolladas
por organizaciones de productores, como Café Orgánico Marcala13, o
procesos apoyados por instituciones como Plan Trifinio14, Zamorano11
y el Instituto Hondureño del Café15. Tales experiencias se han
basado en estudios desarrollados desde 19705, hasta la actualidad2,
16-18.
Los biofertilizantes se dispusieron en un
conjunto de recipientes acondicionados para el proceso experimental. El
muestreo se realizó agitando el contenido de cada recipiente distribuyendo
uniformemente las sustancias presentes, para extraer una alícuota del compuesto
y trasladarla al laboratorio, en botellas de plástico rotuladas, en
contenedores a temperaturas alrededor de 4°C. Se tomaron muestras a los 15, 30,
45, 60 y 75 días del proceso de fermentación, para realizar los análisis de
hongos, bacterias, bacterias productoras de ácido láctico, actinomicetos y
levaduras.
La
selección de los grupos de microorganismos se realizó con base en autores que
los describen como los más importantes MM: Higa y Parr5, los
presentan como poblaciones predominantes de bacterias ácido lácticas y
levaduras, y menores proporciones de bacterias fotosintéticas, actinomicetos y
otros tipos de organismos. Otros autores19, 18 destacan, además, los
hongos fermentadores. Los mismos grupos son confirmados en investigaciones
posteriores2, 11, 7.
Los medios de cultivo utilizados fueron
Agar Nutriente, Agar Papa Dextrosa, Agar Sabouraud Dextrosa, Agar Lactobacillus
MRS y Agar Actinomicetos. De las diluciones preparadas con las muestras
obtenidas de cada unidad experimental (12), se sembraron diluciones 10-1,
10-3 y 10-6, por duplicado, es decir, 6 placas por unidad
experimental para un total de 72 placas, que al multiplicarlas por 5 medios de
cultivo, se obtiene un total de 360 placas con medio de cultivo.
La siembra en todos los medios de cultivo
se realizó por inoculación directa de las diluciones en las placas Petri
utilizando la técnica de recuento en placa. Se contaron las placas con la
dilución que permitió identificar entre 30 y 300 colonias y se obtuvo una media
aritmética de las dos placas con la dilución seleccionada para hacer el
recuento
Análisis de datos
La organización, tabulación y procesamiento
de los datos obtenidos se realizó utilizando hojas de cálculo de Excel y el
programa estadístico InfoStat. El análisis descriptivo de los resultados se
realizó por medio de medidas descriptivas y gráficas. La variación se estudió a
través de un análisis de varianza (ANOVA), determinando
las variaciones con niveles de significancia α = 0.05. Posteriormente,
se realizaron pruebas de rango post ANOVA (prueba de la diferencia honesta significativa
[DHS] de Tukey, con un nivel de significancia α = 0.05), para determinar las diferencias
particulares (entre cada uno de los tratamientos y entre cada uno de los TF).
Poblaciones de hongos
El comportamiento que se observa, de
acuerdo a la Fig. 1, es similar en todos los tratamientos. El T1 (estiércol de bovino)
presenta los valores más bajos a lo largo del período de fermentación (7.3 x 103
UFC/ml), mientras que el C muestran los valores más altos (1.16 x 104
UFC/ml).
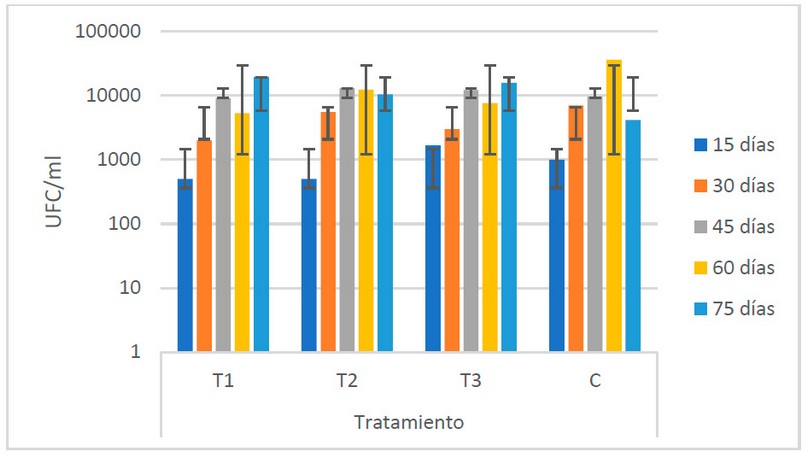
Figura
1. Recuento microbiológico de hongos (UFC/ ml) registrado en los
biofertilizantes según sus tratamientos (Fuente: Laboratorio de Ensayos
Microbiológicos del CUROC).
En general (Fig. 2), el desarrollo de
hongos durante el TF muestra un comportamiento creciente a partir de los 30
días, alcanzando los valores máximos a los 45 días. No se muestran diferencias
estadísticas (α = 0.05) entre las medias de las poblaciones de hongos.
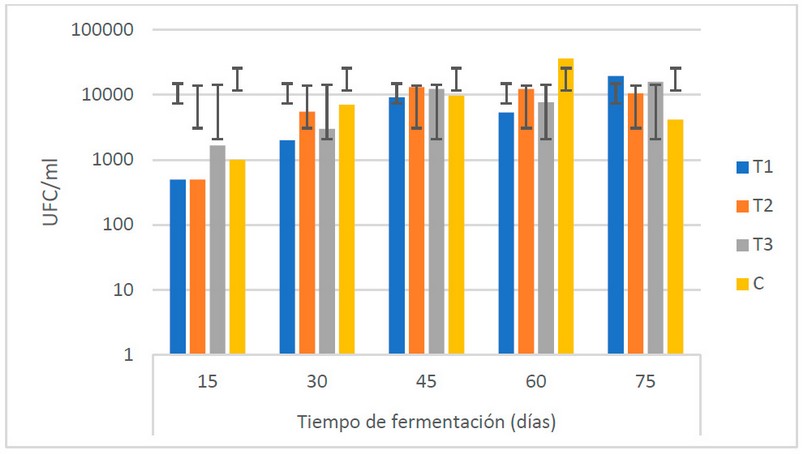
Figure.
2 Recuento microbiológico de hongos (UFC/ml) en los biofertilizantes durante el
TF (días) (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
Poblaciones de bacterias
El comportamiento se muestra similar en todos los tratamientos, siendo
el T3 (1.19 x 104 UFC/ml) el que presenta las poblaciones más
elevadas, particularmente en la última etapa del período de fermentación (la
Fig. 3). No se encuentran diferencias
estadísticas que indiquen que las poblaciones de bacterias presentan variación
en los diferentes tipos de estiércoles utilizados.
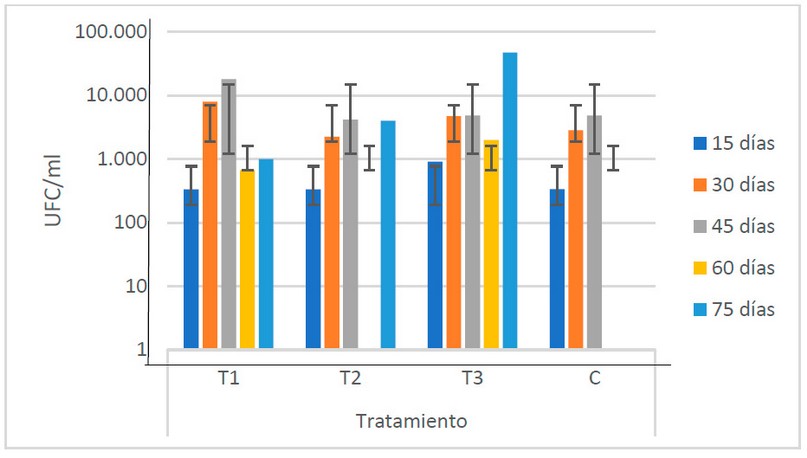
Figura 3. Recuento
microbiológico de bacterias encontradas en los biofertilizantes según sus
tratamientos (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
El comportamiento en el TF muestra en general (Fig.
4), una tendencia creciente hasta los 45 días de fermentación, para sufrir un
descenso a los 60 días y luego alcanzar los valores más altos a los 75 días
(1.7 x 104 UFC/ml). En otro estudio cotejado18, los
resultados más elevados son obtenidos a los 45 días (2.01 x 104 UFC/ml).
El autor indica que esto puede estar relacionado con el
momento en que las bacterias se encuentran en la etapa de multiplicación,
pudiendo estar asimilando los nutrientes para aumentar su población.
Los resultados muestran que, a pesar de la
tendencia creciente hasta los 45 días, no existen diferencias estadísticas (α = 0.05) entre las
medias de las poblaciones de bacterias en el TF, indicando que estas se
mantienen durante los 75 días de fermentación.
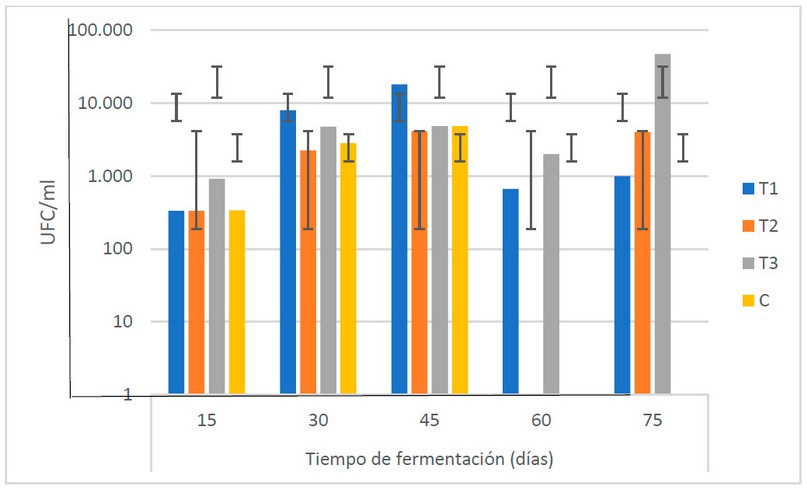
Figura 4. Recuento
microbiológico de bacterias (U.F.C/ml) en los biofertilizantes durante el TF
(días) (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
Poblaciones de bacterias productoras de
ácido láctico
En conjunto (Fig. 5), se identifican el T3
y el C como los grupos con los valores más elevados de poblaciones de bacterias
ácido lácticas (6.4 x 103 y 6.3 x 104 UFC/ml
respectivamente). El ANOVA muestra que no existe variabilidad de los valores de
las poblaciones de bacterias formadoras de ácido láctico entre los diferentes
estiércoles utilizados.
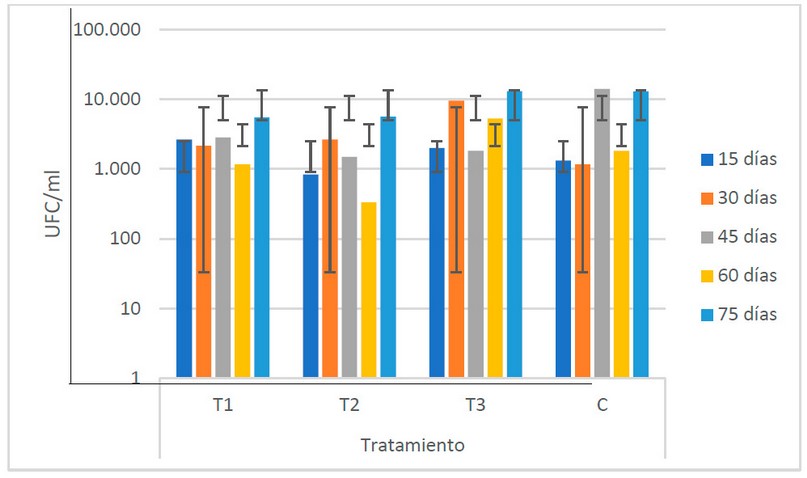
Figura 5. Recuento microbiológico de
bacterias ácido lácticas (U.F.C/ml) en los biofertilizantes según sus
tratamientos (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
En general, las cantidades de bacterias
ácido lácticas encontradas en el biofertilizante muestran un comportamiento
creciente hasta los 45 días (desde 1.7 x 103 hasta 5.08 x 103 U.F.C/ml),
sufriendo una reducción a los 60 días (2.2 x 103 U.F.C/ ml) para
alcanzar los valores más altos a los 75 (9.3 x 103 UFC/ ml) (Fig.
6). El ANOVA muestra que no existen diferencias estadísticas (α = 0.05) entre las
medias de las poblaciones en el período de fermentación de los
biofertilizantes.
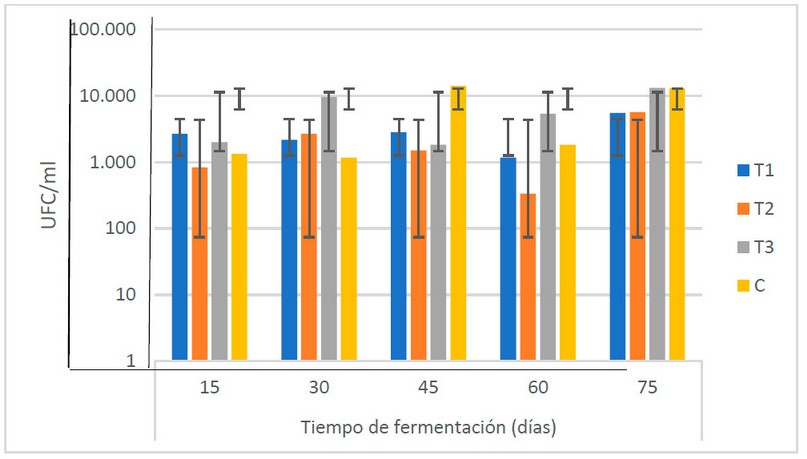
Figura
6. Recuento microbiológico de bacterias ácido lácticas (UFC/ml) en los
biofertilizantes en el TF (Fuente: Laboratorio de Ensayos Microbiológicos del
CUROC).
El recuento microbiológico presentado en
dos estudios muestra que, mientras que las poblaciones de lactobacillus pueden llegar hasta 3.7 x 108 UFC/ml17,
pueden llegar a descender hasta 4.0 x 104 UFC/ml16 en el
periodo de fermentación.
Poblaciones de actinomicetos
Entre los tratamientos, el T2 presenta los
valores más elevados (5.5 x 102 UFC/ml), mientras que el C muestra
los más bajos, con 1.9 x 102 UFC/ml (Fig. 7). Las tendencias
temporales entre estos extremos se mantienen a lo largo del período de
fermentación.
El ANOVA muestra que no existe variabilidad
de los valores de las poblaciones de actinomicetos entre los diferentes
estiércoles utilizados.
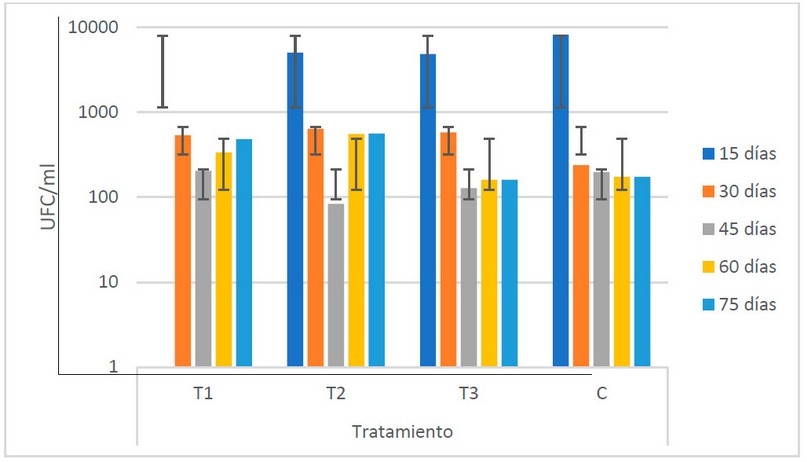
Figura
7. Recuento microbiológico de actinomicetos (UFC/ml) en los biofertilizantes
según sus tratamientos (Fuente: Laboratorio de Ensayos Microbiológicos del
CUROC).
El comportamiento de los actinomicetos
durante el período de fermentación muestra una disminución entre los 15 y los
30 días (de 6.0 x 103 a 4.9 x 102 UFC/ml), manteniéndose
relativamente estable a partir de este tiempo (Fig. 8). El estudio de Suárez18
muestra un comportamiento similar al de esta investigación: una reducción entre
los 30 y 45 días de fermentación y una estabilización el resto del TF. El autor
señala que la velocidad de crecimiento de los actinomicetos es muy lenta (más
que los hongos), lo que hace que haya un mejor aprovechamiento de los elementos
nutritivos de los biofertilizantes por parte de otros microorganismos como
levaduras y bacterias.
El ANOVA indica que hay diferencias en las
poblaciones de actinomicetos entre los TF. La prueba post ANOVA indica que las
variaciones en la población de actinomicetos muestran diferencias estadísticas
entre el inicio y el final del proceso de fermentación, período en el cual se
presenta un descenso de la población de microorganismos de 4.5 x 103
a 3.4 x 102 UFC/ml, mostrando la caída en las poblaciones de
actinomicetos desde los primeros 15 días. Sin embargo, no se encuentran
diferencias desde los 30 días hasta el final del proceso de fermentación,
período en el cual se observa una estabilización de la población de
actinomicetos en el biofertilizante.
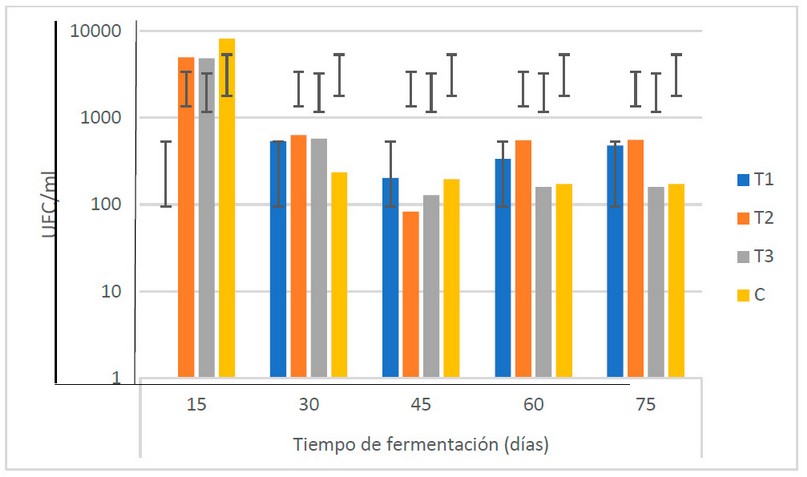
Figura
8. Recuento microbiológico de actinomicetos (UFC/ml) en los biofertilizantes
durante el TF (días) (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
Poblaciones de levaduras
Como se muestra en la Fig. 9, el T1
presenta los valores más elevados de levaduras (3.8 x 104 UFC/ml),
mientras que el T3 registra los valores más bajos (9.9 x 103). No se
presentan diferencias estadísticas entre las medias de los tratamientos,
indicando que no existe variabilidad en los valores de las poblaciones de
levaduras entre los estiércoles utilizados.
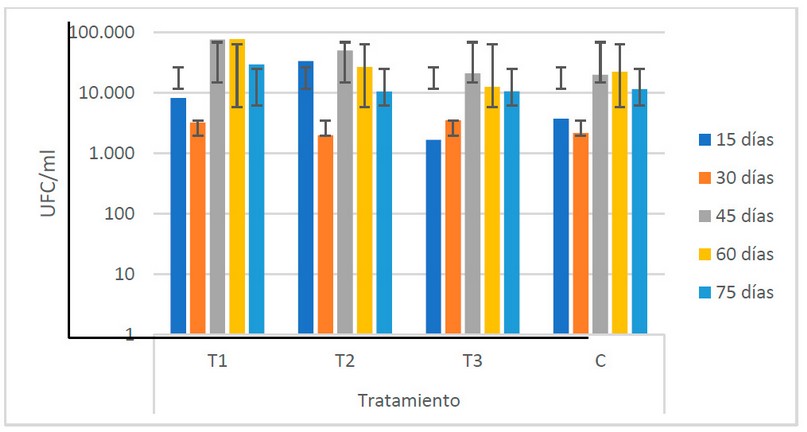
Figura
9. Recuento microbiológico de levaduras (UFC/ml) registrado en los
biofertilizantes según sus tratamientos (Fuente: Laboratorio de Ensayos
Microbiológicos del CUROC).
Las levaduras muestran un comportamiento
creciente, bastante uniforme, durante todo el TF, desde 9.2 x 102
hasta 1.2 x 104 UFC/ ml (véase la Fig. 10). Los resultados muestran
que no existen diferencias estadísticas (α = 0.05) entre las medias de las
poblaciones de levaduras durante el período de fermentación.
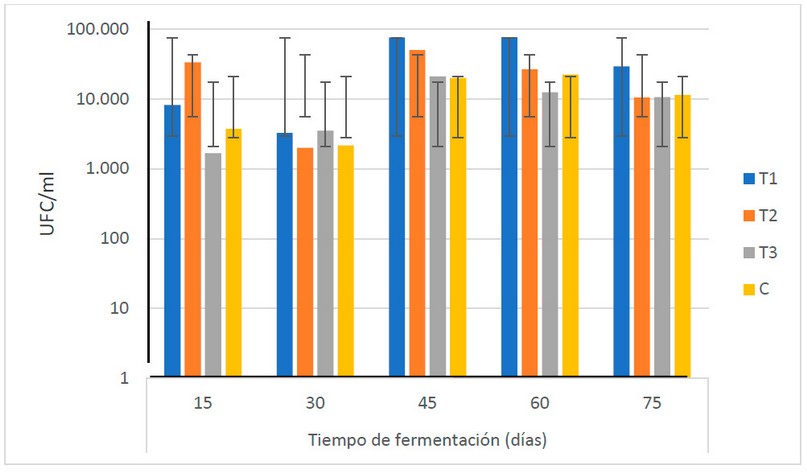
Figura
10. Recuento microbiológico de levaduras (UFC/ml) en los biofertilizantes
durante el TF (días) (Fuente: Laboratorio de Ensayos Microbiológicos del CUROC).
En todos los tratamientos predominan las
poblaciones de levaduras, mientras que los actinomicetos presentan los valores
más bajos (Tabla 1). No hay diferencias
estadísticas en las poblaciones de microorganismos de los estiércoles
utilizados, por lo que su utilización individual en los biofertilizantes no
hace que estos tengan contenido microbiológico diferente.
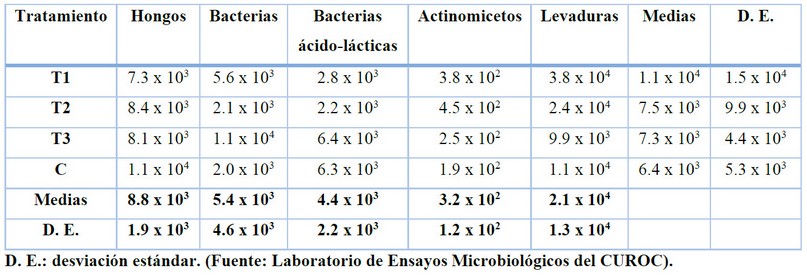
Tabla 1. Variaciones
de los grupos de microorganismos entre los tratamientos (UFC/ml)
Otros estudios muestran que los biofertilizantes
elaborados artesanalmente presentan una gran variabilidad con respecto a las
poblaciones de microorganismos presentes17, 18; sin embargo, en el
presente estudio, esa heterogeneidad no se manifiesta entre los tratamientos,
ya que los resultados no muestran diferencias estadísticas entre ellos.
Durante el TF sólo se encontraron
diferencias en la población de actinomicetos, mostrando una disminución de
éstos desde el inicio del proceso hasta los 30 días, a partir de los cuales se
mantiene estable a lo largo del tiempo restante de fermentación (véase la Tabla
2).
Suárez18 señala que la mayor
población de microorganismos se presenta a los 45 días de fermentación,
principalmente a nivel de bacterias y levaduras. En el presente, la mayor
población de microorganismos que se encuentra en este período es principalmente
hongos y levaduras.
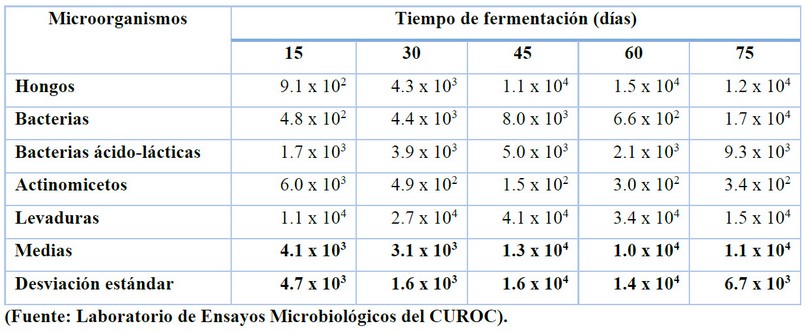
Tabla
2. Variaciones de los grupos de microorganismos en el tiempo de fermentación
(U.F.C/ml)
Las
mediciones se realizaron en períodos de 15 días, hasta completar 75 días,
tomando en cuenta que el biofertilizante es un consorcio microbiano cuyos
ciclos entre diferentes microorganismos son diferentes y teniendo la posibilidad
de observar cambios en esos períodos de tiempo. También se tomó en cuenta que
el tiempo del proceso de compostaje puede llevar varias semanas desde su fase
mesófila hasta la de maduración20.
A partir de los resultados, considerando
que el comportamiento muestra que alrededor de los 45 días se estabilizan o
decrecen las poblaciones de microorganismos, el período de fermentación podría
reducirse a la mitad. Además, debe considerarse realizar análisis para evaluar el almacenamiento del biofertilizante en un período con diferentes intervalos.
Es
importante señalar que los MM funcionan en consorcios, que no todos los
microorganismos de estos consorcios son cultivables y que se seleccionaron los
que se han descrito por ser utilizados como indicadores de calidad de estos
productos. Sin embargo, la mayoría de los microrganismos existentes en estos
compuestos son no cultivables.
La principal contribución hecha por el
estudio deriva de la cuantificación de las poblaciones de hongos, bacterias,
bacterias ácido lácticas, actinomicetos y levaduras en biofertilizantes
inoculados con MM, así como la identificación de su comportamiento durante el
TF. La metodología empleada para la cuantificación de los grupos de
microorganismos es reconocida microbiológicamente, los medios de cultivo
utilizados y los ensayos microbiológicos contaron con los requerimientos
mínimos de aislamiento, asepsia y control y se siguieron las técnicas y los
protocolos de análisis microbiológicos para garantizar la calidad de los
resultados. Sin embargo, las metodologías utilizadas para la recolección de los
microorganismos y la formulación de los biofertilizantes son artesanales,
utilizando técnicas de campo con niveles
bajos de control de factores ambientales y con una precisión baja de las
proporciones y composición de los insumos utilizados. En este aspecto hay que
tomar en cuenta que la constitución de los componentes orgánicos puede variar
grandemente, dependiendo del tipo y origen de los materiales (aves, bovinos,
etc.), del grado de procesamiento, de la ubicación21 o del tipo de
digestor22.
Los resultados del estudio pueden servir de
base para diferentes análisis sobre el uso de MM en biofertilizantes, por
ejemplo, utilizando metodologías moleculares23,
incluyendo los avances de técnicas de genómica para identificar los MM
existentes en la zona de estudio24, así como la determinación de la
biomasa microbiana en el suelo a través de ensayos enzimáticos, o la cuantificación
de hongos filamentosos empleando técnicas moleculares para la determinación de
biomasa fúngica25.
Los efectos de los
biofertilizantes en cultivos específicos pueden ser estudiados, así como el
aislamiento de microorganismos específicos, las interacciones entre
microorganismos y de éstos con los parámetros químicos.
Es conocido que los estiércoles pueden
aportar inóculo microbiológico y otros materiales orgánicos en mayor o menor
cantidad y que la melaza de caña es una importante fuente energética para la
fermentación y para favorecer la actividad microbiológica26. Sin
embargo, una mayor precisión de las
formulaciones de los biofertilizantes requeriría la depuración previa de
algunos insumos, como los estiércoles y los microorganismos obtenidos de la
hojarasca de montaña; un mayor control del pH y el contenido microbiológico del
agua utilizada; y un conocimiento de los contenidos de azúcares de otros
insumos como la melaza.
Precisamente entre las debilidades
referidas reiteradamente en los biofertilizantes, en particular los que
utilizan MM, está la aplicación de métodos no estandarizados en su formulación16
y la falta de definición de indicadores de calidad10. La elaboración
de formulaciones homogéneas y estables18, 16; la implementación de
biofábricas, en las que se manejen los principios de calidad e inocuidad, y a
su vez, trabajar en la estandarización de fórmulas, podrían ser estrategias a
seguir.
Otros aspectos importantes son: la
estabilización y preservación de las propiedades del biofertilizante en el
tiempo, en diferentes condiciones como temperaturas y en diferentes lotes de
producción; la ausencia de microorganismos patógenos. Se pueden identificar
nuevas rutas para el desarrollo de inóculos microbiales y para mejorar la
estabilidad por medio del uso de nanoformulaciones27.
No se mostraron diferencias en ninguno de los
sustratos orgánicos utilizados, con respecto al recuento microbiológico en
ninguno de los grupos de microorganismos analizados. Los
biofertilizantes muestran que no hay diferencias durante el TF con respecto al
recuento microbiológico en cuatro de los cinco grupos de microorganismos
analizados. La estabilidad de las poblaciones microbianas en
todos los tratamientos puede ser un aspecto importante en la durabilidad de los
biofertilizantes y en la utilización de los insumos orgánicos requeridos en su
formulación.
El tiempo de fermentación podría reducirse con base en el comportamiento
de los microorganismos, en el cual se muestra una tendencia creciente en el
inicio y etapas intermedias.
Los
resultados obtenidos deben tomarse como punto de partida para futuras
investigaciones en las que se profundice sobre diferentes aspectos como la
identificación de microorganismos específicos utilizando técnicas avanzadas de
genómica, el estudio de las interacciones de los microorganismos con otros
microorganismos, con el suelo y con las plantas. Se pueden considerar estudios
para evaluar condiciones, tiempos de almacenamiento de biofertilizantes y
dosificaciones, para identificar los cambios en los contenidos de los sustratos
orgánicos (estiércoles) y en los microorganismos utilizados, para evaluar
calidad de los insumos y los procesos y los efectos de los biofertilizantes en
cultivos específicos.
AGRADECIMIENTOS
A la Coordinación Regional de Investigación Científica del CUROC, por
todo el apoyo en la ejecución de la investigación. A la Dirección de
Investigación Científica de la UNAH, por el apoyo para el desarrollo del
estudio a través de la beca de investigación y la asesoría brindada.
1. Toalombo, R. Evaluación de
microorganismos eficientes autóctonos aplicados en el cultivo de cebolla blanca
(Allium fistulosum). Tesis de
Licenciatura. Universidad Técnica de Ambato, Ceballos, Ecuador. 2012.
2.
Acosta Díaz, A. &
Leguizamo González, E. J. Métodos y técnicas de cuantificación microbiana
empleados en la industria de alimentos, farmacéutica, agrícola y ambiental. Tesis de Licenciatura. Pontificia
Universidad Javeriana, Bogotá. 2020.
3.
Arias, A. Microorganismos eficientes y su beneficio para la agricultura y
el medio ambiente. Jou. Cie. Ing. 2010, 2
(2): 42 – 45.
4.
Morocho, M. &
Leiva, M. Microorganismos eficientes, propiedades funcionales y aplicaciones
agrícolas. Ctro. Agr. 2019, 46 (2): 93-103.
5. Higa, T.
& Parr, J. Beneficial and effective
microorganisms for a sustainable agriculture and environment. International Nature Farming Research Center: Atami,
Japón, 1994.
6.
Frioni, L. Microbiología básica, ambiental y agrícola.
Universidad de la República: Montevideo, Uruguay, 2006.
7. Umaña, S.; Rodríguez,
K. & Rojas, C. ¿Funcionan realmente los microorganismos de montaña como una
estrategia de biofertilización? Ciencias
Ambientales, 2017, 51 (2): 133-144. https://doi.org/10.15359/rca.51-2.7
8.
Pontificia Universidad Javeriana. Tecnologías
relacionadas con biofertilizantes. Boletín Tecnológico. Superintendencia de
Industria y Comercio: Bogotá, Colombia, 2014.
9.
Aguado, G. Uso de
microorganismos como biofertilizantes. En Introducción
al uso y manejo de los biofertilizantes en la agricultura; Aguado, G., Ed.;
INIFAP/SAGARPA: Celaya, Guanajuato, México, D. F., 2012; pp. 35-78.
10. Zagoya, J.; Ocampo, J.; Ocampo, I.;
Macías, A. & de la Rosa, P. Caracterización fisicoquímica de biofermentados
elaborados artesanalmente. Biotecnia, 2015, 17 (1): 14-19.
11. Zeballos Heredia, María Fernanda. Caracterización de microorganismos
de montaña (MM) en biofertilizantes artesanales. Tesis de Licenciatura. EAP, Zamorano, Honduras. 2017.
12. Consejo Intermunicipal Higuito. Indicadores socioeconómicos línea de base del Municipio de Dolores, Copán. JICA: Dolores, Copán, 2006.
13. COMSA. Manual de
biotecnologías orgánicas. Café Orgánico Marcala: Marcala, Honduras, 2016.
14. Suchini, J. Innovaciones agroecológicas para una producción agropecuaria sostenible
en la región del Trifinio. CATIE: Turrialba, Costa Rica, 2012.
15. IHCAFE. Cartilla 15:
Manejo de subproductos del café. Uso de microorganismos. 2016. https://ihcafemovil.ihcafe.hn/
16. Acosta Almánzar, H. Microorganismos eficientes de montaña:
evaluación de su potencial bajo manejo agroecológico de tomate en Costa Rica.
Tesis de Maestría. CATIE, Turrialba, Costa Rica. 2012.
17. Araya Alpízar, F. Producción
y caracterización de bioles para su uso en el cultivo de banano (Musa Sp). Tesis de Licenciatura.
ITCR, Cartago, Costa Rica. 2010.
18. Pacheco, F.; Borrero, G. & Villalobos, M. Evaluación de la calidad bioquímica
resultante de biofermentos agrícolas para uso de familias productoras
orgánicas. Red de Coordinación en Biodiversidad: Cartago, Costa Rica, 2017.
19. Suárez Segura, D. M. Caracterización
de un compuesto orgánico producido en forma artesanal por pequeños agricultores
en el departamento del Magdalena. Tesis de Maestría. Universidad Nacional de
Colombia, Santa Marta, Colombia. 2009.
20. Cóndor-Golec, A.; González Pérez, P.
& Lokare, C. Effective microorganisms: myth or reality? Rev. Peru. Biol. 2007,
14 (2): 315-319.
21. Román, P., Martínez, M. & Pantoja, A. Manual de compostaje del agricultor.
FAO: Santiago de Chile, 2013.
22. Syed, S.; Wang, X.; Prasad, T. &
Lian, B. Bio-organic mineral fertilizer for sustainable agriculture. Minerals, 2021, 11, 1336.
https://doi.org/10.3390/ min11121336
23. Warnars, L. & Oppenoorth, H. El biol: el fertilizante supremo. Hivos: Países Bajos, 2014.
24. Carrasquilla Gallego, M. El microbioma del agroecosistema y
su importancia en la agricultura sostenible. Tesis de doctorado. Universitat
Autónoma de Barcelona, Barcelona. 2020.
25. Nogales, B. La microbiología del suelo en la era de la
biología molecular: descubriendo la punta del iceberg. Ecosistemas, 2005,14
(2): 41-51.
26. Restrepo, J. & Hensel, J. Manual práctico de agricultura orgánica y panes de piedra.
Impresora Feriva S.A.: Cali, Colombia, 2009.
27. Yimer, D. & Abena, T. Components,
mechanisms of action, success under greenhouse and field condition, market
availability, formulation and inoculants development on biofertilizer. Biomed.
J. Sci. & Tech. Res., 2019, 12 (4): 9366-9372. DOI: 10.26717/BJSTR.2019.12.002279
Received: 26 September 2023 / Accepted:
15 April 2023 / Published:15 December 2023
Citation: López Guevara J M , Estévez Ramírez
K J, Mejía Arita E, Romero Zepeda E A , Díaz Chacón F A. Caracterización microbiológica de biofertilizantes
inoculados con microorganismos de montaña en el departamento de Copán
HondurasRevis Bionatura 2023;8 (4) 35.
http://dx.doi.org/10.21931/RB/2023.08.04.35
Publisher's Note:
Bionatura stays neutral concerning jurisdictional claims in published maps and
institutional affiliations.
