2020.05.03.10
Files > Volume 5 > Vol 5 No 3 2020
INVESTIGATION / RESEARCH
Evaluación de la calidad de vida como predictor de supervivencia en el cáncer
Quality of life assessment as a predictor of survival in cancer
Carmen Viada1*, Carlos Bouza2, Javier Ballesteros3, Martha Fors4, Mabel Alvarez1, Aliuska Frias1, Lazara Garcia1, Yanela Santiesteban1, Yuliannis Santiesteban1, Mayra Ramos1.
Available from: http://dx.doi.org/10.21931/RB/2020.05.03.10
RESUMEN
La calidad de vida y la supervivencia son variables a tener en cuenta en ensayos clínicos de pacientes oncológicos. Es importante investigar la relación que existe entre ellas para los distintos tipos de cáncer. Se unieron las bases de datos de todos los pacientes oncológicos incluidos en los ensayos clínicos que se ejecutaron en el país, en el período 2000-2020. La calidad de vida se evaluó a través de las encuestas utilizadas en cada protocolo de investigación. Se realizó un análisis del tiempo transcurrido entre la inclusión del paciente y el fallecimiento para determinar el tiempo de supervivencia. Se comprobó que las variables de supervivencia de los pacientes incluidos en ensayos clínicos, mostraron valores superiores a los reportados para los pacientes con similares localizaciones del tumor no incluidos en estas investigaciones. Las localizaciones de mayor supervivencia fueron: pulmón (14.03 meses), cabeza y cuello (19.63 meses) y esófago (16.85 meses). En el caso de la calidad de vida se obtuvo que, globalmente, los pacientes mantuvieron un excelente estado general y la mayoría se incorporó a las actividades domésticas y laborales. Los pacientes incluidos en ensayos clínicos mostraron un incremento de la supervivencia y calidad de vida.
Palabras claves: calidad de vida, ensayos clínicos, oncología, supervivencia.
ABSTRACT
The quality of life and survival are variables to take into account in the clinical trial of oncologic patients. It is essential to the researcher the relationship between both different types of cancer. It merges the database with all the oncological patients who were included in the clinical trials that were executed in Cuba, in the period 2000-2020. The quality of life was evaluated through the surveys used in each investigation protocol. It was carried out an analysis of the time elapsed between the patient's inclusion and the death to determine the time of survival. It was proven that the variables of the patients' survival included in clinical trials, showed superior values to those not reported for the patients with similar localizations of the tumor included in these investigations. The localization of more survival was: lung (14.03 months), head and neck (19.63 months) y esophagus (16.85 months). In the case of the quality of life, it was obtained that, globally, the patients maintained an excellent general state and most incorporated into domestic and labor activities. The patients included in clinical trials showed an increment in the survival and quality of life.
Keywords: quality of life, clinical trials, oncology, survival.
INTRODUCCIÓN
El cáncer constituye un problema de salud mundial, afecta a todos los países, independientemente de la raza, cultura, nivel de desarrollo económico y sistema político. En el mundo entero cada año se detectan unos 18 millones de casos nuevos. Constituye la principal causa de mortalidad a nivel mundial. Se le atribuyen 9 millones de defunciones (o aproximadamente el 13% de las defunciones mundiales) ocurridas en 2018. Se espera que para el 2030 aumenten a 20 millones los casos nuevos, el 60% de ellos en países en desarrollo, que cuentan sólo con el 5% de los recursos destinados a combatir este mal. El número de defunciones anuales mundiales por cáncer seguirá aumentando y llegará a unos 25 millones en 2040. 1, 2, 3
Temido por la población, estudiado por los científicos, el cáncer es un problema de salud mundial que nos agrede año tras año con su carga de angustia y esperanzas.
Sin embargo, la Organización Mundial de la Salud (OMS) considera que el cáncer es una enfermedad prevenible y curable. Un tercio de los casos pueden ser prevenidos, otro tercio curado si se diagnostica tempranamente y el otro podría tener al menos una mejor calidad de vida. 1, 2
En Cuba el cáncer es la segunda causa de muerte para todos los grupos de edades y la primera de años potenciales de vida perdidos, aun cuando su comportamiento ha variado en el tiempo. El riesgo real de morir por cáncer en Cuba tuvo un incremento del 78,21% entre los años 1970 y 2006, con una tendencia ascendente que se acentuó a partir de los primeros años de la década del 80. En el año 2006 la tasa cruda de mortalidad por cáncer casi duplicó la existente al inicio de la década del 70. 4
En el año 2018, se reportan 106 199 defunciones, 750 menos que en el 2017. La tasa de mortalidad general es de 9.4 defunciones por cada 1 000 habitantes, inferior en 1.1% a la del año anterior, la tasa ajustada por edad es de 4.6, una décima menor. Según clasificación en tres grupos de causas de muerte, la tasa de mortalidad, por enfermedades crónicas no trasmisibles es la más elevada, 769.8 defunciones por cada 100 000 habitantes, le sigue en orden decreciente, la tasa de mortalidad por enfermedades transmisibles, las causas de muerte materna, perinatal y nutricional, 90.9, y la mortalidad por causas externas, 73.4. En relación con las 10 primeras causas de muerte, las enfermedades del corazón ocupan el primer lugar con una tasa de 228.2 por 100 000 habitantes, seguida de la muerte por tumores malignos, cuya tasa es de 221.3, ambas causas explican el 47.6 % del total de las defunciones del año 2018. 5, 6
El manejo terapéutico del paciente oncológico se basa fundamentalmente en la aplicación de terapias oncoespecíficas: cirugía, quimioterapia y radioterapia. En las últimas tres décadas este se ha complementado con una cuarta modalidad de tratamiento denominada inmunoterapia, que se fundamenta en dirigir la respuesta inmune contra las células tumorales para lograr la reparación, estimulación o amplificación de los mecanismos inmunitarios involucrados en la detención del crecimiento y de la diseminación del tumor. 7, 8
Habitualmente los resultados de las intervenciones terapéuticas que se emplean en el paciente oncológico se evalúan en términos objetivos, valorando únicamente los conceptos clásicos de curación, supervivencia, morbilidad, etc. Pero estos parámetros no tienen en cuenta, en la mayoría de las ocasiones, la opinión del paciente, estableciendo como prioridad fundamental obtener la curación. Cuando no es posible la curación lo que se plantea es el aumento de la supervivencia, pero en muchas ocasiones el beneficio que se consigue en términos de supervivencia es escaso. Esto ha conducido a la búsqueda de otros objetivos de tratamiento, como por ejemplo el intervalo libre de enfermedad y el beneficio clínico (tiempo que conseguimos mantener al paciente sin síntomas relacionados con su tumor); además ha propiciado, el inicio de un cambio en la mentalidad de los oncólogos clínicos, obligando a introducir en los ensayos clínicos innovaciones metodológicas que incluyan conceptos como calidad de vida. 9, 10
La definición calidad de vida es extremadamente complicada dentro del ámbito de la salud. Aunque existen múltiples y variadas definiciones sobre lo que es calidad de vida, afortunadamente cada vez existe un mayor consenso sobre la misma, la mayoría hacen referencia a la evaluación subjetiva de la vida entendida como un todo, o la valoración de los pacientes sobre la satisfacción con su nivel de funcionamiento normal comparándolo con el que ellos creían que era posible o ideal. Generalmente la evaluación es realizada mediante encuestas y formularios que incluyen una serie de preguntas o afirmaciones relacionadas con diversos aspectos de la vida de los pacientes y que se denominan globalmente cuestionarios de calidad de vida relacionada con la salud. 9, 10
Cuba se encuentra en una posición de avanzada en el desarrollo de fármacos inmunoterapéuticos. En el país se encuentra registrado un anticuerpo monoclonal, una vacuna terapéutica y actualmente se desarrollan más de 30 ensayos clínicos de vacunas y otros productos de la biotecnología. A tono con la tendencia internacional dichas investigaciones han incluido en sus análisis para la evaluación de la respuesta el concepto de calidad de vida.
Los resultados preliminares obtenidos muestran un incremento positivo en las variables de respuesta al tratamiento, lo que ha conllevado a que los productos en ensayo clínico sean considerados por los oncólogos cubanos como una opción terapéutica más en el manejo del paciente. El objetivo general del trabajo fue evaluar la calidad de vida de los pacientes incluidos en ensayos clínicos oncológicos y para ello evaluamos la calidad de vida de los pacientes incluidos en ensayos clínicos oncológicos y su influencia en la supervivencia de los pacientes y se determino el tiempo de supervivencia de los pacientes incluidos en ensayos clínicos oncológicos.
MATERIALES Y MÉTODOS
Se realizó un estudio longitudinal, prospectivo, en los servicios de oncología del país, en el periodo comprendido entre los años 2000 y 2020.
Universo. Pacientes oncológicos incluidos en ensayos clínicos.
Muestra . Se realizó un muestreo opinático partiendo de criterios de inclusión.
Criterios de inclusión.
1. Pacientes cubanos de ambos sexos, con diagnóstico de cáncer en algunas de las localizaciones siguientes: pulmón de células no pequeñas (NSCLC), cabeza y cuello y esófago.
Criterios Diagnóstico
Cáncer de NSCLC: carcinoma de pulmón avanzado de células no pequeñas en estadio IIIB o IV, definido según TNM.
Cáncer de cabeza y cuello: adenocarcinoma de cabeza y cuello estadio III o IV o con enfermedad metastásica evolutiva al momento del diagnóstico, con confirmación cito-histológica de su enfermedad.
Cáncer de esófago: adenocarcinoma de Esófago estadio III o IV o con enfermedad metastásica evolutiva al momento del diagnóstico, con confirmación cito-histológica de su enfermedad.
2. Pacientes con edades mayores o iguales a 18 años.
3. Pacientes que hayan otorgado el consentimiento informado.
4. Pacientes incluidos en alguno de los protocolos de ensayos clínicos que se ejecutan en los servicios de oncología del país.
Pulmón: EC056 Fase II (65), EC081 Fase III (RPCEC00000161, N=228), EC111 Fase III (25), EC120 Fase IV (RPCEC00000181, N=558) y EC157 Fase IV (RPCEC00000205, N=231)Cabeza y cuello: EC055 Fase III (93), EC113 Fase IV (RPCEC00000089, N=144) y CIMAB4 Fase IV (RPCEC00000145, N=42)Esófago: EC075 Fase II (RPCEC00000014, N=38), EC144 Fase III (13) y EC163 Fase IV (RPCEC00000215, N=176)Operacionalización de variables
Calidad de vida: Aprovechamiento general de la vida. Aspectos del sentido del bienestar de una persona y capacidad de llevar a cabo diversas actividades. Bienestar, felicidad, satisfacción de la persona que le permite una capacidad de actuación o de funcionar en un momento dado de la vida. Es propio de cada individuo, que está muy influido por el entorno en el que vive como la sociedad, la cultura y las escalas de valores.
Supervivencia: Se define como el tiempo que transcurre desde la fecha de diagnóstico de la enfermedad hasta el fallecimiento del paciente, independientemente de la causa del mismo.
Metodología
Evaluación de calidad de vida (CV): Se determinó mediante el análisis de las encuestas de calidad de vida aplicadas en los diferentes protocolos de ensayos clínicos en que se incluyeron los pacientes. Se analizaron las encuestas aplicadas en dos momentos: antes de la inclusión en el ensayo clínico y en la evaluación correspondiente al 9º mes de tratamiento. Los pacientes que interrumpieron el tratamiento antes de esta evaluación no se tuvieron en cuenta para el análisis.
Los cuestionarios de calidad de vida utilizados son instrumentos validados por la European Organization in the Research and Treatment of Cancer(EORTC) obtenidos por vía electrónica.
Estos instrumentos evalúan las dimensiones que global e integralmente comprende la calidad de vida:
La puntuación máxima para los temas de funcionamiento y estado de salud global indica un buen funcionamiento (saludable) y una elevada calidad de vida, respectivamente, mientras que un marcaje alto en la evaluación de síntomas representa un alto grado de síntomatología o problema de salud.
Los cuestionarios utilizados fueron: 11, 12
General: EORTC QLQ-C30. Con la estructura siguiente:
Cinco escalas funcionales: funcionamiento físico, rol, emocional, cognitivo y social.
Tres escalas de síntomas: fatiga, dolor, y náusea/vómitos.
Una escala global de salud/calidad de vida.
Ítems individuales que evalúan síntomas adicionales.
Todas las escalas e ítems individuales se convierten en una puntuación de 0 a 100.
Específicos:
Cáncer de pulmón: EORTC QLQ-LC13
Cabeza y Cuello: EORTC QLQ-HN35
Esófago: EORTC QLQ-OES24
Evaluación de la supervivencia (SV): Se analizaron los datos de todos los pacientes incluidos por cada localización tumoral. Los resultados se reportaron en meses, se expresaron en forma de intervalos y medias y se compararon con los reportados en la literatura para las localizaciones analizadas. En el caso de los pacientes que se mantienen vivos se consideró la fecha de último contacto.
Análisis estadístico
Para la Regresión de Cox se utilizaron las escalas de funcionalidad y de síntomas en el momento inicial, para estimar cuál de ellas predecía mejor la supervivencia de los pacientes para las distintas localizaciones de cáncer. Para comparar las Curvas de Kaplan-Meier, se categorizaron las escalas funcionales (1: 100% de la Funcionalidad y 0: <100% de la Funcionalidad) y las escalas de síntomas (0: 0% de síntomas y 1: > 0% de síntomas). Se estimó la media y mediana y sus intervalos de confianza respectivamente del tiempo de supervivencia y aplicó la “Prueba de log rank” con ayuda del paquete estadístico SPSS 25.0 para Windows y un nivel de significación de 0,05.
RESULTADOS
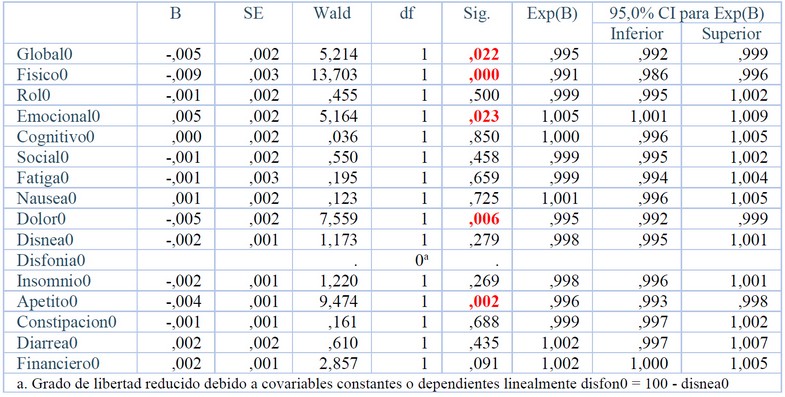
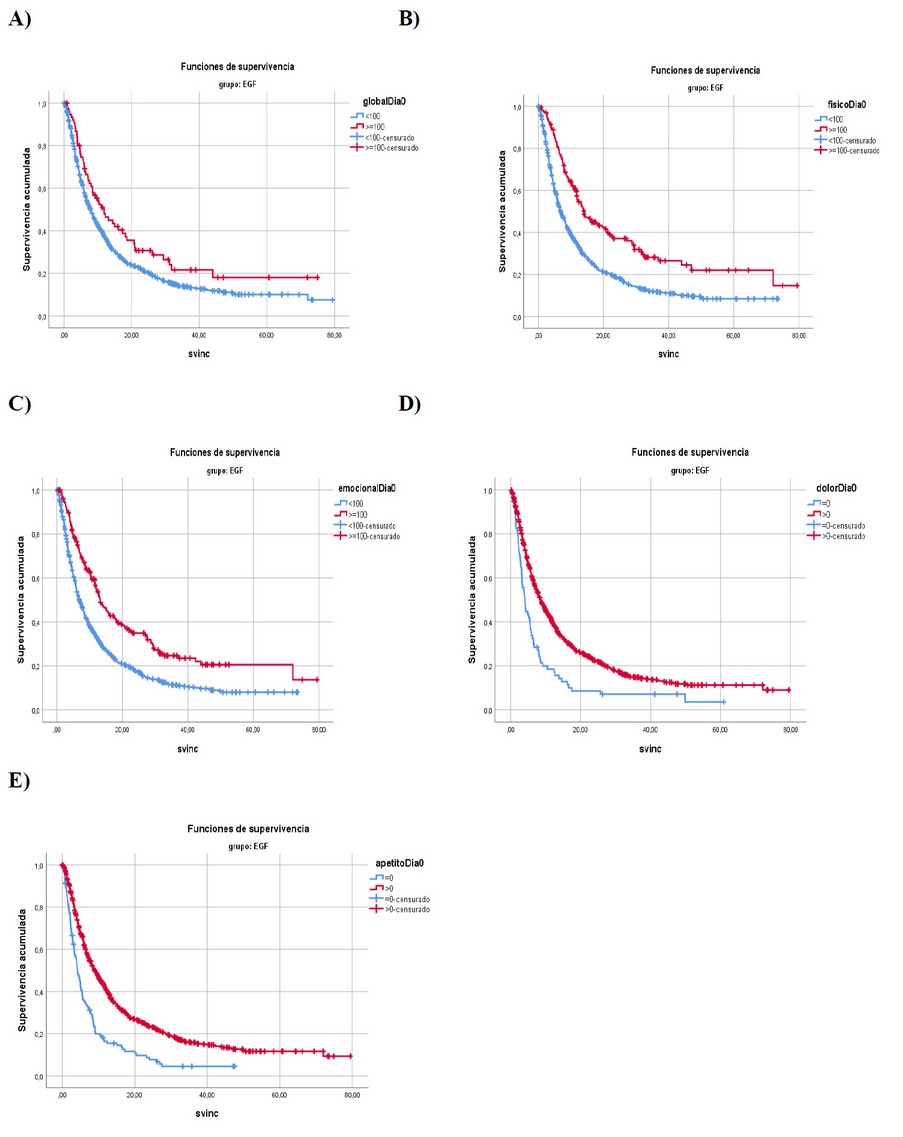
La muestra de pulmón quedó constituida por 1107 pacientes incluidos en los distintos protocolos. En la Tabla 1 aparece la regresión de Cox para los pacientes de pulmón. Las escalas funcionales que influyen en la supervivencia son la global, físico y emocional y los síntomas que influyen en la supervivencia son el dolor y la pérdida de apetito (p<0.05). En la Figura 1 se observan las curvas de Kaplan Meier para las 5 escalas que dieron significativas. La mediana de los pacientes con el 100% de la escala global fue de 11.83 meses y con < 100% fue de 7.89 meses (p=0.018, Fig. 1A). La mediana de los pacientes con el 100% de la escala física fue de 14.03 meses y con < 100% fue de 6.87 meses (p=0.000, Fig. 1B). La mediana de los pacientes con el 100% de la escala emocional fue de 13.21 meses y con < 100% fue de 6.87 meses (p=0.000, Fig. 1C). La mediana de los pacientes con el 0% del síntoma dolor fue de 8.53 meses y con >0% fue de 4.11 meses (p=0.000, Fig. 1D). La mediana de los pacientes con el 0% de pérdida de apetito fue de 8.97 meses y con >0% fue de 4.17 meses (p=0.000, Fig. 1E).
Tabla 1. Variables en la ecuación de Regresión de Cox para Pulmón
Figura 1.- Curvas de Kaplan-Meier para Pulmón
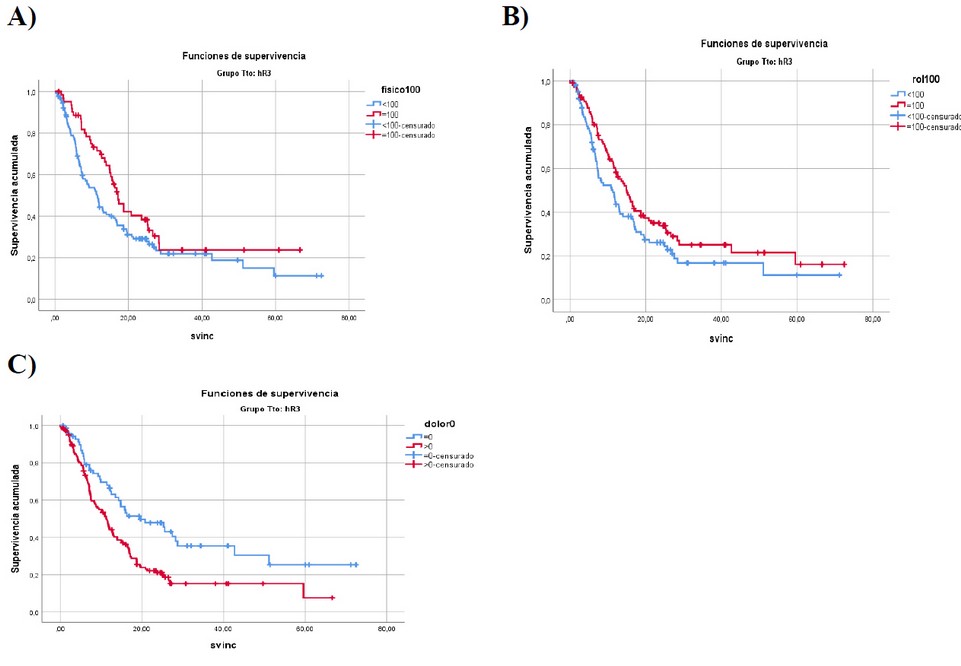
La muestra de cabeza y cuello quedó constituida por 279 pacientes incluidos en los distintos protocolos. En la Tabla 2 aparece la regresión de Cox para los pacientes de cabeza y cuello. Las escalas funcionales que influyen en la supervivencia son la física y el rol y el síntoma que influye en la supervivencia es el dolor (p<0.05). En la Figura 2 se observan las curvas de Kaplan Meier para las 3 escalas que dieron significativas. La mediana de los pacientes con el 100% de la escala física fue de 17.17 meses y con < 100% fue de 11.53 meses (p=0.045, Fig. 2A). La mediana de los pacientes con el 100% de la escala rol fue de 14.87 meses y con < 100% fue de 11.30 meses (p=0.031, Fig. 2B). La mediana de los pacientes con el 0% del síntoma dolor fue de 19.63 meses y con >0% fue de 11.33 meses (p=0.001, Fig. 2C).
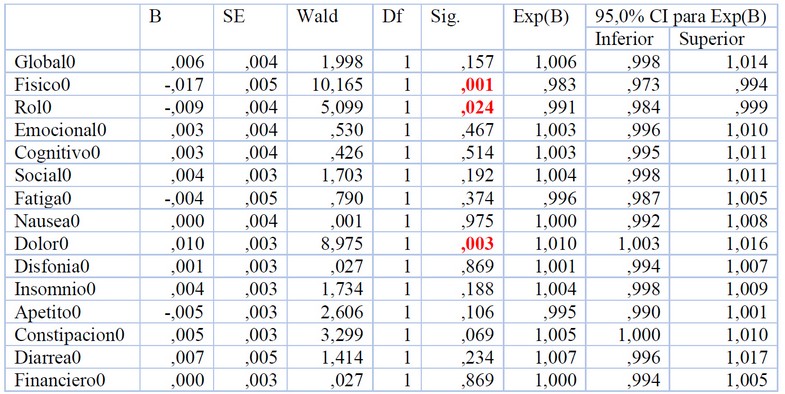
Tabla 2. Variables en la ecuación de Regresión de Cox para Cabeza y Cuello
Figura 2.- Curvas de Kaplan-Meier para Cabeza y Cuello.
La muestra de esófago quedó constituida por 227 pacientes incluidos en los distintos protocolos. En la Tabla 3 aparece la regresión de Cox para los pacientes de esófago. La única escala que influye en la supervivencia es el síntoma dolor (p<0.05).
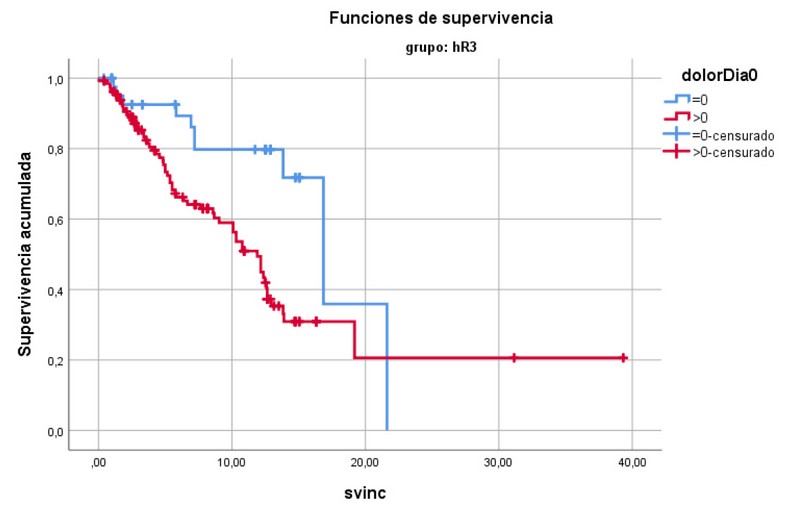
En la Figura 3 se observan las curvas de Kaplan Meier para la única escala significativa. La mediana de los pacientes con el 0% del síntoma dolor fue de 16.85 meses y con >0% fue de 11.89 meses (p=0.001, Fig. 3).
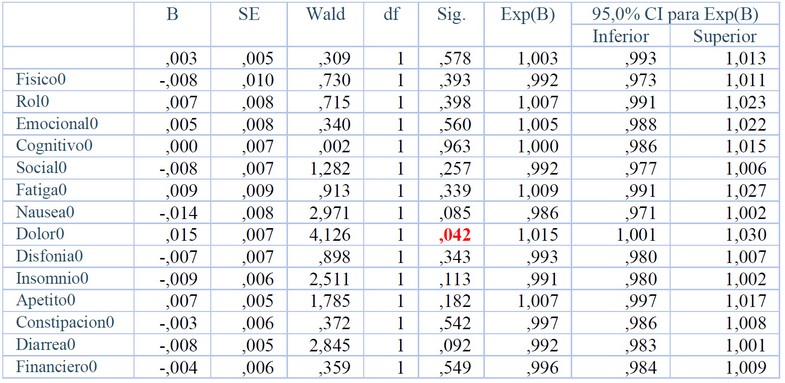
Tabla 3. Variables en la ecuación de Regresión de Cox para Esófago
Figura 3.- Curvas de Kaplan-Meier para Esófago.
DISCUSIÓN
Evaluación de la calidad de vida (CV)
Al realizar un análisis de los resultados se observa que es esperado atendiendo a que en el momento de la evaluación los pacientes han concluido los tratamientos oncoespecíficos, ya sea cirugía, quimioterapia y/o radioterapia, que afectan considerablemente sus condiciones tanto físicas, psicológicas como sociales siendo la dimensión física la más afectada no solo por los síntomas de la enfermedad sino también por los efectos adversos que están asociados a los tratamientos impuestos. 13, 14
Esta dimensión física además influye en el comportamiento del resto de las dimensiones, aunque en el caso de la psicológica y la social también juega un papel importante el manejo que la familia hace del paciente y que muchas veces limita sus actividades aun cuando sus condiciones físicas no lo requieran. 15
Hubo una mejoría en la calidad de vida de los pacientes con cáncer de pulmón en las dimensiones global, físico y emocional y una disminución de los síntomas de dolor y pérdida del apetito. Por otro lado, los pacientes de cabeza y cuello experimentaron una mejoría en la calidad de vida en las dimensiones física y rol y una disminución del síntoma dolor. Por último, los pacientes con cáncer de esófago, tuvieron una disminución del síntoma dolor.
Desde el punto de vista físico la mejoría es explicable por dos factores fundamentales: en primer lugar, por la reducción de los eventos adversos del tratamiento 16 y en segundo lugar por la eficacia que han demostrado los productos en ensayos clínicos utilizados por los pacientes incluidos en el estudio.
Desde el punto de vista psicológico el aumento de los porcentajes en las categorías de la calidad de vida puede estar relacionados con el hecho de que el paciente se siente tratado en un momento de su enfermedad oncológica en que, de manera general, no se imponen tratamientos oncoespecíficas. Otro aspecto que puede influir en este comportamiento puede ser que estos tratamientos no requieren hospitalización del paciente y que la mejoría física evidente hace que el paciente muestre una aptitud mejor ante la vida que durante los tratamientos citotóxicos.
Todas estas razones hacen que los pacientes logren incorporarse a las actividades diarias, ya sean domésticas o laborales, la mejoría de los síntomas y de la aptitud ante la vida presupone una mejor relación con amigos y familiares, todo esto hace que el comportamiento de la dimensión social aumente sus porcentajes positivos.
Según estudios realizados los pacientes durante su tratamiento con productos en ensayos clínicos muestran una mejor calidad de vida que los tratados convencionalmente. 17 Al comparar los resultados obtenidos en este estudio se constata que el comportamiento coincide con esta afirmación y en el mismo influyen factores como el mencionado hecho de la diferencia en los eventos adversos asociados a los tratamientos, pero también la forma de manejo del paciente incluido en ensayo clínico. Las normas que rigen las investigaciones clínicas exigen que los pacientes sean tratados de forma estrictamente protocolizada, velando por sus derechos y bienestar y esto hace que su vida sea finalmente más saludable. Estas razones hacen que muchos autores planteen la necesidad de que las exigencias de la práctica médica habitual se acerquen cada vez más a las de las investigaciones clínicas.
Evaluación de la supervivencia (SV):
Para el análisis de la supervivencia se tomaron como referencia los valores descritos por la literatura para cada localización y luego de recibir el tratamiento oncoespecífico. En todos los casos el tiempo promedio de sobrevida de la muestra superó el valor reportado.
Este es un resultado esperado si tenemos en cuenta que algunos autores plantean que la calidad de vida es el pronosticador más importante de supervivencia entre los pacientes que tienen cáncer y en varias investigaciones publicadas se ha observado un incremento proporcional de ambos factores. 18 Por tanto, los resultados obtenidos del análisis de calidad de vida tienen una relación directa con los del análisis de la supervivencia. 19, 20, 21
Estos resultados subrayan la importancia de ayudar a los pacientes a mejorar la calidad de vida en la medida que podamos para poderles ayudar a vivir más tiempo y mejor.
CONCLUSIONES
Los pacientes incluidos en ensayos clínicos oncológicos mostraron un incremento en la calidad de vida, lo cual influyó positivamente en el aumento de la supervivencia. El tiempo de supervivencia de los pacientes incluidos en los ensayos clínicos fue superior al compararlo con lo reportado por la literatura.
REFERENCIAS
1. Organización Mundial de la Salud [sitio Web en Internet]. Cáncer, Inc.; 2010 [actualizado Ene 2010; citado Feb 2010]. Disponible en: http://www.who.int/mediacentre/factsheets/fs297/es/index.html
2. World Health Organization. Globocan 2018. The Global Cancer Observatory, May 2019.
3. Figueredo K. Cuidados paliativos: una opción vital para pacientes con cáncer de mama. Rev haban cienc méd. [serie en Internet]. 2008 Oct –Dic [citado Nov 2009]; VII (4): [aprox. 4p.]. Disponible en: http://www.ucmh.sld.cu/rhab/rhcm_vol_7num_4/rhcm09408.htm
4. Sansó FJ, Alonso P, Torres RM. Mortalidad por cáncer en Cuba. Revista Cubana de Salud Pública. [serie en Internet]. 2010 [citado Nov 2009]; 36(1): [aprox. 14p.]. Disponible en: http://bvs.sld.cu/revistas/spu/vol_36_01_10/spu09110.pdf
5. Bess S, Alonso I, Sánchez E, López LM y col. Anuario Estadístico de Salud 2018. ISBN: 1561-4433. Abr 2019. http://bvscuba.sld.cu/anuario-estadístico-de-cuba/
6. Bermejo W, Abreu G, Rubio MC, Romero T. Programa Integral para el Control del Cáncer en Cuba 2020. ISBN: 978-959-313-783-6. http://ecimed.sld.cu
7. Arango MC, González A. Vacunas terapéuticas en cáncer. Ensayos clínicos actuales. Rev cubana med. [serie en Internet]. 2002[citado Nov 2009]; 41(6): [aprox. 5p.]. Disponible en:http://scielo.sld.cu/scielo.php?script=sci_arttext&pid=S0034-75232002000600009&lng=es&nrm=iso
8. Lerma JM. Marcadores tumorales en la inmunoterapia contra el cáncer. Revista Salud Pública y Nutrición. 2009; 7.
9. Contreras J. Definición y áreas de la calidad de vida en oncología. Oncología (Barc). [serie en Internet]. 2005 [citado Dic 2009]; 28(3): [aprox. 5p.]. Disponible en: http://scielo.isciii.es/scielo.php?pid=S0378-48352005000300002&script=sci_arttext
10. Arrarás JI, Dueñas T, Meiriño R, Prujá E, Villafranca E, Valerdi JJ. La Calidad de Vida en el paciente oncológico: estudios del Servicio de Oncología del Hospital de Navarra en el Grupo de Calidad de Vida de la EORTC. Anales. [serie en Internet]. 1998 [citado Dic 2009]; 21(1): [aprox. 4p.]. Disponible en: ttp://www.cfnavarra.es/salud/anales/textos/vol21/n1/revis2a.html
11. EORTC [sitio Web en Internet]. Quality of Life, Inc.; 2010 [citado Feb 2010]. Disponible en: http://groups.eortc.be/qol/
12. EORTC [sitio Web en Internet]. Activities, Inc.; 2010 [citado Feb 2010]. Disponible en: http://groups.eortc.be/qol/qolg_activities.htm
13. Perry S, Kowalski T, Chang C. La calidad de vida de evaluación en las mujeres con cáncer de mama: ventajas, la aceptabilidad y la utilización. Health and Quality of Life Outcomes. [serie en Internet]. 2007 [citado Nov 2009]; (5): [aprox. 5p.]. Disponible en: http://viaclinica.com/article.php?pmc_id=1877797
14. Espantoso R, Fernández C, Padierna C, et al. Calidad de vida en pacientes oncológicos un año después de finalizado el tratamiento. Revista de Psicooncología. [serie en Internet]. 2007[citado Nov 2009]; 4(1): [aprox. 5p.]. Disponible en: http://www.psiquiatria.com/articulos/psicologia/psicologia_oncologica/33974/
15. Torres A, Sanhueza O. Modelo estructural de enfermería de calidad de vida e incertidumbre frente a la enfermedad. Cienc. Enferm. [serie en Internet]. 2006 [citado Nov 2009]; 12(1): [aprox. 4p.]. Disponible en: http://www.scielo.cl/scielo.php?pid=S0717-95532006000100002&script=sci_arttext
16. Muriel C, Cervera JM, Constela M, Sánchez I, Neira M. Evaluación del tratamiento del dolor crónico en pacientes oncológicos con buprenorfina transdérmica. Rev. Soc. Esp. Dolor. [serie en Internet]. 2008 [citado Nov 2009]; 15(5): [aprox. 4p.]. Disponible en: http://revista.sedolor.es/articulo.php?ID=563
17. Sánchez R, Ballesteros M, Gómez A. Medición de la calidad de vida en ensayos clínicos de pacientes con cáncer. Un estudio bibliométrico. Rev Colom Cancerol. [serie en Internet]. 2009 [citado Dic 2009]; 13(1): [aprox. 5p.]. Disponible en: http://www.cancer.gov.co/documentos/RevistaCC2009%20Vol%2013(1)/rcc2009v13n1a05.pdf
18. Terra [sitio Web en Internet]. USA. La calidad de vida predice la supervivencia del cáncer de pulmón, Inc.; 2010 [actualizado Ene 2010; citado Feb 2009]. http://www.terra.com/salud/articulo/html/sal16901.htm
19. Montazeri A. Quality of life data as prognostic indicators of survival in cancer patients: an overview of the literature from 1982 to 2008. Health and Quality of Life Outcomes. 2009, 7:102. http://cwww.hqlo.com/content/7/1/102 doi: 10.1186/1477-7525-7-102
20. Montazeri A. Is quality of life data predictive of survival in cancer patients? A rapid and systematic review of the literature. Iranian Journal of Cancer Prevention 2009, Vol 2, No 1: 1-14.
21. White N, Reid F, Harris A, Harries P, Stone P. A systematic review of predictions of survival in palliative care: How accurate are clinicians and who are the experts? PLoS ONE 2016,11(8): e0161407. doi: 10.1371/jornal.pone.0161407
Recibido: 11 junio 2020
Aceptado: 18 julio 2020
Carmen Viada1*, Carlos Bouza2, Javier Ballesteros3, Martha Fors4, Mabel Alvarez1, Aliuska Frias1, Lazara Garcia1, Yanela Santiesteban1, Yuliannis Santiesteban1, Mayra Ramos1.
1 Centro de Inmunología Molecular, Habana, Cuba. Autor de correspondencia: [email protected]
2 Facultad de Matemática y Computación, Universidad de la Habana, Cuba.
3 Universidad del País Vasco, País Vasco, España.
4 Universidad de las Américas, Quito, Ecuador.
Carmen Viada González*1, http://orcid.org/0000-0002-1604-3545
Carlos N. Bouza 2, https://orcid.org/0000-0003-2456-2430 Javier Ballesteros Rodríguez3, https://orcid.org/0000-0002-6713-1916.
Martha Fors López4, https://orcid.org/0000-0002-0844-199X
Mabel Álvarez Cardona1, http://orcid.org/0000-0003-4136-9499
Aliuska Frías Blanco1, https://orcid.org/0000-0002-4135-0598Lazara Garcia Fernadez1, https://orcid.org/0000-0003-4289-4041
Yanela Santiesteban Gonzalez1, https://orcid.org/0000-0003-2580-4235
Yuliannis Santiesteban Gonzalez1, http://orcid.org/0000-0002-1190-2021Mayra Ramos Suzarte1, http://orcid.org/0000-0002-9058-3224