2016.01.03.6
Files > Volume 1 > Vol 1 No 3 2016 > Investigaciones
INVESTIGACIÓN
Terapia celular en la necrosis aséptica de la cabeza del fémur en pacientes con drepanocitosis
Cell therapy in aseptic necrosis of the femoral head in patients with sickle cell disease
Available from: http://dx.doi.org/10.21931/RB/2016.01.03.6
Aymara Maria Baganet-Cobas1, José Armando Galván-Cabrera1, Mariela Forrellat-Barrios1, Norma D. Fernández-Delgado1, Ana Iris González-Iglesias1, Consuelo Macías-Abraham1 , Rosa María Lam-Díaz1, Tania González-Suárez1, Inés Maria Tartabull-Matienzo2 , Porfirio Hernández-Ramírez1
RESUMEN
Introducción: La necrosis aséptica de la cabeza femoral (NACF) es una causa importante de morbilidad en pacientes jóvenes con drepanocitosis. En su tratamiento ningún método es completamente satisfactorio. Investigaciones recientes sugieren que la terapia celular puede contribuir a la reparación de tejidos como el óseo resultando útiles en el proceso de osteogénesis y angiogénesis.
Objetivo: evaluar la utilidad del implante de concentrado de células mononucleares autólogas de médula ósea (CMN-MO) en el tratamiento de la NACF en pacientes con drepanocitosis.
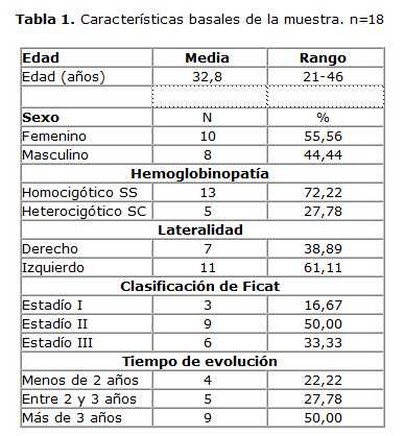
Método: se incluyeron 18 pacientes, con una edad promedio de 32,8 años (rango entre 21 y 46 años), con un seguimiento mínimo de dos años. A todos se les realizó descompresión de la cabeza femoral por perforación e implante de CMN-MO. A estas células se les cuantificó por citometría de flujo expresión de moléculas CD34, CD45, CD117, HLADR, CD29 y CD14.
Resultados: el promedio de viabilidad del concentrado implantado fue del 97%. Fenotípicamente las CMN-MO mostraron un patrón de expresión asociado a poblaciones de células madre adherentes del estroma medular CD34-/CD45-/DR-/CD29+/CD14-/CD117-. Los mejores resultados clínicos y radiográficos se observaron en pacientes en estadios iniciales (I o II) de la enfermedad. En 12 caderas (72,9 %) tratadas, los pacientes no refirieron ningún dolor a los dos años posteriores al tratamiento. Se obtuvieron buenos resultados radiológicos en siete pacientes (41,2 %). Tres pacientes (17,6 %) requirieron el remplazo total de cadera.
Conclusiones:el implante de CMN-MO para los primeros estadios de la NACF, es un tratamiento útil en los pacientes con drepanocitosis. El método empleado es relativamente simple y poco costoso.
Palabras clave : necrosis aséptica de cadera, perforaciones de la cabeza femoral, células madre adultas, células mononucleares, medula ósea, medicina regenerativa, anemia drepanocítica, Cuba.
ABSTRACT
Introduction: Aseptic necrosis of the femoral head (NACF) is an important cause of morbidity in young patients with sickle cell disease. In any treatment method it is completely satisfactory. Recent research suggests that cell therapy can help repair tissue such as bone proving useful in the process of osteogenesis and angiogenesis.
Objective: To evaluate the usefulness of implant concentrated autologous mononuclear bone marrow cells (BM-MNCs) in the treatment of patients with sickle cell disease NACF.
Method: 18 patients were included, with an average age of 32.8 years (range 21 to 46 years) with a minimum follow-up of two years. All underwent decompression of the femoral head by drilling and implant CMN-MO. These cells were quantified by flow cytometry expression of CD34 molecules, CD45, CD117, HLA-DR, CD29 and CD14.
Results: The average viability of the implanted concentrate was 97%. Phenotypically BM-MNCs showed an expression pattern associated with populations of adherent stem cells marrow stromal CD34 / CD45 / DR / CD29 + / CD14- / CD117-. The best clinical and radiographic results were observed in patients in early stages of the disease (I or II). In 12 hips (72.9%) treated patients did not report any pain at two years after treatment. Radiologic good results were obtained in seven patients (41.2%). Three patients (17.6%) required total hip replacement.
Conclusions: The implantation of BM-MNCs for the early stages of the NACF, is a useful treatment in patients with sickle cell disease. The method is relatively simple and inexpensive.
Keywords: aseptic necrosis of the hip, femoral head perforations, adult stem cells, mononuclear cells, bone marrow, regenerative medicine, sickle cell anemia, Cuba.
INTRODUCCIÓN
La necrosis aséptica de la cabeza femoral (NACF) también conocida como osteonecrosis, necrosis avascular, necrosis ósea isquémica es una de las causas más importantes de morbilidad en los pacientes con drepanocitosis. Frecuentemente afecta a pacientes en la tercera o cuarta décadas de la vida. Internacionalmente su prevalencia se estima entre el 4 y el 20 % y en estudios realizados recientemente en nuestro centro es de 11 %.(1-4) Tiene una alta incidencia bilateral y en su fase final puede llevar a la destrucción temprana de la articulación, con necesidad de remplazo total de cadera.(5-7) A pesar de los adelantos de las ciencias médicas, la comprensión de la patogenia y etiología de la NACF continúa siendo un diagnóstico desafiante y un dilema terapéutico.
Varios estudios han analizado la historia natural de la NACF y la asociación con los esteroides y abuso del alcohol,(8-10) pero son pocos los artículos que estudian la historia natural de la NACF en los pacientes adultos con drepanocitosis. Se conoce que la progresión de la NACF en pacientes con drepanocitosis es más frecuente y más rápida que cuando se asocia a otras causas de osteonecrosis.(1,4,11,12) El diagnostico precoz es fundamental dado que la historia natural de esta complicación es hacia la progresión. En general, la mayoría de los estudios han demostrado que el tratamiento conservador no impide el colapso de la cabeza femoral en más del 85 % de los casos.(13-15) De no ser tratada, la destrucción de la cabeza femoral se observa en el 87% de los pacientes con drepanocitosis en los primeros cinco años de diagnosticada la complicación. Generalmente el inicio de esta dolencia se produce en pacientes jóvenes por lo que se recomiendan tratamientos encaminados a la preservación de la articulación desde los estadios iniciales de la NACF dado los pobres resultados a largo plazo de la artroplastia total de cadera.(16-18)
Durante las últimas tres décadas, uno de los tratamientos quirúrgicos más extendidos en las fases tempranas de la NACF y encaminado a la preservación de la articulación, son las perforaciones de la cabeza del fémur.(2,13,19)
En 1964, Arlet y Ficat,(20) propusieron que las perforaciones centrales de la cabeza femoral permiten descomprimir la cámara rígida intraósea, a la vez que favorece el retorno venoso y así se promueve la revascularización de la cabeza femoral. Ficat en 1985, Smith en 1995 y Aigner en 2002, informaron buenos resultados con el uso de este procedimiento.(21-23) Además se conoce que en los pacientes con NACF el número de células mesenquimales y los compartimientos del estroma de la médula ósea (MO) están deprimidos, y la capacidad osteoblástica de las células está disminuida.(24,25) Este hallazgo sugirió la posibilidad de que las células mononucleares de la médula ósea (CMN-MO) pudieran implantarse en una lesión necrótica de la cabeza femoral, ya que contiene células del estroma que tienen muchas de las características de las células madre.(26-28)
En los últimos años el desarrollo y aplicación de novedosos métodos terapéuticos en particular la terapia celular o regenerativa, con el empleo de las células madre autólogas adultas ha permitido ampliar el espectro de tratamiento y lograr la mejoría para muchos padecimientos con escasas posibilidades terapéuticas. Estas células son capaces de diferenciarse hacia líneas celulares de diferentes tejidos; siendo utilizadas tanto en pacientes con isquemia de miembros inferiores como en pacientes con cardiopatía isquémica;(29-32) lo que ha impulsado a una nueva especialidad, la medicina regenerativa, cuyo desarrollo está unido estrechamente con los nuevos conocimientos relacionados con las propiedades de las células madre embrionarias y adultas, así como al potencial regenerativo y terapéutico proporcionado por las células madre. Esta capacidad, a menudo reconocida con el término de plasticidad, ha despertado el interés, de la comunidad científica internacional.(33-36)
Tomando en cuenta la ausencia casi total de reacciones adversas como consecuencia de este tratamiento en pacientes con isquemia crítica de miembros inferiores, que incluye los estudios realizados en nuestro país,(37, 38) se consideró que este proceder podría aplicarse para beneficiar a pacientes con drepanocitosis, que tienen ya una afectación ósea lo suficientemente importante como para que se manifieste clínicamente con dolor a la marcha y limitación de algunos movimientos de la cadera y que además no sean tributarios de recibir una cirugía. Se conoce que si estos pacientes no reciben algún tipo de tratamiento avanzarán inexorablemente hacia el empeoramiento de la complicación y una proporción no despreciable de ellos a la larga engrosarán la lista de los pacientes que requerirán remplazo protésico total.
A partir de estos antecedentes se realizó un estudio para evaluar el uso del implante de CMN-MO autólogas en pacientes con drepanocitosis y NACF y evaluar el tiempo en que se alcanza la mejoría clínica en aras de ofrecer a estos pacientes una opción terapéutica más y contribuir a elevar su calidad de vida.
MÉTODOS
Desde febrero del 2007 a marzo de 2012 se realizó un estudio piloto, cuasiexperimental, aleatorio con seguimiento médico mínimo de dos años posteriores al implante. Se incluyeron 18 pacientes con drepanocitosis atendidos en la consulta de ortopedia del Instituto de Hematología e Inmunología. Todos tenían diagnóstico de NACF según la clasificación de Ficat,(20) que es un sistema de clasificación de cuatro estadios en base a los cambios radiográficos de la cadera (estadio I, normal; estadio II, presenta lesiones escleróticas o quísticas; estadio III, presenta colapso subcondral y estadio IV, disminución del espacio articular con lesiones degenerativas). En todos los casos habían sido tratados previamente sin éxito por los métodos habituales y no eran tributarios de recibir una cirugía. El diagnóstico de la NACF se confirmó por exámenes radiográficos simples y gammagrafía con tecnecio 99 (99Tm). Se les implantaron CMN-MO por vía intraósea. Se excluyeron los casos con diabetes mellitus mal controlada, insuficiencia cardiaca crónica o hepática descompensada. Ninguno tenía una enfermedad infecciosa concurrente que pudiese entorpecer el tratamiento. En la tabla 1 se resumen las características generales de los pacientes.
Obtención de las células mononucleares de la médula ósea
La obtención de la médula ósea del propio paciente para la extracción de las CMN-MO se hizo en el salón de operaciones, previa anestesia general endovenosa. Se realizó mediante la aspiración de médula ósea de la cresta iliaca posterior; y se colectó en bolsas plásticas que contenían CPD-adenina, como anticoagulante. Las células se aislaron mediante un gradiente de densidad con Ficoll - Hypaque, según el proceder estandarizado que se emplea en el Instituto de Hematología e Inmunología.(39) Finalmente las células fueron resuspendidas en solución salina para su inyección.
Recuento e identificación de células mononucleares de la médula ósea
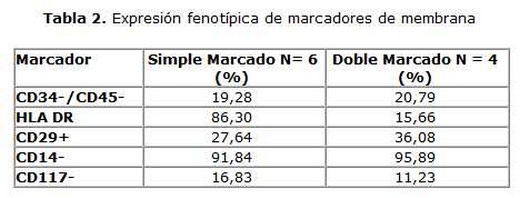
Al concentrado se le realizó el recuento de CMN-MO mediante conteo en un contador automático de células MINDRAY BC-3200 (Bio-Medical Electronics Co. Ltd, Shenzhen, China). El recuento diferencial se realizó además en extensiones del CMN-MO en láminas de cristal teñidas con May - Grunwald - Giemsa. Para la determinación de la viabilidad se empleó el método del Tripán azul. En una submuestra (n=10) se realizó la caracterización inmunofenotípica del concentrado CMN-MO. Para ello se cuantificó la expresión de las moléculas CD34, CD45, CD117, HLADR, CD29 y CD14, mediante inmunofluorescencia directa por citometría de flujo utilizando simple y doble marcaje en un citómetro FaCScan (BentonDickinson, EE UU).
Implantación de las células mononucleares de la médula ósea en la cadera afectada
El implante se llevó a cabo en el salón de operaciones, bajo anestesia general endovenosa en mesa ortopédica y controlada con un intensificador de imágenes. Se realizó una incisión lateral de unos 5 cm de longitud, distal al trocante mayor; se localizó el hueso y a unos 2 cm por debajo de la fosa trocantérica del trocante mayor se inició la perforación con un trépano de 4.5 mm de diámetro, que se pasó a través del cuello y la cabeza femoral hasta la zona necrótica hasta 2-3 mm de la superficie articular. Se implantaron las células a través del orificio en la zona necrótica mediante un trocar de biopsia ósea. Posteriormente se suturó por planos.
Seguimiento evolutivo
En el post-operatorio fueron egresados entre las 48 horas y siete días. Se restringió el apoyo del miembro operado por ocho semanas. Todos los pacientes fueron seguidos por un mínimo de dos años en consulta externa, siendo evaluados por la escala de la Clínica de los Hermanos Mayo.(40) Esta escala de medición de los resultados tiene un máximo de 80 puntos y está basada en especial en el síntoma dolor, ya que es la principal causa que lleva al paciente al acto operatorio. La asignación de puntos se describe a continuación:
Evaluación de la intensidad del dolor (10 a 40 puntos): 10 intenso, 20 moderado, 30 ocasional y 40 ausencia de dolor.
Evaluación a la función ( 0 a 20 puntos): Incluye distancia de marcha; 15 puntos (0 no camina, 2 en la casa, 7 hasta 300 metros, 12 hasta 600 metros y 15 hasta 1000 metros) y uso de bastones; 5 puntos (3 permanente, 4 ocasional y 5 ninguno).
Evaluación de la movilidad y poder muscular (0 a 20 puntos): de 3 a 5 para capacidad de introducirse en un automóvil (3 con dificultad y 5 fácilmente); de 3 a 5 para cuidado de sus pies (3 con dificultad y 5 fácilmente); de 0 a 5 claudicación (0 severa, 3 moderada y 5 no presenta); de 0 a 5 para subir escaleras (0 no puede, 2 escalón a escalón, 4 sosteniéndose y 5 normal).
La respuesta se midió por la suma de los valores dados a estos parámetros clínicos y se consideró: malo por debajo de 49 puntos; regular entre 50 y 59; bueno entre 60 y 69 y excelente entre 70 y 80 puntos.
La valoración radiográfica fue realizada por los expertos comparando las imágenes, antes y después del implante, donde solo se evaluaba la evolución del área necrótica. La misma podía desaparecer, disminuir, mantenerse o aumentar el área.
Análisis estadístico
El tratamiento de los datos se realizó mediante el programa estadístico SPSS versión 15.0 para Windows, previa confección de una base de datos donde se introdujo la información obtenida. Como medida de resumen para los datos cuantitativos se utilizaron la media y la desviación estándar y para los cualitativos las frecuencias absolutas y los porcentajes.
Se realizó la comparación del promedio de los valores de las variables cuantitativas antes del tratamiento y a los 6, 12 y 24 meses, mediante la prueba de Friedman, considerando un nivel de significación de p ≤0,05. En caso de que las comparaciones múltiples resultaran estadísticamente significativas, para analizar cuáles grupos diferían entre sí, se utilizó la prueba de Wilcoxon para dos muestras relacionadas, acompañada de la corrección de Bonferroni para controlar la probabilidad de cometer errores de tipo I. La aplicación de esta corrección al hacer comparaciones por pares llevó a basar las decisiones en un nivel de significación de 0,05/6=0,008. Es decir, se consideró que los promedios de dos variables diferían significativamente cuando el nivel crítico obtenido fuera menor que 0,008.
Aspectos éticos
Esta investigación se realizó de acuerdo a los principios establecidos en la Declaración de Helsinski (41) para la investigación con seres humanos y se obtuvo el consentimiento informado por escrito de cada paciente o su representante legal, así como la aprobación de los consejos científicos y de ética de la investigación del Instituto de Hematología e Inmunología.
RESULTADOS
No se presentaron efectos adversos con la extracción de la MO, aunque un paciente presentó un síndrome torácico agudo en las primeras 48 horas de implantado, que evolucionó favorablemente con el tratamiento aplicado. No hubo infección en el sitio de extracción, ni en la herida quirúrgica.
El promedio del volumen total de extracción fue de 94,6 mL. El promedio del volumen final del concentrado fue de 9,2 mL con un rango entre 6 y 12 mL. En ese volumen el conteo de células mononucleares tuvo una media de 546,6 x 109 con un rango de (60 a 1 208 x 109). La viabilidad celular osciló entre 89 a 99 %, con un promedio de 97 %.
En la caracterización fenotípica del concentrado se observó una mayor expresión de las moléculas específicas de membrana que corresponden con el patrón de expresión de las poblaciones de células madre adherentes del estroma medular CD34-/CD45-/DR-/CD29+/CD14-/CD117- comparadas con el fenotipo de moléculas de membrana descrito para la célula madre hematopoyética CD34+/CD45-/CD117+/DR+ (tabla 2). Esto demuestra la presencia de células mesenquimales, hematopoyéticas y endoteliales en el concentrado implantado.
La escala de la Clínica de los hermanos Mayo se aplicó a los 18 pacientes. Una paciente falleció por un tromboembolismo pulmonar a los siete meses de tratada, cuando se encontraba en rehabilitación, este evento no estuvo asociado al implante de CMN-MO. Se observó mejoría en todos los parámetros evaluados por esta escala. En la tabla 3 se reflejan la media y la desviación estándar de las diferentes variables en cada una de las etapas evaluadas. La disminución de la intensidad del dolor fue evidente desde la primera semana del tratamiento en el 100% de los pacientes. En general, las comparaciones de todas las variables de tratamiento fueron significativas (p=0.000). En las pruebas a posteriori todas las comparaciones fueron significativas, excepto la de 12 meses vs 24 meses (tabla 3).
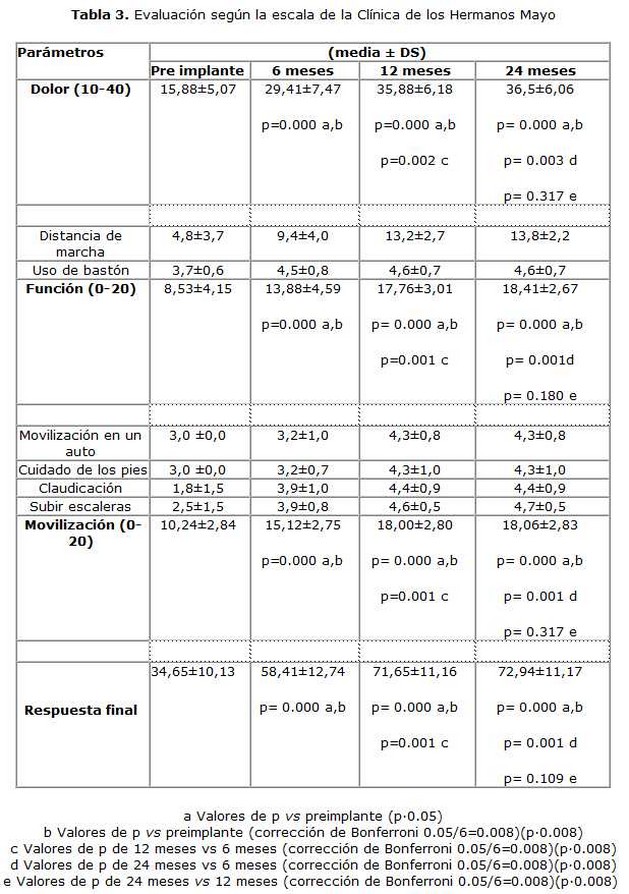
En cuanto a la evaluación de la respuesta final, la media de los resultados fue de 72,9 puntos y se informaron 12 pacientes por encima de dicha cifra.
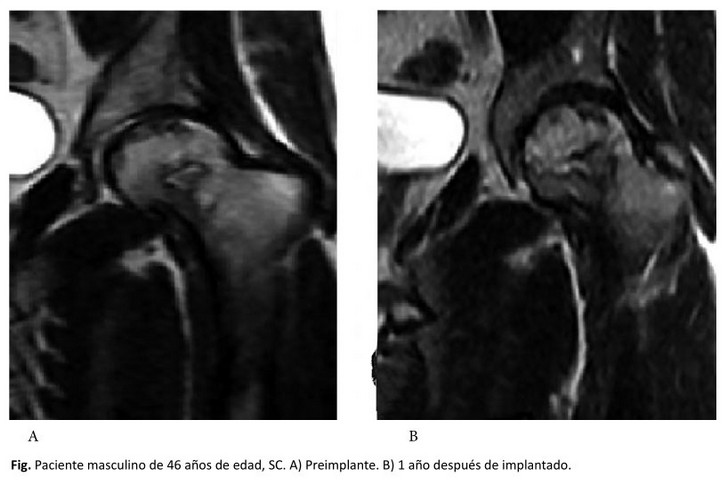
En la evaluación radiográfica se evidenció resolución completa del área necrótica en siete caderas (41,2 %) y disminución en tres caderas (17,6 %). Mientras que en cuatro caderas (23,5 %) no hubo variación radiológica y en otras tres caderas (17,6 %) se evidenció un aumento del área necrótica. En la figura se muestra uno de los pacientes con evolución satisfactoria. El remplazo total de cadera fue necesario en tres pacientes (17,6 %), de ellas uno en estadio II y dos en estadio III, según la clasificación empleada.
Los mejores resultados clínicos y radiográficos se observaron e aquellos pacientes que se encontraron en los estadios iniciales (I o II) de la enfermedad.
DISCUSIÓN
Con el implante de CMN-MO se observó mejoría significativa (p=0.000) de los signos y síntomas causados por la NACF que se mantuvo por un periodo mayor a dos años. Es de destacar que se alcanza una mejoría clínica a partir de los 6 meses de implantado siendo máxima a los 12 meses y que se mantiene a los 24 meses en la mayoría de los pacientes según se muestra en la tabla 3.
Algunos estudios han indicado que en la evolución de la NACF y específicamente la destrucción de la cabeza femoral puede influir el tamaño de la lesión, localización, estadio y causa de la NACF.(1, 5, 11) En este estudio el 82 % tuvo una evolución favorable independientemente de las variables antes expuestas, por lo que podemos sugerir que esta terapia es efectiva en pacientes con drepanocitosis. Varios autores plantean que la descompresión es un tratamiento aceptable para la lesión grado I de Ficat pero que deben ser utilizados método alternativos de tratamiento para los estadios II y III porque para estos los resultados no son favorables.( 42, 43) Nuestros resultados sugieren que el implante de CMN-MO más que una alternativa es un complemento viable para el tratamiento de la NACF en pacientes con drepanocitosis porque incluso en el 50% de los pacientes con lesión grado III se logró posponer el reemplazo protésico por más de dos años, por lo que este invasivo proceder sólo estaría indicado en grados avanzados de necrosis. No obstante, mientras más incipiente sea el grado de lesión mejor serán los resultados.
Se conoce que existe una disminución del número de células mesenquimales en el tercio proximal del fémur en los pacientes con NACF.(24,25) Esta insuficiencia de células osteogénicas podría explicar un inadecuado mecanismo de reparación ósea, que conduce al colapso de la cabeza femoral. Cuando se realiza el implante de este concentrado celular obtenido de la medula ósea aumenta el número de células y se favorece o potencia este mecanismo. Se ha comprobado que las células madre hematopoyéticas pueden producir varios elementos solubles que son esenciales para su acción y que incluyen factores que intervienen en la citoprotección, proliferación, diferenciación y migración celular, angiogénesis, respuesta inflamatoria, asentamiento celular, entre otras.(44) Estudios recientes evidencian la existencia de diferentes poblaciones de células madre no hematopoyéticas en la medula ósea y que incluyen: células madre mesenquimales (CMM); células progenitoras multipotentes adultas (MAPCs, del inglés progenitor multipotent stem cells); células inducibles de multilinaje adultas aisladas de médula ósea (MIAMI, del inglés marrow isolated adult multilineage inducible); células madre multipotentes adultas (MASCs, del inglés, multipotent adult stem cells); células progenitoras endoteliales (CPE); omnicitos y células madre pequeñas parecidas a células embrionarias, conocidas como VSELs (del inglés, very small embryonic like) que han sido identificadas y caracterizadas como una población de células adherentes derivadas de la médula ósea capaces de diferenciarse a múltiples líneas mesodérmicas.(45,46) Ellas tienen la capacidad de diferenciarse hacia osteoblastos, condrocitos, adipocitos o incluso músculo esquelético según las condiciones en las que se cultivan lo que contribuyen a la osteogénesis y angiogénesis, a esto se debe la efectividad de las CMN-MO,(47) favoreciendo el proceso de remodelación ósea; principalmente en las etapas más tempranas de la NACF. Aunque la muestra es pequeña podemos avalar el efecto terapéutico del implante de CMN-MO en la NACF en pacientes con drepanocitosis. El mismo tiene una repercusión notable sobre la calidad de vida del enfermo ya que permite su incorporación a la actividad diaria y evita su invalidez. Este proceder tiene como ventajas que es sencillo, fácil y económico para centros con recursos limitados, lo que facilita su extensión sobre todo en regiones con una alta incidencia de pacientes con drepanocitosis. Estos resultados concuerdan con estudios anteriores.(7,26, 48) Aunque hay relativamente pocas investigaciones clínicas en este campo; algunas de ellas pequeños ensayos no controlados, han evidenciado los efectos beneficiosos de la implantación de CMN-MO en la NACF.
Conclusiones
El implante de CMN-MO para los primeros estadios de la NACF, es un tratamiento útil en los pacientes con drepanocitosis. Se observó mejoría clínica a partir de los seis meses de implantado que se mantenía a los dos años. La mejoría radiológica se observó a partir del primer año de implantado. No se observaron complicaciones por el tratamiento.
El método empleado es relativamente simple, poco costoso lo que permite su extensión a otras instituciones de salud incluyendo las que tengan recursos limitados.
Agradecimientos
A la Dra. Elvira Dorticós Balea. Especialista de 2 grado en Hematología. Investigador y Profesor Auxiliar. Dr. Alberto Benítez-Herrera. Especialista de 2 grado en Ortopedia y Traumatología. Investigador y Profesor Auxiliar. Lic. Lázara Minerva Tam-Rey. Lic. Laboratorio Clínico.
REFERENCIAS BIBLIOGRAFICAS
1. Poignard A, Flouzat-Lachaniette CH, Amzallag J, Galacteros F, Hernigou P. The natural progression of symptomatic humeral head osteonecrosis in adults with sickle cell disease. J Bone Joint Surg Am. 2012 Jan 18;94(2):156-62. PubMed DOI: 10.2106/jbjs.j.00919.
2. Styles LA, Vichinsky EP. Core decompression in avascular necrosis of the hip in sickle-cell disease. American journal of hematology. 1996 Jun;52(2):103-7. PubMed DOI: 10.1002/(sici)1096-8652(199606)52:2<103::aid-ajh6>3.0.co;2-y.
3. Hernigou P. Avascular necrosis of head of femur. Indian J Orthop. 2009 Jan;43(1):1-2. PubMed DOI: 10.4103/0019-5413.45316 [doi].
4. Sorich MM, Cherian JJ, McElroy MJ, Banerjee S, Jones LC, Minniti CP, et al. Osteonecrosis of the Hip in Hematologic Disease: A Review of Conditions and Treatment Options. Journal of long-term effects of medical implants. 2015;25(4):253-68. PubMed.
5. Martí-Carvajal AJ, Solà I, Agreda-Pérez LH. Treatment for avascular necrosis of bone in people with sickle cell disease. Cochrane Database of Systematic Reviews. 2014;10.1002/14651858.CD004344.pub5(7). PubMed DOI: 10.1002/14651858.CD004344.pub5.
6. Mukisi-Mukaza M, Manicom O, Alexis C, Bashoun K, Donkerwolcke M, Burny F. Treatment of sickle cell disease's hip necrosis by core decompression: a prospective case-control study. Orthop Traumatol Surg Res. 2009 Nov;95(7):498-504. PubMed DOI: 10.1016/j.otsr.2009.07.009.
7. Kamath AF, McGraw MH, Israelite CL. Surgical management of osteonecrosis of the femoral head in patients with sickle cell disease. World journal of orthopedics. 2015 Nov 18;6(10):776-82. PubMed DOI: 10.5312/wjo.v6.i10.776.
8. Banerjee S, Issa K, Pivec R, Kapadia BH, Khanuja HS, Mont MA. Osteonecrosis of the hip: treatment options and outcomes. Orthop Clin North Am. 2013 Oct;44(4):463-76. PubMed DOI: 10.1016/j.ocl.2013.07.004.
9. Pivec R, Johnson AJ, Harwin SF, Mont MA. Differentiation, diagnosis, and treatment of osteoarthritis, osteonecrosis, and rapidly progressive osteoarthritis. Orthopedics. 2013 Feb;36(2):118-25. PubMed DOI: 10.3928/01477447-20130122-04.
10. Hernigou P, Flouzat-Lachaniette CH, Roussignol X, Poignard A. The natural progression of shoulder osteonecrosis related to corticosteroid treatment. Clin Orthop Relat Res. 2010 Jul;468(7):1809-16. PubMed DOI: 10.1007/s11999-009-1094-1.
11. Hernigou P, Habibi A, Bachir D, Galacteros F. The natural history of asymptomatic osteonecrosis of the femoral head in adults with sickle cell disease. J Bone Joint Surg Am. 2006 Dec;88(12):2565-72. PubMed DOI: 10.2106/jbjs.e.01455.
12. Flouzat-Lachaniete CH, Roussignol X, Poignard A, Mukasa MM, Manicom O, Hernigou P. Multifocal joint osteonecrosis in sickle cell disease. Open Orthop J. 2009;3:32-5. PubMed DOI: 10.2174/1874325000903010032 [doi].
13. Mukisi Mukaza M, Manicom O, Alexis C, Bashoun K, Donkerwolcke M, Burny F. Sickle cell disease's hip necrosis: The core decompression treatment option. 2009 Nov;95(7):601-8. PubMed DOI: 10.1016/j.rcot.2009.09.005.
14. Shah SN, Kapoor CS, Jhaveri MR, Golwala PP, Patel S. Analysis of outcome of avascular necrosis of femoral head treated by core decompression and bone grafting. Journal of clinical orthopaedics and trauma. 2015 Sep;6(3):160-6. PubMed DOI: 10.1016/j.jcot.2015.03.008.
15. Liu D, Chen Q, Chen Y, Liu Y. Long-term follow-up of early-middle stage avascular necrosis of femoral head with core decompression and bone grafting. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi. 2012 Oct;26(10):1165-8. PubMed.
16. Hernigou P, Caton J. Design, operative technique and ten-year results of the Hermes patellofemoral arthroplasty. Int Orthop. 2014 Feb;38(2):437-42. PubMed DOI: 10.1007/s00264-013-2158-0.
17. Shao Y, Zhang C, Charron KD, Macdonald SJ, McCalden RW, Bourne RB. The Fate of the Remaining Knee(s) or Hip(s) in Osteoarthritic Patients Undergoing a Primary TKA or THA. J Arthroplasty. 2013 Dec;28(10):1842-5. PubMed DOI: S0883-5403(13)00067-3 [pii]10.1016/j.arth.2012.10.008.
18. Hernigou P, Roussignol X, Delambre J, Poignard A, Flouzat-Lachaniette CH. Ceramic-on-ceramic THA associated with fewer dislocations and less muscle degeneration by preserving muscle progenitors. Clin Orthop Relat Res. 2015 Dec;473(12):3762-9. PubMed DOI: 10.1007/s11999-015-4378-7.
19. Bellot F, Havet E, Gabrion A, Meunier W, Mertl P, de Lestang M. Core decompression of the femoral head for avascular necrosis. Revue de chirurgie orthopedique et reparatrice de l'appareil moteur. 2005 Apr;91(2):114-23. PubMed.
20. Arlet J, Ficat P. Forage-biopsie de la tête fémorale dans l'ostéonécrose primitive. Observations histo-pathologiques portant sur huit forages. . Rev Rhumat. 1964;31:257-64. PubMed.
21. Ficat RP. Idiopathic bone necrosis of the femoral head. Early diagnosis and treatment. J Bone Joint Surg Br. 1985 Jan;67(1):3-9. PubMed.
22. Smith SW, Fehring TK, Griffin WL, Beaver WB. Core decompression of the osteonecrotic femoral head. J Bone Joint Surg Am. 1995 May;77(5):674-80. PubMed.
23. Aigner N, Schneider W, Eberl V, Knahr K. Core decompression in early stages of femoral head osteonecrosis--an MRI-controlled study. Int Orthop. 2002;26(1):31-5. PubMed.
24. Feng Y, Yang SH, Xiao BJ, Xu WH, Ye SN, Xia T, et al. Decreased in the number and function of circulation endothelial progenitor cells in patients with avascular necrosis of the femoral head. Bone. 2009 Jan;46(1):32-40. PubMed DOI: S8756-3282(09)01890-0 [pii]
25. Hernigou P, Beaujean F, Lambotte JC. Decrease in the mesenchymal stem-cell pool in the proximal femur in corticosteroid-induced osteonecrosis. J Bone Joint Surg Br. 1999 Mar;81(2):349-55. PubMed.
26. Rackwitz L, Eden L, Reppenhagen S, Reichert JC, Jakob F, Walles H, et al. Stem cell- and growth factor-based regenerative therapies for avascular necrosis of the femoral head. Stem Cell Res Ther. 2012;3(1):7. PubMed DOI: scrt98 [pii]10.1186/scrt98.
27. Hernigou P. Bone transplantation and tissue engineering, part III: allografts, bone grafting and bone banking in the twentieth century. Int Orthop. 2015 Mar;39(3):577-87. PubMed DOI: 10.1007/s00264-015-2669-y.
28. Ziadlou R, Shahhoseini M, Safari F, Sayahpour FA, Nemati S, Eslaminejad MB. Comparative analysis of neural differentiation potential in human mesenchymal stem cells derived from chorion and adult bone marrow. Cell Tissue Res. 2015 Nov;362(2):367-77. PubMed DOI: 10.1007/s00441-015-2210-z.
29. Bura A, Planat-Benard V, Bourin P, Silvestre J, Gross F. Phase I trial: the use of autologous cultured adipose-derived stroma/stem cells to treat patients with non-revascularizable critical limb ischemia. Cytotherapy. 2014;16:245 - 57. PubMed.
30. Nakashima T, Liu T, Yu H, Ding L, Ullenbruch M, Hu B, et al. Lung bone marrow-derived hematopoietic progenitor cells enhance pulmonary fibrosis. American journal of respiratory and critical care medicine. 2013 Oct 15;188(8):976-84. PubMed DOI: 10.1164/rccm.201303-0479OC.
31. Andrade BM, Baldanza MR, Ribeiro KC, Porto A, Pecanha R, Fortes FS, et al. Bone marrow mesenchymal cells improve muscle function in a skeletal muscle re-injury model. PLoS One. 2015;10(6):e0127561. PubMed DOI: 10.1371/journal.pone.0127561.
32. Sanina C, Hare JM. Mesenchymal Stem Cells as a Biological Drug for Heart Disease: Where Are We With Cardiac Cell-Based Therapy? Circulation research. 2015 Jul 17;117(3):229-33. PubMed DOI: 10.1161/circresaha.117.306306.
33. Hernández Ramírez P, Dorticós Balea E. Medicina regenerativa: Células madre embrionarias y adultas. Rev Cubana Hematol Inmunol Hemoter. 2004;20:0-. PubMed.
34. Rasini V, Dominici M, Kluba T, Siegel G, Lusenti G, Northoff H, et al. Mesenchymal stromal/stem cells markers in the human bone marrow. Cytotherapy. 2013 Mar;15(3):292-306. PubMed DOI: 10.1016/j.jcyt.2012.11.009.
35. Neckar P, Sykova E. Stem cells in orthopaedics. Casopis lekaru ceskych. 2015;154(3):107-9. PubMed.
36. Hernández RP, Forrellat BM. Ventajas de la terapia celular con células mononucleares derivadas de la médula ósea, aplicadas en su conjunto. Rev Cubana Hematol Inmunol Hemoter. 2013;29(4):407-12. PubMed.
37. Hernández P, Cortina L, Artaza H, Pol N, Lam RM, Dorticós E, et al. Autologous bone-marrow mononuclear cell implantation in patients with severe lower limb ischaemia: A comparison of using blood cell separator and Ficoll density gradient centrifugation. Atherosclerosis 2007;194:52-6. PubMed.
38. Mizuno H, Miyamoto M, Shimamoto M, Koike S, Hyakusoku H, Kuroyanagi Y. Therapeutic angiogenesis by autologous bone marrow cell implantation together with allogeneic cultured dermal substitute for intractable ulcers in critical limb ischaemia. J Plast Reconstr Aesthet Surg. 2010 Nov;63(11):1875-82. PubMed DOI: 10.1016/j.bjps.2009.11.037.
39. Cortina Rosales L, Hernández Ramírez P, López De Roux MR, Artaza Sanz HM, Dorticós Balea E, Macías Abraham C, et al. Aislamiento de células mononucleares de sangre periférica para trasplante de células madre: Método simplificado. Rev Cubana Hematol Inmunol Hemoter. 2008;24:0-. PubMed.
40. Kavanagh BF, Ilstrup DM, Fitzgerald RH. Revision total hip arthroplasty. J Bone Joint Surg Am. 1985;67(4):517-26. PubMed.
41. Association WM. World Medical Association Declaration of Helsinki: Ethical Principles for Medical Research Involving Human Subjects. JAMA : the journal of the American Medical Association. 2013;10.1001/jama.2013.281053. PubMed DOI: 10.1001/jama.2013.281053.
42. Aigner N, Petje G, Schneider W, Meizer R, Wlk M, Kotsaris S, et al. Bone marrow edema syndrome of the femoral head: treatment with the prostacyclin analogue iloprost vs. core decompression: an MRI-controlled study. Wien Klin Wochenschr. 2005 Feb;117(4):130-5. PubMed.
43. Flouzat-Lachaniette CH, Roubineau F, Heyberger C, Bouthors C, Hernigou P. Multifocal osteonecrosis related to corticosteroid: ten years later, risk of progression and observation of subsequent new osteonecroses. Int Orthop. 2016 Apr;40(4):669-72. PubMed DOI: 10.1007/s00264-015-3060-8.
44. Fidelis-de-Oliveira P, Werneck-de-Castro JP, Pinho-Ribeiro V, Shalom BC, Nascimento-Silva JH, Costa e Souza RH, et al. Soluble factors from multipotent mesenchymal stromal cells have antinecrotic effect on cardiomyocytes in vitro and improve cardiac function in infarcted rat hearts. Cell Transplant. 2012;21(5):1011-21. PubMed DOI: 10.3727/096368911x623916.
45. Macías-Abraham C, Valle-Pérez LO, Baganet -Cobas A, Dorticós- Balea E, Jaime-Fagundo JC, Lam -Díaz RM. Caracterización fenotípica de las células madre de médula ósea utilizadas en la terapia celular regenerativa. Rev Cubana Hematol Inmunol Hemoter 2011;27(2):233-43. PubMed.
46. Niemeyer P, Kornacker M, Mehlhorn A, Seckinger A, Vohrer J, Schmal H. Comparison of immunological properties of bone marrow stromal cells and adipose tissue-derived stem cells before and after osteogenic differentiation in vitro. Tissue Eng. 2007;13:111 - 21. PubMed.
47. Pak J, Lee J, Lee S. Regenerative repair of damaged meniscus with autologous adipose tissue-derived stem cells. Biomed Res Int. 2014;2014:436029. PubMed.
48. Xu M, Peng D. Mesenchymal stem cells cultured on tantalum used in early-stage avascular necrosis of the femoral head. Med Hypotheses. 2010 Feb;76(2):199-200. PubMed DOI: S0306-9877(10)00394-4 [pii]10.1016/j.mehy.2010.09.028
Recibido: 3 de marzo de 2016.
Aprobado: 23 de abril de 2016.
Aprobado: 23 de abril de 2016.
Aymara Maria Baganet-Cobas1, José Armando Galván-Cabrera1, Mariela Forrellat-Barrios1, Norma D. Fernández-Delgado1, Ana Iris González-Iglesias1, Consuelo Macías-Abraham1 , Rosa María Lam-Díaz1, Tania González-Suárez1, Inés Maria Tartabull-Matienzo2 , Porfirio Hernández-Ramírez1
1 Instituto de Hematología e Inmunología . La Habana, Cuba.
2 Hospital General Docente "Enrique Cabrera". La Habana, Cuba.
Correspondencia: Dra. Aymara Maria Baganet Cobas. Instituto de Hematología e Inmunología. Apartado Postal 8070, La Habana, CP 10800. Cuba. E-mail: [email protected]
