2016.01.03.3
Files > Volume 1 > Vol 1 No 3 2016 > Investigaciones
INVESTIGACIÓN
Evaluación del proteinograma plasmático del cocodrilo cubano (Crocodylus rhombifer)
Evaluation of plasmatic proteinogram of cuban crocodile (Crocodylus rhombifer)
Available from: http://dx.doi.org/10.21931/RB/2016.01.03.3
Vivian Morera, Arline Fernández, Claudia Puentes, Etiam Pérez, Gustavo Sosa, Leiter Guerra, Félix Santanay Yoamel Milian
RESUMEN
El cocodrilo cubano (Crocodylus rhombifer) es una especie endémica de Cuba y en Peligro Crítico de extinción. Con el objetivo de preservar esta especie en la Ciénaga de Zapata, Matanzas, Cuba se mantiene una población en cautiverio. El manejo de una especie en esta categoría tiene como componente esencial el conocimiento del estado de salud de los animales en las diferentes etapas de la vida. El estudio de las proteínas plasmáticas constituye una herramienta eficaz en la clínica veterinaria para determinar la presencia de enfermedades en los cocodrilos. El objetivo de este trabajo fue evaluar el proteinograma plasmático en cuanto a la concentración total de proteínas en el plasma de Crocodylus rhombifer y a las concentraciones de sus fracciones proteicas. Las muestras se tomaron de 35 ejemplares cautivos clínicamente sanos, divididos en dos categorías: juvenil (n=20) y sub-adulto (n=15). Adicionalmente, se tomaron muestras de 8 ejemplares procedentes del medio natural. La concentración total de proteínas en el plasma se determinó mediante el método colorimétrico del ácido bicinconílico. Las proteínas del plasma fueron fraccionadas empleando electroforesis en geles de agarosa y electroforesis en gel de poliacrilamida en presencia de dodecil sulfato sódico. Mediante espectrometría de masas se identificaron las principales proteínas plasmáticas. La identificación por espectrometría de masas mostró la presencia de albúmina fosforilada en el plasma de los animales. Los valores de concentración total de proteínas y de albúmina fueron mayores en los animales cautivos que en los de medio natural, siendo más altos los de la categoría sub-adulto. Contrariamente, las γ globulinas presentaron mayores valores de concentración en los animales procedentes del medio natural. No se encontraron diferencias significativas en la concentración de las fracciones proteicas entre animales en las distintas etapas del desarrollo. En la categoría juvenil la fracción β globulina mostró mayor concentración y la fracción γ la menor concentración. Lo opuesto fue encontrado para la categoría sub-adulto. Los resultados de este estudio constituyen el primer informe sobre el proteinograma plasmático de Crocodylus rhombifer en cautiverio y aportan una herramienta bioquímica para contribuir al manejo adecuado de esta especie en cautiverio.
Palabras clave: Crocodylus rhombifer , proteinograma, proteínas, plasma.
ABSTRACT
Cuban crocodile (Crocodylus rhombifer) is an endemic and critically endangered species. In order to preserve this species a population of them is maintained in captivity in the farm "Zapata Swamp", Matanzas, Cuba. To manage such species, the knowledge of the animal health status, in different stages of live, is an essential component. The plasmatic proteinogram is an effective tool in veterinary medicine to determine the presence of diseases in crocodiles. The goal of this thesis was the evaluation of the plasmatic proteinograma, taking into account the total protein concentration and the relationship between its fractions. Samples were taken from clinically healthy 35 captive animals, divided in two categories: juveniles (n=20) and sub-adults (n=15) and additionally 8 animals from the natural environment. The total protein concentration was determined using bincinconilic acid method. The plasma proteins were separated using electrophoresis on agarose gels and polyacrylamide gels. By mass spectrometry were identified the main plasmatic proteins. The identification by mass spectrometry showed the presence of phosphorylated albumin. The values of total protein concentration and albumin were higher in captive animal, being the highest those corresponding to sub-adults. Contrarily, the γ globulins fraction was higher in wild animals. For animals with different development stages no significant difference were found. In juveniles, β fraction was higher and γ fraction was lower. In sub-adults, the opposite was found. The results of this thesis are the first report concerning the characterization of plasmatic proteinogram of Crocodylus rhombifer in captivity.
Keywords : Crocodylus rhombifer, proteinogram, proteins, plasma.
INTRODUCCIÓN
El Crocodylus rhombifer1 es una especie endémica de Cuba y la más amenazada dentro de la familia Crocodylidae. Su distribución en el archipiélago cubano está limitada a 300 km2 en la Ciénaga de Zapata, Matanzas y a 100 km2 en la Ciénaga de Lanier, Isla de la Juventud. Las principales amenazas a esta especie son la caza indiscriminada, la destrucción de su hábitat natural y la hibridación con Crocodylus acutus2. Crocodylus rhombifer es un miembro clave de la herpetofauna cubana para la conservación del principal humedal cubano: la Ciénaga de Zapata. Esto se debe a que mantiene la estructura dinámica y la función del ecosistema porque realiza actividades como la depredación selectiva de especies de peces, el reciclamiento de nutrientes y el mantenimiento de refugios con agua durante las sequías 3. Esta especie está incluida en el apéndice I por la Convención Internacional para el Comercio de Flora y Fauna Silvestres (CITES) y en el Libro Rojo de la Unión Internacional para la Conservación de la Naturaleza y los Recursos Naturales (UICN) bajo la categoría de especie En Peligro Crítico de Extinción4. Una alternativa para el mantenimiento de una especie cuando las poblaciones naturales están casi agotadas es su reproducción en cautiverio, es decir animales nacidos y levantados exclusivamente en un medio controlado, donde el criador les suministra un espacio idóneo, alimento, limpieza, cuidado sanitario y protección contra la depredación.
El manejo en cautiverio de una especie en peligro de extinción requiere el conocimiento de la situación de salud de los animales. Los cocodrilos enfermos en condiciones de cautiverio muestran signos clínicos inespecíficos lo que hace difícil identificar su estado y predecir la aparición de enfermedades por simple observación. Por otra parte, al ser animales ectotermos y variar su temperatura corporal en la misma dirección que la temperatura ambiental, la medición de esta no puede ser empleada como una herramienta clínica. Sin embargo, algunos parámetros bioquímicos de la sangre como las proteínas plasmáticas constituyen una valiosa ayuda en el diagnóstico de ciertas enfermedades5,6. Esto se debe a que las proteínas plasmáticas tienen funciones importantes como el mantenimiento de la presión osmótica, el equilibrio ácido-base, el transporte de metabolitos como los lípidos y las hormonas y algunas de ellas juegan un papel importante en la defensa del organismo frente a patógenos. Es por ello que la medición de estas proteínas refleja el estado de salud de los individuos 7.
La electroforesis de proteínas es actualmente la técnica de referencia para el fraccionamiento de las proteínas del plasma. Aun cuando su especificidad diagnóstica es baja, los resultados de la electroforesis de las proteínas plasmáticas constituyen una herramienta útil en Clínica. En particular, la electroforesis nativa de las proteínas del plasma en geles de agarosa es una de las técnicas más empleadas por su buena resolución, reproducibilidad y claridad de las bandas. En este tipo de electroforesis las proteínas son separadas en función de su carga ya que el tamaño del poro es tan grande que el gel no ejerce la función de tamizaje en virtud del tamaño molecular. De esta manera, las proteínas del plasma pueden ser fraccionadas en las cinco bandas clásicas correspondientes a albúmina, seguida de varias bandas de globulinas denotadas consecutivamente como α1, α2, β y γ globulinas8.
La información relacionada con el proteinograma plasmático para la especie Crocodylus rhombifer resulta inexistente. El propósito de este estudio fue determinar los valores de concentración total de proteínas del plasma y de sus diferentes fracciones para Crocodylus rhombifer y establecer las posibles diferencias atribuibles a la etapa del desarrollo.
MÉTODOS
Animales y muestras
Se emplearon 35 ejemplares de Crocodylus rhombifer mantenidos en cautiverio en el criadero "Ciénaga de Zapata", Matanzas, Cuba y 8 ejemplares del medio natural. Los animales provenientes del medio natural fueron capturados en la región y trasladados al criadero para su estudio. Los animales mantenidos en cautiverio fueron alimentados una vez por semana con desperdicios de ganado vacuno. El estado de salud aparente se evaluó por observación del estado general, la vivacidad, el dinamismo, el apetito, la coloración de la piel y las mucosas, así como la ausencia de lesiones externas. Los cocodrilos fueron capturados manualmente con la ayuda de una cuerda sin utilizar narcóticos o tranquilizantes. La extracción de sangre se realizó por punción cardíaca y se tomó 5 mL de cada animal. Las muestras se colectaron empleando jeringas estándar de 10 mL humectadas con EDTA 0.05 mol/L y sealmacenaron en tubos Vacutainer que contenían EDTA como anticoagulante (VACUETTE® K3E K3EDTA, Greiner Bio-one GmbH, Austria). Durante el muestreo la sangre se mantuvo en un termo con hielo. El plasma se obtuvo por centrifugación a 2000 g durante 15 min a 4oC en una centrífuga Sigma (Alemania). Este se conservó a -20°C hasta el momento de los análisis.
Determinación de la concentración total de proteínas
La concentración total de proteínas en el plasma de cada animal se determinó mediante la técnica colorimétrica del ácido bicinconílico (BCA). Se empleó el protocolo en placas de 96 pozos del juego de reactivos ``Ensayo de Proteínas BCA" (Thermo Scientific, EUA). Para la realización de este ensayo se utilizó como proteína patrón la albúmina bovina de suero (BSA) y se realizaron diluciones seriadas a diferente concentración en el rango de 125-1500 μg/mL. Las determinaciones se realizaron por triplicado. Como control positivo del ensayo se empleó la proteína patrón diluida con agua 1:2 (v:v). La lectura se realizó a 540 nm en un lector de placas (Merck Sensident Scan, Finlandia).
Electroforesis en geles de agarosa
Se utilizó como soporte electroforético agarosa para proteínas plasmáticas (Biozym ME agarose, Biozym, Alemania). El gel se preparó al 2% en tampón de corrida. El tampón de corrida fue tris-ácido bórico 90 mmol/L, pH 8.5. La solución tampón de muestra consistió en glicerol al 30 % conteniendo 0.0005g de bromofenol azul. La corrida se realizó con el gel sumergido en solución de corrida en una cámara horizontal durante 75 minutos; se aplicó un voltaje de 100 Volt. La fijación se realizó durante 15 min con una solución de etanol, ácido acético y agua destilada (1:6:3, v:v:v). Los geles se tiñeron utilizando una solución de Negro amida. La solución de distinción contenía ácido acético glacial, etanol absoluto y agua destilada (1:4.5:4.5, v:v:v); el tiempo de distinción fue de aproximadamente 24 horas.
Electroforesis en geles de poliacrilamida en presencia de dodecil sulfato sódico
La electroforesis en gel de poliacrilamida en presencia de dodecil sulfato sódico se realizó en geles al 10 % y con el protocolo básico de Laemmli9. Para las corridas se utilizó una cámara Mini-Protean II (Bio-Rad, EUA) y una corriente de 30 mA generada con una fuente (Pharmacia, Suecia). Las muestras se mezclaron con tampón de desnaturalización 2x: 0.125 mol/L Tris-HCL, SDS al 2 %, glicerol al 25%, gotas de bromofenol azul y β-mercaptoetanol al 5%, pH 6.8 y se calentaron a 100oC durante 5 min en un baño de arena (Thermolyne, EUA). Luego de la corrida los geles se colocaron en la solución de fijación compuesta por ácido acético al 10 %, etanol al 40 % y agua destilada al 50%. Para la tinción de los geles se utilizó una solución coloidal de Coomassie azul brillante G-250 al 0,1 %, ácido ortofosfórico al 2 % y sulfato de amonio al 10 %. Los geles se decoloraron mediante lavados con agua destilada. Se utilizó un patrón comercial de bajas masas moleculares (Bio-Rad, EUA). Para la identificación de las proteínas mayoritarias del plasma mediante espectrometría de masas los geles se tiñeron con plata10.
Determinación de la concentración total de proteínas de las fracciones obtenidas mediante electroforesis
La determinación de la concentración total de proteínas de las fracciones separadas mediante electroforesis en gel de agarosa se realizó utilizando el programa TotalLab versión 1.10 (EUA). Este programa permite la selección del área coloreada de cada fracción y calcula el porciento que representa cada una del total de fracciones en la carrilera. Con estos datos se calcula la concentración total de proteínas en cada fracción utilizando la siguiente fórmula:
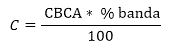
donde C, es la concentración total de proteína en cada banda; CBCA, es la concentración total de proteínas en el plasma antes del fraccionamiento mediante electroforesis y determinada por el método colorimétrico del BCA y % banda, es el porcentaje obtenido con el programa TotalLab versión 1.10 (EUA).
Digestión de proteínas en el gel
Los fragmentos de gel, directamente obtenidos de la SDS-PAGE, se lavaron 3 veces con agua durante 10 min cada vez. Posteriormente, se cortaron en cubos de aproximadamente 1 mm2 y se deshidrataron con 1 mL de acetonitrilo al 90 % con agitación durante 5 min. Después de retirada la solución, las muestras se secaron 5 min en una centrífuga concentradora al vacío y se rehidrataron con una solución de tripsina a 12.5 ng/mL en bicarbonato de amonio 0,05 mol/L. Se digirió durante 16 h a 37°C. Los péptidos trípticos se desalaron en micro columnas ZipTips C18 activadas con una solución de acetonitrilo al 60 %, ácido fórmico al 1% y equilibradas con una solución de ácido fórmico al 1 %. La mezcla de péptidos se eluyó con 3 µL de una solución de acetonitrilo al 60 %, ácido fórmico al 1%.
Espectrometría de masas
Los espectros de masas se obtuvieron en un espectrómetro de masas híbrido con geometría ortogonal QTOF-1 TM (Micromass, Reino Unido) equipado con fuente de ionización por electronebulización Z-spray. El capilar de entrada se sometió a 1200 V y el voltaje del cono fue de 35 V. El analizador se calibró usando yoduro de sodio y cesio como referencia, en el rango de m/z de 50 a 2000 Th. Para la obtención de espectros MS/MS de señales mono, doble y triple cargadas cuyas intensidades en el espectro ESI-MS sobrepasaran 15 conteos/segundos, se empleó una ventana de detección de 4 Th. La energía de colisión para la fragmentación fue previamente definida tomando en consideración el estado de carga. La identificación de proteínas basada en los espectros MS/MS, se realizó empleando el programa MASCOT 11 y la base de datos UniProtKB12.
Análisis estadístico
Se comprobó la normalidad de los datos mediante una prueba Kolmogorov-Smirnov y la homogeneidad de varianza mediante una prueba Levene. Se calcularon los valores de media, desviación estándar, intervalo de confianza y mínimo-máximo de la: concentración total de proteínas en plasma, de albúmina, de α1 globulinas, de α2 globulinas, de β globulinas, de γ globulinas, de globulinas totales y la relación albúmina-globulinas para los tres grupos estudiados. Se realizó una prueba t de Student para comparar la concentración de: proteínas en plasma, albúmina, α1 globulinas, α2 globulinas, β globulinas, γ globulinas, de globulinas totales y la relación albúmina-globulinas de acuerdo a etapa del desarrollo. Todos los cálculos fueron realizados con el programa Statistic versión 8.0 (StatSoftInk) teniendo en cuenta un grado de significación p< 0.05 y los intervalos de confianza del 95%.
RESULTADOS
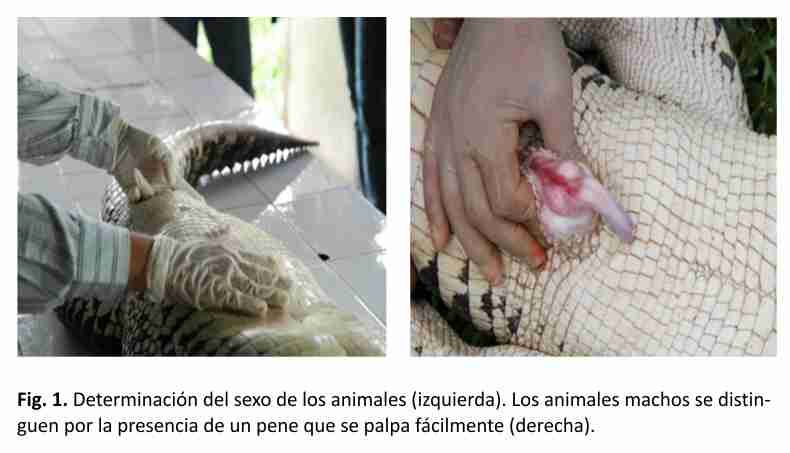
La clasificación de los animales por categorías se realizó teniendo en cuenta los parámetros establecidos por los especialistas del criadero. Ellos consideran los valores de largo total como puntos de corte: categoría juvenil, entre 60 y 149 cm, categoría sub-adulto, entre 150 y 179 cm y categoría adulto mayores de 180 cm. El sexo de los animales se determinó mediante examinación manual (Fig. 1). De los animales cautivos, 20 clasificaron en la categoría juvenil. De ellos, 17 animales resultaron hembras y 3 machos. En la categoría sub-adulto clasificaron 15 animales, de ellos 13 resultaron hembras y 2 machos. De los animales provenientes del medio natural, 1 ejemplar clasificó como juvenil, 4 como sub-adultos y 3 como adultos. En este grupo 7 animales eran machos y 1 hembra.
Para la población global en cautiverio el valor promedio de concentración total de proteínas en el plasma fue de 5.41 g/dL y los valores oscilaron entre 3.53 y 7.53 g/dL. En el grupo de animales cautivos con categoría juvenil el valor promedio de concentración total de proteínas en el plasma fue de 5.30 g/dL y los valores oscilaron entre 4.24 y 7.18 g/dL. Para los animales cautivos con categoría sub-adulto el valor promedio de concentración total de proteínas en el plasma fue de 5.55 g/dL y los valores oscilaron entre 3.53 y 7.53 g/dL. Los animales del medio natural presentaron un valor promedio de concentración total de proteínas en el plasma de 4.89 g/dL, y los valores oscilaron entre 2.30 y 6.91 g/dL (Tabla 1). Para evaluar la variabilidad de la concentración total de proteínas en el plasma en cuanto a etapa del desarrollo y a procedencia se aplicaron pruebas t de Student. Para ello se compararon los grupos de animales cautivos con categoría juvenil y sub-adulto, y los grupos de animales cautivos con categoría sub-adulto y los animales procedentes del medio natural, respectivamente. Ambos análisis revelaron la presencia de diferencias no significativas entre los grupos comparados (p>0.05).
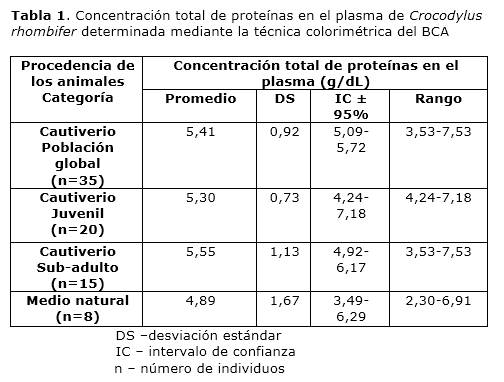
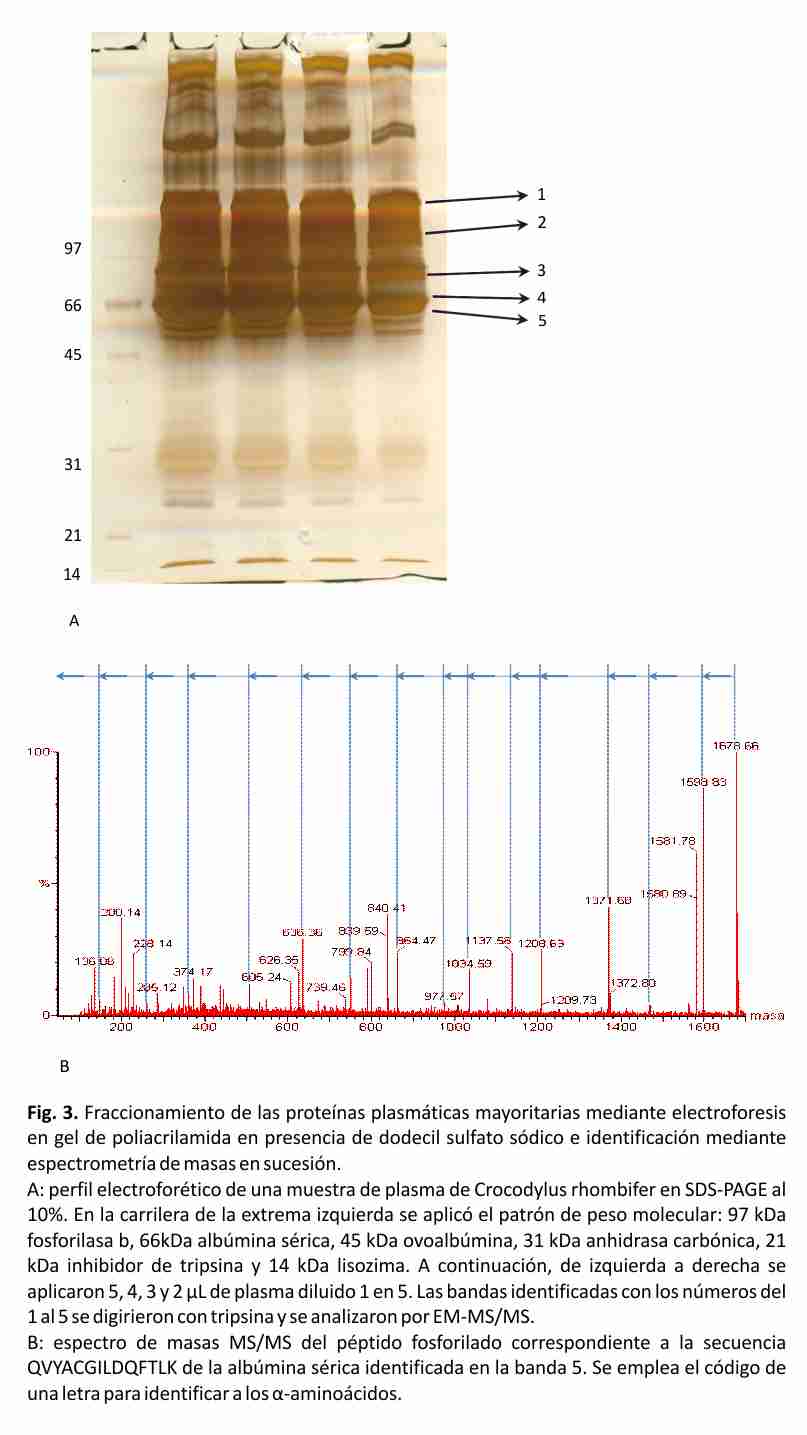
El perfil típico del proteinograma plasmático obtenido para Crocodylus rhombifer en gel de agarosa al 2% mostró 6 fracciones proteicas. En el perfil electroforético la albúmina se identificó por su cercana migración a la de una muestra de albúmina bovina de suero, aplicada en el gel como referencia de masa molecular (resultados no mostrados). La banda que migró más próxima al ánodo se asignó a albúmina fosforilada (Fig. 2). Esta asignación fue posible tras el análisis de una muestra de plasma tratada con agentes reductores mediante SDS-PAGE, seguido de la digestión proteolítica con tripsina de las principales bandas de proteínas y el análisis de los péptidos por espectrometría de masas en sucesión (EM-MS/MS) (Fig. 3). La identificación de las proteínas plasmáticas mayoritarias se basó en las secuencias de los péptidos trípticos obtenidas a partir de los espectros MS/MS (Tabla 2). Las bandas 1-5 correspondieron a la α2 macroglobulina, la transferrina, la cadena pesada de la inmunoglobulina y la albúmina sérica, respectivamente. Todas las proteínas fueron identificadas con más de un péptido y el porcentaje de homología entre las secuencias obtenidas en este trabajo y las secuencias homólogas informadas en la base de datos resultó superior al 64% (Tabla 2). Las secuencias homólogas, en todos los casos, correspondieron a especies del Orden Crocodylia. La cadena pesada de la inmunoglobulina y la albúmina sérica fueron identificadas en las bandas 4 y 5, con un total de 9 y 6 péptidos, respectivamente. De ellos, 3 resultaron péptidos fosforilados. La diferencia de masas de 80 Da entre la señal m/z del ion precursor (1678.66 m/z) y la señal del primer fragmento obtenido (1598.83 m/z) sugiere la presencia en esa secuencia de un aminoácido fosforilado (Tabla 2, Fig. 3).
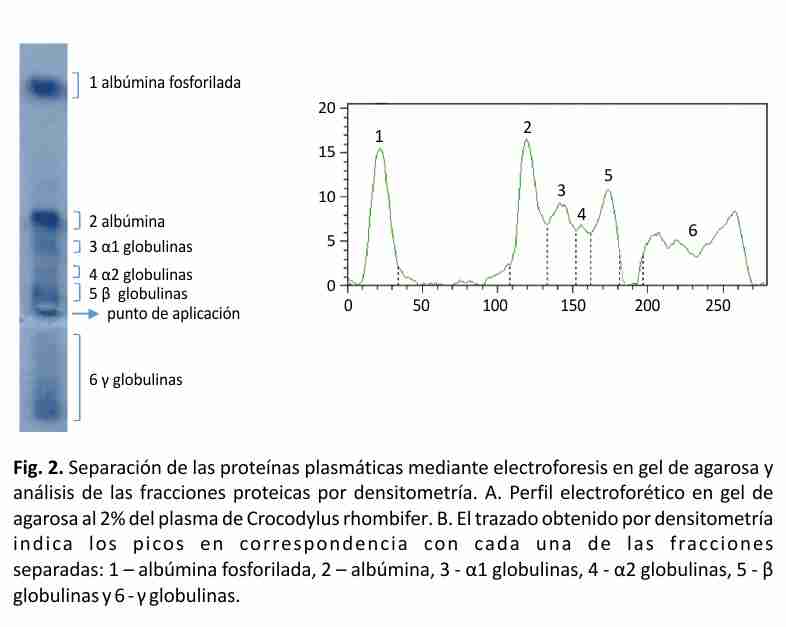
Tabla 2. Resumen de la identificación de las proteínas plasmáticas mayoritarias de Crocodylus rhombifer basada en los espectros MS/MS. En rojo se destacan las diferencias puntuales encontradas entre las secuencias obtenidas en este trabajo y las secuencias informadas en la base de datos UniProtKB*. En negritas se destacan las secuencias correspondientes a péptidos fosforilados, encontrados en este trabajo.
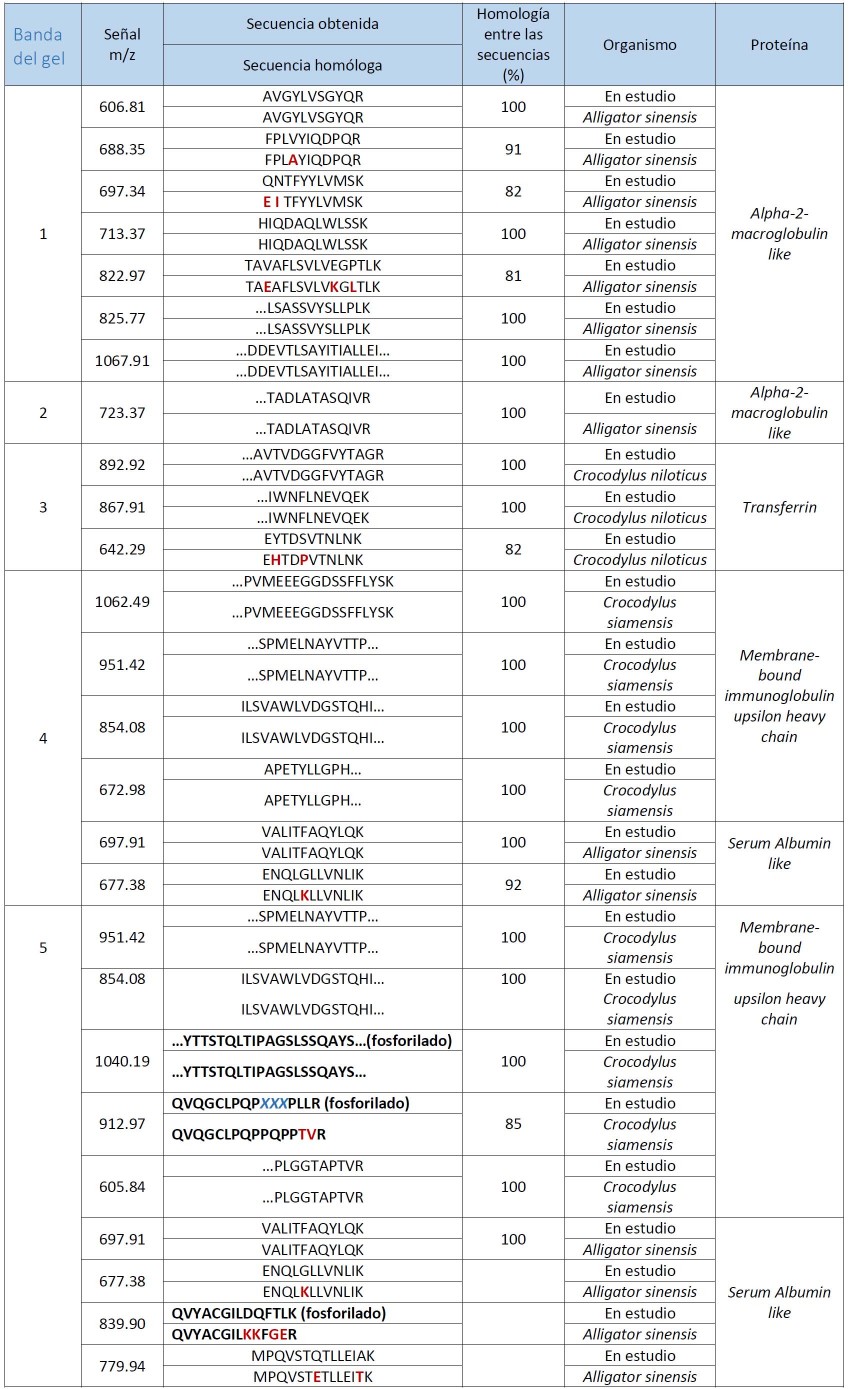
m/z – relación masa-carga del ión
XXX– aminoácidos no identificados en el espectro MS/MS
*http://www.uniprot.org
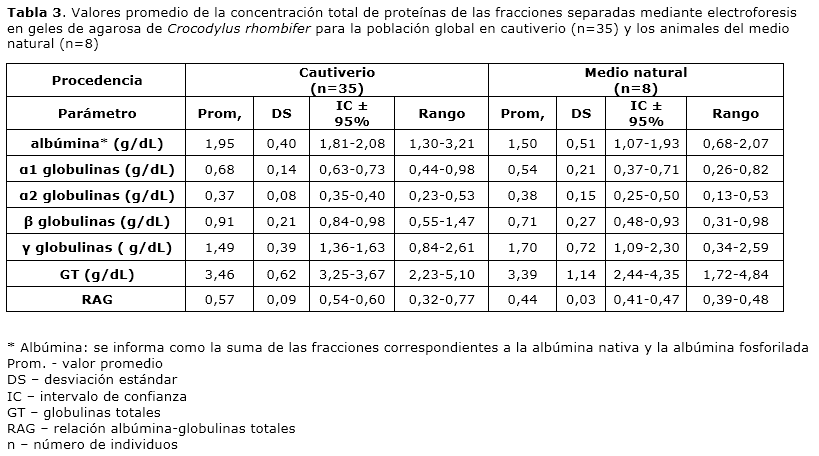
La determinación de la concentración total de proteínas de cada fracción obtenida mediante electroforesis en gel de agaroa se realizó por análisis densitométrico. A partir del porcentaje que representó cada fracción en el porcentaje total de las fracciones en la carrilera se determinó la concentración de cada una. El valor de albúmina se consideró como la suma de las fracciones correspondientes a la albúmina nativa y la albúmina fosforilada. Para la población global de animales en cautiverio (n=35) se obtuvo un valor promedio de la concentración total de proteínas por fracción de: albúmina 1.95 g/dL, α1 globulinas 0.68 g/dL, α2 globulinas 0.37 g/dL, β globulinas 0.91 g/dL y γ globulinas 1.49 g/dL. El valor promedio de globulinas totales resultó 3.46 g/dL y la relación albúmina-globulinas 0.56. Para el grupo de animales del medio natural (n=8) se obtuvo un valor promedio de la concentración total de proteínas por fracción de: albúmina 1.50 g/dL, α1 globulinas 0.54 g/dL, α2 globulinas 0.38 g/dL, β globulinas 0.71 g/dL y γ globulinas 1.70 g/dL. El valor promedio de globulinas totales y de la relación albúmina-globulinas resultó 3.39 g/dL y 0.44, respectivamente (Tabla 3).
Para el grupo de animales cautivos con categoría juvenil (n=20) se obtuvo un valor promedio de la concentración total de proteínas por fracción de: albúmina 1.86 g/dL, α1 globulinas 0.67 g/dL, α2 globulinas 0.37 g/dL, β globulinas 0.95 g/dL y γ globulinas 1.44 g/dL. El valor promedio de globulinas totales y de la relación albúmina-globulinas resultó 3.44 g/dL y 0.54, respectivamente. Para el grupo de animales cautivos con categoría sub-adulto (n=15) se obtuvo un valor promedio de la concentración total de proteínas por fracción de: albúmina 2.07 g/dL, α1 globulinas 0.69 g/dL, α2 globulinas 0.37 g/dL, β globulinas 0.86 g/dL y γ globulinas 1.56 g/dL. El valor promedio de globulinas totales y de la relación albúmina-globulinas resultó 3.48 g/dL y 0.60, respectivamente (Tabla 4).

La comparación de la concentración total de proteínas de las fracciones proteicas separadas mediante electroforesis en geles de agarosa se realizó mediante un ANOVA de clasificación simple y se compararon los grupos de animales cautivos con categoría juvenil, animales cautivos con categoría sub-adulto y los animales procedentes del medio natural. Se observó que el mayor valor de albúmina correspondió a los animales cautivos con categoría sub-adulto, mientras que el menor valor de esta proteína correspondió a los animales del medio natural. El ANOVA reveló que las diferencias en la concentración de albúmina son significativas (F= 4.99 y p= 0.01). Por otra parte, seobservó que el valor de relación albúmina-globulinas es mayor para el grupo de animales cautivos con categoría sub-adulto. El menor valor de esta variable se obtuvo para los animales procedentes del medio natural. El ANOVA reveló que las diferencias entre los valores de relación albúmina-globulinas para los tres grupos son altamente significativas (F= 10.96 y p= 0.0001).
La concentración de globulinas totales no demostró variaciones significativas entre los grupos comparados (p=0.96). Las fracciones α1 globulinas, α2 globulinas y γ globulinas no mostraron diferencias entre los grupos (p>0.05). El mayor de valor de la fracción de las γ globulinas se observó en los animales del medio natural y el menor valor para el grupo de animales cautivos con categoría juvenil. La fracción correspondiente a las β globulinas mostró diferencias significativas entre los grupos (F= 3.79 y p= 0.03); el mayor valor de esta fracción correspondió al grupo de animales cautivos con categoría juvenil y el menor valor a los animales del medio natural.
DISCUSIÓN
Las proteínas plasmáticas están involucradas en casi todos los procesos biológicos vitales por lo que el estudio del proteinograma plasmático resulta útil en la evaluación del estado de salud o enfermedad, así como del estado nutricional de muchas especies. La medición de estas proteínas se emplea para diferenciar los estados de enfermedad agudos de estados crónicos 13. En este trabajo se determinó la concentración total de proteínas plasmáticas y de sus fracciones para una muestra de la población cautiva de Crocodylus rhombifer del criadero "Ciénaga de Zapata", Matanzas, Cuba. Los resultados obtenidos se compararon con un grupo de animales procedentes del medio natural. Las variaciones eventuales debido al efecto postprandial y el ritmo circadiano que pudieran registrarse en la concentración total de proteínas fueron excluidas del diseño experimental debido a que la toma de las muestras se realizó en horas tempranas de la mañana y en ayuno.
El rango de valores de concentración total de proteínas plasmáticas para la población cautiva estudiada de Crocodylus rhombifer, así como el valor experimental promedio obtenido están dentro del rango de valores informado para la clase Reptilia 14. Aunque casi todas las especies de reptiles estudiadas se encuentran dentro de este rango, es posible observar variaciones entre órdenes, familias, géneros, especies e incluso individuos de una misma especie 15. En la tabla 5 aparecen los valores de concentración total de proteínas, albúmina, globulinas totales y relación albúmina-globulinas para algunas especies que pertenecen al Orden Crocodylia, específicamente de las familias Alligatoridae y Crocodylidae. La variabilidad y los amplios rangos de estos valores pueden ser atribuidos a las particularidades fisiológicas de los reptiles ya que los parámetros sanguíneos fluctúan considerablemente en función del sistema de alimentación, el hábitat, el clima, el sexo y la edad 16-19.
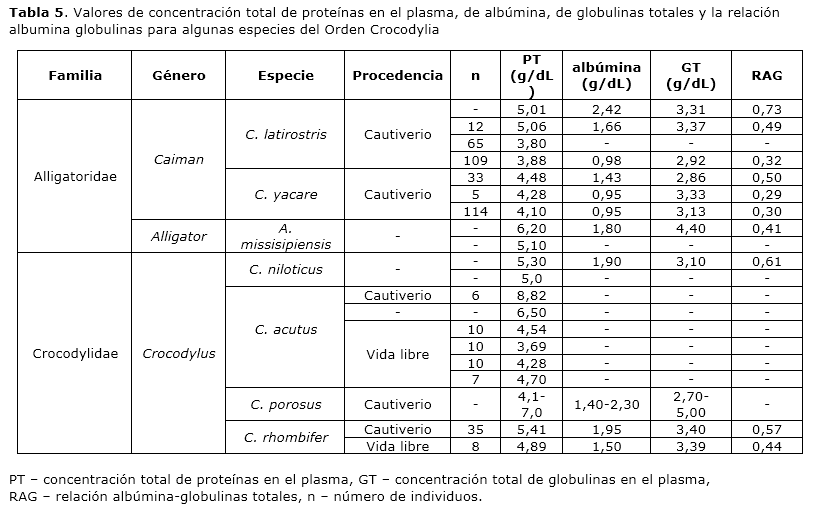
La cuantificación de proteínas totales, el perfil electroforético (proteinograma) y la relación albúmina-globulinas se emplean en el diagnóstico de las alteraciones protéicas. En particular la relación albúmina-globulinas resulta de especial interés en Clínica, ya que este parámetro permite la clasificación sistemática del perfil electroforético y la identificación de las disproteinemias20. En este trabajo los valores de concentración total de proteínas en el plasma atendiendo a la etapa de desarrollo no resultaron significativamente diferentes (categoría juvenil contra categoría sub-adulto) o procedencia (categoría sub-adulto contra medio natural) (p>0.05). Sin embargo, nuestros resultados arrojaron el mayor valor promedio de concentración total de proteínas en el plasma de los animales cautivos con categoría sub-adulto y el menor, en el plasma de los animales procedentes del medio natural. En correspondencia con este hecho, se encontró el mayor valor de concentración de albúmina en el grupo de animales cautivos con categoría sub-adulto y el menor valor en los animales del medio natural y las diferencias de este parámetro resultaron significativas. Por otra parte, se observó que el valor de relación albúmina-globulinas es mayor para el grupo de animales cautivos con categoría sub-adulto y menor para los animales procedentes del medio natural. El ANOVA reveló que las diferencias entre los valores de relación albúmina-globulinas para los tres grupos son altamente significativas. Los animales cautivos empleados en este estudio fueron alimentados una vez por semana, con una dieta rica en proteínas, mientras que los animales del medio natural se alimentan de una manera más irregular en frecuencia y componentes de la dieta. La relación entre la dieta y la concentración total de proteínas plasmáticas es bien conocida y se fundamenta en el hecho de que la albúmina es la proteína mayoritaria del plasma. Su síntesis ocurre en el hígado a una tasa que depende de la ingestión de proteínas. Una dieta escasa en proteínas provoca una disminución de alrededor del 50% en la síntesis de albúmina en 24 horas 21. Por lo tanto, su contribución a la concentración total de proteínas y a la relación albúmina-globulinas es significativa. Algunos autores, empleando electroforesis en acetato de celulosa y valoración densitométrica, han obtenido resultados similares en una población cautiva de Caiman latirostris y Caiman yacare (categoría sub-adulto): el suministro regular de alimentos promueve los valores de proteína total, albúmina y relación albúmina-globulinas a mayores valores que en animales de Zoológico22. Similares resultados han sido encontrados por Uhart y colaboradores23 para Caiman yacare. En un estudio con Rana catesbeiana, anfibio de vida acuática filogenéticamente relacionado con los reptiles, se ha determinado que los valores de concentración total de proteínas y de albúmina en el suero son directamente proporcionales a la cantidad y calidad de la proteína dietaria 24 y en caimanes se ha demostrado que el cambio del alimento habitual, rico en carne bovina, a una dieta compuesta por harina de carne y sangre produce un incremento de la albumina sérica25.
Entre otros factores que determinan la alta variabilidad encontrada en los valores experimentales de concentración total de proteínas en el plasma de los reptiles podemos mencionar el método empleado para su determinación. Para este fin no existe un sistema completamente satisfactorio, por lo que elegir el método a emplear dependerá de la cantidad de muestra de la que disponga el investigador, de la necesidad o no de recuperar la muestra intacta, de la presencia de compuestos que pudieran interferir y afectar la especificidad y por último de la sensibilidad, la precisión y la reproducibilidad que se requieran en el estudio. Los métodos de unión a colorantes se utilizan con frecuencia, pero sufren de alta variabilidad entre las proteínas de diferentes especies y esto se debe a la diferente afinidad de las proteínas por los colorantes26. Algunos trabajos con reptiles emplean la técnica colorimétrica del Biuret 27-34. Con esta técnica es posible detectar concentraciones de proteínas de hasta 0.5 mg/mL pero se requieren grandes cantidades de muestra 35. El método colorimétrico del ácido bicinconílico empleado en este estudio, sigue el mismo principio que la reacción del Biuret pero presenta la ventaja de ser un juego de reactivos comercial optimizado lo que garantiza mayor reproducibilidad en los resultados y mayor sensibilidad del ensayo. Este método permite determinar la concentración total de proteínas en el orden de los μg/mL36. En particular para la determinación de la albúmina en plasma y a pesar de que ha demostrado ser un método poco preciso para especies no mamíferas, el empleo del colorante verde de bromocresol ha sido sugerido por algunos autores 37-39. Sin embargo, se reconoce que la electroforesis seguida del análisis densitométrico permite medir la albúmina presente en el plasma de una manera más precisa que los métodos basados en el empleo de colorantes. Considerando que algunos autores no describen las técnicas analíticas empleadas en la determinación de los valores de concentración total de proteínas y de albúmina en sus trabajos es muy difícil comparar los datos obtenidos en este trabajo para Crocodylus rhombifer con los datos obtenidos para otras especies del Orden.
La electroforesis nativa en gel de agarosa es una de las técnicas electroforéticas más empleada para la separación de las proteínas plasmáticas. Con esta técnica electroforética las proteínas se analizan en su estado nativo. A pH 8.5-9 ellas ganan cargas negativas y migran bajo la acción del campo eléctrico, del electrodo negativo al positivo. El soporte, o sea el gel de agarosa, el cual a diferencia del gel de poliacrilamida tiene poros muy grandes, limita sustancialmente la separación de las proteínas según su tamaño molecular y como resultado las proteínas se separan en función de su densidad de carga superficial. Cuando las proteínas del plasma se resuelven empleando esta técnica, este se fracciona en cinco o seis bandas dependiendo del ajuste del sistema electroforético empleado. Las bandas corresponden a la albúmina, las α1 globulinas, las α2 globulinas, las β1 globulinas, las β2 globulinas y las γ globulinas. Por densitometría se puede obtener un trazado que dibuja una serie de ondas o picos en correspondencia con cada una de las bandas. La superficie de cada pico es proporcional a la intensidad de color y tamaño de las bandas originales. El trazado varía de acuerdo a diferentes factores fisiológicos a saber: especie, sexo, edad, estado fisiológico, estado metabólico, aptitud productiva y factores ambientales. La combinación de la electroforesis con la densitometría permite calcular la concentración relativa de las proteínas plasmáticas. Las condiciones seleccionadas y empleadas en nuestro trabajo nos permitieron fraccionar el plasma de los cocodrilos en 6 fracciones.
Una de las potencialidades de la espectrometría de masas, es su capacidad de dilucidar la secuencia de péptidos. Esto se realiza a través de la descomposición de la molécula ionizada en fragmentos generados durante el proceso de ionización. A partir de las series de fragmentos N-terminal se obtiene la secuencia de aminoácidos desde el extremo C hacia el N, mientras que la series de fragmentos C-terminal brindan la información secuencial del extremo N al C. La diferencia de masas entre señales consecutivas de iones correspondientes a una misma serie, nos indica la pérdida de un aminoácido, la posición que ocupa dentro de la secuencia y en el caso en que se obtengan valores de masas inesperados, estos pueden relacionarse con modificaciones en la estructura de los α-aminoácidos. De esta forma es posible determinar la secuencia de péptidos de forma bidireccional y localizar modificaciones post-traduccionales. De todas las proteínas plasmáticas, la albúmina es la proteína más pequeña y con mayor número de grupos cargados negativamente; esta característica le permite migrar con mayor rapidez bajo la acción de un campo eléctrico y en geles de agarosa es la fracción más próxima al ánodo. Sin embargo, en esa misma dirección y mucho más próxima al ánodo se observó otra fracción proteica que migró con mayor velocidad que la albúmina. Para establecer la identidad de esa banda se empleó la espectrometría de masas mediante la secuenciación de sus péptidos trípticos. La diferencia de masas de 80 Da entre la señal m/z del ion precursor y la señal del primer fragmento obtenido sugierió la presencia en esa secuencia de un aminoácido fosforilado. A partir de este resultado identificamos a la banda que migró en los geles de agarosa al 2 % más próxima al ánodo como albúmina fosforilada. La ausencia en la literatura científica de informes anteriores sobre la separación de una fracción de albúmina fosforilada en el plasma de los cocodrilos puede deberse al hecho de que generalmente para la separación de las proteínas plasmáticas se utilizan sistemas electroforéticos automáticos o semiautomáticos. La mayoría de estos sistemas emplean la electroforesis en acetato de celulosa, la cual resulta menos resolutiva que la electroforesis en geles de agarosa, y tiempos de corrida que no sobrepasan los 30 minutos 40-42. La fosforilación de las proteínas es una modificación post-traduccional muy importante porque regula la división y la diferenciación celular así como la función de las proteínas. La fosforilación y la desfosforilación catalizada por proteínas quinasas y fosfatasas puede modificar la función de las proteínas de casi todas las maneras posibles: aumentando o disminuyendo su actividad biológica, estabilizándola o marcándola para su destrucción, facilitando o impidiendo su movimiento entre compartimentos celulares, iniciando o disociando las interacciones proteína-proteína. La fosforilación de la albúmina encontrada en este estudio pudiera responder a uno de los mecanismos de regulación planteados para mediar los ritmos de síntesis y degradación de esta proteína en los cocodrilos 43 .
Conclusiones
El valor promedio de concentración total de proteínas en el plasma de una muestra de la población de Crocodylus rhombifer en cautiverio fue de 5.41 ± 0.92 g/dL. El rango de valores osciló entre los 3.53 - 7.53 g/dL. Estos valores están en el rango informado para la clase Reptilia. Mediante el empleo de la espectrometría de masas fue posible identificar la fosforilación de la albúmina del plasma de Crocodylus rhombifer. A partir de este hallazgo sugerimos que la fracción que migró más próxima al ánodo en los geles de agarosa al 2% corresponde a la albúmina fosforilada. La electroforesis en gel de agarosa al 2% permitió separar el plasma en seis fracciones proteicas correspondientes a la albúmina fosforilada, la albúmina nativa, las α1 globulinas, las α2 globulinas, las β globulinas y las γ globulinas. Los valores promedio de la concentración de proteínas de las diferentes fracciones del plasma de una muestra de la población de animales cautivos de Crocodylus rhombifer fueron: albúmina 1.95 ± 0.40 g/dL, α1 globulinas 0.61 ± 0.14 g/dL, α2 globulinas 0.37 ± 0.08 g/dL, β globulinas 0.91 ± 0.21 g/dL y γ globulinas 1.49 ± 0.39 g/dL. No se observaron diferencias significativas entre los valores de la concentración total de proteínas en el plasma y de las fracciones separadas mediante electroforesis en geles de agarosa entre los animales cautivos de acuerdo a la etapa del desarrollo.
Agradecimientos
Este trabajo fue realizado gracias al soporte financiero recibido de la Fundación Alexander von Humboldt de Alemania.
REFERENCIAS BIBLIOGRÁFICAS
1. Cuvier, G.L.C.F.D.B.d. (1807) Sur les diferentes especes de crocodiles vivantes et sur leurs caracteres distinctifs. Ann Mus Hist Nat. 10: 8-66.
2. Ramos, R. (2006) First National Workshop on the Status of the Cuban Crocodile. Group Specialist Crocodile Newsletter. 25 (4): 5-6.
3. Ramos R. (2013) Ecología y conservación del cocodrilo cubano (Crocodylus rhombifer) en la "Ciénaga de Zapata", Cuba. Tesis Doctoral. Universidad de Alicante, España y Universidad de Pinar del Rio, Cuba.
4. Targarona, R. R.; R. R. Soberón; L. Cotayo; M. A. Tabet, y J. Thorbjarnarson (2008) Crocodylus rhombifer. En: IUCN Red List of Threatened Species.
5. Barragán, F. y B. Karol (2002) Enfermedades de Reptiles y Anfibios. Boletín GEAS. Vol III, No 2: 18-27.
6. Strik, N.I., A.R. Alleman y K.E. Harr (2007) Circulating Inflammatory Cells. Infectious Diseases and Pathology of Reptiles: Color Atlas and Text. CRC Press. Florida, Estados Unidos, 167-218.
7. Zaldívar, C. y G. Hernández (1987) Temas de Bioquímica Clínica. Combinado Poligráfico Evelio Rodríguez Curbelo. Cuba. 7-23.
8. Zaias, J. y Cray, C. (2002) Protein electrophoresis: a tool for the reptilian and amphibian practitioner. JHMS, 12: 30-32.
9. Laemmli U.K. (1970) Cleavage of Structural Proteins During the Assembly of the Head of Bacteriophage T4. Nature. 227: 680-685. DOI:10.1038/227680a0.
10. Tao Huang, Xueling Chen, Huan Gu, Conghui Zhao, Xingmu Liu, Meiling Yan, Xiaodong Deng, Zaiping Zhang y Jiang Gu. (2016) Fractionation of Fab glycosylated immunoglobulin G with concanavalin A chromatography unveils new structural properties of the molecule. Oncotarget 7: 31166 - 31176. DOI: 10.18632/oncotarget.9085.
11. MASCOT, http://www.matrixscience.com
12. UniProtKB, http://www.uniprot.org/help/uniprotkb
13. Calvacante, P.H., A.C. Silva, S.M. Sakamoto y B. Soto (2012) Serum protein fractions in Brazilian-breed donkeys using agarose gel electrophoresis. Turk Vet Anim Sci. 36: 9-12. DOI:10.3906/vet-1011-565
14. Campbell, T.W. (1996) Clinical Pathology. Reptile Medicine and Surgery. W.B. Sauders Company. Filadelfia, Estados Unidos de América. 248-247.
15. Stacy, B.A y N. Whitaker (2000) Hematology and blood biochemistry of captive mugger crocodile (Crocodylus palustris). Zoo and Wildlife Med. 31: 339-347.
16. Campbell, T.W. (2004) Blood Biochemistry of Lower Vertebrates. American College of Veterinary Pathologists & American Society for Veterinary Clinical Pathology. Disponible en: www.acvp.org.
17. Gicking J.C., B.S. Allen, M. Foley, E.H. Kendal, R.E. Raskin y E. Jacobson (2004) Plasma Protein Electrophoresis of the Atlantic Loggerhead Sea Turtle, Caretta caretta. Herpetological Medicine and Surgery 14: 13-17.
18. Coppo, J.A, N.B Mussart, S.A. Fioranelli y P.A. Zeinsteger (2005) Blood and urine physiological values in captive Bullfrog, Rana catesbeiana (Anura: Ranidae). Rev vet. 25: 15-17.
19. Koza, G.A.; N.B. Mussart; N.N. Barboza y J.A Coppo (2011) Morphometrical and hematological changes in Caiman yacare supplemented with beef and fish meats. Rev vet. 22: 114-118.
20. Kaneko, J. (1997) Clinical Biochemistry of Domestic Animals. Serum Proteins and the Dysproteinemias. 117 - 138 pp. Elsevier. DOI:10.1016/B978-012396305-5/50000-2.
21. Allison, A.C. (1976) Structure and function of plasma protein. Plenum press, New York, Estados Unidos de América, 72-208 pp.
22. Coppo J.A., N.B. Mussart, N.N Barboza, P.A. Zeinsteger y W.S Prado (2006) Electrophoretic proteinogram reference interval from Argentina Northeastern captive caimans (Crocodylia: Alligatoridae). In Vet. 8 (1): 129-137.
23. Uhart M, W. Prado, P. Beldoménico, C. Rossetti, M.C. Ferreyra, A. Martínez, J.C. Bardón, G. Avilés y W. Karesh (2001) Estudios sanitarios comparativos de yacarés (Caiman latirostris y Caiman yacare) silvestres y cautivos. Boletín Técnico Fundación Vida Silvestre Argentina. 55: 1-15.
24. Coppo, J.A., N.B. Mussart y S.A. Fioranelli (2004) Impacto de la alimentación, clima y sistema de manejo del criadero sobre el peso y las proteínas plasmáticas de Rana catesbiana. Vet Arg. 21: 101-116.
25. Ferreyra, H. y M. Uhart (2001) Evaluación y evolución del estado sanitario de Caiman latirostris y Caiman yacare en el Refugio El Cachapé. Boletín Técnico de la Fundación Vida Silvestre Argentina No 55, anexo III: 1- 15.
26. Harr, K.E. (2002) Clinical chemistry of comparison avian species: a review. Vet Clin Path. 31: 140-151. DOI: 10.1111/j.1939-165X.2002.tb00295.x.
27. Dessauer H.C. (1970) Blood Chemistry of Reptiles: Physiological and Evolutionary aspects. Academic Press. New York, Estados Unidos de América, 1-72.
28. Lance, V., T. Joanen, y L. McNease (1983) Selenium, vitamin E, and trace elements in the plasma of wild and farm-reared alligators during the reproductive cycle. Can J Zool. 61: 1774-1751.
29. Densmore, L. D. y R. D. Owen (1989) Molecular systematic of the order Crocodilia. Amer Zool. 29: 831-841.
30. Sigler, L. (1990) Constantes Fisiológicas y Valores Hemáticos de Cocodrilianos Mexicanos en Cautiverio en los estados de Chiapas, Quintana Roo y Yucatán. Tesis Doctoral. División de Estudios Profesionales de la Facultad de Medicina Veterinaria y Zootecnia. UNAM. México.
31. Ponce-Campos, P., C. Magallón-Morineau, J. Quintana y J. Dubach (2004) Concentraciones Totales de Proteína en Plasma del "Caimán" Crocodylus acutus en Poblaciones Silvestres de Jalisco, México. Memorias de la VI Reunión de Trabajo de la COMACROM, Puerto Vallarta, Jalisco, 25-27 de agosto, 9
32. GickingJ.C., B.S. Allen, M. Foley, E.H. Kendal, R.E. Raskin y E. Jacobson (2004) Plasma Protein Electrophoresis of the Atlantic Loggerhead Sea Turtle, Caretta caretta. Herpetological Medicine and Surgery. 14: 13-17.
33. Barboza N., N.B Mussart, J.A. Coppo, S.A. Fioranelli y G.A. Koza (2008) El medio interno de Caiman latirostris en cautiverio. Influencia del sexo, crecimiento y estación del año. Rev vet. 19: 33-41.
34. Barboza, N, A. Panseri, N.B. Mussart, G.A. Kosa y J.A. Coppo (2010) Análisis multivariado de los cambios hemáticos y morfométricos de Caiman latirostris y Caiman yacare según especie, sexo y estación del año. Rev vet 21: 112-122.
35. Sapan C., L. Roger, N. Lundblad y C. Price. (1999) Colorimetric protein assay techniques. Biotechnol Appl Biochem. 29: 99-108. DOI: 10.1111/j.1470-8744.1999.tb00538.x.
36. Boletin técnico Micro BCA Protein Assay Kit, www.piercenet.com.
37. Spano, .S., J.F. Whitesides, W.M. Pedersoli, L.M. Krista y W.M. Ravis (1988) Comparative albumin determinations in ducks, chickens and turkeys by electrophoretic and dye-binding methods. Am Vet Res. 49: 325-326.
38. Cray, C. y L.M. Tatum (1998) Applications of protein electrophoresis in avian diagnostics. Avian Med Surg. 12: 4-10.
39. Harr, K.E. (2002) Clinical chemistry of comparison avian species: a review. Vet Clin Path. 31: 140-151. DOI: 10.1111/j.1939-165X.2002.tb00295.x.
40. Alberghina, D., S. Casella, I. Vazzana, V. Ferrantelli, C. Giannetto y G. Piccione (2010) Analysis of serum proteins in clinically healthy goats ( Capra hircus) using agarose gel electrophoresis. Vet Clin Pathol 39: 317-321. DOI: 10.1111/j.1939-165X.2010.00226.x.
41. Giménez, M., J. Martorell, Y. Saco, R. Pato y A. Bassols (2009) Proteinograma en Iguana iguana: valores de referencia, detección de bisalbuminemia y localización de hemolisis, fibrinógeno y lipemia. 42 Congreso Nacional de AVEPA: 292 pp.
42. Cooper-Bailey, K., S.A. Smith, Z. Kurt, R. Lane, R.E. Raskin y D. de Nardo (2011) Hematology, leukocyte cytochemical analysis, plasma biochemistry, and plasma electrophoresis of wild-caught and captive-bred Gila monsters (Heloderma suspectum). Vet Clin Pathol. 40: 316-323. DOI: 10.1111/j.1939-165X.2011.00337.x.
43. Pinwattana, K., J. Wangb, C-T. Linb, H. Wub, D. Dub, Y. Linb y O. Chailapakul (2010) CdSe/ZnS quantum dots based electrochemical immunoassay for the detection of phosphorylated bovine serum albumin. Biosensors and Bioelectronics 26: 1109-1113. DOI:10.1016/j.bios.2010.08.02.x
Recibido: 14 de mayo de 2016.
Aprobado: 23 de junio de 2016.
Vivian Morera1, Arline Fernández2, Claudia Puentes2, Etiam Pérez3, Gustavo Sosa3, Leiter Guerra3, Félix Santana2 y Yoamel Milian2.
1 Universidad de Las Américas, Quito, Ecuador.
2 Universidad de La Habana, La Habana, Cuba.
3 Criadero Ciénaga de Zapata. Matanzas, Cuba.
Autor de correspondencia: Vivian Morera. Facultad de Ingeniería y Ciencias Agropecuarias. Universidad de Las Américas. Sede Queri: calle José Queri s/n entre Av. Granados y Av. Eloy Alfaro, Quito, Ecuador. Teléf. (593) 23981000 Ext. 112. Correo electrónico: [email protected]
cocodrilo cubano (Crocodylus rhombifer)
