2023.08.01.30
Files > Volume 8 > Vol 8 No 1 2023
Manejo odontológico de las manifestaciones orales inducidas por radioterapia de cabeza y cuello
Dental management of oral manifestations induced by radiotherapy of the head and neck
Nagely J. Mejía-Chuquispuma 1, Katia V. Flores-Jiménez 1, Allison C. Castro-Auqui 1, Manuel A. Mattos-Vela 1,*
1 Facultad de Odontología, Universidad Nacional Mayor de San Marcos, Lima Perú; [email protected] . ORCID: https://orcid.org/0000-0003-3288-718X (NJM-Ch); [email protected] . ORCID: https://orcid.org/0000-0003-4733-5898 (KVF-J); [email protected] . ORCID: https://orcid.org/0000-0002-4241-2244 (ACC-A); [email protected] . ORCID: https://orcid.org/0000-0002-5701-1961 (MAM-V)
* Correspondence: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.01.30RESUMEN
La radioterapia es una de las primeras opciones de tratamiento para el cáncer de cabeza y cuello; sin embargo, puede ocasionar diversas manifestaciones secundarias en la cavidad oral tales como mucositis oral, xerostomía, infecciones orales oportunistas, osteorradionecrosis y trismo. El presente artículo tiene como objetivo describir el manejo preventivo y terapéutico de las complicaciones orales inducidas por radioterapia de cabeza y cuello en la práctica odontológica propuestos hasta la actualidad. Se encontraron diversas medidas que han logrado reducir la incidencia y gravedad de dichas manifestaciones orales; sin embargo, aún existen algunas que requieren de más estudios para confirmar su efectividad.
Palabras clave: cáncer de cabeza y cuello; manifestaciones bucales; radioterapia; terapéutica.
ABSTRACT
Radiotherapy is one of the first treatment options for head and neck cancer; however, it can cause various secondary manifestations in the oral cavity such as oral mucositis, xerostomia, opportunistic oral infections, osteoradionecrosis and trismus. This article aims to describe the preventive and therapeutic management of oral complications induced by head and neck radiotherapy in dental practice proposed to date. Several actions were found that have managed to reduce the incidence and severity of these oral manifestations; however, there are still some that require further studies to confirm their effectiveness.
Keywords: head and neck neoplasms; oral manifestations; radiotherapy; therapeutics.
INTRODUCCIÓN
El cáncer de cabeza y cuello (CCC) es el séptimo tipo de cáncer más común en todo el mundo y representa el 5% de todos los cánceres 1,2. Según las últimas estimaciones de GLOBOCAN en el 2018, se reportaron un estimado de 887 649 nuevos casos y 453 307 muertes relacionadas con este tipo de cáncer en todo el mundo 3. Los enfoques terapéuticos más utilizados para estas neoplasias son la cirugía, la radioterapia y la quimioterapia, que se pueden emplear de forma combinada o separada.
La radioterapia consiste en el uso de radiación ionizante y electromagnética para dañar el ADN, molécula necesaria para la replicación celular; por consiguiente, destruye las células cancerosas e inhibe el crecimiento de los tumores 4,5. Sin embargo, su mecanismo de acción no es selectivo y puede afectar también al tejido sano. Los efectos nocivos en los tejidos biológicos se clasifican en determinísticos y estocásticos 6. Los efectos determinísticos ocurren cuando se utilizan dosis mayores que el umbral, es decir, por debajo de este, los efectos no se producen; además su severidad aumenta con la dosis y comprende los efectos agudos 7. Por otro lado, los efectos estocásticos no tienen un umbral de dosis para su manifestación, por lo que pueden aparecer inclusive con dosis bajas e ir aumentando la probabilidad de aparición con el aumento de la dosis de radiación; sin embargo, esta no influye en la gravedad o severidad del efecto, se manifiestan de forma tardía, es decir, generalmente aparecen años o décadas después de la exposición a la radiación 8.
En el CCC se utiliza, con mayor frecuencia,
una dosis de radiación de 2 Gy en solo una fracción al día, durante 5 días y en
el transcurso de 7 semanas, alcanzando una dosis acumulativa de 50 Gy a 70
Gy 9. Esta modalidad de tratamiento es la que provoca mayores
complicaciones en la cavidad oral (Figura 1) 10,11. Puede generar manifestaciones
orales agudas y tardías; las cuales dependen directamente de la tasa de
recambio tisular, el área de tejido expuesto, la dosis total de radiación y la
respuesta de cada individuo 12,13. Los efectos agudos ocurren
durante el tratamiento o dentro de 2 a 3 semanas después de finalizar la
radioterapia e incluyen la mucositis oral, xerostomía e infecciones
secundarias; por otro lado, los efectos tardíos ocurren semanas a años más
tarde e incluyen la osteoradionecrosis y trismo 10,14,15.
Las manifestaciones descritas conllevan a
la limitación de ciertas funciones básicas como alimentarse, hablar y respirar.
Además, de interrumpir el tratamiento antineoplásico, afectando así la calidad
de vida del paciente 16. Por tanto, es necesaria la
intervención odontológica antes, durante y después de la radioterapia tanto
para disminuir las tasas de incidencia como la gravedad de dichas
manifestaciones (Figura 2).
Con base a lo mencionado, el presente estudio tuvo por objetivo describir el
manejo preventivo y terapéutico de las complicaciones orales inducidas por
radioterapia de cabeza y cuello en la práctica odontológica propuestos hasta la
actualidad .
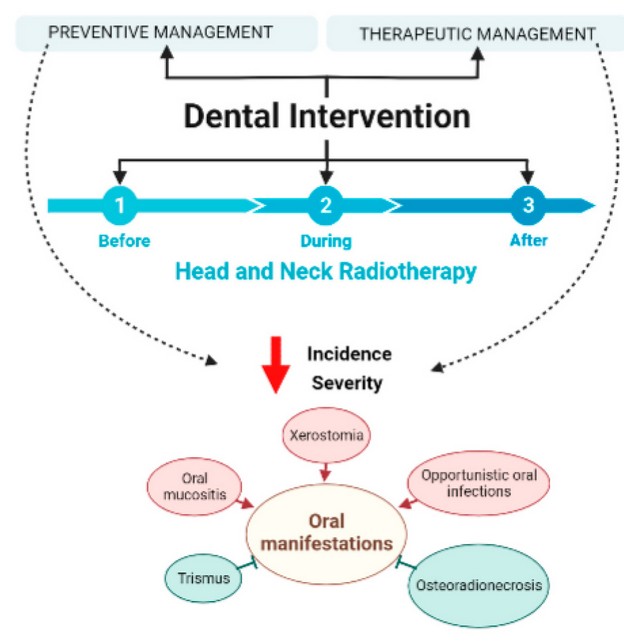
Figura 1. Efectos adversos en la cavidad
oral inducidos por radioterapia de cabeza y cuello. Imagen creada con BioRender
(https://biorender.com/).
Manejo de las manifestaciones orales inducidas por radioterapia de cabeza y cuello en la práctica odontológica
Se han reportado una amplia gama de intervenciones para prevenir o tratar las manifestaciones orales inducidas por radioterapia de cabeza y cuello, a continuación, se mencionan algunas de ellas (Tabla 1).
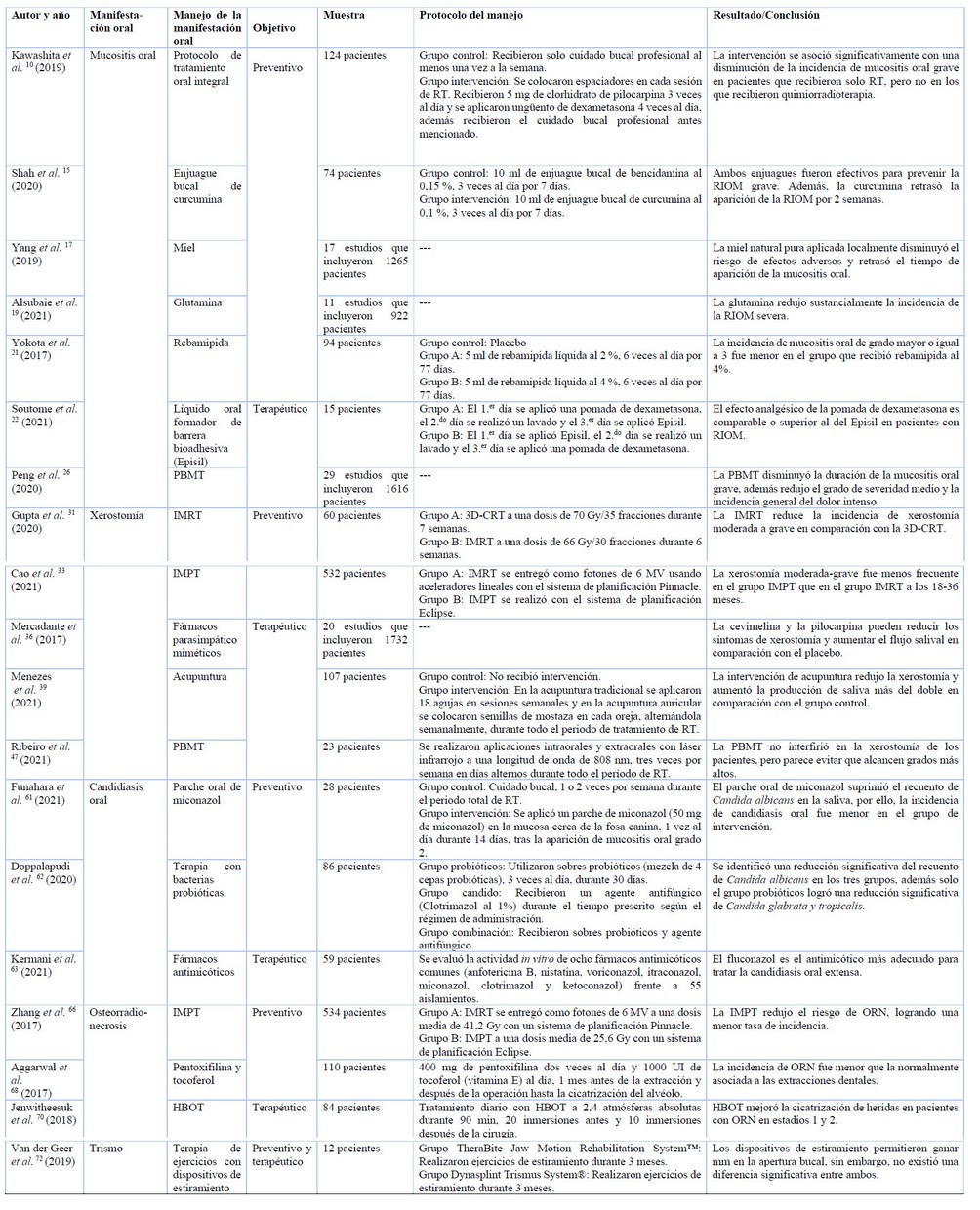
RT: radioterapia, RIOM: mucositis oral inducida por radioterapia, PBMT: terapia de fotobiomodulación, IMRT: radioterapia de intensidad modulada, 3D-CRT: radioterapia convencional tridimensional, IMPT: terapia de protones de intensidad modulada, ORN: osteorradionecrosis, HBOT: oxigenoterapia hiperbárica. (Fuente: creación propia.)
Table 1. Estudios sobre el manejo de las manifestaciones orales inducidas por radioterapia de cabeza y cuello.
Mucositis oral
La mucositis inducida por radioterapia (RIOM, por sus siglas en inglés) puede involucrar a cualquier persona expuesta a radiación. Su primer signo clínico es el eritema, que aparece en dosis de radiación de aproximadamente 10 Gy, progresando hasta una ulceración cuando las dosis acumulativas son mayores 17,18. Está acompañada de un espectro de manifestaciones clínicas que incluyen dolor, odinofagia, reducción de la ingesta oral e infecciones secundarias 19. Es uno de los efectos agudos y determinísticos más frecuentes en pacientes irradiados por CCC, ocurriendo en casi la totalidad de ellos, aproximadamente entre el 85% y 100% 7,10,20,21.
Manejo preventivo para la mucositis oral
Contar con un protocolo de tratamiento oral integral que incluya no solo la evaluación constante de la cavidad oral, sino también la disminución de factores de riesgo predisponentes resulta fundamental para la prevención de la RIOM. Kawashita et al. 18 aplicaron un protocolo de atención que consistía en colocar espaciadores (dispositivos intraorales de 3-5 mm de diámetro que cubren la dentición completa) para evitar la radiación dispersa durante la radioterapia, tomar clorhidrato de pilocarpina para disminuir la sensación de sequedad oral, aplicar una pomada de dexametasona sobre áreas con enrojecimiento o formación de pseudomembranas y recibir cuidado bucal profesional al menos una vez a la semana; encontraron que dicha intervención se asoció significativamente con una disminución de la incidencia de mucositis oral grave en pacientes que recibían solo radioterapia. Adicionalmente, el estudio de Mallick et al. 19 recomendó usar un cepillo de cerdas suaves y evitar el calor, la comida picante, el alcohol y el tabaquismo.
Se han realizado varios estudios acerca de agentes tópicos, principalmente en presentación de enjuagues bucales, utilizados con fines preventivos para la RIOM 18,22-24.
La bencidamina es un agente con propiedades antiinflamatorias, analgésicas y antimicrobianas que tiene fuerte respaldo en la prevención de la RIOM en pacientes que reciben dosis moderadas de radioterapia 22,23. Sin embargo, tiene poco efecto cuando la dosis de radiación es igual o mayor a 50 Gy y cuando, conjuntamente, se aplica quimioterapia 18.
La curcumina, un agente herbal preventivo con acciones antiinflamatorias, antineoplásicas, analgésicas, antibacterianas y antioxidantes ha mostrado mejores resultados en la prevención de la RIOM 23,24. Shah et al. 23 compararon los efectos del enjuague bucal de curcumina al 0,1% y el de bencidamina al 0,15% y encontraron que, si bien ambos no evitaron la aparición de la RIOM, el enjuague de curcumina logró un mayor efecto en retardar su aparición.
El carácter cicatrizante y antimicrobiano de la miel, además de su fácil accesibilidad y su bajo costo hacen que sea considerado un producto prometedor para prevenir la RIOM 24. Un estudio encontró que la miel como terapia adyuvante de primera línea es efectiva y segura para pacientes con RIOM moderada-severa, especialmente si se aplica miel local natural pura 25.
La glutamina es un nutriente utilizado para aumentar la proliferación celular, por ende, su deficiencia podría afectar negativamente la función de los tejidos del huésped 26. Un metaanálisis señaló que, si bien la glutamina no logró una diferencia significativa en la incidencia de mucositis oral en comparación con el grupo control, redujo sustancialmente la gravedad de la RIOM 27. Davy & Heathcote 20 evaluaron la eficacia de tres intervenciones de bajo costo para mitigar la RIOM y concluyeron que la glutamina oral era la única recomendada para dicho fin.
La rebamipida es un agente mucoprotector que mejora la preservación de las células epiteliales existentes y promueve el reemplazo de tejido perdido 28. Chaitanya et al. 28 determinaron que las gárgaras con rebamipida son eficaces para aplazar la aparición de mucositis oral, así como para reducir su gravedad. Otro estudio encontró similares resultados y además señaló que, según los perfiles de eficacia y seguridad, la dosis óptima de rebamipida líquida es al 4% 29.
Si bien los agentes preventivos no evitan por completo la aparición de la RIOM, pueden disminuir su gravedad o retrasar su aparición. Sin embargo, hasta la actualidad no existe agente con una total eficacia.
Manejo terapéutico para la mucositis oral
El tratamiento de la RIOM es en gran parte sintomático, basado en el control del dolor y de la infección oral coexistente 10. Pueden utilizarse agentes tópicos o sistémicos, los cuales están disponibles en diversas presentaciones. Un estudio realizado en pacientes con RIOM comparó el efecto de un líquido oral (Episil), formador de barrera cristalina bioadhesiva superficial que protege a la mucosa, con la pomada de dexametasona para mitigar el dolor relacionado a la mucositis oral y encontró que el Episil alivió el dolor en un 71,4% y la pomada de dexametasona en un 85,7% de los pacientes 30. Rasic et al. 31 administraron localmente un spray compuesto por lisozima, cetilpiridinio y lidocaína en pacientes con RIOM y encontraron que fue eficaz al disminuir los signos de inflamación y la intensidad del dolor al comer y hablar.
La terapia con láser de baja potencia o fotobiomodulación (PBMT, por sus siglas en inglés) es una de las más efectivas en el tratamiento de la RIOM ya que al poder penetrar en los tejidos blandos tiene efectos cicatrizantes y analgésicos, agilizando el proceso de curación de dicha manifestación 32,33. Un metaanálisis encontró que la PBMT terapéutica disminuyó significativamente la duración de la mucositis oral grave, además redujo el grado de severidad medio y la incidencia general del dolor intenso 34. Sin embargo, la implementación de esta intervención en un servicio de atención médica puede incurrir en costos muy altos debido al uso de equipos y a la capacitación del personal 20.
Xerostomía
La xerostomía es definida como la sensación subjetiva de boca seca y es una de las complicaciones más frecuentes, reportándose en un 81-100% de los pacientes durante y después del curso de radioterapia 35. Si bien esta se correlaciona con la tasa de secreción salival reducida conocida como hiposalivación, ambos fenómenos son independientes 36,37. El daño de las glándulas salivales es generalmente irreversible a dosis superiores a 50 Gy, por ende, puede ser considerado un efecto determinístico 38. Existen tres enfoques terapéuticos para su tratamiento: prevención, estimulación y tratamiento sintomático 39.
Manejo preventivo para la xerostomía
La radioterapia de intensidad modulada (IMRT, por sus siglas en inglés) representa una forma avanzada de radioterapia basada en haces de fotones que permite administrar dosis de radiación más altas y precisas al tumor, mientras se reduce considerablemente la irradiación a los tejidos normales circundantes, por consiguiente, tiene un alto potencial para preservar la función de las glándulas salivales 12,40. Dos estudios clínicos han encontrado que la IMRT proporciona una reducción significativa en la incidencia de xerostomía, en comparación con la radioterapia conformada tridimensional 41,42.
La terapia de protones de intensidad modulada (IMPT, por sus siglas en inglés) proporciona una mejor distribución de la dosis que la radioterapia basada en fotones, gracias a que los protones tienen mejores propiedades físicas y radiobiológicas, depositando alta energía en el tumor y casi ninguna en los tejidos normales 43. Un estudio realizado en pacientes con cáncer de orofaringe determinó que, 18 a 36 meses después del tratamiento, la xerostomía moderada-grave fue menos frecuente en el grupo que recibió IMPT que en el que recibió IMRT 44.
La amifostina es un agente citoprotector que puede reducir la incidencia de xerostomía, gracias a que se acumula en las glándulas salivales y elimina los radicales libres derivados del oxígeno 12,45. Riley et al. 45 evaluaron la eficacia de varias intervenciones farmacológicas en la prevención de la disfunción glandular después de radioterapia por CCC y concluyeron que a pesar de la existencia de estudios que demuestran los beneficios de la amifostina, su uso se debe sopesar debido a su alto costo y la existencia de efectos adversos como vómitos, hipotensión, náuseas y respuesta alérgica. (Figura 1).
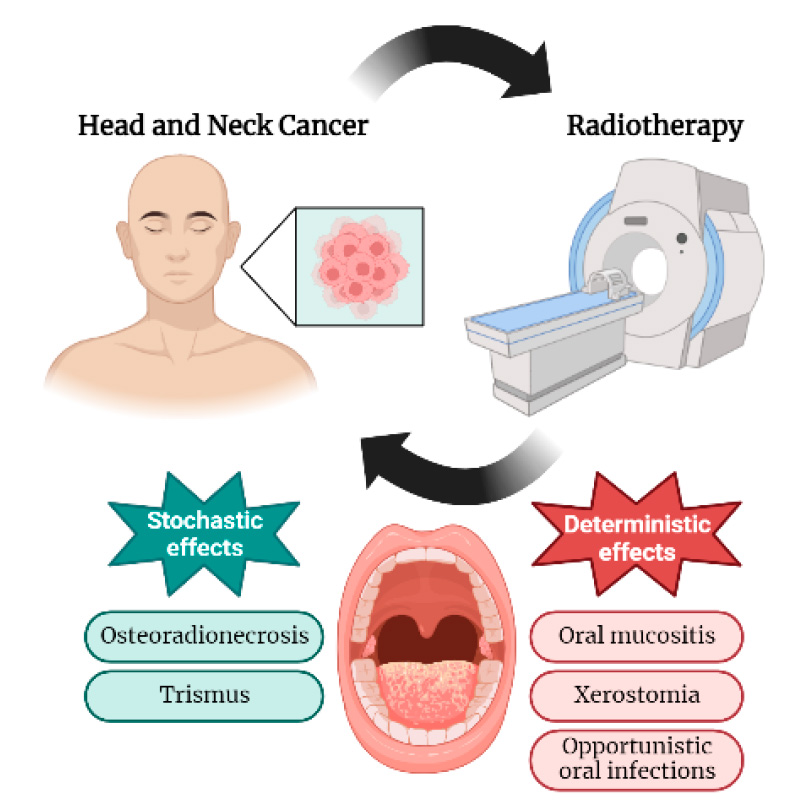
Figura 2. Intervención odontológica para reducir
la incidencia y severidad de las manifestaciones orales. Imagen creada con
BioRender (https://biorender.com/).
Manejo terapéutico para la xerostomía
Cuando la capacidad secretora residual de las glándulas salivales aún está presente, puede ser apropiada la estimulación de la secreción salival 46. Entre las opciones reportadas en la literatura están los fármacos parasimpaticomiméticos, la acupuntura, la fitoterapia, la estimulación nerviosa y la PBMT 38,45-58.
Los fármacos parasimpaticomiméticos, también denominados fármacos agonistas colinérgicos, tienen la capacidad de aumentar la secreción salival, gracias a que actúan a nivel del sistema nervioso parasimpático. Dos metanálisis concluyeron que este tipo de fármacos como la pilocarpina, el betanecol y la cevimelina deberían representar la primera línea de tratamiento en pacientes con CCC y xerostomía inducida por radioterapia 46,47. Sin embargo, estos sialogogos sistémicos no son totalmente eficaces y pueden generar efectos adversos tales como sudoración, frecuencia urinaria, rinitis, náuseas, astenia y diarrea 45,48.
La acupuntura es una forma de medicina alternativa que consiste en la colocación de agujas en puntos específicos del cuerpo. Se cree que los mecanismos por los cuales aumenta la secreción salival son la estimulación del sistema nervioso parasimpático y simpático a través de la activación neuronal y el aumento del flujo sanguíneo en los acinos glandulares 38. Menezes et al. 50 demostraron que el protocolo de acupuntura tradicional y acupuntura auricular redujo los síntomas de xerostomía y aumentó el volumen y densidad salival. Otros estudios evidenciaron que la acupuntura es superior que el cuidado bucal estándar para aliviar los síntomas de xerostomía inducida por radioterapia, presentando una incidencia muy baja de efectos adversos 38,49.
La fitoterapia es otra forma de medicina alternativa y complementaria que se puede utilizar para aliviar la xerostomía. Aunque se desconoce cuál es exactamente el mecanismo de acción de las plantas medicinales utilizadas con dicho fin, es probable que estimulen el movimiento del fluido transcelular y la secreción en las células acinares secretoras 51. Heydarirad et al. 52 concluyeron que los remedios herbales a base de dos plantas mucilaginosas deben considerarse un tratamiento adecuado para la xerostomía en pacientes irradiados por CCC.
La estimulación nerviosa eléctrica transcutánea (TENS, por sus siglas en inglés) es una técnica no invasiva que transmite corrientes eléctricas sobre la superficie intacta de la piel con el fin de activar los nervios subyacentes. Se ha propuesto como terapia prometedora para la xerostomía ya que logra estimular la función salival 53. Existen dos tipos de TENS: la TENS convencional que consiste en la estimulación local de las glándulas salivales y la TENS similar a la acupuntura que consiste en la estimulación a distancia 53,54. Estudios han demostrado que ambos tipos de TENS son eficaces y seguros para disminuir la xerostomía inducida por radioterapia 55,56.
Es bien sabido el papel de la PBMT en el tratamiento de la RIOM; además, debido a su bajo costo y fácil aplicación, se espera que tenga la misma eficacia en reducir la queja de xerostomía reportada por los pacientes con CCC. Ribeiro et al. 57 concluyeron que la PBMT no interfirió significativamente en la incidencia de xerostomía, pero sí parece evitar que esta complicación se agrave. Otra investigación no encontró diferencias significativas en la xerostomía entre el grupo que recibió la PBMT y el grupo control 58. Por lo tanto, se precisan de más estudios clínicos que confirmen su efectividad.
Otro enfoque terapéutico es el alivio sintomático de la sequedad bucal, para ello existe una gran variedad de productos como chicles sin azúcar, sustitutos salivales, cremas hidratantes y dentífricos 39.
Los sustitutos salivales, también denominados lubricantes orales o saliva artificial, se utilizan como reemplazo de la saliva natural ya que son capaces de imitar sus funciones. Si bien son de aplicación tópica y logran reducir los síntomas de xerostomía, las principales desventajas son que la mayoría de estos no logra proporcionar las funciones antimicrobianas de la saliva normal y sus efectos son de corta duración 12,35,59. Están disponibles comercialmente en forma de aerosoles, geles, enjuagues bucales y dentífricos, además debido a que contienen conservantes y generan efectos adversos, especialmente reacciones alérgicas, no se recomienda tragarlos 60. Algunos estudios recomiendan una utilización simultánea de varios agentes tópicos, por ejemplo, Martín et al. 39 encontraron que el uso por 15 días de pasta dental, enjuague bucal, spray y gel, que contenían aceite de oliva, betaína y xilitol, mejoró significativamente los síntomas de boca seca en pacientes tratados con radioterapia por CCC.
En la actualidad, se cuentan con sustitutos salivales comestibles como la jalea humectante oral, la cual ha demostrado tener una eficacia superior al gel comercial tópico para aliviar los síntomas de xerostomía y los problemas de deglución 60.
Candidiasis oral
Las especies de candida forman parte de la microflora bucal normal por lo que, en condiciones normales, no causan enfermedades; sin embargo, cualquier cambio en el ambiente oral y /o sistémico puede generar un aumento en la colonización e infección de estas especies 61,62. Particularmente, la radioterapia de cabeza y cuello se asocia a la candidiasis oral debido a factores predisponentes locales como la disminución en la cantidad y calidad de saliva y los daños en la mucosa oral y/o factores predisponentes sistémicos como la inmunosupresión 62-65. Es la infección oportunista más frecuente en pacientes que reciben radioterapia por CCC, reportándose en un 25-53% 62,66-68.
Manejo preventivo para la candidiasis oral
La modificación de factores predisponentes puede reducir el número de especies de candida y evitar la infección. Lam-Ubol et al. 69 reportaron que dos sustitutos salivales fueron eficaces en pacientes con xerostomía inducida por radioterapia de cabeza y cuello ya que disminuyeron significativamente el número de especies de candida entre 1 y 2 meses.
La profilaxis con agentes antimicóticos tópicos ha demostrado ser efectiva para evitar la candidiasis oral durante la radioterapia 14,70. Funahara et al. 70 encontraron que la administración de un parche oral de miconazol 14 días después de la aparición de mucositis oral logró reducir el crecimiento de Candida albicans en pacientes irradiados por CCC. Es por ello, que la presencia de algún factor predisponente debería ser un indicador para aplicar una terapia profiláctica.
La terapia con bacterias probióticas también resulta ser una medida prometedora en la prevención de candidiasis oral. Se ha encontrado que las bacterias probióticas han sido efectivas para reducir la Candida albicans y algunas especies de candida no albicans como Candida glabrata y Candida tropicalis 71.
Manejo terapéutico para la candidiasis oral
Los agentes tópicos se recomiendan como tratamiento de primera línea en las formas más leves de candidiasis oral y se pueden encontrar en diversas presentaciones como pastillas, suspensión oral, crema y enjuagues bucales. Por otro lado, los agentes sistémicos se deben utilizar cuando la terapia tópica haya fracasado o cuando la candidiasis oral sea clínicamente grave 14.
Generalmente, los fármacos antimicóticos utilizados en pacientes irradiados por CCC pertenecen a la familia de los azoles o los polienos. Dos estudios han encontrado que la terapia con fluconazol es la más eficaz y segura en estos pacientes 61,72.
Osteorradionecrosis
La osteorradionecrosis se define como el área de hueso expuesto a la radiación que no cicatriza en un periodo de tiempo de 3 a 6 meses 73. Las extracciones dentales, el trauma de la dentadura, la infección dental, la inserción de implantes dentales, entre otros, son los responsables de desencadenar la osteorradionecrosis después de la radioterapia 74. Es una complicación tardía y poco común de la radioterapia en pacientes con CCC, presentándose en ausencia de la neoplasia tratada y con una incidencia de 4-8 % 73,74.
Manejo preventivo para la osteorradionecrosis
La IMPT consiste en la irradiación de energía en tejidos específicos y una disminución de esta en zonas alejadas del punto de irradiación. De este modo, se generan mayores beneficios al proporcionar dosis necesarias para la neoplasia y reducir la exposición de los tejidos sanos, disminuyendo el riesgo de los efectos adversos inducidos por radioterapia como la osteorradionecrosis 75. Un estudio realizado en pacientes con CCC que fueron divididos en un grupo que recibió IMPT y otro grupo que recibió IMRT determinó que se desarrollaron menores casos de osteorradionecrosis en los pacientes que recibieron IMPT 75.
La pentoxifilina y el tocoferol actúan como antioxidantes y su manejo se basa en la teoría de la fibrosis inducida por radiación, la cual es considerada como la causa principal de osteorradionecrosis, según Delanian y Lefaix 74,76. Un estudio realizado en pacientes que recibieron radioterapia por CCC junto a un manejo profiláctico con pentoxifilina y tocoferol antes y después de las extracciones dentales, reportó que solo un paciente desarrolló osteorradionecrosis, evidenciándose una disminución en la incidencia de esta complicación después de las extracciones dentales 74. Otra investigación realizada en pacientes con tratamiento previo de radioterapia por CCC y que recibieron el tratamiento profiláctico con pentoxifilina y tocoferol un mes antes de la extracción dental hasta la cicatrización del alvéolo, evidenció que dos pacientes desarrollaron osteorradionecrosis, reportándose una incidencia menor que la normalmente asociada 77.
Manejo terapéutico para la osteorradionecrosis
La oxigenoterapia hiperbárica (HBOT, por sus siglas en inglés) consiste en la inhalación de oxígeno (O2) al 100% en una cámara con presión atmosférica superior a la del nivel del mar, con el objetivo de redistribuir el oxígeno a los tejidos hipóxicos ya que estimula la proliferación de fibroblastos, aumenta la angiogénesis y posee mecanismos bactericidas y bacteriostáticos para prevenir infecciones 78. Algunos estudios han utilizado la HBOT como medida preventiva y terapéutica para la osteorradionecrosis con resultados prometedores 78. Jenwitheesuk et al. 79 evaluaron la eficacia de la HBOT adyuvante en la osteorradionecrosis, los resultados evidenciaron que mejoró la cicatrización de heridas de pacientes con osteorradionecrosis en estadios 1 y 2 que recibieron tratamiento con HBOT antes y después de las extracciones dentales.
La reconstrucción de tejido libre microvascular se realiza en casos graves de osteorradionecrosis, este procedimiento consiste en la resección quirúrgica del hueso necrótico y sus márgenes para posteriormente realizar la reconstrucción con tejido libre vascularizado. Sin embargo, no existe un consenso acerca de la correcta extensión de escisión, lo que conlleva, muchas veces, a casos de recurrencia 78.
Trismo
El trismo se genera cuando la apertura bucal máxima es menor a 35 mm y puede presentarse en pacientes con CCC con una incidencia entre el 5% y el 38%. Presenta diversas causas como la invasión tumoral de los tejidos masticatorios, la inflamación de la mucosa, las infecciones bucales, y además resultar del tratamiento neoplásico como la radioterapia o la cirugía 80.
Manejo preventivo y terapéutico para el trismo
Para tratar el trismo se indica una variedad de terapias de ejercicio. La terapia de ejercicios con dispositivos de estiramiento como TheraBite y Dynasplint Trismus System permiten aumentar la apertura bucal hasta 14 mm, resultando de gran ayuda para estos pacientes 81. Van der Geer et al. 81 atendieron pacientes con trismo inducido por radioterapia de cabeza y cuello e informaron un aumento de la apertura bucal después de realizar la terapia de ejercicios con los dispositivos de estiramiento TheraBite y Dynasplint Trismus System; además al compararlos, se evidenció que los pacientes que utilizaron el dispositivo TheraBite ganaron 3 mm, mientras que los pacientes que utilizaron Dynasplint Trismus System, 1,5 mm. Otra investigación realizada por Lee et al. 82 demostró que los ejercicios con TheraBite o espátulas de madera antes, durante y después de la radioterapia aliviaron el trismo inducido por radiación en pacientes con CCC en estadios 3 y 4.
CONCLUSIONES
Existen varias alternativas preventivas y terapéuticas para el manejo de las manifestaciones orales inducidas por radioterapia de cabeza y cuello que han resultado ser eficaces y seguras, permitiendo reducir su incidencia y gravedad. Por ello, resulta fundamental la inclusión del odontólogo como parte del equipo multidisciplinario que brinde atención antes, durante y después de la terapia oncológica con la finalidad de mejorar la calidad de vida del paciente.
Contribuciones de autoría: Conceptualización, N.J.M-Ch., K.V.F-J., A.C.C-A. y M.A.M-V.; metodología, M.A.M-V.; investigación, N.J.M-Ch., K.V.F-J. y A.C.C-A.; recursos, N.J.M-Ch., K.V.F-J. y A.C.C-A.; redacción—preparación del borrador original, N.J.M-Ch., K.V.F-J., A.C.C-A. y M.A.M-V.; redacción—revisión y edición, N.J.M-Ch., K.V.F-J., A.C.C-A. y M.A.M-V.; supervisión, M.A.M-V.; administración del proyecto, N.J.M-Ch. Todos los autores han leído y aceptado la versión publicada del manuscrito.
Financiamiento: Esta investigación no recibió financiación externa.
Conflicto de intereses: Los autores declaran no tener conflicto de intereses.
REFERENCIAS
1. Dhull A, Atri R, Dhankhar R, Chauhan A, Kaushal V. Major Risk Factors in Head and Neck Cancer: A Retrospective Analysis of 12-Year Experiences. World J Oncol. 2018;9(3):80-4.
2. Liu Z, Dong L, Zheng Z, Liu S, Gong S, Meng L, et al. Mechanism, Prevention, and Treatment of Radiation-Induced Salivary Gland Injury Related to Oxidative Stress. Antioxidants. 2021;10(11):1666-90.
3. Bray F, Ferlay J, Soerjomataram I, Siegel R, Torre L, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68(6):394-424.
4. Sia J, Szmyd R, Hau E, Gee HE. Molecular Mechanisms of Radiation-Induced Cancer Cell Death: A Primer. Frontiers in Cell and Developmental Biology. 2020;8(41):1-8.
5. Liu Y, Zheng C, Huang Y, He M, Xu WW, Li B. Molecular mechanisms of chemo‐ and radiotherapy resistance and the potential implications for cancer treatment. MedComm (2020). 2021;2(3):315-40.
6. Aldana VG, Saaibi JF, Medina LA. Tumores cerebrales y lesiones encefálicas por radiación ionizante. Rev Colomb Cardiol. 1 de marzo de 2020;27:79-81.
7. Puerta-Ortiz JA, Morales-Aramburo J. Efectos biológicos de las radiaciones ionizantes. Rev Colomb Cardiol. 1 de marzo de 2020;27:61-71.
8. Barba Ramírez L, Ruiz García de Chacón V, Hidalgo Rivas A, Barba Ramírez L, Ruiz García de Chacón V, Hidalgo Rivas A. El uso de rayos X en odontología y la importancia de la justificación de exámenes radiográficos. Avances en Odontoestomatología. agosto de 2020;36(3):131-42.
9. Baujat B, Bourhis J, Blanchard P, Overgaard J, Ang KK, Saunders M, et al. Hyperfractionated or accelerated radiotherapy for head and neck cancer. Cochrane Database of Systematic Reviews [Internet]. 2010 [citado 14 de noviembre de 2022];(12). Disponible en: https://www.cochranelibrary.com/es/cdsr/doi/10.1002/14651858.CD002026.pub2/full/es
10. Conceição T, Sanches A, Freire T, Martins G, Marques M, Dantas J. Acute Oral Manifestations in Patients Submitted to Radiotherapy in the Head and Neck Region: Literature Narrative Review. J Health Sci. 2021;23(2):92-8.
11. Coelho L, Silva C, Pedra R, Rosado L, Verner F, Aquino S. Probability of oral complications of radiotherapy and chemotherapy for head and neck cancer. Gen Dent. 2021;69(4):70-4.
12. Jaguar G, Prado J, Campanhã D, Alves F. Clinical features and preventive therapies of radiation-induced xerostomia in head and neck cancer patient: a literature review. Appl Cancer Res. 2017;37(1):31-8.
13. Minicucci EM, da Silva GN, Salvadori DMF. Relationship between head and neck cancer therapy and some genetic endpoints. World J Clin Oncol. 10 de mayo de 2014;5(2):93-102.
14. Sroussi H, Epstein J, Bensadoun R, Saunders D, Lalla R, Migliorati C, et al. Common oral complications of head and neck cancer radiation therapy: mucositis, infections, saliva change, fibrosis, sensory dysfunctions, dental caries, periodontal disease, and osteoradionecrosis. Cancer Med. 2017;6(12):2918-31.
15. Silva E, Oliveira G, Cardoso A, Ferreira I, Brazão M, Guimarães D. Evaluation of Quality of Life and Oral Changes of Patients in Head and Neck Radiotherapy: Observational Study. J Cancer Ther. 2021;12(11):641-53.
16. Nascimento E, Ferreira I, Lajolo P, Paiva C, Paiva Y, Graças G. Health-related quality of life became worse in short-term during treatment in head and neck cancer patients: a prospective study. Health Qual Life Outcomes. 2020;18(1):307-19.
17. Moslemi D, Nokhandani A, Otaghsaraei M, Moghadamnia Y, Kazemi S, Moghadamnia A. Management of chemo/radiation-induced oral mucositis in patients with head and neck cancer: A review of the current literature. Radiother Oncol. 2016;120(1):13-20.
18. Kawashita Y, Koyama Y, Kurita H, Otsuru M, Ota Y, Okura M, et al. effectiveness of a comprehensive oral management protocol for the prevention of severe oral mucositis in patients receiving radiotherapy with or without chemotherapy for oral cancer: a multicentre, phase II, randomized controlled trial. Int J Oral Maxillofac Surg. 2019;48(7):857-64.
19. Mallick S, Benson R, Rath G. Radiation induced oral mucositis: a review of current literature on prevention and management. Eur Arch Otorhinolaryngol. 2016;273(9):2285-93.
20. Davy C, Heathcote S. A systematic review of interventions to mitigate radiotherapy-induced oral mucositis in head and neck cancer patients. Support Care Cancer. 2021;29(4):2187-202.
21. Musha A, Hirai C, Kitada Y, Tsunoda A, Shimada H, Kubo N, et al. Relationship between oral mucositis and the oral bacterial count in patients with head and neck cancer undergoing carbon ion radiotherapy: A prospective study. Radiother Oncol. 2021;167:65-71.
22. Daugėlaitė G, Užkuraitytė K, Jagelavičienė E, Filipauskas A. Prevention and Treatment of Chemotherapy and Radiotherapy Induced Oral Mucositis. Medicina (Kaunas). 2019;55(2):25-38.
23. Shah S, Rath H, Sharma G, Senapati S, Mishra E. Effectiveness of curcumin mouthwash on radiation-induced oral mucositis among head and neck cancer patients: A triple-blind, pilot randomised controlled trial. Indian J Dent Res. 2020;31(5):718-27.
24. Yarom N, Hovan A, Bossi P, A A, Sb J, M G, et al. Systematic review of natural and miscellaneous agents, for the management of oral mucositis in cancer patients and clinical practice guidelines - part 2: honey, herbal compounds, saliva stimulants, probiotics, and miscellaneous agents. Supportive care in cancer : official journal of the Multinational Association of Supportive Care in Cancer [Internet]. mayo de 2020 [citado 14 de noviembre de 2022];28(5). Disponible en: https://pubmed.ncbi.nlm.nih.gov/32056010/
25. Yang C, Gong G, Jin E, Han X, Zhuo Y, Yang S, et al. Topical application of honey in the management of chemo/radiotherapy-induced oral mucositis: A systematic review and network meta-analysis. Int J Nurs Stud. enero de 2019;89:80-7.
26. Yarom N, Hovan A, Bossi P, Ariyawardana A, Jensen S, Gobbo M, et al. Systematic review of natural and miscellaneous agents for the management of oral mucositis in cancer patients and clinical practice guidelines—part 1: vitamins, minerals, and nutritional supplements. Support Care Cancer. 2019;27(10):3997-4010.
27. Alsubaie H, Alsini A, Alsubaie K, Abu-Zaid A, Alzahrani F, Sayed S, et al. Glutamine for prevention and alleviation of radiation-induced oral mucositis in patients with head and neck squamous cell cancer: Systematic review and meta-analysis of controlled trials. Head Neck. 2021;43(10):3199-213.
28. Chaitanya B, Pai K, Yathiraj P, Fernandes D, Chhaparwal Y. Rebamipide gargle in preventive management of chemo-radiotherapy induced oral mucositis. Oral Oncol. 2017;72(9):179-82.
29. Yokota T, Ogawa T, Takahashi S, Okami K, Fujii T, Tanaka K, et al. Efficacy and safety of rebamipide liquid for chemoradiotherapy-induced oral mucositis in patients with head and neck cancer: a multicenter, randomized, double-blind, placebo-controlled, parallel-group phase II study. BMC Cancer. 2017;17:314-21.
30. Soutome S, Yanamoto S, Kawashita Y, Yoshimatsu M, Murata M, Kojima Y, et al. Effects of a bioadhesive barrier-forming oral liquid on pain due to radiation-induced oral mucositis in patients with head and neck cancer: A randomized crossover, preliminary study. J Dent Sci. enero de 2021;16(1):96-100.
31. Rasic A, Kapo B, Avdicevic A, Mekic - Abazovic A, Jankovic SM, Lokvancic A. Efficacy and Safety of Lysozyme, Cetylpyridinium and Lidocaine Fixed Combination for Treatment of Chemotherapy- and Radiotherapy-Induced Oral Mucositis: a Pilot Study. Mater Sociomed. 2019;31(3):166-71.
32. Martins A, Nogueira T, Morais M, Oton A, Valadares M, Batista A, et al. Effect of photobiomodulation on the severity of oral mucositis and molecular changes in head and neck cancer patients undergoing radiotherapy: a study protocol for a cost-effectiveness randomized clinical trial. Trials. 2019;20(1):97-106.
33. Pires Marques EC, Piccolo Lopes F, Nascimento IC, Morelli J, Pereira MV, Machado Meiken VM, et al. Photobiomodulation and photodynamic therapy for the treatment of oral mucositis in patients with cancer. Photodiagnosis Photodyn Ther. marzo de 2020;29:101621.
34. Peng J, Shi Y, Wang J, Wang F, Dan H, Xu H, et al. Low-level laser therapy in the prevention and treatment of oral mucositis: a systematic review and meta-analysis. Oral Surg Oral Med Oral Pathol Oral Radiol. 2020;130(4):387-97.
35. Snider J, Paine C. Sticky stuff: xerostomia in patients undergoing head and neck radiotherapy-prevalence, prevention, and palliative care. Ann Palliat Med. 2020;9(3):1340-50.
36. Lima M, Ribeiro L, Albuquerque R, Carvalho A, Silva I, Leão J. Evaluation of the salivary flow of patients undergoing conventional radiotherapy for head and neck cancer. Gen Dent. 2021;69(5):21-5.
37. Schulz R, Bonzanini L, Ortigara G, Soldera E, Danesi C, Antoniazzi R, et al. Prevalence of hyposalivation and associated factors in survivors of head and neck cancer treated with radiotherapy. J Appl Oral Sci. 2021;29:20200854.
38. Garcia M, Meng Z, Rosenthal D, Shen Y, Chambers M, Yang P, et al. Effect of True and Sham Acupuncture on Radiation-Induced Xerostomia Among Patients With Head and Neck Cancer. JAMA Netw Open. 2019;2(12):1916910.
39. Martín M, Marín A, López M, Liñán O, Alvarenga F, Büchser D, et al. Products based on olive oil, betaine, and xylitol in the post-radiotherapy xerostomia. Rep Pract Oncol Radiother. 2017;22(1):71-6.
40. Jensen S, Vissink A, Limesand K, Reyland M. Salivary Gland Hypofunction and Xerostomia in Head and Neck Radiation Patients. J Natl Cancer Inst Monogr. 2019;2019(53):016.
41. Pan X, Chen K, Huang S, Jiang Y, Ma J, Liang Z, et al. Comparison of the efficacy between intensity-modulated radiotherapy and two-dimensional conventional radiotherapy in stage II nasopharyngeal carcinoma. Oncotarget. 2017;8(44):78096-104.
42. Gupta T, Sinha S, Ghosh S, Budrukkar A, Mummudi N, Swain M, et al. Intensity-modulated radiation therapy versus three-dimensional conformal radiotherapy in head and neck squamous cell carcinoma: long-term and mature outcomes of a prospective randomized trial. Radiat Oncol. 2020;15(1):218-26.
43. Yasuda K, Minatogawa H, Dekura Y, Takao S, Tamura M, Tsushima N, et al. Analysis of acute-phase toxicities of intensity-modulated proton therapy using a model-based approach in pharyngeal cancer patients. J Radiat Res. 2021;62(2):329-37.
44. Cao J, Zhang X, Jiang B, Chen J, Wang X, Wang L, et al. Intensity-modulated proton therapy for oropharyngeal cancer reduces rates of late xerostomia. Radiother Oncol. 2021;160:32-9.
45. Riley P, Glenny A, Hua F, Worthington H. Pharmacological interventions for preventing dry mouth and salivary gland dysfunction following radiotherapy. Cochrane Database Syst Rev. 2017;7(7):012744.
46. Mercadante V, Al Hamad A, Lodi G, Porter S, Fedele S. Interventions for managing radiotherapy-induced xerostomia and hyposalivation: A systematic review and meta-analysis. Oral Oncol. 2017;66:64-74.
47. Johns D. Radiotherapy related xerostomia in head and neck oncology: A systematic review. Ann Oncol. 2017;28(5):390-1.
48. Cheng C, Xu H, Liu L, Wang R, Liu Y, Li J, et al. Efficacy and safety of pilocarpine for radiation-induced xerostomia in patients with head and neck cancer: A systematic review and meta-analysis. J Am Dent Assoc. 2016;147(4):236-43.
49. Ni X, Tian T, Chen D, Liu L, Li X, Li F, et al. Acupuncture for Radiation-Induced Xerostomia in Cancer Patients: A Systematic Review and Meta-Analysis. Integr Cancer Ther. 2020;19:1-14.
50. Menezes A, Sanches G, Gomes E, Soares R, Durães C, Fonseca L, et al. The combination of traditional and auricular acupuncture to prevent xerostomia and anxiety in irradiated patients with HNSCC: a preventive, parallel, single-blind, 2-arm controlled study. Oral Surg Oral Med Oral Pathol Oral Radiol. 2021;131(6):675-83.
51. Nik W, Lim R, Chan S, Lai N, Liew A. A systematic review on Chinese herbal treatment for radiotherapy-induced xerostomia in head and neck cancer patients. Complement Ther Clin Pract. 2018;30:6-13.
52. Heydarirad G, Rezaeizadeh H, Choopani R, Mosavat S, Ameri A. Efficacy of a traditional Persian medicine preparation for radiation-induced xerostomia: a randomized, open-label, active-controlled trial. J Integr Med. 2017;15(3):201-8.
53. Salimi F, Saavedra F, Andrews B, FitzGerald J, Winter S. Trans-cutaneous electrical nerve stimulation to treat dry mouth (xerostomia) following radiotherapy for head and neck cancer. A systematic review. Ann Med Surg. 2021;63:102146.
54. Tulek A, Mulic A, Hogset M, Utheim T, Sehic A. Therapeutic Strategies for Dry Mouth Management with Emphasis on Electrostimulation as a Treatment Option. Int J Dent. 2021;2021:1-21.
55. Iovoli A, Ostrowski A, Rivers C, Hermann G, Groman A, Miller A, et al. Two- Versus Four-Times Weekly Acupuncture-Like Transcutaneous Electrical Nerve Stimulation for Treatment of Radiation-Induced Xerostomia: A Pilot Study. J Altern Complement Med. 2020;26(4):323-8.
56. Paim E, Berbert M, Zanella V, Macagnan F. Electrical stimulation in the treatment of radiotherapy-induced hyposalivationElectrical stimulation in the treatment of radiotherapy-induced hyposalivation. CoDAS. 2019;31(4):2018176.
57. Ribeiro L, Lima M, Carvalho A, Albuquerque R, Leão J, Silva I. Evaluation of the salivary function of patients in treatment with radiotherapy for head and neck cancer submitted to photobiomodulation. Med Oral Patol Oral Cir Bucal. 2021;26(1):14-20.
58. Louzeiro G, Cherubini K, Figueiredo M, Salum F. Effect of photobiomodulation on salivary flow and composition, xerostomia and quality of life of patients during head and neck radiotherapy in short term follow-up: A randomized controlled clinical trial. J Photochem Photobiol B. 2020;209:111933.
59. Assery M. Efficacy of Artificial Salivary Substitutes in Treatment of Xerostomia: A Systematic Review. J Pharm Bioallied Sci. 2019;11(1):1-12.
60. Nuchit S, Lam-ubol A, Paemuang W, Talungchit S, Chokchaitam O, Mungkung O ong, et al. Alleviation of dry mouth by saliva substitutes improved swallowing ability and clinical nutritional status of post-radiotherapy head and neck cancer patients: a randomized controlled trial. Support Care Cancer. 2020;28(6):2817-28.
61. Jahanshiri Z, Manifar S, Moosa H, Asghari F, Mahmoodzadeh H, Shams M, et al. Oropharyngeal candidiasis in head and neck cancer patients in Iran: Species identification, antifungal susceptibility and pathogenic characterization. J Mycol Med. 2018;28(2):361-6.
62. Kawashita Y, Funahara M, Yoshimatsu M, Nakao N, Soutome S, Saito T, et al. A retrospective study of factors associated with the development of oral candidiasis in patients receiving radiotherapy for head and neck cancer: Is topical steroid therapy a risk factor for oral candidiasis? Medicine. 2018;97(44):13073.
63. Tarapan S, Matangkasombut O, Trachootham D, Sattabanasuk V, Talungchit S, Paemuang W, et al. Oral Candida colonization in xerostomic postradiotherapy head and neck cancer patients. Oral Dis. 2019;25(7):1798-808.
64. Arrifin A, Heidari E, Burke M, Fenlon M, Banerjee A. The Effect of Radiotherapy for Treatment of Head and Neck Cancer on Oral Flora and Saliva. Oral Health Prev Dent. 2018;16(5):425-9.
65. Almhöjd U, Cevik-Aras H, Karlsson N, Chuncheng J, Almståhl A. Stimulated saliva composition in patients with cancer of the head and neck region. BMC Oral Health. 2021;21(1):509-19.
66. Nishii M, Soutome S, Kawakita A, Yutori H, Iwata E, Akashi M, et al. Factors associated with severe oral mucositis and candidiasis in patients undergoing radiotherapy for oral and oropharyngeal carcinomas: a retrospective multicenter study of 326 patients. Support Care Cancer. 2020;28(3):1069-75.
67. Bispo M, Nascimento D, Borges J, Lima H, Medrado A, Pereira M, et al. Frequência de comorbidades associadas ao tratamento radioterápico de cabeça e pescoço. Rev Ciênc Méd Biol. 2018;17(2):185-9.
68. Chitapanarux I, Wongsrita S, Sripan P, Kongsupapsiri P, Phakoetsuk P, Chachvarat S, et al. An underestimated pitfall of oral candidiasis in head and neck cancer patients undergoing radiotherapy: an observation study. BMC Oral Health. 2021;21(1):353-62.
69. Lam-Ubol A, Matangkasombut O, Trachootham D, Tarapan S, Sattabanasuk V, Talungchit S, et al. Efficacy of gel-based artificial saliva on Candida colonization and saliva properties in xerostomic post-radiotherapy head and neck cancer patients: a randomized controlled trial. Clin Oral Investig. 2021;25(4):1815-27.
70. Funahara R, Soutome S, Funahara M, Tsuda S, Hasegawa T, Umeda M, et al. Effects of a miconazole oral patch on preventing development of oral candidiasis in patients with head and neck cancer undergoing radiotherapy: results of a preliminary study quantifying the prevalence of Candida albicans in saliva. Support Care Cancer. 2021;30(1):907-14.
71. Doppalapudi R, Vundavalli S, Prabhat M. Effect of probiotic bacteria on oral Candida in head- and neck-radiotherapy patients: A randomized clinical trial. J Cancer Res Ther. 2020;16(3):470-7.
72. Kermani F, Sadeghian M, Shokohi T, Hashemi S, Moslemi D, Davodian S, et al. Molecular identification and antifungal susceptibility testing of Candida species isolated from oral lesions in patients with head and neck cancer undergoing radiotherapy. Curr Med Mycol. 2021;7(1):44-50.
73. Kubota H, Miyawaki D, Mukumoto N, Ishihara T, Matsumura M, Hasegawa T, et al. Risk factors for osteoradionecrosis of the jaw in patients with head and neck squamous cell carcinoma. Radiat Oncol. 5 de enero de 2021;16:1.
74. Patel V, Gadiwalla Y, Sassoon I, Sproat C, Kwok J, McGurk M. Prophylactic use of pentoxifylline and tocopherol in patients who require dental extractions after radiotherapy for cancer of the head and neck. Br J Oral Maxillofac Surg. junio de 2016;54(5):547-50.
75. Zhang W, Zhang X, Yang P, Blanchard P, Garden AS, Gunn B, et al. Intensity-modulated proton therapy and osteoradionecrosis in oropharyngeal cancer. Radiother Oncol. junio de 2017;123(3):401-5.
76. Rivero JA, Shamji O, Kolokythas A. Osteoradionecrosis: a review of pathophysiology, prevention and pharmacologic management using pentoxifylline, α-tocopherol, and clodronate. Oral Surg Oral Med Oral Pathol Oral Radiol. noviembre de 2017;124(5):464-71.
77. Aggarwal K, Goutam M, Singh M, Kharat N, Singh V, Vyas S, et al. Prophylactic Use of Pentoxifylline and Tocopherol in Patients Undergoing Dental Extractions Following Radiotherapy for Head and Neck Cancer. Niger J Surg. diciembre de 2017;23(2):130-3.
78. Shokri T, Wang W, Vincent A, Cohn JE, Kadakia S, Ducic Y. Osteoradionecrosis of the Maxilla: Conservative Management and Reconstructive Considerations. Semin Plast Surg. mayo de 2020;34(2):106-13.
79. Jenwitheesuk K, Mahakkanukrauh A, Punjaruk W, Jenwitheesuk K, Chowchuen B, Jinaporntham S, et al. Efficacy of Adjunctive Hyperbaric Oxygen Therapy in Osteoradionecrosis. Biores Open Access. 8 de octubre de 2018;7(1):145-9.
80. Martins CA, Goldenberg DC, Narikawa R, Kowalski LP. Trismus and oral health conditions during diagnosis of malignant oral neoplasms. Braz J Otorhinolaryngol. octubre de 2020;86(5):552-7.
81. van der Geer SJ, Reintsema H, Kamstra JI, Roodenburg JLN, Dijkstra PU. The use of stretching devices for treatment of trismus in head and neck cancer patients: a randomized controlled trial. Support Care Cancer. enero de 2020;28(1):9-11.
82. Lee R, Yeo ST, Rogers SN, Caress AL, Molassiotis A, Ryder D, et al. Randomised feasibility study to compare the use of Therabite® with wooden spatulas to relieve and prevent trismus in patients with cancer of the head and neck. Br J Oral Maxillofac Surg. mayo de 2018;56(4):283-91.
Received: October 23, 2022 / Accepted: January 15, 2023 / Published:15 February 2023
Citation: Mejía-Chuquispuma, NJ.; Flores-Jiménez, KV.; Castro-Auqui, AC.; Mattos-Vela MA. Manejo odontológico de las manifestaciones orales inducidas por radioterapia de cabeza y cuello. Revis Bionatura 2023;8 (1)30. http://dx.doi.org/10.21931/RB/2023.08.01.30
