2023.08.04.7
Files > Volume 8 > Vol 8 no 4 2023
Variabilidad de actividades enzimáticas en suelos arenosos de playas del Municipio Puerto Cabello, Estado Carabobo, Venezuela
Variability of enzymatic activities in sandy soils of beaches of Puerto Cabello Municipality, Carabobo State, Venezuela
Joselin Albujar 1*; Arnaldo Armado 2Jorge Briceño 3; Daniela Avalos 4; Sonia Salazar 5; Marcelo Rojas 6
1 Laboratorio de Investigaciones Bioquímicas, Suelos y Ambiente (LIBSA), Centro de Investigación y Extensión en Ambiente, Biología y Química (AMBIOQUIM), Facultad Experimental de Ciencia y Tecnología (FACyT), Universidad de Carabobo. Venezuela. Campus Académico Bárbula, Naguanagua, Carabobo, Venezuela, [email protected]
2 Laboratorio de Investigaciones Bioquímicas, Suelos y Ambiente (LIBSA), Centro de Investigación y Extensión en Ambiente, Biología y Química (AMBIOQUIM), Facultad Experimental de Ciencia y Tecnología (FACyT), Universidad de Carabobo. Venezuela. Campus Académico Bárbula, Naguanagua, Carabobo, Venezuela, [email protected]
3 Universidad Estatal de Bolívar, Campus Académico “Alpachaca” Av. Ernesto Che Guevara s/n y Av. Gabriel Secaira, Guaranda, Ecuador, [email protected]
4 Universidad Estatal de Bolívar, Campus Académico “Alpachaca” Av. Ernesto Che Guevara s/n y Av. Gabriel Secaira, Guaranda, Ecuador, [email protected]
5 Universidad Estatal de Bolívar, Campus Académico “Alpachaca” Av. Ernesto Che Guevara s/n y Av. Gabriel Secaira, Guaranda, Ecuador, [email protected]
6 Universidad Estatal de Bolívar, Campus Académico “Alpachaca” Av. Ernesto Che Guevara s/n y Av. Gabriel Secaira, Guaranda, Ecuador, [email protected]
*Autor de correspondencia: [email protected]
Available from: http://dx.doi.org/10.21931/RB/2023.08.04.7
RESUMEN
Los ecosistemas costeros reciben impactos negativos por actividades industriales, explotación de especies costeras, actividades turísticas y recreativas, lo que hace necesario evaluar su calidad ambiental. El objetivo de este trabajo fue estudiar la variabilidad de las actividades enzimáticas de catalasa, ureasa y proteasa en suelos arenosos de playas del municipio Puerto Cabello, estado Carabobo para su uso como indicadores de calidad ambiental. Las playas estudiadas fueron El Palito (EP), Waikiki (W) y Playa Blanca (PB). Se establecieron cuatro unidades de muestreo: zona lejana (L), zona cercana (C), zona seca (S), zona húmeda (H), tomando muestras superficiales (s) y sub-superficiales (ss) en época lluviosa y seca. Se determinaron parámetros fisicoquímicos y las actividades enzimáticas de catalasa, ureasa y proteasa. La actividad de catalasa, muestra variabilidad asociada a las zonas evaluadas, pero no se evidencian variaciones estacionales. La actividad de ureasa, refleja una variabilidad con respecto a las zonas de la playa y la fuente contaminante; mientras que la actividad proteasa no muestra variación estacional, pero si respecto a las zonas de la playa y la fuente contaminante. Se evidenció una correlación negativa significativa entre la actividad catalasa y el contenido de arena, retención de humedad, materia orgánica y una correlación positiva entre la actividad de la ureasa y el contenido de materia orgánica. Finalmente, se concluye que las actividades enzimáticas de catalasa, ureasa y proteasa son sensibles ante impactos antropogénicos, por lo que pueden ser usadas como indicadores de calidad en los suelos arenosos evaluados.
Palabras clave: Catalasa; indicadores de calidad de suelo; proteasa; suelos arenosos; ureasa.
ABSTRACT
Coastal ecosystems receive negative impacts from industrial activities, exploitation of coastal species, and tourist and recreational activities, making assessing their environmental quality necessary. This work aimed to study the variability of the enzymatic activities of catalase, urease and protease in sandy beach soils of the Puerto Cabello municipality, Carabobo state, for their use as indicators of environmental quality. The beaches studied were El Palito (EP), Waikiki (W) and Playa Blanca (PB). Four sampling units were established: distant zone (L), near zone (C), dry zone (S), and humid zone (H), taking surface (s) and sub-surface (ss) samples in the rainy and dry seasons. Physicochemical parameters and the enzymatic activities of catalase, urease and protease were determined. The catalase activity shows variability associated with the evaluated areas, but no seasonal variations are evident. The urease activity reflects variability concerning the beach areas and the polluting source. In contrast, the protease activity does not show seasonal variation; it does concerning the beach areas and the polluting source. A significant negative correlation was evidenced between catalase activity and sand content, moisture retention, and organic matter, and a positive correlation between urease activity and organic matter content. Finally, it is concluded that the enzymatic activities of catalase, urease and protease are sensitive to anthropogenic impacts so that they can be used as quality indicators in the evaluated sandy soils.
Keywords: Catalase; soil quality indicators; protease; sandy soils; urease.
INTRODUCCIÓN
En suelos arenosos de ecosistemas costeros se desarrollan diversos procesos relacionados con funciones del suelo distintas al uso agrícola, entre las que podemos mencionar filtrar, regular y transformar sustancias para proteger al ambiente de la contaminación, además de servir como hábitat para las plantas, animales y microorganismos1. Estas zonas reciben, cada vez más, impactos negativos como la contaminación por actividades industriales, explotación de especies costeras, actividades turísticas y recreativas, por lo que es necesario evaluar su calidad ambiental2. En el caso específico del municipio Puerto Cabello, del estado Carabobo, en Venezuela, se encuentran industrias como refinerías cercanas a playas arenosas que impactan de manera negativa, tanto el ecosistema marino, como el terrestre. El incremento de estas actividades pueden modificar los procesos bioquímicos naturales y el funcionamiento de estos ecosistemas, debido a que sus residuos pueden contener gran cantidad de metales y otras sustancias contaminantes que ocasionarían cambios notables en la calidad del sedimento superficial3.
Para evaluar la calidad ambiental del suelo se emplean propiedades físicas, químicas y biológicas que describan los procesos que ocurren en él. Estas son consideradas herramientas de medición que indican si la calidad de un suelo mejora, permanece constante o disminuye4. En este sentido, se considera a las propiedades bioquímicas del suelo indicadores de cambios en los procesos edáficos, debido a su sensibilidad y su relación con la actividad microbiana y los procesos de mineralización de la materia orgánica5. De estos, los parámetros biológicos y bioquímicos tienden a reaccionar de manera rápida y son sensibles a los cambios producidos por su uso, por lo que pueden constituir una señal temprana para estimar la calidad edáfica, incluso antes que las propiedades físicas y químicas. Numerosas investigaciones sugieren el uso de indicadores que reflejen la actividad, la abundancia y la diversidad de los microorganismos del suelo6.
Las enzimas del suelo funcionan como uno de los componentes orgánicos más activos en el suelo, y están involucrados en todos los procesos bioquímicos del suelo7. Las actividades enzimáticas se consideran apropiadas para evaluar la calidad del suelo, porque son sensibles al estrés ambiental8, más que los indicadores físicos y químicos9 y pueden reflejar oportunamente condiciones de recuperación en diferentes ecosistemas del suelo10. La variación en la actividad enzimática está directamente asociada con la dinámica y la concentración poblacional de microorganismos en la capa superior del suelo11. La actividad de las enzimas del suelo impulsa la formación y degradación de la materia orgánica del suelo, ciclo de nutrientes y descomposición de xenobióticos12. Dentro de las más estudiadas se encuentran las deshidrogenasas, catalasas, peroxidasas, β-glucosidasas, ureasas y fosfatasas.
Diversos estudios han mostrado que actividades humanas como el uso de la tierra y la fertilización pueden afectar significativamente las actividades enzimáticas del suelo13-20. Por lo tanto, el conocimiento de las actividades de las enzimas del suelo se puede utilizar para describir cambios en la calidad del suelo debido a la recuperación a largo plazo, comprender mejor el funcionamiento de los ecosistemas del suelo y ayudar a los gobiernos en la evaluación de la calidad del suelo costero recuperado21.
La evaluación de los cambios en las actividades de las enzimas del suelo puede proporcionar una base fundamental no sólo para comprender los procesos que ocurren en el suelo sino también para predecir la respuesta de estos a las condiciones e impactos ambientales22. En esta investigación, se buscó analizar la diversidad en la actividad enzimática de la catalasa, ureasa y proteasa en suelos de tipo arenoso presentes en las playas ubicadas en el municipio Puerto Cabello, en el estado de Carabobo.
Se seleccionaron tres playas para el estudio: El Palito (EP) (10.4809, -68.10923), Waikiki (W) (10.48311, -68.03862) y Playa Blanca (PB) (10.47367, -68.01626), ubicadas en el municipio Puerto Cabello, estado Carabobo (Figura 1). En cada playa se tomaron cuatro unidades de muestreo, dos de acuerdo a su ubicación respecto al foco de contaminación puntual (L, zona lejana; C, zona cercana) y dos unidades en función de las zonas de la playa, en el área correspondiente a la duna, denominada zona seca (S) y en la intermareal, señalada como zona húmeda (H). En cada unidad de muestreo se tomaron 10 submuestras simples superficiales (0-20 cm) y 10 submuestras subsuperficiales (20-40 cm) para obtener las muestras compuestas. El muestreo se realizó en época lluviosa (julio, 2019) y seca (marzo, 2020). El tipo de muestreo fue aleatorio estratificado con un patrón de zig zag. En la tabla 1 se muestran las notaciones empleadas para identificar las unidades de muestreo.
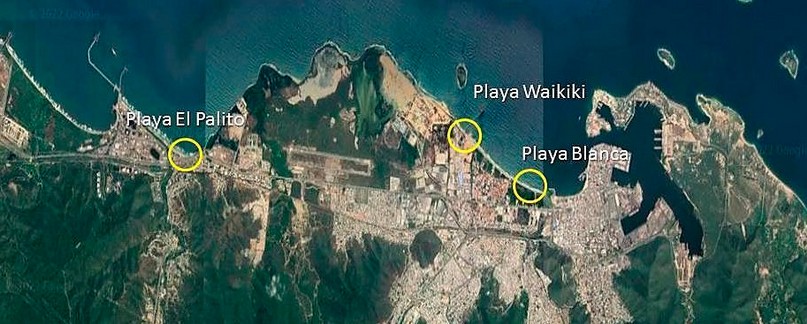
Figura 1. Ubicación de las playas El Palito, Waikiki y Blanca del municipio Puerto Cabello, estado Carabobo. Fuente: Google Maps

Tabla 1. Notación de unidades de muestreo en playa el Palito, playa Waikiki y playa Blanca en el Municipio Puerto
Cabello, Estado Carabobo.
Se tomó una alícuota de 500 g de cada muestra y se almacenaron en bolsas plásticas a 4°C por un período no mayor a un mes para la evaluación de los parámetros bioquímicos. El resto de las muestras fueron secadas al aire a temperatura ambiente para los análisis de parámetros fisicoquímicos. La textura se estimó a través del método descrito por Bouyoucos (1936)23, el pH y la conductividad se determinaron en un extracto acuoso en proporción 1:2 (m/v), la retención y el contenido de humedad se estimaron gravimétricamente. La materia orgánica se determinó mediante el método de pérdidas por ignición, según procedimiento descrito por Cargua et al., (2017)24 y el carbono orgánico total (COT) se determinó mediante oxidación húmeda con H2SO4 concentrado y K2Cr2O7 2N y determinando el Cr (III) espectrofométricamente a 600 nm25. La capacidad de intercambio catiónico se determinó a pH 7, adicionando al suelo una solución de NH4CH3COO 1N, se filtró y se realizaron lavados con CH3CH2OH y luego con NaCl (10%), estos últimos se recolectaron y se les adicionó CH2O (40%). La solución se valoró con NaOH 0,1N26.
Las actividades enzimáticas se determinaron mediante los procedimientos que se resumen a continuación: para catalasa 27, se adicionó una cantidad determinada de H2O2 (0,3% v/v) al suelo, incubando a 20 °C durante 10 min, el H2O2 residual se valoró con KMnO4 0,01M, en medio ácido. Para ureasa28, se adicionó a la muestra de suelo, 0,5 mL de una solución de urea 79,7mM con incubación a 37°C por 2 h, seguido de la adición de solución de KCl-HCl 1M, luego se agitó, centrifugó, y a los sobrenadantes se les agregó agua destilada, solución de salicilato de sodio/hidróxido de sodio y solución de dicloroisocianurato de sodio al 0,1% p/v. Se dejaron en reposo por 30 minutos para el desarrollo de color, y se midió la absorbancia a 690 nm. Para la proteasa29 se le adicionó a las muestras de suelo, solución amortiguadora Tris-HCl (pH 9) y solución calentada de caseinato de sodio al 2% p/v, se incubaron a 50°C por 2 horas, se adicionaron 5 mL de ácido cloracético (ACA) al 20%, se agitó y centrifugó a 3000 rpm durante 15 minutos. Al sobrenadante, se le colocó Na2CO3 (2,8 N), CuSO4 (0,06%), reactivo de Folin-Ciocalteu (1:3), se colocaron por 5 minutos a 37°C y se determinó la absorbancia a 578 nm. Se realizó una curva de calibración utilizando una solución madre de tirosina de 200 μg/mL.
Para el análisis estadístico se utilizó el software libre PAST 3.24. Inicialmente se verificaron los supuestos de normalidad, y se determinó que los datos no cumplían los criterios de datos normales, por lo que se realizó la comparación mediante la prueba Kruskal-Wallis, con un nivel de confianza del 95%. Se realizó la comparación estadística de las actividades enzimáticas con respecto a las tres playas seleccionadas para el estudio a fin de establecer si estos parámetros son sensibles a las características del sitio; con respecto a las zonas de la playa (seca y húmeda); según la profundidad del muestreo (superficial y subsuperficial); proximidad a la fuente de contaminación puntual, en las que sólo se evaluaron a las playas El Palito y Waikiki, puesto que en Playa Blanca no se observó una fuente contaminante puntual. En el caso de la playa El Palito la fuente de contaminación puntual es una refinería y en Waikiki, una empresa de almacenamiento y distribución de productos químicos. También se realizó la comparación de cada actividad enzimática según las estaciones en las que se realizaron la toma de muestras. Adicionalmente se realizó un análisis de correlaciones de Spearman para estudiar las relaciones entre los parámetros seleccionados para el estudio.
RESULTADOS Y DISCUSIÓN
En la tabla 2 se muestran los intervalos obtenidos para los parámetros fisicoquímicos en las unidades de muestreo de las playas evaluadas en las estaciones lluviosa y seca, respectivamente. En los resultados obtenidos se refleja que el porcentaje de arena varía entre 89 y 92 %; mientras que el de arcilla varía entre 8,7 y 10 %. Esto permite clasificar los suelos como Arenosoles30. La variación textural a lo largo de todas las zonas señala una ligera tendencia a disminuir el tamaño de partícula desde la playa (zona seca) hacia la zona intermareal, tal como lo describe Bunicontro et al., (2017)31. Los valores de pH obtenidos varían en un intervalo entre 7,5 y 9; lo cual indica que los suelos evaluados se clasifican como alcalinos. En cuanto a la conductividad, se observó una variación desde 0,2 hasta 8,3 mS. Este parámetro influye en los indicadores biológicos como el carbono microbiano32. Los valores de retención de humedad evidencian variaciones desde 20 a 35 %. La capacidad de retención de agua por el suelo depende de las fuerzas que se desarrollan en este y de factores como el tamaño de las partículas y la porosidad. En este caso, la retención del agua es baja. La materia orgánica mostró una variación de 0,09 a 0,4 %. Este es un parámetro que tiene efectos importantes sobre las propiedades físicas químicas y biológicas del suelo. El carbono orgánico total varió de 0,01 a 1,6 g C/kg ss. Estos resultados son bastante bajos, lo que indica que la disponibilidad de este elemento como nutriente está limitada. La capacidad de intercambio catiónico varió desde 1,2 hasta 11,2 meq/100 gss, valores que se relacionan con el bajo contenido de arcilla y materia orgánica.
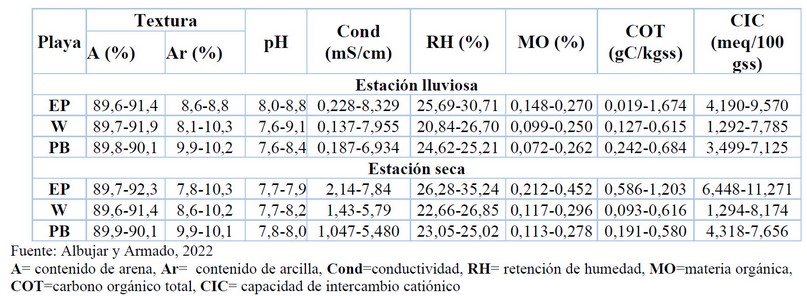
Tabla 2. Parámetros fisicoquímicos en las playas El Palito, Waikiki y playa Blanca del Municipio Puerto Cabello, Estado Carabobo en las estaciones lluviosa (julio 2019) y seca (marzo 2020)
Los resultados de la aplicación de la prueba de Kruskal-Wallis para la comparación de las actividades enzimáticas según diferentes criterios, para las playas en estudio se muestran en la tabla 3.
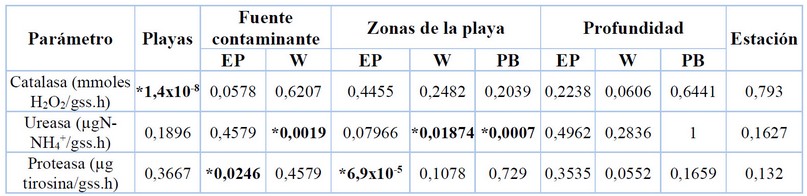
Tabla 3. Comparación de actividades enzimáticas con respecto a las playas evaluadas, la proximidad a la fuente contaminante, zonas de la playa, profundidad del muestreo y estacionalidad.
De acuerdo a los resultados reflejados en la tabla 3, se observó diferencia significativa entre las playas evaluadas para la actividad de la catalasa, lo que evidencia que este parámetro es sensible a las actividades antrópicas que se desarrollan en cada una de las playas seleccionadas, así como también a las características fisicoquímicas y las condiciones hidrodinámicas del medio. En tal sentido, Furtak y Galqzka (2019)33 encontraron diferencias en la actividad de esta enzima con respecto al uso del suelo. Reyes (2019)34, reportó que la actividad catalasa cambia con la fertilidad y actividad microbiana del suelo.
Con respecto a la fuente contaminante, en la playa El Palito, el parámetro que difiere es la actividad de proteasa; mientras que en la playa Waikiki, es la actividad de ureasa. Estas dos enzimas tienen relación con el contenido de carbono y el tipo de materia orgánica. En el caso de la playa El Palito, los valores de actividad proteasa son más altos en la zona lejana al posible foco de contaminación, mientras que en Waikiki, se encuentran en la zona cercana. Esto puede asociarse a que en las zonas mencionadas los compuestos orgánicos son más fáciles de degradar por este tipo de enzimas. En la zona cercana de El Palito, los compuestos orgánicos que se pueden encontrar en mayor proporción pertenecen a las familias de hidrocarburos complejos y de alto peso molecular, lo que puede inferirse por los procesos que se realizan en la industria cercana; mientras que en la zona lejana los compuestos orgánicos provienen en su mayoría de las descargas de aguas residuales, por tanto, son más fácilmente oxidables. En la playa Waikiki, el COT es mayor en la zona cercana, por lo que es de esperarse que en esta zona la actividad proteasa sea mayor. Esto puede explicar las diferencias observadas para la actividad ureasa, donde diversos autores han reportado la dependencia del tipo de materia orgánica con la actividad de esta enzima 34-35.
Para las zonas de playa se observan diferencias significativas en la actividad de la enzima proteasa en la playa El Palito. En playa Waikiki y playa Blanca, la diferencia se refleja en la actividad de la ureasa. Tanto la proteasa como la ureasa han mostrado dependencia con el contenido de carbono orgánico en el suelo y este parámetro tiende a disminuir en dirección hacia el mar36. En las zonas secas y húmedas de las playas se observa también una variación en la distribución del tamaño de grano. En arenas finas hay mayor superficie que impulsa el desarrollo de hábitats para las poblaciones microbianas37. Esto permite explicar las diferencias observadas en estos parámetros con respecto a las zonas de las playas.
Con respecto a la profundidad del muestreo, no se observaron diferencias significativas entre los parámetros evaluados; en tal sentido, es posible inferir que no tienen una variación significativa a través de los perfiles del suelo de los sistemas evaluados. Tomando en cuenta lo descrito, se puede establecer que las actividades de las enzimas evaluadas son sensibles a las actividades antrópicas que generan impacto ambiental, así como a las características físicas y químicas de los suelos de las playas arenosas evaluadas.
En la figura 2 se muestra el comportamiento obtenido para la actividad de catalasa, donde se evidencia variabilidad asociada a las zonas evaluadas, pero no variaciones estacionales. Está reportado que actividades enzimáticas como la catalasa están controladas principalmente por factores geológicos específicos e influenciadas por variaciones en las características innatas del suelo como textura y mineralogía 38.
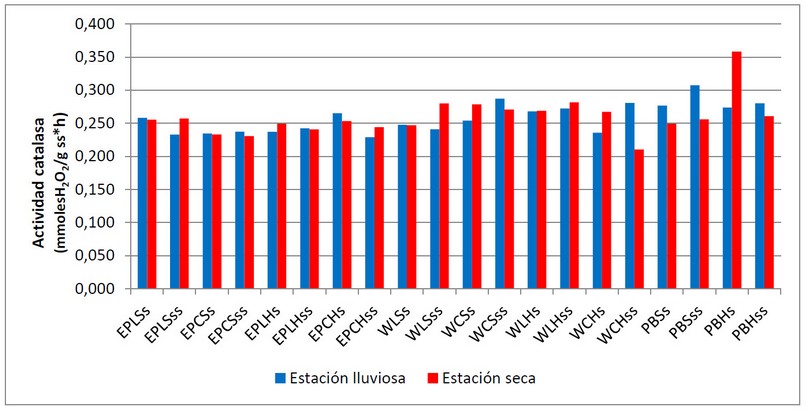
Figura 2. Variación de la actividad enzimática de catalasa en las unidades de muestreo de las playas El Palito, Waikiki y Playa Blanca en las estaciones lluviosa (julio 2019) y seca (marzo 2020).
Los valores más altos de la actividad enzimática de la catalasa se observan en playa Blanca, donde la afluencia de personas, realizando actividades variadas en el suelo, es mayor con respecto a las otras zonas de estudio. Esto puede generar un impacto en el estado físico del suelo lo que tiene repercusiones en sus propiedades fisicoquímicas y biológicas. Vallejo et al., (2018)18, establecen que el estado físico del suelo tiene un efecto potencial en la densidad, estructura, composición y actividad de la comunidad microbiana, lo que ha sido evaluado en diferentes tipos de ecosistemas con diferentes grados de intervención antrópica y condiciones climáticas. En tal sentido, Velez (2019)39 señala que los organismos que habitan la zona litoral se ven afectados por el pisoteo, ya que la presión humana ejerce compactación y resuspende el sedimento. En la zona intermareal, las comunidades son vulnerables a condiciones de estrés, incluso a niveles de actividad antrópica bajos, particularmente los que se ubican en las capas superficiales del suelo. Estos factores pueden tener influencia directa en el aumento leve de la actividad de la catalasa, que es una enzima asociada con situaciones de estrés ambiental.
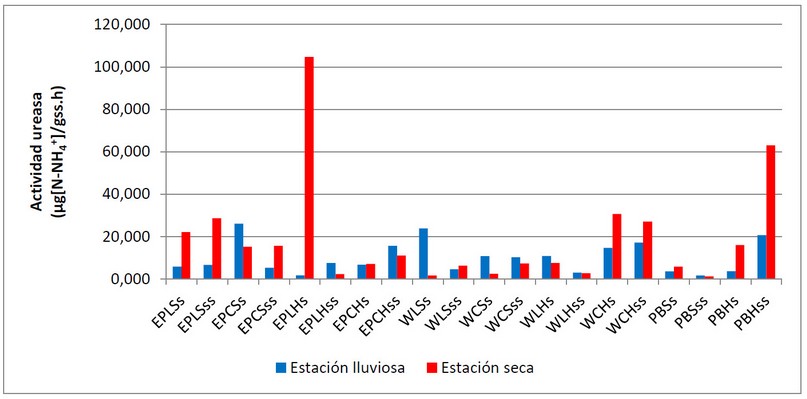
Figura 3. Variación de la actividad enzimática de ureasa en las unidades de muestreo de las playas El Palito, Waikiki y Playa Blanca en las estaciones lluviosa (julio 2019) y seca (marzo 2020).
En la figura 3 se muestra el comportamiento de la actividad enzimática de la ureasa en las unidades de muestreo seleccionadas para el estudio. Se refleja una variabilidad con respecto a las zonas de la playa y la fuente contaminante; al igual que la catalasa no se observa una variación con la estacionalidad. Diversos autores han reportado una correlación positiva entre la actividad ureasa con el contenido y tipo de materia orgánica, carbono orgánico del suelo y contenido de agua 40,21,33-34, propiedades que tienen valores bajos en los suelos arenosos; por lo que se esperaría que la actividad de esta enzima sea baja en los suelos evaluados. Se observa un valor alto en la unidad de muestreo correspondiente a la playa El Palito, zona lejana al posible foco contaminante, zona intermareal superficial, con respecto a las otras unidades evaluadas. En esta zona, existe un punto de descarga de aguas residuales, provenientes de los locales comerciales de la zona que aportan materia orgánica nitrogenada, lo que incrementa la actividad de la ureasa.
Se observaron incrementos de este parámetro en las zonas lejana seca de playa El Palito y en la cercana húmeda de Playa Waikiki en la estación seca. En estas zonas se evidenció también un incremento de la materia orgánica con respecto a las otras unidades de muestreo, lo que permite inferir que estos parámetros podrían estar relacionados, en este tipo de suelos. Adicionalmente, en la estación seca en el momento de la toma de muestra, se observó la presencia de la especie Carabela Portuguesa (Physalia physalis) en las zonas estudiadas41; una especie que genera toxinas compuestas por catecolaminas, aminas vasoactivas (histamina, serotoninas) bradicininas, colagenasas, hialuronidasas, proteasas, fosfolipasas, fibrinolisinas, dermatoneurotoxinas, cardiotoxinas, miotoxinas, nefrotoxinas, neurotoxinas y antígenos proteicos42; compuestos orgánicos que contienen grupos nitrogenados que pueden ser degradados por la ureasa, lo que incrementaría los valores de su actividad.
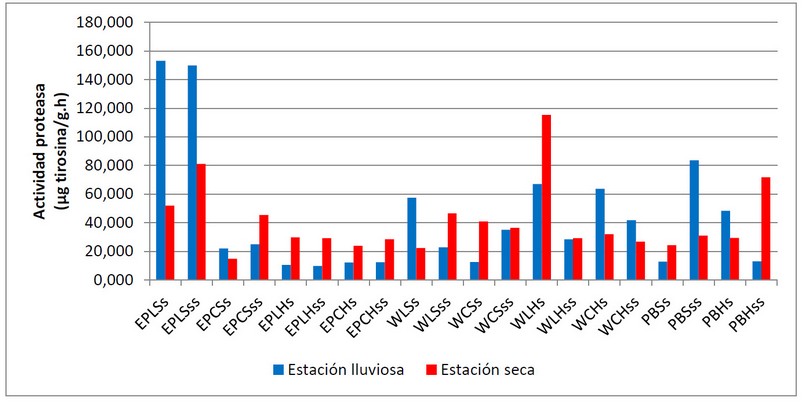
Figura 4. Variación de la actividad enzimática de proteasa en las unidades de muestreo de las playas El Palito, Waikiki y Playa Blanca en las estaciones lluviosa (julio 2019) y seca (marzo 2020).
En la figura 4 se muestra la variabilidad de la actividad enzimática de la proteasa en las unidades de muestreo seleccionadas. Al igual que para la actividad catalasa y ureasa, la actividad proteasa no muestra variación estacional, pero si respecto a las zonas de la playa y la fuente contaminante. Se observaron los valores más altos en las unidades de muestreo de la playa El Palito, zona lejana seca, para la estación lluviosa. En estas zonas, también se observaron los valores más altos de carbono orgánico total (COT); esto coincide con lo planteado por Madejón et al. (2007)40, quienes reportaron una alta dependencia de la funcionalidad de las enzimas del suelo con el contenido de materia orgánica. Resultados similares fueron reportados por Cañizales et al., (2011)43 quienes encontraron una disminución de la actividad de esta enzima a estratos más profundos y lo relacionaron con el contenido de carbono orgánico. Ferreras et al., (2015)44 también reportan incremento de la actividad microbiana como resultado de un aumento de la fracción de carbono fácilmente oxidable, que a su vez, genera una mayor producción de enzimas vinculadas a la degradación de sustratos y liberación de nutrientes.
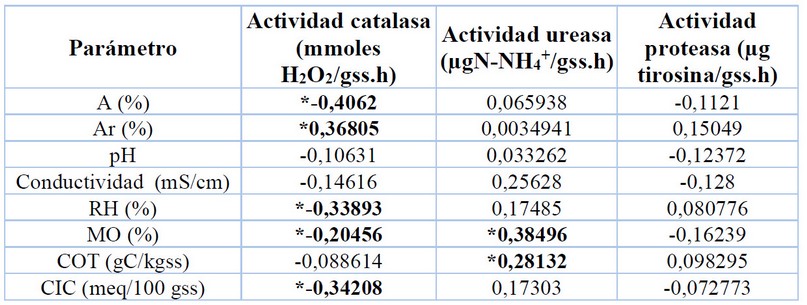
Tabla 4. Coeficientes de correlación de Spearman (p<0,05) para la actividades enzimáticas de la catalasa, ureasa y proteasa con parámetros fisicoquímicos en suelos arenoos de playas del Municipio Puerto Cabello, Estado Carabobo.
Con el fin de estudiar las relaciones entre las variables analizadas se realizó un análisis de correlación de Spearman con un 95% de confianza (Tabla 4), donde se evidenció una relación negativa entre la actividad de la catalasa y el contenido de arena, mientras que mostró una positiva con el contenido de arcilla, comportamiento similar al reportado por Avazpoor et al., (2019)45 para otras enzimas. Esto permite suponer que esta enzima puede adsorberse en materiales arcillosos, ya sea en superficies externas o dentro de las redes de capas de silicatos46. La catalasa también muestra una relación negativa significativa con la retención de humedad, contenido de materia orgánica y capacidad de intercambio catiónico. Estos parámetros se relacionan de manera directa con las características texturales de los suelos. La retención de humedad es un parámetro asociado a la capacidad de almacenamiento de agua en el suelo y de acuerdo con los resultados obtenidos, puede sugerirse que se produce un efecto inhibitorio de la actividad enzimática de la catalasa al aumentar el contenido de agua. Con respecto a la materia orgánica, podría suponerse que al aumentar las sustancias coloidales húmicas, disminuye la adsorción de esta enzima en estas sustancias, disminuyendo así su actividad catalítica. Para la CIC, se puede establecer que el aumento de este parámetro implica una mayor disponibilidad de sitios en el complejo de cambio del suelo para el intercambio de especies catiónicas, lo que disminuye la cantidad de sitios disponibles para ser ocupados por la enzima, disminuyendo su actividad. Con respecto a la actividad enzimática de la ureasa, se observó relación positiva significativa con el contenido de materia orgánica y carbono orgánico total. Diversos autores han reportado relaciones similares entre la ureasa y la cantidad y tipo de materia orgánica21,34,20.
CONCLUSIONES
Las actividades enzimáticas de catalasa, ureasa y proteasa presentaron variabilidad asociada a la fuente contaminante y zonas de las playas evaluadas. En las tres actividades enzimáticas no se observaron variaciones estacionales. Los valores más altos de actividades enzimáticas de ureasa y proteasa, se asocian a valores altos de carbono orgánico total; lo que demuestra una dependencia de la funcionalidad de las enzimas del suelo con el contenido de materia orgánica. La actividad de la catalasa se relaciona de manera negativa con el contenido de arena, retención de humedad, contenido de materia orgánica y capacidad de intercambio catiónico; mientras que la actividad enzimática de la ureasa se relacionó de manera positiva con el contenido de materia orgánica y el carbono orgánico total. Se evidenció que las actividades enzimáticas de catalasa, ureasa y proteasa son sensibles ante impactos antropogénicos, por lo que pueden ser usadas como indicadores de calidad en los suelos arenosos evaluados. Estos resultados son importantes porque brindan información sobre las relaciones causa – efecto de los procesos de degradación a los que son sometidos los ecosistemas costeros; en tal sentido la evaluación de las actividades enzimáticas constituye una herramienta para la detección temprana de alteraciones en la calidad del suelo, lo que permitiría aplicar acciones de gestión ambiental de manera oportuna y el desarrollo de métodos de remediación o recuperación de suelos contaminados o impactados basados en propiedades bioquímicas.
AGRADECIMIENTOS
Este trabajo ha sido financiado parcialmente por la Universidad Estatal de Bolívar a través del proyecto “Desarrollo y optimización de métodos analíticos para la extracción y cuantificación de polifenoles en matrices vegetales” (PIV-66-2021).Conflicts of Interest: Los autores declaran no tener conflicto de interés.
REFERENCIAS
1. Hernández, I. (2019). Impacto de actividades antrópicas sobre parámetros microbiológicos y bioquímicos del suelo: tres casos de estudio. Acta Biológica Venezuelica, 39(1): 73-90. Disponible en: https://saber.ucv.ve/ojs/index.php/revista_abv/article/view/19382
2. Albujar, J. y Armado, A. (2022). Actividad microbiológica como indicador de calidad en suelos arenosos de playas del municipio Puerto Cabello, estado Carabobo. Revista Ingeniería UC, 29(2) ,145-155. DOI: https://doi.org/10.54139/revinguc.v29i2.177.
3. Fuentes, M. (2008). Metales pesados Cu, Cr, Ni, Zn, Pb y Cd en los sedimentos del muelle pesquero de Güiria, estado Sucre, Venezuela. Tecnociencia, 10(2): 61-79. Disponible en: https://revistas.up.ac.pa/index.php/tecnociencia/article/view/848.
4. González, H.; González, A.; Atencio, J. y Soto, A. (2021). Evaluación de calidad de suelos plataneros a través de la actividad microbiana en el sur el lago de Maracaibo, estado Zulia, Venezuela. Revista de la Facultad de Agronomía (LUZ), 38:01-25. DOI: https://doi.org/10.47280/RevFacAgron(LUZ).v38.n1.03.
5. De La Portilla, N.; Vaca, R.; Del Águila, P.; Salinas, L.; Yañez, G. y Lugo, J. (2021). Carbono de la biomasa microbiana, respiración basal y cinética del carbono de dos suelos erosionados enmendados con biosólidos. Revista Internacional de Contaminación Ambiental, 37: 443-453. DOI: https://doi.org/10.20937/RICA.53863.
6. Fernández, R.; Frasier, I.; Rorig, M.; Quiroga, A. y Noellemeyer, E. (2018). Evaluación de indicadores biológicos en suelos de la región semiárida pampeana central. Ecología Austral, 28:145-156. DOI: https://doi.org/10.25260/EA.18.28.1.0.555.
7. Li, J.; Pu, L.; Han, M.; Zhu, M.; Zhang, R. y Xiang Y. (2014). Soil salinization research in China: Advances and prospects. Journal of Geographical Sciences, 24 (5):943-960. DOI: https://doi.org/10.1007/s11442-014-1130-2.
8. Gili, P.; Marando, G.; Irisarri, J. y Sagardoy, M. (2004). Actividad biológica y enzimática en suelos afectados por sales del Alto Valle de Río Negro y Neuquén. Revista Argentina de Microbiología, 36(4):187-192. Disponible en: http://www.scielo.org.ar/scielo.php?script=sci_arttext&pid=S0325-75412004000400008.
9. Zhang, X.; Dong, W.; Dai, X.; Schaeffer, S.; Yang, F.; Radosevich, M.; Xu, L.; Liu, X. y Sun, X. (2015). Responses of absolute and specific soil enzyme activities to long term additions of organic and mineral fertilizer. Science of the Total Environment, 536: 59-67. DOI: https://dx.doi.org/10.1016/j.scitotenv.2015.07.043.
10. Araújo, A.; Cesarz, S.; Leite, L.; Borges, C.; Tsai, S. y Eisenhauer, N. (2013). Soil microbial properties and temporal stability in degraded and restored lands of Northeast Brazil. Soil Biology & Biochemistry, 66: 175-181. DOI: https://doi.org/10.1016/j.soilbio.2013.07.013.
11. Monserrat, V. (2020). Desarrollo de indicadores Bioquímicos de Calidad de Suelos del Sudoeste Bonaerense con Enmiendas de Residuos y Efluentes Agroindustriales. AJEA- Actas de Jornadas y Eventos Académicos de UTN. V Jornadas de Intercambio y Difusión de los Resultados de Investigaciones de los Doctorados en Ingeniería. https://doi.org/10.33414/ajea.5.787.2020.
12. Song, Y.; Song, Ch.; Yang, G.; Miao, Y.; Wang, J. y Guo, Y. (2012). Changes in Labile Organic Caron Fractions and Soil Enzyme Activities after Marshland Reclamation and Restoration in the Sanjiang Plain in Northeast China. Environmental Management, 50: 418-426. DOI: https://doi.org/10.1007/s00267-012-9890-x.
13. Ferreras, L.; Toresani, S.; Bonel, B.; Fernández, E.; Bacigaluppo, S.; Faggioli, V. y Beltrán C. (2009). Parámetros químicos y biológicos como indicadores de calidad del suelo en diferentes manejos. Ciencia del Suelo, 27(1): 103-114. Disponible en: http://www.scielo.org.ar/scielo.php?pid=S1850-20672009000100011&script=sci_abstract.
14. García, J.; Kobza.; J.; Soler, P. y Javorekova, S. (2013). Soil Microbial and Enzyme Activities Response to Pollution Near an Aluminium Smelter. CLEAN Soil Air Water, 00(0):1-8. DOI: https://doi.org/10.1002/clen.201200099.
15. Durango, W.; Uribe, L.; Henríquez, C. y Mata, R. (2015). Respiración, biomasa microbiana y actividad fosfatasa del suelo en dos agroecosistemas y un bosque de Turrialba, Costa Rica. Agronomía Costarricense 39(1): 37-46. Disponible en: https://www.scielo.sa.cr/
16. Farrús, E. (2016). Influencia de la fertilización sobre la actividad biológica del suelo. Estudio comparativo de diferentes fuentes de materia orgánica. Tesis Doctoral. Universitat de les Illes Balears. Palma de Mallorca. Disponible en: https://dialnet.unirioja.es/servlet/tesis?codigo=214849.
17. Jin, S.; Li, J.; Chen, J.; Wang, G.; Mayes, M.; Dzantor, K.; Hui, D. y Luo, Y. (2016). Soil extracellular enzyme activities, soil carbon and nitrogen storage under nitrogen fertilization: A meta-analysis. Soil Biology & Biochemistry, 101: 32-43. DOI: http://dx.doi.org/10.1016/.soilbio.2016.07.003.
18. Vallejo, V.; Afanador, L.; Hernández, M. y Parra, D. (2018). Efecto de la implementación de diferentes sistemas agrícolas sobre la calidad del suelo en el municipio de Cachipay, Cundinamarca, Colombia. Bioagro, 30(1), 27-38. Disponible en: https://dialnet.unirioja.es
19. He, L.; Lu, S.; Wang, Ch.; Mu, J.; Zhang Y. y Wang, X. (2021). Changes in soil organic carbon fractions and enzyme activities in response to tillage practices in the Loess Plateau of China. Soil & Tillage Research, 209: 104940. DOI: https://doi.org/10.1016/j.still.2021.104940.
20. Sun, X.; Ye, Y.; Ma, Q.; Guan, Q. y Jones, D. (2021). Variation in enzyme activities involved in carbon and nitrogen cycling in rhizosphere and bulk soil after organic mulching. Rhizosphere, 19. DOI: https://doi.org/10.1016/j.rhisph.2021.100376.
21. Xie, X.; Pu, L.; Wang, Q; Zhu, M.; Xu, Y. y Zhang, M. (2017). Response of soil physicochemical properties and enzyme activities to long – term reclamation of coastal saline soil, Eastern China. Science of the Total Environment, 607-608: 1419-1427. DOI: http://dx.doi.org/10.1016/j.scitotenv.2017.05.185.
22. Cao, R.; Yang, W.; Chang, Ch.; Wang, Z.; Wang, Q.; Li, H. y Tan, B. (2021). Differential seasonal changes in soil enzyme activity along an altitudinal gradient in an alpine-gorge region. Applied Soil Ecology, 166: 104078. DOI: https://doi.org/10.1016/j.apsoil.2021.104078.
23. Bouyoucos, G. (1936). Directions for making mechanical analysis of soils by the hydrometer method, Soil Science, 42 (3): 225-228. DOI: https://doi.org/10.1097/00010694-193609000-00007
24. Cargua, F. Rodríguez, M. Damián, D. Recalde, C.y Santillán, G. (2017). Comparación de dos métodos analíticos para la determinación de carbono orgánico del suelo de bosque andino, parque nacional Sangay-Ecuador, Acta agronómica. Funcionamiento biológico, químico y físico del suelo, 66(39), 408-413, DOI: https://doi.org/10.15446/acag.v66n3.52467.
25. Walinga, I.; Kithome, M.; Novozamsky, I.; Houba, V. y Van der Lee, J. (1992).Spectrophotometric determination of organic carbon in soil. Communications in Soil Science and Plant Analysis, (15-16), 1935-1944. DOI: https://doi.org/1080/00103629209368715.
26. Jaramillo, D. (2002). Introducción a la ciencia del suelo. Universidad Nacional de Colombia. Medellín. Disponible en: https://repositorio.unal.edu.co/
27. Johnson, J. y Temple, K. (1964). Some variables affecting the measurement of “Catalase Activity” in soil. Soil Science Society of America Journal. 28 (2): 207-209. DOI: https://dx.doi.org/10.2136/sssaj1964.03615995002800020024x.
28. Kandeler, E. y Gerber, H. (1988). Short-term assay of urease activity using colorimetric determination of ammonium. Biology and Fertility of Soils, 6: 68-72. DOI: https://doi.org/10.1007/BF00257924
29. Ladd, J. y Butler, J. (1972). Short-term assays of soil proteolytic enzyme activities using proteins and dipeptide derivatives as substrates. Soil Biology and Biochemistry, 4(1): 19-30 https://doi.org/10.1016/0038-0717(72)90038-7.
30. Organización de las Naciones Unidas para la Alimentación y la Agricultura, FAO. (2009). Guía para la descripción de los suelos, Roma, Italia. Disponible en: https://www.fao.org/3/a0541s/a0541s.pdf.
31. Bunicontro, M.; Marcomini, S.; Weiler, N.; López, R. y Quenardelle, S. (2017). Caracterización textural, composicional y análisis de procedencia de los sedimentos de playa del Golfo Nuevo, Provincia de Chubut. Revista de la Asociación Geológica Argentina, 74(2): 207-222. Disponible en: http://ppct.caicyt.gov.ar/index.php/raga/article/view/9104
32. Sánchez, L.; Paolini, J. y Rodríguez, J. (2010). Dinámica de las propiedades del suelo en bosques de Rhizophora mangle L. (Rhizophoraceae) en Isla de Margarita, Venezuela. Revista de Biología Tropical, 58(2): 547-564. Disponible en: https://www.scielo.sa.cr/scielo.php?script=sci_arttext&pid=S0034-77442010000200002.
33. Furtak, K y Galpzka, A. (2019). Enzymatic activity as a popular parameter used to determine the quality of the soil Environment. Polish Journal of Agronomy, 37:22-30. DOI: https://doi.org/10.26114/pja.iung.385.2019.37.04.
34. Reyes, A. (2019). Características de la actividad enzimática y el humus en suelos de Chinampa. Terra Latinoamericana, 37: 339-349. DOI: https://doi.org/10.8940/terra.v37i4.487
35. Liu, L.; Li, D.; Sun, Y.; Zhu, Y.; Li, L.; Ren, Z.; Kong, R.; Jia, P.; Peng, N.; Jing, J.; Ghulam, R.; Rafique, T.; He, J.; Ji, Y. y Wang, X. (2021). Pattern of soil extracellular enzyme activities along a tidal wetland with mosaic vegetation distributions in Chongming Island, China. Journal of Cleaner Production. DOI: https://doi.org/10.1016/j.jclepro.2021.127991
36. Calva, L. y Torres, M. (2011). Textura de sedimentos y carbono orgánico en el sistema costero lagunar Alvarado, Veracruz. Contactos, 81:11-16. Disponible en: https://www.researchgate.net/publication/259604696_Textura_de_sedimentos_y_carbono_organico_en_el_sistema_costero_lagunar_Alvarado_Veracruz.
37. McLachlan, A. y Defeo, O. (2018). The Ecology of Sandy Shores. DOI: https://doi.org/10.1016/B978-0-12-809467-9.00013-8
38. Tan, X.; Xie, B.; Wang, J.; He, W.; Wang, X. y Wei, G. (2014). County-Scale Spatial Distribution of Soil Enzyme Activities and Enzyme Activity Indices in Agricultural Land: Implications for Soil Quality Assessment. The Scientific World Journal. DOI: http://dx.doi.org/10.1155/2014/535768.
39. Velez, J. (2019). Efectos de perturbaciones naturales y antropogénicas sobre las comunidades macrobentónicas en playas arenosas del Cantón San Vicente, Manabí-Ecuador. Tesis de Maestría. Universidad Nacional Agraria La Molina. Perú. Disponible en: http://repositorio.lamolina.edu.pe/handle/20.500.12996/4363.
40. Madejón, E.; Moreno, F.; Murillo, J. y Pelegrín, F. (2007). Laboreo de conservación: efectos a largo plazo sobre el carbono orgánico y propiedades bioquímicas del estrato superficial de un suelo representativo de Andalucía occidental. Tendencias Actuales de la Ciencia del Suelo. Disponible en: http://hdl.handle.net/10261/37678.
41. Rodríguez, P. (2020). Peligroso cardumen de “aguamala” amenaza a playas porteñas. Te Lo Cuento Todo. https://telocuentotodo.com/2020/03/10/peligroso-cardumen-de-aguamala-amenaza-a-playas-portenas.
42. Vera, C.; Kolbach, M.; Zegpi, M.; Vera, F. y Lonza, J. (2004). Picaduras de medusas: actualización. Revista Médica de Chile. 132 (2): 233-241. DOI: http://dx.doi.org/10.4067/S0034-98872004000200014.
43. Cañizales, N.; Tovar, M. y Ruiz, M. (2011). Actividad enzimática en suelos aluviales de los Llanos Centro-Occidentales. Conferencia: XIX Congreso Venezolano de la Ciencia del Suelo. Calabozo, Estado Guárico, Venezuela. Volumen 1. Disponible en: https://www.researchgate.net/publication/
44. Ferreras, L.; Toresani, S.; Faggioli, V. y Galrza, C. (2015). Sensibilidad de indicadores biológicos edáficos en un Argiudol de la Región Pampeana Argentina. Spanish Journal of Soil Science. 5(3): 227-242. DOI: https://doi.org/10.3232/SJSS.2015.V5.N3.04.
45. Avazpoor, Z.; Moradi, M.; Basiri, R.; Mirzaei, J.; Taghizadeh-Mehrjardi, R. y Kerry, R. (2019). Soil enzyme activity variations in riparian forests in relation to plant species and soil depth. Arabian Journal of Geosciences, 12:708. DOI: https://doi.org/10.1007/s12517-019-4910-2.
46. Burns, G. (1982). Enzyme activity in soil: location and a possible role in microbial Ecology. Soil Biology Biochemistry, Vol. 14, pp.: 423-427. DOI: https://doi.org/10.1016/0038-0717(82)90099-2.
Received: 28 September 2023/ Accepted: 15 November 2023 / Published:15 December 2023
Citation. Albujar J; Armado A, Briceño J; Avalos D; Salazar S; Rojas M. Variabilidad de actividades enzimáticas en suelos arenosos de playas del Municipio Puerto Cabello, Estado Carabobo, Venezuela
Revis Bionatura 2023;8 (4) 7. http://dx.doi.org/10.21931/RB/2023.08.04.7
Publisher's Note: Bionatura stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2023 by the authors. Submitted for possible open-access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
