Phage display
Files > Volume 1 > Vol 1 No 1 2016 > Revisiones
Tecnología de presentación sobre fagos filamentosos en la búsqueda de agentes biológicos anti-infectivos
Display technology on filamentous phage in the search for anti-infective biological agents
Available from: http://dx.doi.org/10.21931/RB/2016.01.01.6
Nelson Santiago Vispo1, Frank Camacho2, Maritza Pupo Antúnez3, Roberto Toledo4, Oliberto Sánchez Ramos5
Resumen
Introducción: las causas de la resistencia a antibióticos son complejas. La tecnología de presentación sobre fagos filamentosos (TPFF) ha sido utilizada principalmente para obtener anticuerpos monoclonales (MAbs) y péptidos dirigidos contra dianas de cáncer o enfermedades inflamatorias. Hoy la tecnología se reconoce como una herramienta poderosa para seleccionar nuevos péptidos y anticuerpos que se pueden unir a una amplia gama de antígenos, que van desde células enteras, hasta proteínas y lípidos. En esta revisión, resaltamos artículos que utilizan esta tecnología para descubrir nuevos fármacos en contra de las enfermedades infecciosas, concentrándonos en péptidos y anticuerpos de acción antimicrobianos.
Métodos: se hizo una revisión de la literatura básica y actualizada sobre aspectos generales de la tecnología de presentación sobre fagos filamentosos y la aplicación de la misma en la búsqueda de nuevos péptidos o anticuerpos de uso farmacéutico para combatir las enfermedades infecciosas trasmitidas por bacterias y virus.
Resultados: se muestra información actualizada sobre los temas escogidos, con un enfoque orientador y práctico, dirigido a investigadores en el campo de la biología molecular con vistas a continuar profundizando y aplicando la tecnología de presentación sobre fagos filamentosos, con énfasis especial en las aplicaciones que se han realizado en Cuba.
Conclusiones: los avances en los métodos de selección, producción, y las tecnologías de humanización muestran que la tecnología de presentación sobre fagos filamentosos puede hacer una contribución significativa en la lucha contra patógenos clínicamente importantes.
Resultados: se muestra información actualizada sobre los temas escogidos, con un enfoque orientador y práctico, dirigido a investigadores en el campo de la biología molecular con vistas a continuar profundizando y aplicando la tecnología de presentación sobre fagos filamentosos, con énfasis especial en las aplicaciones que se han realizado en Cuba.
Conclusiones: los avances en los métodos de selección, producción, y las tecnologías de humanización muestran que la tecnología de presentación sobre fagos filamentosos puede hacer una contribución significativa en la lucha contra patógenos clínicamente importantes.
Palabras clave: bacteriófagos; bibliotecas combinatorias; tecnología de presentación sobre fagos filamentosos; selección; enfermedades infecciosas; péptidos; anticuerpos.
Abstract
Introduction: The causes of antibiotic resistance are complex. The phage display technology has been used mainly to produce monoclonal antibodies (MAbs) and peptides directed against cancer or inflammatory disease targets. Today, this technology is recognized as a powerful tool for selecting novel peptides and antibodies that can bind to a wide range of antigens, ranging from whole cells to proteins and lipid targets. In this review, we highlight research that exploits the phage display technology to discover new drugs against infectious diseases, with a focus on antimicrobial peptides and antibodies.
Methods: Basic and recent literature review was made, mainly focused on general aspects of phage display technology and the application in the search of new peptides or antibodies of pharmaceutical use to combat the infectious diseases transmitted by bacteria and virus.
Results: Updated information on the selected topics is shown, with a guiding and practical approach aimed at researchers in the field of molecular biology to continue deepening the technology with special emphasis in the applications that have been developed in Cuba.
Conclusions: Advances in methods of screening, manufacturing, and humanization technologies show that phage display technology can significantly contribute in the fight against clinically important pathogens.
Methods: Basic and recent literature review was made, mainly focused on general aspects of phage display technology and the application in the search of new peptides or antibodies of pharmaceutical use to combat the infectious diseases transmitted by bacteria and virus.
Results: Updated information on the selected topics is shown, with a guiding and practical approach aimed at researchers in the field of molecular biology to continue deepening the technology with special emphasis in the applications that have been developed in Cuba.
Conclusions: Advances in methods of screening, manufacturing, and humanization technologies show that phage display technology can significantly contribute in the fight against clinically important pathogens.
Keywords: Bacteriophages, combinatorial libraries, phage display technology, biopaning, infectious diseases, peptides, antibodies.
Introducción
Los bacteriófagos combatiendo enfermedades infecciosas
Fue el francés Félix D’Herelle quien en 1918 definió el termino bacteriófago para referirse a “un microbio invisible antagonista de los bacilos de la disentería” que más tarde se definieron como virus que infectan bacterias.1 Los bacteriófagos son la forma de vida más numerosa en la Tierra, diez veces más que las bacterias.2 Pueden ser encontrados en todos los ambientes donde las bacterias crecen, desde el Sahara, los mares del Norte y las frías aguas de las Islas polares.3 Son los responsables del 10 al 80 % de la mortalidad total de las bacterias en los ecosistemas acuáticos y son un importante factor limitante para las poblaciones bacterianas.4 Son los virus más estudiados y los que más han contribuido al desarrollo de la Biología Molecular. Su acción lítica sobre bacterias patógenas permitió su uso como alternativa terapéutica frente a infecciones bacterianas. Su eficacia ha sido probada incluso contra microorganismos resistentes a antibióticos.5
Las enfermedades infecciosas continúan siendo una de las principales causas de muerte a pesar de la disponibilidad de vacunas y antibióticos. En el interconectado mundo de hoy las enfermedades infectas contagiosas son capaces de propagarse rápidamente de forma global.6 Nuevas enfermedades infecciosas han sido detectadas que emergen con una frecuencia anual superior a las década de los 70 y 90,7 y otras han surgido recientemente con episodios letales como son el Síndrome Respiratorio Agudo Severo (SARS) 8 y la influenza aviar.9 También tenemos el hecho de la diseminación de cepas resistentes a antibióticos como el Staphylococcus aureus resistente a metilicina (MRSA), Enterococcus faecium resistente a vancomicina (VRE), Klebsiella pneumoniae resistente a carbapenem (NDM-1) y Pseudomonas aeruginosa resistentes a multidrogas (MDR). Una crisis en la salud pública mundial debido a las “Super bacterias” resistentes a antibióticos junto con un pobre desarrollo en las investigaciones de nuevos antimicrobianos es vaticinada por la OMS, declarando la búsqueda de nuevos fármacos para superar esta resistencia a los antibióticos, como una tarea priorizada.10
Con la secuenciación del genoma bacteriano en 1995 parecía que la aparición de cientos de nuevas moléculas blancos serian exploradas para la búsqueda de nuevos antimicrobianos como candidatos terapéuticos. Los antimicrobianos que han llegado al mercado en los últimos años son de amplio espectro y muy pocos específicos.11 El éxito comercial de los mismo ha limitado el desarrollo de drogas patógeno específicas. Sin embargo las bacterias resistentes a antibióticos han hecho que se fuercen nuevas estrategias patógenas específicas. Algunas de estas estrategias hacen necesario la selección a partir de grandes bibliotecas de compuestos químicos, productos naturales o biológicos por su capacidad para inhibir el crecimiento de patógenos específicos en ensayos con la bacteria entera. Comparando con las moléculas pequeñas sintéticas de origen químico, el descubrimiento de compuesto biofarmacéuticos anti infectivos ocupa un nuevo nicho comercial y de desarrollo clínico. Con las tecnologías recombinantes emergentes como la Tecnología de presentación sobre fagos filamentosos (TPFF)” (phage display technology) para el descubrimiento de anticuerpos monoclonales humanos (Mabs) y péptidos, se desarrollan nuevas oportunidades para el descubrimiento de nuevos antimicrobianos específicos. Algunos péptidos y Mabs obtenidos de estas bibliotecas se encuentran actualmente en ensayos preclínicos y clínicos.12,13 La TPFF está jugando un papel significativo en el descubrimiento de péptidos y anticuerpos que serían nuevos fármacos terapéuticos.14,15 En este artículo resumiremos las dos últimas décadas de estudios para el desarrollo de antimicrobianos y la aplicación de esta tecnología en la industria para el desarrollo de nuevas drogas anti infectivas.
Tecnología de presentación sobre fagos filamentosos (TPFF)
Los fagos filamentosos son partículas virales flexibles tubulares de 900 nm de longitud y 6 nm de diámetro. Cada partícula viral está formada por un ADN de cadena única protegido por proteínas de la cápsida viral. La proteína mayoritaria de la cápsida es la pVIII, la cual puede encontrarse hasta en 2700 copias por partícula viral. El resto de las proteínas (presentes en tres a cinco copias por fago) cubren ambos extremos de la estructura tubular (pIII y pVI en un extremo y pVII y pIX en el otro) (Fig. 1).16
Los fagos filamentosos (cepas M13, f1 y fd) infectan bacterias de la cepa Escherichia coli a través de su unión (mediada por la proteína pIII) al receptor (pilus F de la bacteria) y su translocación hacia el citoplasma de la célula. En la replicación del genoma del fago participan proteínas virales y de la célula hospedera. Las nuevas partículas virales se ensamblan y se liberan al medio a través de la membrana bacteriana por un proceso lisogénico.17
La tecnología de presentación sobre fagos filamentosos constituye la plataforma de presentación de péptidos y proteínas más poderosa en la actualidad.18 Esta tecnología se basa en la modificación por ingeniería genética de las partículas de fagos, de forma tal que cada una de ellas puede incorporar a su material genético genes foráneos de interés, y exponer en su superficie las secuencias proteicas codificadas por ellos (fusionadas a proteínas de la cápsida viral).19 De este modo existe una conexión entre fenotipo (molécula presentada) y genotipo (gen foráneo que codifica para esa molécula) en la misma partícula viral.20
Ciclos de selección
La TPFF permite seleccionar un péptido o proteína a partir de una biblioteca empleando, un anticuerpo monoclonal (AcM), un suero policlonal, una proteína, un receptor, o incluso moléculas de origen lipídico o azúcares, mediante un procedimiento de purificación por afinidad denominado genéricamente selección o “biopanning”. Debido a que la secuencia de ADN que codifica para el péptido o proteína se encuentra unida al genoma del fago vector, la secuencia aminoacídica del péptido expuesto puede ser deducida a partir de la secuencia nucleotídica de los pocos fagos seleccionados específicamente, que serán después clonados y amplificados.
Debido a estas propiedades, la tecnología de exposición funcional de péptidos y proteínas en fagos ha sido utilizada fundamentalmente para la caracterización de los residuos aminoacídicos que intervienen en las interacciones entre proteínas, la selección de mutantes de proteínas con una actividad incrementada y la selección y modificación de anticuerpos a partir de grandes bibliotecas de regiones variables naturales y sintéticas.
Históricamente este método ha sido importante para el aislamiento de péptidos y anticuerpos contra blancos conocidos como proteínas, lípidos o pequeñas moléculas. Aunque los métodos estándares de la TPFF utiliza antígenos purificados, la selección utilizando células enteras es otra opción.21 En las últimas décadas muchos grupos de investigadores utilizan células bacterianas o de mamíferos como blancos para identificar receptores específicos o péptidos y anticuerpos específicos de un tipo de célula.22,23, 24,25
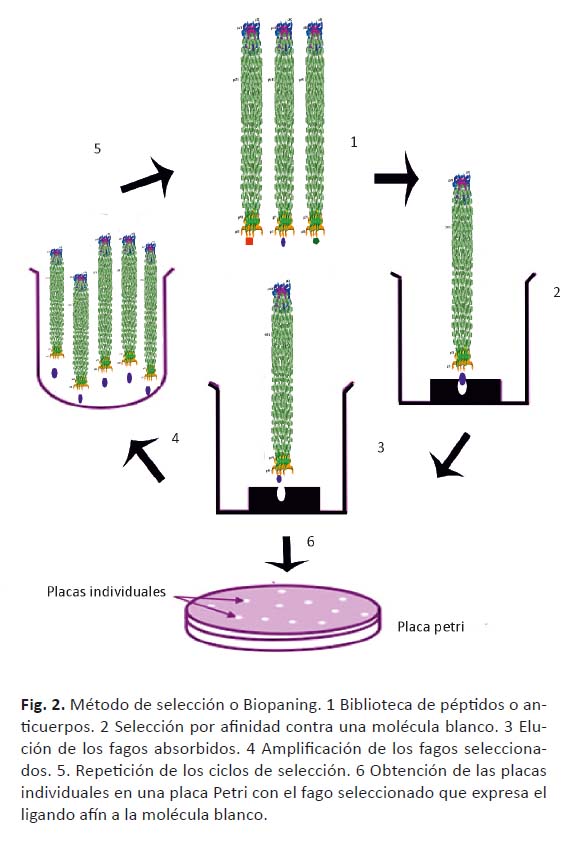
Se han diseñado métodos de selección diversos para la obtención de fragmentos de anticuerpo contra determinada diana. En esencia la biblioteca de anticuerpos sobre fagos se enfrenta al antígeno en ciclos de selección repetidos que incluyen pasos de unión, lavados y elución de los fagos unidos. Se infectan bacterias con los fagos eluidos y se cultivan para producir los fragmentos de anticuerpo sobre la superficie de la partícula viral (Fig. 2).
Con el objetivo de incrementar la probabilidad de obtener fragmentos de anticuerpo diversos y de elevada afinidad, se recomienda realizar entre dos y tres ciclos de selección y utilizar técnicas de alto flujo (ELISA, microarray, inmunoensayos sobre membranas de nitrocelulosa) para el tamizaje y la identificación de los anticuerpos deseados.26
La mayor complejidad de las estrategias de selección se alcanza en los sistemas in vivo.27,28 La mezcla de fagos de partida se inyecta directamente en animales y se colectan y se examinan los tejidos u órganos de interés. Se aíslan aquellos fagos portadores de fragmentos de anticuerpo que se acumularon selectivamente en la región blanco producto de las interacciones antígeno-anticuerpo. Este método de selección resulta de interés para la identificación de nuevos fármacos y sus mecanismos de circulación in vivo.
Tecnología de presentación sobre fagos filamentosos en la búsqueda de agentes biológicos antiinfectivos
La TPFF se ha utilizado ampliamente para la identificación de péptidos y anticuerpos seleccionados contra patógenos como blancos, estos son subdivididos en dos categorías. i) blancos moleculares como las enzimas del proceso de replicación o división celular y factores de virulencia del patógeno en el hospedero. ii) células bacterianas enteras.
La selección utilizando células enteras, es una estrategia libre, que tiene la ventaja de reconocer estructuras en la superficie celular que no han sido considerado moléculas blancos cuando se asume una estrategia en base al genoma celular o que aún no han sido identificados si se comparan con blancos moleculares específicos. La utilización de patógenos vivos como blancos tiene la ventaja también que todas las estructuras con potencial farmacéutico en la superficie se seleccionan simultáneamente en su contexto nativo fisiológico, permitiendo la selección de potenciales antimicrobianos desde afuera de la célula. Los antígenos en la superficie celular del patógeno son posibles candidatos como blancos debido a que pueden interferir con la división celular de la bacteria, 29 la colonización o la virulencia. 30Ambas estrategias han sido aplicadas ampliamente para desarrollar nuevas herramientas para el diagnóstico y tratamiento terapéutico de enfermedades infecciosas.
Bacterias grampositivas
La tuberculosis (TB) es una enfermedad infectocontagiosa causada por diversas especies del genero Mycobacterium, todas ellas pertenecientes al Complejo Mycobacterium tuberculosis (Mtb).31 En la actualidad, la epidemia de TB se atribuye a dos factores principales: la infección con el VIH y su asociación con la TB activa, y el incremento de la resistencia de las cepas de M. tuberculosis a los fármacos anti-TB más efectivos.
Según estimados de la OMS, la tercera parte de la población mundial (aproximadamente 2 billones de personas) se encuentra infectada por M. tuberculosis y solo en el año 2009 se reportaron 9,4 millones de nuevos casos de TB y 1,7 millones de muertes. La mayoría de estos casos ocurrieron en Asia (55 %) y África (30 %); y proporciones menores en las regiones Mediterránea del Este (7 %), Europea (4 %) y Las Américas (3 %).32
Hasta la fecha, la única vacuna anti-tuberculosa aprobada por la OMS y disponible para su uso en humanos es la cepa viva atenuada de M. bovis BCG. Se considera que la eficacia de la vacunación varía considerablemente de una población a otra. En niños recién nacidos protege contra las formas diseminadas de la enfermedad, mientras que no ofrece protección contra la TB pulmonar: la más frecuente y responsable de la diseminación.
Una de las más efectivas estrategias es la prevención de la transmisión y por lo tanto son necesarias nuevas herramientas para el diagnóstico rápido. Los ensayos utilizados actualmente para detectar células T respondedoras han mostrado diferentes problemas incluyendo la falta de respuesta a los antígenos utilizados debido a las variaciones provocadas por las infecciones concomitantes y a la ausencia del agente infectivo.
Lípidos, glicolipidos y lipopèptidos derivados del Mtb son presentados a las células T por las moléculas de superficie celular no polimórficas CD1, expandiendo la posibilidad de blancos disponibles al sistema adaptativo inmune para el control de la infección.33,34
La presentación de lípidos antigénicos a las Células T ha sido descrita en la TB, mediada por la presentación de lípidos asociados a las moléculas Cd1b.35 Un nuevo antígeno lipídico que pertenece al grupo de los sulfoglicolipidos diacetilados (Ac2SGL) purificado del Mtb ha sido identificado.36 Este Ac2SGL presentado a las moléculas Cd1b por Células T específicas está presente en los pacientes con TB y PPD-positivos y no en los PPD-negativos. Teniendo en cuenta que las moléculas de CD1b no son polimórficas, Ac2SGL es expresadas solamente por la micobacteria virulenta y este lípido no está sujeto a las mutaciones inducida por la presión selectiva del sistema inmune del hospedero: el uso del complejo CD1b:Ac2SGL como marcador universal de la infección por tuberculosis fue evaluado por un grupo del Instituto Finlay de La Habana utilizando un anticuerpo de cadena simple que reconoce el complejo CD1b:Ac2SGL de M. tuberculosis expuesto en la proteína III de los fagos filamentosos. Los resultados mostraron que la fusión a pIII fue exitosamente expuesta en la superficie del fago. Los estudios de reconocimiento por ELISA de los fagos e inmunohistoquímica muestran el reconocimiento del complejo CD1b:Ac2SGL en células humanas de pulmón de un paciente tuberculoso, comprobando las especificad del mimo. 37
Uno de los más importantes patógenos humanos y de las principales amenazas contra la salud humana es la bacteria Staphylococcus aureus. Un gran porcentaje de las infecciones por S.aureus es mediada por Staphylococcus aureus resistente a metilicina (MRSA). Se han reportado, desde 1980, cepas de S.aureus resistentes al antibiótico vancomicina, considerado como la última alternativa.38
Yacoby y colaboradores utilizaron fagos específicos contra S.aureus para llevar el antibiótico hasta las células bacteriana, ellos seleccionaron una biblioteca de péptidos de 12 aminoácidos para elegir un fago especifico contra S.aureus y también expresaron en el N terminal de la proteína III del fago el dominio ZZ que tiene una fuerte unión a las inmunoglobulinas, la droga fue conjugada al N terminal de la proteína VIII utilizando un enlace ester. La capacidad de carga del fago fue probado uniendo el mismo al antibiótico amino glicosidiconeomicina.39 La droga es liberada del fago por hidrolisis del enlace ester en presencia del suero. La inhibición del crecimiento bacteriano fue incrementada significativamente incubando el fago transportador con la droga, comparándolo con la droga solo.
Listeria monocytogeneses una bacteria que se desarrolla intracelularmente y es causante de la Listeriosis. Es uno de los patógenos causante de infecciones alimentarias más virulentos, con una tasa de mortalidad entre un 20 a 30 %, más alta que casi todas las restantes toxico infecciones alimentarias. Para evitar la infección es necesario detectar bajos niveles del patógeno en los alimentos.
Se utilizó la Tecnología de presentación sobre fagos para identificar un anticuerpo scFv que se puede unir a Listeria monocytogenes pero no a otras cepas de Listeria.40 Tres años después de este hallazgo se desarrolló un sensor de Resonancia de superficie Plasmones (SPR) basado en el anticuerpo scFV.41 El anticuerpo especifico contra L. monocytogenes scFV expuesto en el fago fue inmovilizado en la superficie del sensor detectando hasta un límite de 2 × 106 CFU/ml. El mecanismo de unión a la célula hospedera infectada por Listeria monocytogenes no está esclarecido, limitando el desarrollo de una estrategia preventiva o terapéutica apropiada. Utilizando la biblioteca de péptidos de 12 aminoácidos expuesta sobre fagos filamentosos Gasanov y colaboradores demostraron que la invasión por Listeria monocytogeneses mediada por la unión al receptor de Insulin-Like Growth Factor II (IGFIIR) en las células de mamíferos.42 Otros péptidos que se unen a Listeria monocytogenes fueron identificados seleccionando bibliotecas de 9 y 12 aminoácidos.43 En el 2006 la FDA (Food and DrugAdministration) de Estados Unidos aprobó el uso de bacteriófagos en ciertas carnes con el fin de acabar con la bacteria Listeria monocytogenes.
Bacterias gramnegativas
La pared celular es esencial para la supervivencia de muchas bacterias y el antibiótico penicilina puede matar a las bacterias inhibiendo un paso en la síntesis del peptidoglicano (también denominado mureína),que está formado por cadenas de polisacárido entrecruzadas por péptidos inusuales que contienen aminoácidos D. En las bacterias grampositivas la pared celular contiene una capa gruesa de peptidoglicano además de ácidos teicoicos, que son polímeros de glicerol o ribitol fosfato. Los ácidos teicoicos se unen al peptidoglicano o a la membrana citoplasmática.
La mayoría de las bacterias tienen una pared celular gramnegativa y solamente Firmicutes y Actinobacteria (conocidas previamente como bacterias grampositivas de contenido GC bajo y bacterias Grampositivas de contenido GC alto, respectivamente) tienen paredes grampositivas. Estas diferencias en estructura pueden producir diferencias en la susceptibilidad antibiótica, por ejemplo, la vancomicina puede matar solamente a bacterias grampositivas y es ineficaz contra patógenos Gramnegativos, tales como Haemophilus influenzae o Pseudomonas aeruginosa. La síntesis de la pared celular de la bacteria involucra una serie de enzimas como MurA-G, transglycosilasas, y transpeptidasas, la interrupción de cualquier parte de esta vía metabólica produce fallos en la síntesis de los peptidoglicanos y por consiguiente la lisis de la bacteria.44,45 Se obtuvieron inhibidores de MurA seleccionando una biblioteca de 12 aminoácidos y otra de 7 aminoácidos constreñidas por dos cisteínas en los extremos del péptido y utilizando como molécula blanco la enzima MurA de Pseudomonas aeruginosa a una concentración de inhibición de un 50 % (IC50s) en el rango de los 200 μM.46 Las mismas bibliotecas fueron utilizadas para seleccionar contra la enzima MurC de P. aeruginosa como molécula blanco y se obtuvieron un péptido de 12 aminoácidos (DHRNPNYSWLKS) y otro cíclico de 7 aminoácidos (CQDTPYRNC) los cuales mostraron similar IC50s (1,5 mM y 0,9 mM, respectivamente) para la inhibición de MurC. Sin embargo los péptidos no se pudieron utilizar para desarrollar fármacos debido a su baja permeabilidad y a la susceptibilidad a proteasas del plasma. Se identificaron péptidos inhibidores de las enzimas MurE y MurF of P. aeruginosa.47,48 seleccionando contra la biblioteca de 12 aminoácidos, los dos péptidos (NHNMHRTTQWPL y TMGFTAPRFPHY) inhiben las enzimas MurE y MurF a una IC50s de 500 μM y 250 μM, respectivamente. Se seleccionaron inhibidores contra las enzimas FtsA y FtsZde P. aeruginosa, que intervienen en la división celular, utilizando una biblioteca de 12 aminoácidos y otra de 7 aminoácidos constreñidas por dos cisteínas en los extremos del péptido.49,50 Se probaron además selecciones con estas bibliotecas y utilizando como blanco las células intactas de P. aeruginosa, los péptidos seleccionados se inmovilizaron en biosensores y fueron probados eficientemente en ensayos diagnósticos.51
La Neisseria meningitidis, también conocida por su nombre más simple de meningococo, es una bacteria diplocóccica heterótrofa gramnegativa, de importancia en salud pública por su papel en la meningitis y otras formas de enfermedad meningocóccica. Es la única forma conocida de meningitis bacteriana en causar epidemias. De los 13 serogrupos de esta bacteria, seis serogrupos (MenA, MenB, MenC, MenW, MenX y MenY) son los responsables de esta enfermedad a nivel mundial. Grupos del CIGB y del Instituto Finlay de La Habana han trabajado utilizando la Tecnología de presentación sobre fagos en busca de nuevos acercamientos diagnósticos y terapéuticos contra esta patología.
Se evaluó la inmunogenicidad y actividad funcional de anticuerpos obtenidos en ratón contra un péptido cíclico, unido por puentes disulfuros, correspondiente a la región variable 2 de la proteína exterior de membrana Por A de la cepa B385 (serosubtipo P1.15) de Neisseria meningitidis presentada en la superficie de los fagos filamentosos. El epítopo flanqueadotanto por cisteínas o cisteínas y tres residuos de glicina, fue expresado fusionado a la proteína pVIII de los fagos filamentosos M13. La inmunización de ratones Balb/C con cada uno de los fagos generaron una respuesta especifica de anticuerpos. El suero de los ratones inmunizados con el fago que exponía el péptido cíclico unido a las tres glicinas reconocía la proteína nativa mejor que el suero de ratones obtenidos solo el péptido cíclico. Solo los fagos que exponían el péptido cíclico con la cola de glicinas fue capaz de inducir una respuesta inmune con actividad bactericida, estos resultados indican la posibilidad de usar la tecnología de presentación sobre fagos de péptidos que requieran una adecuada conformación al ser presentados al sistema inmune para lograr una respuesta inmune funcional.52 Otra uso de la tecnología de fagos en esta patología fue para la obtención de un candidato vacunal contra el serogrupo B de la cepa meningococcal (MenB). El polisacárido capsular (MenB CPS) comparte epítopos cros reactivos y no cros reactivos contra los polisacáridos humanos. El anticuerpo mAb (13D9) que reconoce un epítopo único en MenB CPS fue utilizado como molécula blanco para seleccionar contra una biblioteca de péptidos de 15 aminoácidos fusionada al N terminal de la proteína pVIII de los fagos filamentosos. Se identificaron 4 péptidos capaces de unirse al anticuerpo mAb 13D9 en competencia con el MenB CPS. La inmunización de ratones contra estos péptidos expuestos en los fagos produjo anticuerpos IgG, principalmente IgG2a, es relevante que algunos de los péptidos identificados en este trabajo inducen niveles detectables de anticuerpos bactericida contra MenB y uno de ellos fue protectivo en un modelo in vivo. La tares de diseñar vacunas contra el serogrupo B de la enfermedad meningococcica basado en antígenos no capsulares avanza lentamente y la posibilidad de utilizar péptidos miméticos para determinantes antigénicos no cros reactivos de MenB.CPS capaz de inducir actividad bactericida y anticuerpos protectivos es sin duda una posibilidad para el desarrollo de vacunas por sí mismo o en combinación con otros candidatos vacunales.53
Helicobacter pylori es una bacteria gramnegativa que causa infecciones estomacales con inflamación crónica y está firmemente relacionada al desarrollo de ulceras y tumores en el sistema digestivo. La ureasa que es uno de los principales factores de virulencia producida por H. pylori ha sido utilizado como blanco para la selección de dos bibliotecas de péptidos fusionadas a pIII de 24 y 6 aminoácidos respectivamente.54 De los péptidos seleccionados (TFLPQPRCSALLRYLSEDGVIVPS y YDFYWW) dos se unen e inhiben la división de H. pylori. El mismo grupo de investigadores seleccionaron anticuerpos tipo ScFv de una biblioteca sobre fagos que inhiben la proteína ureasa de H. pylor.55 Algunos de estos anticuerpos scFv pueden ser usados directamente en la terapéutica, otros fueron seleccionados utilizando como molécula blanco la bacteria completa. 56
Virus
Entre las formas de determinar los residuos aminoacídicos que intervienen en el reconocimiento antígeno-anticuerpo, la síntesis de péptidos sintéticos, es una práctica habitual que cubre la secuencia del antígeno original. Nosotros analizamos primeramente con esta metodología los posibles sitios de unión del anticuerpo monoclonal CB-Hep1 al HbsAg (Antígeno de superficie de la Hepatitis B) y posteriormente abordamos esta práctica con la biblioteca de péptidos expuestos en la superficie de los fagos fusionada a la proteína VIII.
El AcM CB-Hep.1 reconoce específicamente el determinante común “a”. Este determinante del HBsAg se localiza en un lazo que se extiende desde el residuo aminoacídico 101 al 159. Esta región es hidrofílica y extremadamente rica en cisteínas, conteniendo 8 residuos de los 14 que tiene el HBsAg.
El grupo de Folgori en 1994,57 con sueros de individuos vacunados con el antígeno (HBsAg) y una biblioteca de péptidos de nueve aminoácidos, caracterizó la respuesta humoral de estos individuos. Se seleccionó un fagotopo de secuencia CKTCTTPAQGN reconocido por el 80 % de las muestras de suero de individuos inmunizados con el HBsAg, lo que indica que el motivo C(K/R)TC es un epítopo inmunodominante. Debido a su importancia tanto en el desarrollo de vacunas, como en el establecimiento de sistemas de diagnóstico, el estudio de la estructura y composición epitópica del determinante “a” del HBsAg sigue constituyendo uno de los aspectos centrales de la investigación en estos campos. No menos importante es el hecho de haber comprobado que el AcM CB-Hep.1, actualmente en uso en el proceso de obtención de la vacuna recombinante Heberbiovac, reconoce de manera específica la región CKTC del determinante “a”, crítica para el carácter “común” de éste, lo que garantiza que durante la inmunopurificación se seleccionen aquellas moléculas de antígeno que expongan adecuadamente esta región, esencial para el desarrollo de una respuesta inmune protectora frente a diferentes subtipos virales.58
La Tecnología de presentación sobre fagos fue usada también para la búsqueda de anticuerpos y péptidos del alta afinidad contra el Virus de la hepatitis A (HAV) 59 y anticuerpos neutralizantes contra las proteínas de la cápsida del Virus de la Hepatitis E.91
TPFF y Dengue
El Dengue (VD) es la infección arboviral transmitida por mosquitos de mayor importancia en humanos en términos de morbi-mortalidad. Es causada por cualquiera de 4 sus cuatro serotipos (VD1, VD2, VD3 y VD4) resultando en un amplio rango de síntomas clínicos que puede ir desde la forma subclínica, la fiebre clásica de dengue (FD) y la fiebre hemorrágica de dengue (FHD). La infección por un serotipo confiere una protección duradera contra una re-infección por el mismo serotipo, pero esta es solo transciente contra una infección secundaria contra uno de los 3 serotipos restantes.60 Los VD codifican y expresan 3 proteínas estructurales (capsida, C; pre membrana prM y envoltura E) y 7 proteínas no estructurales (NS1, 2a, 2b, 3, 4a, 4b, and 5) 61 de estas la proteína E es el blanco principal de la respuesta humoral en la infección por VD, aunque se ha reportado respuesta de células B a las proteínas prM y NS1.62 Actualmente, la infección por dengue, representa una preocupación para las autoridades de salud a nivel global ya que dos quintos de la población mundial viven en regiones endemo/epidémicas.63, 64 Es por ello que el dengue ha sido también objeto de estudio en la tecnología de presentación sobre fagos filamentosos (TPFF). Esta poderosa técnica a partir de bibliotecas combinatoriales altamente diversas, ya sea exponiendo péptidos o proteínas, permite distinguir moléculas únicas con selectiva afinidad por un blanco especifico y presenta como ventaja primordial que el proceso de producción de los mismos, es muy rápido, barato y reproducible y permite disponer de un mayor y diverso número de moléculas.65 En los últimos 15 años ha sido aplicada, preferentemente a enfermedades con alto potencial económico y a las llamadas enfermedades ″olvidadas″ contra las que actualmente no hay disponible moléculas antivirales o vacunas, 66 entre estas el dengue.
Debido a que hasta el momento, no existe una terapia específica para el dengue la prevención de la enfermedad está limitada al control del vector.63 De esta forma, se hacen necesarios métodos de diagnóstico rápidos y específicos así como la obtención de una vacuna que representaría un importante avance en el control de la enfermedad. En ambos casos la identificación de epítopos de importancia biológica es esencial. Los epítopos inmunogénicos sobre las proteínas E y NS1 han sido los más documentados.67 No obstante existen algunos reportes sobre la identificación de epítopos del VD sobre otras proteínas estructurales y no estructurales 68,69como la proteínas prM, capsida y NS4a, los cuales son de gran importancia tanto en la patogénesis, el diagnóstico y el desarrollo de vacunas. 70,71
Las características de un ensayo diagnostico ideal para dengue depende del propósito para el cual el ensayo será usado, cualquiera que sea este, es indispensable el conocimiento de los epítopos inmunogénicos presentes en las proteínas virales. Los métodos directos (detección de antígeno) no son los realizados de rutina en el laboratorio y existen pocos juegos diagnósticos comerciales disponibles que hayan sido validados. No obstante, se han desarrollados nuevos ensayos inmunoenzimaticos (ELISA) e inmunocromatograficos que tienen como blanco la proteína NS1 y que han revelado que pueden detectar altas concentraciones de este antígeno en muestras de pacientes con infección primaria o secundaria de dengue.72 Los métodos indirectos (serológicos) son los más comúnmente usados para el diagnóstico de la infección por dengue debido a que su uso es mucho más fácil comparado con las técnicas de aislamiento en cultivo celulares o detección de RNA.73 Estos dependen de la detección de anticuerpos específicos a dengue en el suero del paciente. Con esta finalidad, existen varios juegos de diagnósticos comerciales (ELISA) en los cuales es utilizado como antígeno el virus completo obtenido ya sea por cultivos celulares o tejidos de animales infectados ambos sustratos altamente caros.74 Estos formatos de prueba rápida, continúan siendo costosos y a pesar de que algunos han ofrecido buenos resultados, no se ha establecido ninguno como referencia. Además, pueden conducir a un diagnostico errado debido a la reactividad cruzada entre los anticuerpos no dengue flavivirus específicos; lo cual hace necesaria la búsqueda de moléculas que remplacen el antígeno viral completo con el fin de lograr mayor sensibilidad y especificidad.75 En este sentido, una propuesta ha sido el uso de péptidos mimotópos obtenidos por TPFF, herramienta de gran utilidad para el diagnóstico pues ha constituido una fuente alternativa de antígenos en la identificación de anticuerpos anti-dengue.
La selección de péptidos que imitan epítopos del virus dengue han sido realizadas a través del mapeo de anticuerpos monoclonales (AcM) dirigidos al antígeno viral de interés o utilizando suero de individuos inmunes. Como fue referido anteriormente, las proteína de la envoltura (E) y la proteína no estructural 1 (NS1) han sido las más estudiadas debido a la importancia de estas en la inmunidad y en la etiopatogenia de la enfermedad.76,77 La NS1 representa un interesante blanco para el diagnóstico debido a la presencia en la sangre de pacientes infectados principalmente desde el día 1 al 6 después del comienzo de los síntomas clínicos.78 Por ello, los primeros mapeos de AcM a dengue con esta tecnología, fueron dirigidos hacia aquellos específicos contra la proteína NS1 del VD. A partir de estos estudios pudo ser identificada la secuencia HRYSWK que corresponde a los residuos 111-116 de esta proteína. Esta secuencia en un formato de péptidos múltiples demostró ser especifica al serotipo 1 del VD capaz de detectar anticuerpos en muestras de pacientes confirmados con esta enfermedad y manifestó también la influencia ejercida de una histidina en la posición 111 en la actividad de unión al anticuerpo.79 Un nuevo AcM especifico contra la proteína NS1 del VD2 y la aplicación de la TPFF con una biblioteca de péptidos, hizo posible la identificación del epítopo serotipo específico para células B de este anticuerpo y permitió sintetizar un péptido con esta secuencia motivo, que resulto crucial en la unión al anticuerpo. Este péptido sintético identifico muestras de suero de ratones y conejos inmunizados contra dengue además de diferenciarlos de anticuerpos en ratones inmunizados con el virus de la encefalitis Japonesa.80 Varios de los péptidos identificados a partir de la proteína NS1 están en uso de forma exitosa como herramienta de diagnóstico para la detección de anticuerpos y prometen aplicaciones potenciales en el diagnóstico diferencial entre los flavivirus.
La TPFF exponiendo péptidos se ha utilizado también para investigar el posible uso de anticuerpos con dominios variables de cadenas pesadas (anticuerpos VHH o nanoanticuerpos) como herramienta diagnostica alternativa al uso convencional de los AcM. Los nanoanticuerpos representan los fragmentos más pequeños de la unión antígeno-anticuerpo pudiendo instaurar, dadas sus propiedades, las bases para una nueva generación de anticuerpos. Fátima y colaboradores en 2014 generaron nanoanticuerpos contra una proteína recombinante de NS1 del VD2 a partir de una biblioteca no-inmune de llama (Lama glama) y determinaron los epítopos de unión de los anticuerpos VHH usando la TPFF de una librería de péptidos. Estos nanoanticuerpos y AcM convencionales a esta proteína fueron usados y comparados en la preparación de un juego diagnostico inmunocromatográfico rápido. Ambos anticuerpos reconocieron la misma región de la proteína NS1, sin embargo los anticuerpos VHH mostraron mayor sensibilidad y especificidad demostrando que estos anticuerpos son una opción en el desarrollo de pruebas diagnósticas para la infección por VD.81
La TPFF exponiendo anticuerpos ha sido también utilizada, Cabezas y colaboradores a partir de una biblioteca universal de anticuerpos humanos de individuos no inmunizados, obtuvieron un total de 9 anticuerpos anti-dengue. Siete de ellos fueron altamente específicos para tres de los serotipos seleccionados (VD1, 3 y 4). Uno de los fragmentos (seleccionado contra DEN-3) mostró reactividad cruzada contra DEN-1, mientras que otro (seleccionado contra DEN-2) reaccionó con los cuatro serotipos. Estos patrones de especificidad y reactividad cruzada fueron confirmados con un panel más amplio de cepas de los cuatro serotipos. Se logró la selección de fragmentos de anticuerpo contra epítopos virales comunes dentro de cada serotipo reconocido, lo que apoya su aplicación en el diagnóstico y/o la tipificación del virus dengue.
La caracterización de seis de los fragmentos de anticuerpo como moléculas solubles (fuera del contexto de los fagos) confirmó sus propiedades de reconocimiento y demostró que reconocen al virus a concentraciones muy bajas (en el orden de los nmol/l), lo que indica una alta afinidad de las interacciones. El análisis de las secuencias de las regiones variables de estos primeros anticuerpos humanos seleccionados contra el virus dengue muestra una gran diversidad en su origen inmunogenético y aporta información valiosa sobre el repertorio de inmunoglobulinas humanas involucradas en el reconocimiento de este patógeno.82,83
Humira o Adalimumab fue el primer anticuerpo terapéutico derivado de una biblioteca sobre fagos filamentosos que fue aprobado por la FDA (EUA) en el año 2002 para uso en humanos. Este anticuerpo tiene la capacidad de neutralizar al TNF-α y se utiliza actualmente para el tratamiento de la artritis reumatoide.84 Existen además otros anticuerpos o fragmentos derivados de ellos en estudios preclínicos y algunos más avanzados en diferentes fases de ensayos clínicos. Se caracterizan por su capacidad de neutralizar citocinas, receptores de moléculas angiogénicas o patógenos completos, útiles para la terapia de diversos tipos de cáncer, enfermedades autoinmunes, alérgicas e infecciosas.85, 86
De la misma forma se ha demostrado que los fragmentos de anticuerpo aislados a través de la tecnología de presentación sobre fagos filamentosos pueden ser empleados en todas las técnicas en las que normalmente se utilizan los AcMs derivados de la tecnología de hibridomas (ELISAs, western blot, inmunohistoquímica, inmunoflorescencia, citometría de flujo, entre otras).87,88 Debido a que los fragmentos de anticuerpo pueden ser fácilmente modificados genéticamente, algunos de ellos se han fusionado a moléculas marcadoras.89,90 De esta forma se convierten en proteínas bifuncionales, mantienen su capacidad de unión al antígeno diana y a la vez presentan actividad de marcaje.
Conclusiones
Al igual que otras metodologías de selección de afinidad, la Tecnología de presentación sobre fagos tienes sus limitantes. Para la obtención de nuevos agentes antimicrobianos, incluyendo péptidos y anticuerpos este método obtiene con altas probabilidades moléculas de relativa baja afinidad y muchas de ellas carecen del principal atributo de ser antimicrobiano o necesitan modificaciones para mejorar su actividad. Por ejemplo, la reconstrucción de anticuerpos de tipo ScFv o Fabs en anticuerpos enteros utilizando células de mamífero, además péptidos catiónicos con actividad antimicrobiana generalmente muestran uniones no específicas y toxicidad en células de mamíferos.91 lo que limita la aplicación de la tecnología para seleccionar desde bibliotecas de péptidos.
Para la mayoría de las indicaciones, una droga debe unirse a su molécula blanco con un grado razonable de afinidad. Aproximadamente el 60 % de los proyectos para la búsqueda de nuevas moléculas fallan debido a que la molécula blanco no es la ideal o la seleccionada no posee una potencia real de unión al blanco y por ende de producir una función biológica.92 La Tecnología de presentación sobre fagos tiene como ventaja que facilita los procesos de selección, para obtener sobre la molécula blanco aquellas de mayor afinidad y mejor potencia (afinidad en el orden de nM) y que permita el desarrollo de nuevos agentes terapéuticos.93
En las moléculas de origen químico obtenido de la selección de compuestos sintéticos se obtienen normalmente afinidades con el blanco de un 50 % de la concentración efectiva (EC50s)/IC50s en el rango de 1 a 5 μM. Se requieren muchos ciclos de diseño de estructura, síntesis y ensayos de actividad para obtener moléculas con una potencia en el orden de los nM, esta tarea toma frecuentemente muchos años y se necesita de un gran equipo de trabajo dedicado a la síntesis y la química médica. Además para muchos blancos no es fácil lograr con pequeños compuestos químicos sintéticos una actividad biológica elevada debido a que poseen una superficie de contacto limitada. En contraste el poder de las técnicas de ADN recombinante utilizando diversos ciclos de selección por afinidad y maduración con la tecnología de fagos permite obtener moléculas potentes en poco tiempo. A modo de comentario, es de notar que moléculas de alta afinidad y potencia no se obtiene rutinariamente de las bibliotecas de péptidos y anticuerpos disponibles comercialmente.94 Mucho conocimiento de la molécula blanco y experiencia en las técnicas de biología molecular son requeridas para el diseño de una biblioteca de péptidos o anticuerpos. Además algunos péptidos o MAbs funcionan solo cuando forman parte integral de la proteína de la cápsida del fago u otro andamiaje proteico y no aislado solo en solución.95,96,16,97
Es cierto que la mayoría de los antibióticos y antivirales en el mercado farmacéutico actual o en desarrollo derivan de pequeñas moléculas químicas sintéticas, sin embargo hay una serie de proyectos en tránsito de posibles candidatos a drogas a partir de bibliotecas sobre fagos. Hasta hace poco, la tecnología de exposición en fagos fue utilizada para producir MAbs de aplicación principalmente en las áreas de cáncer y las enfermedades inflamatorias. Las disputas de patentes impidieron su amplio uso y contribuyeron a la escasez de candidatos de posibles anticuerpos en la clínica durante los años 1990. La selección de bibliotecas naives o inmunizadas utilizando fagos permiten potencialmente desarrollar anticuerpos enteros contra agentes infecciosos y tienen el potencial para el desarrollo de agentes anti infecciosos de aquellos patógenos refractarios a los actuales tratamientos. Las tasas de transición exitosa de fase I (prueba de seguridad) a fase II (prueba de eficacia) para todos los MAbs terapéuticos derivados de ratones transgénicos y de bibliotecas de fagos son 87 % y 94 %, respectivamente. Desde la fase II hasta la aprobación por la FDA, los índices de éxito son 52 % y 37 %, respectivamente.15 Por lo tanto los MAbs obtenidos de bibliotecas de fagos tienen comparativamente una tasa de 35 % de pasaje exitoso de fase I hasta su lanzamiento, comparado con un promedio en la industria de un 12 % para un candidato de droga química sintética. Dado la escasez de nuevos agentes antimicrobianos y antivirales en el desarrollo clínico o preclínico, creemos que es imperativo considerar que las bibliotecas de péptidos o anticuerpos expuestos en el cápsida de los fagos filamentosos son una alternativa valiosa para de forma rápida obtener nuevas moléculas de uso clínico.
Agradecimientos
Agradecemos de manera especial al Proyecto Prometeo de la Secretaría de Educación Superior, Ciencia, Tecnología e Innovación de la República del Ecuador por su patrocinio en este trabajo
Referencias bibliográficas
1 D’Herelle F. Sur un microbe invisible antagoniste des bacilles dysentériques. Comp Rend Acad Sci Paris 1917; 165: 373-5.
2 Hanlon GW. Bacteriophages: an appraisal of their role in the treatment of bacterial infections. Int J Antimicrob Agents. 2007; 30:118–128.
3 Säwström CH, Lisle J, Anesio AM, Priscu JC, Laybourn-Parry J. Bacteriophage in polar inland waters. Extremophiles. 2008; 12:167–175.
4 Weinbauer M. Ecology of procaryotic viruses. FEMS Microbiol Rev. 2004;28:127–181.
5 Vispo NS, Puchades Y. Bacteriofagos: de la terapia con fagos a la biología combinatoria. Biotecnología Aplicada .2001; vol 18. 135-147.
6 Headley CM. Bad bugs, bad bugs—whatchagonna do when they come for you? Nephrol. Nurs. J. 2011;38:433–34.
7 Satcher D. Emerging infections: getting ahead of the curve. Emerg. Infect. Dis.1995;1:1–6.
8 Rota PA. Characterization of a novel coronavirus associated with severe acute respiratory syndrome. Science.2003;300:1394–99.
9 Lyall J, Irvine RM, Sherman A, McKinley TJ, Núñez A, Purdie A, Outtrim L, Brown IH, Rolleston-Smith G, Sang H, Tiley L.Suppression of avian influenza transmission in genetically modified chickens. Science.2011;331:223–226.
10 WHO global strategy for containment of antimicrobial resistance. World Health Organization, Geneva, Switzerland: http://www.who.int/drugresistance/guidance/en/index.html.2001.
11 Boucher HW, Talbot GH, Bradley JS, Edwards JE, Gilbert D, Rice LB, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America. Clin. Infect. Dis.2009; 48:1–12.
12 Giuliani A, Pirri G, Nicoletto S. Antimicrobial peptides: an overview of a promising class of therapeutics. Cent. Eur. J. Biol.2007; 2:1–33.
13 Reichert JM, Rosensweig CJ, Faden LB, Dewitz MC. Monoclonal antibody successes in the clinic. Nat. Biotechnol.2005;23:1073–78.
14 Fjell CD, Hiss JA, Hancock RE, Schneider G. Designing antimicrobial peptides: form follows function. Nat. Rev. Drug Discov.2012;11:37–51.
15 Nelson AL, Dhimolea E, Reichert JM. Development trends for human monoclonal antibody therapeutics. Nat. Rev. Drug Discov.2010;9:767–774.
16 Smith GP, Petrenko VA. Phage Display. Chem Rev. 1997 Apr 1;97(2):391-410.
17 Azzazy HM, Highsmith WE, Jr. Phage display technology: clinical applications and recent innovations. Clin Biochem. 2002 Sep;35(6):425-45.
18 Santiago Vispo N. Combinatoria Molecular. Elfos Scientiae. La Habana; 2004.
19 Smith GP. Filamentous fusion phage: novel expression vectors that display cloned antigens on the virion surface. Science. 1985 Jun 14;228(4705):1315-7.
20 Hoogenboom HR, de Bruine AP, Hufton SE, Hoet RM, Arends JW, Roovers RC. Antibody phage display technology and its applications. Immunotechnology. 1998 Jun;4(1):1-20.
21 Watters JM, Telleman P, Junghans RP. An optimized method for cell-based phage display panning. Immunotechnology1997;3:21–9.
22 Bishop-Hurley SL, Rea PJ, Mc Sweeney CS. Phage-displayed peptides selected for binding to Campylobacter jejuni are antimicrobial. Protein Eng. Des. Sel.2010;23:751–7.
23 Cao J, Zhao P, Miao XH, Zhao LJ, Xue LJ, Qi ZtZt. Phage display selection on whole cells yields a small peptide specific for HCV receptor human CD81. Cell. Res.2003; 13:473–9.
24 Pereira S, Maruyama H, Siegel D, Van Belle P, Elder D, Curtis P, Herlyn D.A model system for detection and isolation of a tumor cell surface antigen using antibody phage display. J. Immunol. Methods 1997; 203:11–24.
25 Szardenings M1, Törnroth S, Mutulis F, Muceniece R, Keinänen K, Kuusinen A, Wikberg JE.Phage display selection on whole cells yields a peptide specific for melanocortin receptor 1. J. Biol. Chem.1997;272:27943–48.
26 Buckler DR, Park A, Viswanathan M, Hoet RM, Ladner RC. Screeningisolatesfromantibodyphage-displaylibraries. DrugDiscovToday. 2008 Apr; 13(7-8):318-24.
27 Johns M, George AJ, Ritter MA. In vivo selection of sFv from phage display libraries. J Immunol Methods. 2000 May 26; 239(1-2):137-51.
28 Robert R, Jacobin-Valat MJ, Daret D, Miraux S, Nurden AT, Franconi JM, et al. Identification of human scFv stargeting atherosclerotic lesions: selection by single round in vivo phage display. J BiolChem. 2006 Dec 29; 281(52):40135-43.
29 Lock RL, Harry EJ. Cell-divisioninhibitors: new insightsforfutureantibiotics. Nat. Rev. DrugDiscov. 2008; 7:324–338.
30 Rasko DA, Sperandio V. Anti-virulence strategies to combat bacteria-mediated disease. Nat. Rev. Drug Discov.2010; 9:117–28.
31 Flynn JL, Chan J: Immunology of tuberculosis. Annu Rev Immunol 2001; 19:93-129.
32 WHO. Global tuberculosis report 2012.
33 Gilleron M, Stenger S, Mazorra Z, Wittke F, Mariotti S, Bohmer G, et. Al. Diacylatedsulfoglycolipids are novel mycobacterialantigensstimulating CD1-restricted T cellsduringinfectionwithMycobacterium tuberculosis. J ExpMed 2004; 199:649-59.
34 Tourne S, Maitre B, Collmann A, Layre E, Mariotti S, Signorino-Gelo F, et al. Cuttingedge: a naturallyoccurringmutation in CD1e impairslipidantigenpresentation. J Immunol 2008; 180:3642-6.
35 Mori L, De Libero G. Presentation of lipidantigensto T cells. ImmunolLett 2008; 117:1-8.
36 Richman SA, Kranz DM. Display, engineering, and applications of antigenspecific T cellreceptors. BiomolEng 2007; 24:361-73.
37 Camacho F, Huggett J, Kim L, Infante JF, Lepore M, Perez V, et al. Phagedisplay of functional αβ single-chain T-cell receptor moleculesspecificfor CD1b:Ac₂SGL complexesfromMycobacterium tuberculosis-infectedcells. BMC Immunology 2013; 14 (Suppl 1):S2.
38 Weigel LM. Geneticanalysis of a high-levelvancomycin-resistantisolate of Staphylococcusaureus. Science 2003; 302:1569–1571.
39 Yacoby I, Bar H, Benhar I. Targeteddrug-carryingbacteriophages as antibacterialnanomedicines. Antimicrob. Agents Chemother. 2007; 51:2156–2163.
40 Paoli GC, Chen CY, Brewster JD. Single-chain Fvantibody with specificity for Listeria monocytogenes. J. Immunol. Methods. 2004; 289:147–155.
41 Nanduri V, Bhunia AK, Tu SI, Paoli GC, Brewster JD. SPR biosensor for the detection of L. monocytogenes using phage-displayed antibody. Biosens. Bioelectron. 2007; 23:248–252.
42 Gasanov U, Koina C, Beagley KW, Aitken RJ, Hansbro PM. Identification of the insulin-like growth factor II receptor as a novel receptor forbinding and invasionby Listeria monocytogenes. Infect. Immun. 2006; 74:566–577.
43 Carnazza S, Gioffre G, Felici F, Guglielmino S. Recombinant phage probesfor Listeria monocytogenes. J. Phys. Condens. Matter 2007; 19:395011
44 Scheffers D-J, Pinho MG. Bacterial cell wall synthesis: new insights from localization studies. Microbiol. Mol. Biol. Rev. 2005; 69:585–607.
45 Typas A, Banzhaf M, Gross CA, Vollmer W. From the regulation of peptide glycan synthesis to bacterial growth and morphology. Nat. Rev. Microbiol. 2012; 10:123–136.
46 Molina-Lopez J, Sanschagrin F, Levesque RC. A peptide inhibitor of MurA UDP-N-acetyl glucosamine enolpyruvyl transferase: the first committed step in peptidoglycan biosynthesis. Peptides. 2006; 27:3115–21.
47 Paradis-Bleau C, et al. Phage display-derived inhibitor of the essential cell wall biosynthesis enzyme MurF. BMC Biochem. 2008; 9:33.
48 Paradis-Bleau C. Pseudomonas aeruginosa MurE amide ligase: enzyme kinetics and peptide inhibitor. Biochem. J. 2009; 421:263–72.
49 Paradis-Bleau C, Sanschagrin F, Levesque RC. Identification of Pseudomonas aeruginosa FtsZ peptide inhibitors as a tool for development of novel antimicrobials. J. Antimicrob. Chemother. 2004; 54:278–80.
50 Paradis-Bleau C, Sanschagrin F, Levesque RC. Peptide inhibitors of the essential cell division protein FtsA. Protein Eng. Des. Sel. 2005, 18:85–91.
51 Carnazza S, Foti C, Gioffre G, Felici F, Guglielmino S. Specific and selective probes for Pseudomonas aeruginosa from phage-displayed random peptide libraries. Biosens. Bioelectron. 2008; 23:1137–44.
52 Menéndez T, De Haz I, Delgado M, Garay H, Martín A, Vispo NS. Immunisation with phage-displayed variable region 2 from meningococcal PorA outer membrane protein induces bactericidal antibodies against Neisseria meningitidis. Immunol Lett. 2001 Oct 1; 78(3):143-8.
53 Menéndez T, Vispo NS, Cruz-Leal Y, Coizeau E, Garay H, Reyes O, et al. Identification and characterization of phage-displayed peptide mimetics of Neisseria meningitidisserogroup B capsular polysaccharide. Int J Med Microbiol. 2011 Jan; 301(1):16-25.
54 Houimel M, Mach JP, Corthesy-Theulaz I, Corthesy B, Fisch I. New inhibitors of Helicobacter pylori urease holoenzyme selected from phage-displayed peptide libraries. Eur. J. Biochem. 1999; 262:774–80.
55 Houimel M. Selection of human single chain Fv antibody fragments binding and inhibiting Helicobacter pylori urease. Tumour Biol. 2001; 22:36–44.
56 Sabarth N. Identification of Helicobacter pylori surface proteins by selective proteinase K digestion and antibody phage display. J. Microbiol. Methods 2005; 62:345–49.
57 Folgori A, Tafi R, Felici F, Galfre G, Cortese R, Monaci P, Nicosi A. A general strategy to identify mimotopoes of pathological antigens using only random peptides libraries and human sera. EMBO J. 1994;13: 2236-43.
58 Felici F, Puchades Y, Fernández de Cossío ME, Vispo NS. Exposición multivalente con la utilización de la proteína pVIII de la cápsida de los fagos filamentosos. Combinatoria Molecular. N Santiago Vispo (Editor) Elfos Scientiae. 2004.
59 Larralde OG. Identification of hepatitis A virus mimotopes by phage display, antigenicity and immunogenicity. J. Virol. Methods 2007; 140:49 –58.
60 Schmitz J, Roehrig J, Barrett A, Hombach J. Next generation dengue vaccines: A review of candidates in preclinical development. Vaccine 2011;(29):7276– 84.
61 Lindenbach BD, Rice CM. Flaviviridae: The Viruses and Their Replication. En: Knippe DM HP, eds. Fields Virology. London: Lippincott Williams & Wilkins,2007:991-1042.
62 Moreland NJ, Susanto P, Lim E, Tay MYF, Rajamanonmani R, Hanson BJ et al. Phage Display Approaches for the Isolation of Monoclonal Antibodies Against Dengue Virus Envelope Domain III from Human and Mouse Derived Libraries Int. J. Mol. Sci. 2012(13):2618-35.
63 Guzman MG, Kouri G. Dengue and dengue hemorrhagic fever in the Americas: lessons and challenges. Journal of Clinical Virology 2003;(27):1-13.
64 Hughes HR, Crill WD, Chang GJ. Manipulation of immune dominant dengue virus E protein epitopes reduces potential antibody-dependent enhancement Virology Journal 2012;(9):1151.
65 Mehta J VDB, Devriese L, Rouah-Martin E, Bekaert K, Somers K, Somers V, et al. The Use of Phages and Aptamers as Alternatives to Antibodies in Medical and Food Diagnostics. En: Komorowska M. A and Olsztynska-Janus S, eds. Biomedical Engineering: Trends, Research and Technologies InTech, 2011.
66 Castel G, Chtéoui M, Heyd B and Tordo N. Phage Display of Combinatorial Peptide Libraries: Application to Antiviral Research. Molecules 2011;(16): 3499-518.
67 Wu HC, Huang YL, Chao TT, Jan JT, Huang JL, Chiang HY, et al. Identification of B-cell epitope of dengue virus type 1 and its application in diagnosis of patients. J Clin Microbiol. 2001;39(3):977-82.
68 Rathakrishnan A and Sekaran SD. New development in the diagnosis of dengue infections. Expert Opin. Med. Diagn. 2012:1-14.
69 Menéndez F. Fagos filamentosos como inmunógenos: Combinatoria Molecular. Vispo NS, ed. La Habana: Elfos Scientiae, 2004:253.
70 Luo YY, Feng JJ, Zhou JM, Yu ZZ, Fang DY, Yan HJ et al. Identification of a novel infection-enhancing epitope on dengue prM using a dengue cross-reacting monoclonal antibody. BMC Microbiology 2013;(13):194.
71 AnandaRao R, Swaminathan S, Khanna N. The identification of immunodominant linear epitopes of dengue type 2 virus capsid and NS4a proteins using pin-bound peptides. Virus Research, 2005;(112):60–68.
72 Dussart, P, Labeau B, Lagathu G, Louis P et al. Evaluation of an enzyme immunoassay for detection of dengue virus NS1 antigen in human serum. Clin. Vaccine Immunol, 2006; (13): 1185–89.
73 Peeling WR, Artsob H, Pelegrino JL, Buchy P, Cardosa MJ, Devi S, et al. Evaluation of diagnostic tests: dengue. Nat Rev Microbiol. 2010 Dec;8(12 Suppl):S30-8.
74 Ananda Rao R, Swaminathan S, Fernando S, Jana AM, Khanna N. Recombinant multiepitope protein for early detection of dengue infections. Clin Vaccine Immunol. 2006;(13):59–67.
75 Ananda Rao R, Swaminathan S, Khanna N. The identification of immunodominant linear epitopes of dengue type 2 virus capsid and NS4a proteins using pin-bound peptides. Virus Research 2005;(112):60–68.
76 Lai CY, Tsai WY, Lin SR. Antibodies to envelope glycoprotein of dengue virus during the natural course of infection are predominantly cross-reactive and recognize epitopes containing highly conserved residues at the fusion loop of domain II. J Virol 2008;82:6631–6643
77 Libraty DH, Young PR, Pickering D, Endy TP, Kalayanarooj S, Green S, et al. High circulating levels of the dengue virus nonstructural protein NS1 early in dengue illness correlate with the development of dengue hemorrhagic fever. J Infect Dis. 2002;186(8):1165-8.
78 Alcon S, Talarmin A, Debruyne M, Falconar A, Deubel V, et al. Enzyme-linked immunosorbent assay specific to dengue virus type 1 nonstructural protein NS1 reveals circulation of the antigen in the blood during the acute phase of disease in patients experiencing primary or secondary infections. J Clin Microbiol 2002;(40):376–81.
79 Wu HC, Huang YL, Chao TT, Jan JT, Huang JL, Chiang HY, et al. Identification of B-cell epitope of dengue virus type 1 and its application in diagnosis of patients. J Clin Microbiol. 2001;39(3):977-82.
80 Sun EC, Ma JN, Liu NH, Yang T, Zhao J, et al. Identification of two linear B-cell epitopes from West Nile virus NS1 by screening a phage displayed random peptide library. BMC Microbiology 2011;11:160.
81 Fatima A, Wang H, Kang K, Xia L, Wang Y, Ye W et al. Development of VHH Antibodies against Dengue Virus Type 2 NS1 and Comparison with Monoclonal Antibodies for Use in Immunological Diagnosis. PLOS ONE 2014l;9(4) e95263.
82 Cabezas S, Rojas G, Pavon A, Alvarez M, Pupo M, Guillen G, et al. Selection of phage-displayed human antibody fragments on Dengue virus particles captured by a monoclonal antibody: application to the four serotypes. J Virol Methods. 2008;147(2):235-43.
83 Cabezas S, Rojas G, Pavon A, Bernardo L, Castellanos Y, Alvarez M, et al. Phage-displayed antibody fragments recognizing dengue 3 and dengue 4 viruses as tools for viral serotyping in sera from infected individuals. Arch Virol. 2009;154(7):1035-45.
84 Machold KP, Smolen JS. Adalimumab - a new TNF-alpha antibody for treatment of inflammatory joint disease. Expert Opin Biol Ther. 2003 Apr;3(2):351-60.
85 Filpula D. Antibody engineering and modification technologies. Biomol Eng. 2007 Jun;24(2):201-15.
86 Hoogenboom HR. Selecting and screening recombinant antibody libraries. Nat Biotechnol. 2005 Sep;23(9):1105-16.
87 Petrenko VA, Sorokulova IB. Detection of biological threats. A challenge for directed molecular evolution. J Microbiol Methods. 2004 Aug;58(2):147-68.
88 Petrenko VA, Vodyanoy VJ. Phage display for detection of biological threat agents. J Microbiol Methods. 2003 May;53(2):253-62.
89 Morino K, Katsumi H, Akahori Y, Iba Y, Shinohara M, Ukai Y, et al. Antibody fusions with fluorescent proteins: a versatile reagent for profiling protein expression. J Immunol Methods. 2001 Nov 1;257(1-2):175-84.
90 Muller BH, Chevrier D, Boulain JC, Guesdon JL. Recombinant single-chain Fv antibody fragment-alkaline phosphatase conjugate for one-step immunodetection in molecular hybridization. J Immunol Methods. 1999 Jul 30;227(1-2):177-85.
91 Hancock RE. Peptideantibiotics. Lancet. 1997; 349:418–422.
92 Cheng AC, et al. Structure-based maximal affinity model predicts small-molecule druggability. Nat. Biotechnol.2007; 25:71–75.
93 Hopkins AL, Groom CR. Thedruggablegenome. Nat. Rev. DrugDiscov. 2002; 1:727–30.
94 Saerens D, Ghassabeh GH, Muyldermans S. Antibodytechnology in proteomics. Brief. Funct. Genomic. Proteomic. 2008; 7:275–282.
95 Vispo NS, Felici F, Castagnoli L, Cesareni G. Hybrid Rop-pIII proteins for the display of constrained peptides on filamentous phage capsids. Ann Biol. Clin. 1993; 50: 917-22.
96 Pini A. Antimicrobial activity of novel dendrimeric peptides obtained by phage display selection and rational modification. Antimicrob. Agents Chemother. 2005; 49:2665–72.
97 Rojas G, Pupo A, Del Rosario Aleman M, Vispo NS. Preferential selection of Cys-constrained peptide from a random phage-displayed library by anti-glucitollysine antibodies.J PeptSci. 2008 Nov; 14(11):1216-21.
1 Doctor en Ciencias. Investigador Titular. Prof. Titular. Investigador Prometeo del SENESCYT Ecuador, Ministerio de Industrias y Productividad. Zona 1 de desarrollo del Ecuador. Docente Universidad Yachay Tech. Ecuador.
2 Doctor en Ciencias. Dirección de Investigaciones, Instituto Finlay. Centro de Investigación-Desarrollo-Producción de Vacunas.
La Habana, Cuba.
3 Doctor en Ciencias. Profesor Titular. Departamento de Microbiología y Virología. Laboratorio de Virología. Facultad de Biología.
Universidad de la Habana Cuba.
4 Doctor en Ciencias. Departamento de Fisiopatología, Facultad de Ciencias Biológicas, Universidad de Concepción, Chile.
5 Doctor en Ciencias. Departamento de Farmacología, Faculta de Ciencias Biológicas, Universidad de Concepción, Chile.
Autor de correspondencia: Nelson Santiago Vispo. [email protected]
Como citar este articulo: Santiago Vispo, N., Camacho, F., Pupo Antúnez, M., Toledo, R., & Sánchez Ramos, O. (2016). Display technology on filamentous phage in the search for anti-infective biological agents. Bionatura, 1(1), 22–29. doi:10.21931/rb/2016.01.01.6