2023.08.04.36
Files > Volume 8 > Vol 8 no 4 2023
Formulación y caracterización de una crema de anfotericina B y aceite esencial de Bursera graveolens para el tratamiento local de la candidiasis cutánea
Formulation and characterization of an amphotericin B cream and Bursera graveolens essential oil for the local treatment of cutaneous candidiasis
Lupe Carolina Espinoza 1,* , Oscar
Correa 1 , Lilian Sosa 2,3, Natalia Días-Garrido 4,
Santiago Ojeda 1, Eduardo Valarezo 1, Luis Cartuche 1,
Thalía Bravo 1 y Paulo C.
Granda 1,5.
1 Departamento de Química,
Laboratorio de Tecnología Farmacéutica y Productos Naturales, Universidad
Técnica Particular de Loja, Loja 110150, Ecuador.
2 Instituto de Investigaciones en Microbiologia (IIM), Universidad
Nacional Autonóma de Honduras (UNAH), Tegucigalpa, Honduras.
3 Instituto de Investigación de Ciencias Aplicadas y Tecnológicas (IICAT),
Universidad Nacional Autonóma de Honduras (UNAH), Tegucigalpa, Honduras.
4 Department of Biochemistry and Physiology, Faculty
of Pharmacy and Food Sciences, University of Barcelona, 08028 Barcelona, Spain.
5 Department of Pharmacy, Pharmaceutical Technology
and Physical Chemistry, Faculty of Pharmacy and Food Sciences, University of
Barcelona, 08028, Barcelona, Spain.
*Corresponding author: [email protected]
Available
from. http://dx.doi.org/10.21931/RB/2023.08.04.36
RESUMEN
La candidiasis cutánea es una micosis producida
principalmente por la proliferación de Candida albicans. La anfotericina
B es un fármaco altamente eficaz que se administra por vía intravenosa para
tratar esta enfermedad infecciosa. Los tratamientos locales con este fármaco
están limitados por el elevado peso molecular y alta hidrofobicidad que limitan
su paso a través de la piel. Objetivo. El propósito de este estudio fue diseñar
y caracterizar una crema tópica de anfotericina B enriquecida con aceite esencial
de Bursera graveolens (denominado tambien aceite de palo santo) para
promover la permeación de este fármaco. La formulación fue elaborada utilizando
excipientes farmacéuticamente aceptados para su uso tópico. Se evaluaron
diferentes parámetros físicos y químicos como: pH, comportamiento reológico,
extensibilidad, contenido de fármaco y estabilidad. Los estudios de permeación ex
vivo fueron realizados utilizando piel humana y celdas de difusión de
Franz. La actividad antimicrobiana in vitro de la crema fue evaluada
mediante determinación de la Concentración Mínima Inhibitoria (CMI) contra cepas
de C. albicans y su citotoxicidad
fue analizada utilizando la línea celular de queratinocitos humanos HaCaT.
Resultados. La formulación presentó características apropiadas para su
administración tópica incluyendo un pH de 5.6, una viscosidad de 854.0±30.21 mPa·s con comportamiento
pseudoplástico, una adecuada extensibilidad, así como alta estabilidad y baja
citotoxicidad. La incorporación del aceite esencial de B. graveolens mejoró la difusión del fármaco a
través del estrato córneo (675.98
µg/g/cm2) y aumentó la eficacia contra el patógeno
aproximadamente 4 veces con respecto a una formulación de anfotericina B sin el
aceite esencial. Conclusión. La crema de anfotericina B formulada en este
estudio presenta resultados prometedores para infecciones causadas por C.
albicans desde el punto de vista fisicoquimico y microbiológico, estudios
en humanos se recomiendas para evaluar su actividad in vivo.
Palabras clave: candidiasis, anfotericina B, aceite esencial, Bursera graveolens.
ABSTRACT
Cutaneous candidiasis is a
mycosis caused mainly by the proliferation of Candida albicans.
Amphotericin B is a highly effective intravenously drug to treat this
infectious disease. Local treatments with this drug are limited by the high
molecular weight and high hydrophobicity that limit its passage through the
skin. Aim. This study aimed to design and characterize a topical amphotericin B
cream enriched with Bursera graveolens essential oil (also known as palo
santo oil) to promote the permeation of this drug. The formulation was prepared
using pharmaceutically accepted excipients for topical use. Physical and
chemical parameters, such as pH, rheological behavior, extensibility, drug
content, and stability, were evaluated. Ex vivo permeation studies were
performed using human skin and Franz diffusion cells. The in vitro
antimicrobial activity of the cream was evaluated by determining the Minimum
Inhibitory Concentration (MIC) against C. albicans strains, and its
cytotoxicity was analyzed using the HaCaT human keratinocyte cell line.
Results. The formulation presented appropriate characteristics for topical
administration, including a pH of 5.6, a viscosity of 854.00 ± 30.21 mPa·s with
pseudoplastic behavior, adequate extensibility, high stability and low
cytotoxicity. Incorporating the essential oil of B. graveolens improved the
diffusion of the drug through the stratum corneum (675.98 µg/g/cm2). It
increased the efficacy against the pathogen approximately 4 times compared to
an amphotericin B formulation without the essential oil. Conclusion. The
amphotericin B cream formulated in this study presents promising results for
infections caused by C. albicans from a physicochemical and
microbiological point of view; studies in humans are recommended to evaluate
its in vivo activity.
Keywords: candidiasis, amphotericin B, essential oil, Bursera
graveolens.
INTRODUCCIÓN
En la actualidad los casos de micosis
cutáneas tienen una gran importancia clínica debido al continuo aumento de
pacientes y la resistencia a los fármacos convencionales1. La candidiasis cutánea destaca como
una de las micosis superficiales de mayor frecuencia, la cual es producida por
la proliferación en la piel de organismos fúngicos del tipo Candida spp.,
principalmente C. albicans2,
3. La infección por este hongo produce
irritación en la piel, enrojecimiento y la formación de edemas acompañados de
prurito intenso4.
Los tratamientos empleados contra C. albicans consisten en el uso de
azoles y polienos, entre ellos clotrimazol, miconazol, fluconazol, itraconazol
y nistatina. Sin embargo, el uso constante e inadecuado de estos medicamentos
ha provocado que C. albicans desarrolle mecanismos de resistencia a
ellos5,
6. Frente a esto, se han empleado
fármacos con mayor umbral terapéutico como la anfotericina B, un fármaco
altamente eficaz para tratar diversas patologías relacionadas con hongos. El
mecanismo de acción de este fármaco consiste en unirse al ergosterol presente
en la membrana celular del agente fúngico, creando canales que inducen pérdida
de protones y cationes monovalentes y, en consecuencia, despolarización y
muerte celular7. No obstante, su uso se ve limitado
ya que debido a su administración intravenosa provoca un efecto sistémico
causando efectos adversos graves como la hepatotoxicidad y nefrotoxicidad8,
9.
Una formulación tópica de
anfotericina B podría ser usado como estrategia para provocar un efecto local
en la piel y reducir los efectos sistémicos del fármaco. Sin embargo, la
Anfotericina B tiene un elevado peso molecular (926.07 Da) y una pobre
solubilidad lo que dificulta su permeación a través del estrato córneo y su
distribución en la epidermis y la dermis, siendo necesario la incorporación de
excipientes con propiedades potenciadoras de la permeabilidad, los cuales
idealmente deberían inducir una reducción temporal y reversible de la función
de barrera del estrato córneo para facilitar la permeación del fármaco a través
de la piel 8,
10, 11.
Los aceites esenciales han sido
objeto de interés dentro de la industria farmacéutica debido a sus propiedades
como promotores en la permeación de fármacos, así como sus actividades
antibacterianas, antifúngicas, antioxidantes y antiinflamatorias12,
13. Como promotores de la permeación, los aceites
esenciales aumentan la difusión del fármaco mediante cambios en la estructura
del estrato córneo y la interacción con los lípidos intercelulares, esta
propiedad facilita el transporte de moléculas por las diferentes capas de la
piel siendo útil para mejorar la biodisponibilidad de algunos fármacos14,
15.
En particular, el aceite esencial
obtenido a partir del fruto de Bursera graveolens compuesto
principalmente de limoneno (49,89%), α-felandreno (37,64%) y mentofurano
(6,08%), es un metabolito secundario volátil de interés ya que su composición
química rica en terpenos le confiere al aceite una posible acción potenciadora
de la permeación de fármacos16,
17. Adicionalmente, varios estudios han
reportado importantes actividades terapéuticas del aceite esencial de B.
graveolens incluyendo su potencial antioxidante, antifúngico y
anticancerígeno18.
Con estos antecedentes, el propósito
de este estudio fue diseñar y caracterizar una crema tópica de anfotericina B y
aceite esencial de B. graveolens como alternativa para el tratamiento
local de la candidiasis cutánea.
MATERIALES Y MÉTODOS
La anfotericina B
fue obtenida de la empresa Acofarma (Barcelona, España). El Dimetilsulfoxido
(DMSO) fue obtenido de la empresa Alfa Aesar (Massachusetts, Estados Unidos). El aceite de B.
graveolens fue donado del Laboratorio de Operaciones Unitarias de la
Universidad Técnica Particular de Loja17. El Propilenglicol
fue adquirida de Sigma-Aldrich (San
Luis, Misuri, Estados Unidos). El alcohol cetoestearílico,
Petrolato líquido, Alcohol cetílico, Tween 80, Ácido cítrico y Benzoato de
sodio se obtuvieron de Fagron Ibérica (Barcelona, España). Todos los compuestos
químicos y reactivos fueron de grado analítico.
Cuantificación por
Cromatografía Líquida de Alta Resolución (HPLC)
La valoración de la
anfotericina B se realizó usando un cromatógrafo líquido de alta resolución (HPLC, por sus siglas en inglés) Thermo Scientific™
UltiMate™ 3000 acoplado a espectrometría de masas amaZon speed - Bruker
Daltonics. El método cromatográfico se llevó a cabo utilizando una columna
Kromasil C18 (250×4.4 mm, 5µm) y una fase móvil de acetonitrilo y ácido acético
glacial al 3,75% (65:35, v/v), la cual fue bombeada a un caudal de 0.5
mL/min. Se inyectó un volumen de 10 µL y se analizó el eluido a una longitud de
onda UV de 407 nm.
Desarrollo de la
crema tópica de anfotericina B y aceite esencial de B.
graveolens
Para la preparación
de la crema tópica, la anfotericina B fue disuelta en DMSO, se incorporó el
propilenglicol y finalmente el aceite de B. graveolens mediante
agitación constante. El alcohol cetoestearílico, alcohol cetílico y petrolato
líquido fueron fundidos a 55 ºC. A la vez, el benzoato de sodio y ácido cítrico
fueron disueltos a la misma temperatura en agua destilada. Posteriormente, se
mezclaron los aceites fundidos con la fase acuosa y el tween 80 durante 3
minutos utilizando un agitador Ultraturrax IKA T50 a 1500 rpm. Finalmente, se
incorporó la mezcla de anfotericina B, propilenglicol y aceite de B.
graveolens agitando durante 2 minutos.
Caracterización
física y química
Se realizó un
control organoléptico analizando el color, olor y apariencia del producto
desarrollado. Asi mismo, se llevó a cabo un control de calidad físico químico
que incluyó análisis de pH, comportamiento reológico, viscosidad y contenido de
fármaco. El pH de la crema se determinó utilizando un pH metro GLP 22.
Las mediciones
reológicas y de viscosidad de la crema de anfotericina B y aceite de B.
graveolans se realizaron con un reómetro rotacional Thermo Scientific Haake
Rheostress 1 (Thermo Fisher Scientific, Kalsruhe, Alemania) equipado con un
sistema sensor de placa cónica que incluye una placa inferior fija y un cono
superior móvil Haake C60 / 2Ti. (60 mm de diámetro, 2º ángulo, 0,105 mm de
separación). Después de 24 h de preparación de la crema, se realizó el
experimento por duplicado, en el cual la muestra fue sometida a un programa de
perfil de corte de 3 pasos: un periodo de aceleración (0 a 50 s-1)
durante 3 min, período de velocidad de cizallamiento constante a 50 s-1
durante 1 min y un periodo de desaceleración (50 a 0 s-1) durante 3
min.
La determinación de
la alteración de la microestructura durante la prueba o "tixotropía
aparente" (Pa/s) se evaluó mediante la determinación del área del bucle de
histéresis. Luego, los datos obtenidos de las curvas de flujo se ajustaron a
diferentes modelos matemáticos: Newton, Bingham, Ostwald-de-Waele, Cross,
Casson y Herschel-Bulkley y se seleccionó el mejor ajuste según el valor del
coeficiente de correlación (r)19.
La extensibilidad
de la formulación se analizó utilizando 1 g de muestra, la cual fue colocada en
el centro de la placa base de un extensómetro (Departamento de Farmacia y
Tecnologia Farmaceutica y Fisicoquímica). Posteriormente, se colocó una placa
de vidrio (7,93 g) sobre la muestra sin deslizar y se añadieron una serie de
pesos (7.93, 27.89, 57.82, 107.69, 157.55, 207.46, 237.50 y 307.69 g) a
intervalos de 1 min. El área extendida de la muestra se registró y luego se
ajustó a modelos matemáticos utilizando GraphPad Prism® versión 6.0.
El contenido de
fármaco en la crema se determinó disolviendo 100 mg de formulación en 5 mL de
DMSO: metanol (1:1, v/v). Después de someter a baño de ultrasonido
durante 1 min, la solución se filtró y se analizó mediante el método de HPLC
descrito anteriormente.
Estudios de
estabilidad física y química
Para los estudios
de estabilidad, se almacenaron muestras de crema en envases de vidrio ámbar de
100 mL de capacidad en condiciones preestablecidas de temperatura y humedad
relativa (HR): 30±2 °C / 65±5% HR y 25±2 °C / 60±5% HR durante 3 meses. La
caracterización física y química de la formulación se realizó antes y después
del almacenamiento en las condiciones mencionadas de acuerdo con los métodos
descritos en el apartado previo. El contendio de crema en los envases de vidrio
ambar fue de aproximadamente de 90 mL.
Estudios de
permeación ex vivo
Para los estudios
de permeación, se probó la crema formulada a base de anfotericina B y aceite
esencial de B. graveolens y adicionalmente, se desarrolló una segunda
crema utilizando la misma fórmula cuali-cuantitativa, pero sin la incorporación
del aceite esencial, con el fin de evaluar el papel de este aceite en la
permeación de fármacos. Estos ensayos se realizaron en celdas de difusión de
Franz de 6 mL con área de difusión de 0,64 cm2 utilizando Transcutol
P como medio receptor, el cual fue mantenido en constante agitación durante
todo el experimento. Muestras de piel humana fueron usadas como membranas para
la permeación, las mismas que fueron obtenidas durante una lipectomía abdominal
de una mujer sana de 38 años, quien otorgó su consentimiento informado por
escrito de acuerdo con el Comité Ético (número 001, de 20 de enero de
2016). Las muestras de piel cortadas a
0.4 mm de espesor fueron montadas entre el compartimento donante y receptor y
se ajustó la temperatura de ensayo a 32±0.5 °C. Se colocó una muestra de 200 mg
de cada formulación en el compartimento donante en contacto con la superficie
exterior de la piel y a intervalos prestablecidos de tiempo se recogieron
alícuotas de 300 µL del compartimento receptor y reemplazándose con el mismo
volumen de medio receptor fresco. Estas alícuotas se analizaron por HPLC
utilizando la metodología previamente descrita. Al final del experimento, se
retiraron las muestras de piel de las celdas de difusión de Franz, se lavaron
con agua destilada y se cortaron en sus bordes para retener solo el área de
permeación. Luego, las muestras de piel se pesaron y se sumergieron en 1 mL de
DMSO durante 30 min bajo sonicación fría para extraer el fármaco retenido en la
piel (Qret, µg fármaco/g tejido/cm2). Finalmente, la solución
resultante se filtró y analizó por HPLC.
Estudios de
citotoxicidad
Se realizó un
ensayo de citotoxicidad de MTT in vitro
usando la línea celular de queratinocitos humanos HaCaT. Las células se
ajustaron a 2 × 105 células/mL, se sembraron en una placa de 96
pocillos durante 24 h en medio Eagle modificado de Dubelcco (DMEM) con alto
contenido de glucosa tamponado con HEPES 25mM y se suplementaron con 1% de
aminoácidos no esenciales: 100 U/mL de penicilina, 100 g/mL de estreptomicina y
suero fetal bovino inactivado por calor al 10%. Luego, las células se incubaron
con diferentes diluciones (1/500 a 1/2000 durante 24 h) de crema formulada a base de
anfotericina B y aceite esencial de B. graveolens. Posteriormente, las células HaCaT se lavaron con PBS estéril al 1% y
se incubaron con solución de MTT (Sigma-Aldrich Chemical Co, St. Louis, MO, EE.
UU.) (2.5 mg/mL) durante 2h a 37°C. A continuación, se eliminó cuidadosamente
el medio y se añadieron 0.1 mL de reactivo de solubilización (Dimetilsulfóxido
al 99%) para lisar las células y disolver los cristales de MTT de color
púrpura. La viabilidad celular se midió a 570 nm en un fotómetro de microplaca
Varioskan TM LUX (Thermo Scientific, Waltham, MS, EE. UU.). Paralelamente, se
procesó un control negativo (células sin estimulación ni tratamiento) para su
comparación. Los resultados se expresaron como porcentaje de supervivencia
celular en relación con el control (células HaCaT no tratadas, viabilidad del
100%) usando la siguiente ecuación:
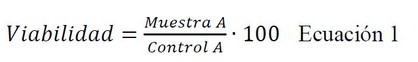
Estudios de
eficacia microbiológica in vitro
Para la
determinación de la Concentración mínima inhibitoria (CMI) se realizó un
estudio de micro dilución en caldo con la técnica doble seriada según el
procedimiento de EUCAST usando esporas de C. albicans ATCC 10231. Estas
cepas fueron incubadas para su reactivación mediante la técnica Overnight 18
horas antes del ensayo. Seguidamente se tomaron 10 mL del caldo Saboround de la
empresa BD con 10 µL de la cepa Overnight con el fin de llegar a una concentración
de 1.5x según la escala de McFarland.
Por otro lado, se
preparó una solución de la crema disolviendo sobre 80 µL de DMSO 1 mg de la
crema preparada con una concentración inicial de 1 µg/mL. Se probaron la crema
formulada a base de anfotericina B y aceite esencial de B. graveolens y
una crema de anfotericina B con la misma fórmula cuali-cuantitativa, pero sin
la incorporación del aceite esencial.
En una microplaca
estéril de 96 pocillos se dispensó 180 µL de caldo Saboraund, y 20 µL de
solución de crema, siendo la primera dilución de la cual se resuspendió y se
tomó 100 µL y se dispensó en el siguiente pocillo, repitiendo este
procedimiento hasta obtener las concentraciones seriadas desde 1 µg/mL hasta
0.015625 µg/mL. Finalmente se añadió 100 µL de la cepa preparada (1.5x). Se incubó a 37
ºC por 24 horas en una incubadora INB 500.
RESULTADOS Y DISCUSIÓN
Formulación y caracterización de la crema de anfotericina B y aceite esencial de B. graveolens
La fórmula de composición del producto desarrollado se detalla en la
Tabla 1. La formulación presentó un color durazno, olor cítrico maderero
intenso y una apariencia totalmente homogénea, libre de grumos y precipitados,
evidenciando una buena afinidad entre los excipientes20.
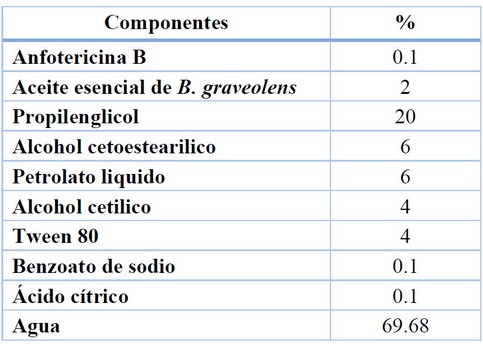
Tabla 1. Composición de la crema de anfotericina B y aceite esencial de B.
graveolens.
El pH de la crema fue ligeramente ácido (5.6) mostrando un pH eudérmico,
lo que indica que sería ideal para su aplicación tópica debido a la
biocompatibilidad con la acidez natural de la piel asegurando efectos no
irritantes 21. El contenido de fármaco evaluado mediante
HPLC mostró un valor de 99.1±0,06% al día siguiente de la fabricación del
producto.
La viscosidad y el comportamiento reológico de
una formulación influyen en parámetros biofarmacéuticos como las velocidades y
cantidades de liberación de fármacos a partir de sus vehículos y proporcionan
información sobre las características sensoriales, la capacidad de
esparcimiento y el comportamiento de llenado/dosificación de la fórmula 22. En este estudio, se determinó que la crema
de anfotericina B y aceite esencial de B. graveolens presenta un comportamiento
reológico pseudoplástico (modelo Cross
r2=0.9997) con una viscosidad media a 50 s-1 de 854.0±30.21 mPa·s.
Asimismo, se encontró una tixotropía aparente de 958,3 Pa/s (bucle de hysteresis) (Figura 1). El comportamiento tixotrópico favorece la
aplicación tópica, ya que en este tipo de reología la viscosidad de la
formulación varía con el rozamiento e induce una mejor retención sobre la piel
lo que genera ventajas especialmente en aquellos casos donde deseamos que el
efecto sea local 23.
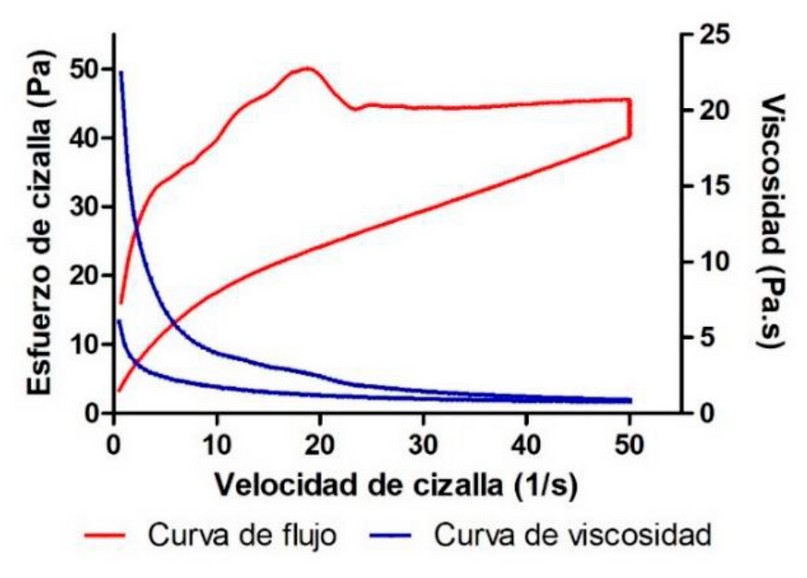
Figura 1.
Comportamiento reológico de la crema de anfotericina B y aceite esencial de B.
graveolens
Los valores de extensibilidad a 25 °C
aumentaron proporcionalmente con el peso adicionado hasta alcanzar una
extensibilidad máxima de 17.21 cm2 siguiendo un modelo matemático de
asociación de una fase (Figura 2). Este resultado indica características
óptimas y adecuadas para la manipulación, distribución y absorción de la crema
en el sitio de aplicación, siendo agradable al tacto y cómodo para su uso en
los pacientes24, 25.
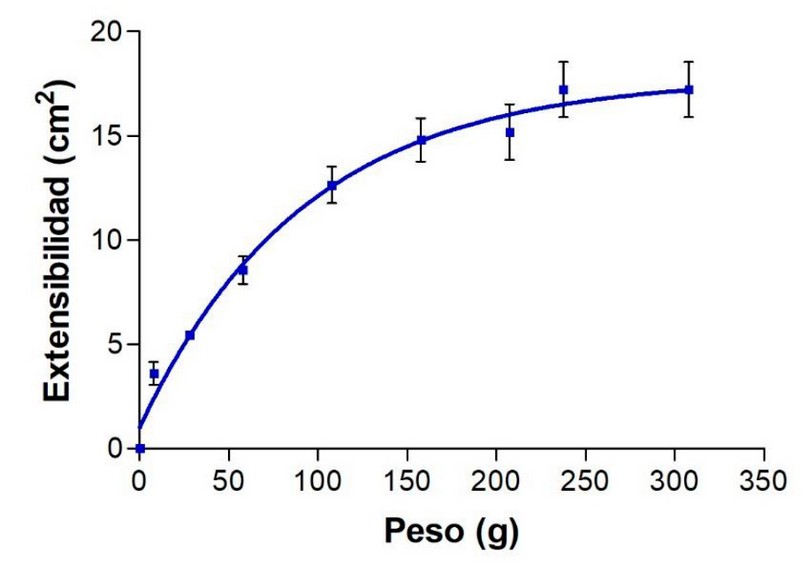
Figura 2. Perfil de
extensibilidad de la crema de anfotericina B y aceite esencial de B.
graveolens.
Estudios de estabilidad física y química
Durante los estudios de estabilidad llevados a
cabo durante 3 meses a 25 y 30 °C, la formulación no mostró cambios en los
aspectos organolépticos como color, olor y apariencia, lo que sugiere ausencia
de posibles interacciones químicas que alteren las cualidades de la crema.
Estos resultados fueron corroborados con los análisis a nivel físico y químico
(Tabla 2), los cuales confirmaron que parámetros como el pH y viscosidad se
mantienen sin cambios significativos en las diferentes condiciones de almacenamiento,
mostrando valores adecuados para su uso dérmico24, 26, 27.
El contenido de fármaco dentro de la crema se mantuvo estable durante
los 3 meses de estudio, únicamente se observó una disminución de 0.1 y 0.6% de
fármaco en las muestras almacenadas a 25 y 30 °C, respectivamente. Este
resultado sugiere una alta compatibilidad entre el fármaco y los excipientes
utilizados, confiriendo a la formulación final una estabilidad química
aceptable y en consecuencia se garantiza la eficacia del fármaco. Sin embargo,
estudios adicionales de estabilidad a largo plazo son requeridos para confirmar
estos hallazgos y dar cumplimiento a las normas internacionales28.
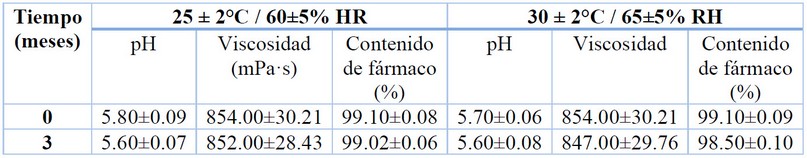
Tabla 2. Estabilidad fisicoquímica de la crema de anfotericina B y
aceite esencial de B. graveolens
Estudios de
permeación ex vivo
La eficacia de un producto administrado
tópicamente depende de la capacidad del fármaco para atravesar el estrato
córneo y así alcanzar una concentración efectiva en el sitio acción 29, 30. El gran peso molecular (926.07 Da) y la alta
hidrofobicidad de la anfotericina B podría limitar su paso a través de la piel,
por ello el uso de estrategias de formulación como la adición de promotores de
permeación podrían ser útiles para sobrellevar estas desventajas 31. En este estudio, la permeación ex vivo se
realizó con la crema formulada a base de anfotericina B más aceite esencial de B.
graveolens y una crema de anfotericina B en ausencia de este aceite con el
objetivo de evaluar el rol del aceite esencial en la permeación del fármaco.
Los resultados mostraron que no se detectó anfotericina B en el compartimento
receptor en ninguna de las dos formulaciones durante un período de 24 h de
ensayo. Este mismo comportamiento se ha observado en otros estudios donde no
hubo permeación del fármaco en formulaciones elaboradas a base de anfotericina
B31, 32. A pesar de que en nuestro estudio no se
observó permeación, si se encontró fármaco retenido dentro de la piel con un
valor mayor para la crema con aceite esencial (675.98 µg/g/cm2) en
comparación con la crema realizada sin dicho aceite (342.19 µg/g/cm2). Este resultado sugiere que la adición del
aceite esencial de B. graveolens mejoró la difusión del fármaco a través de la
epidermis y la dermis, posiblemente debido a su contenido rico en terpenos como
d-limoneno que según reportes promueve la
permeación de fármacos hidrófilos y lipófilos mediante cambios reversibles en
el empaquetamiento intercelular y la estructura lipídica del estrato córneo
facilitando la difusión del fármaco33. La permeación no detectada y la
significativa cantidad de fármaco retenido en la piel para la crema de
anfotericina B y aceite esencial de B. graveolens indica que el fármaco
no se absorberá y que su efecto será eminentemente local.
Estudios de
citotoxicidad
El efecto de diferentes concentraciones de crema formulada a base de
anfotericina B y aceite esencial de B.
graveolens sobre queratinocitos humanos se evaluó utilizando el ensayo
de citotoxicidad MTT. Luego de 24 h de incubación, se observó que las
diferentes diluciones ensayadas (1/500 hasta 1/2000) de la crema no afectaron
la viabilidad celular, ya que los resultados obtenidos para las células de
control fueron similares a los de la incubación de la crema (Figura 3). Por lo
tanto, estos resultados sugieren que el producto desarrollo en el presente
trabajo no desencadena toxicidad en los queratinocitos.
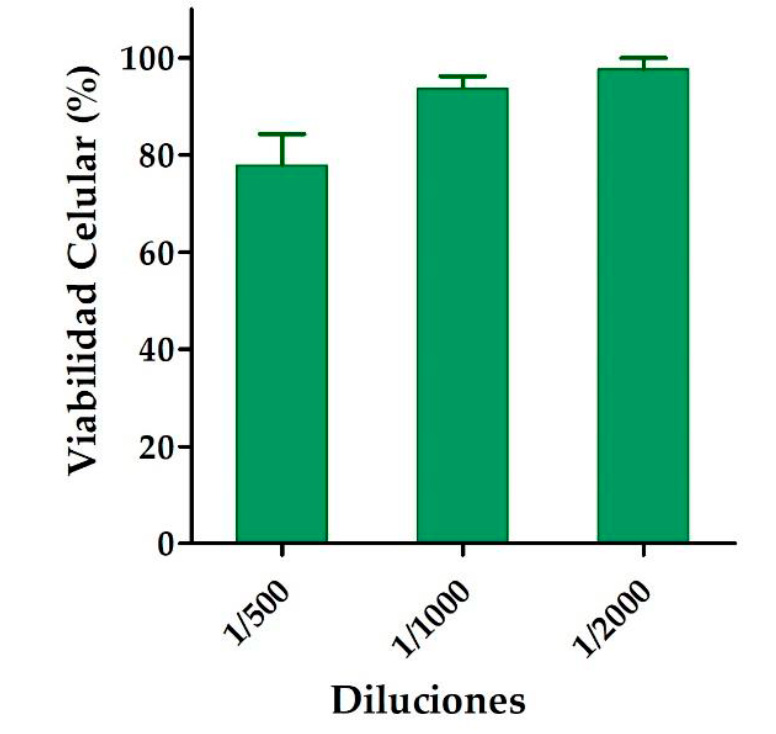
Figura 3.
Porcentaje de viabilidad de la línea celular HaCaT expuesta a diferentes
concentraciones de la crema de anfotericina B y aceite esencial de B. graveolens.
Estudios de eficacia microbiológica in vitro
En la tabla 3, se detallan los
resultados obtenidos para la crema formulada a base de anfotericina B más aceite
esencial de B. graveolens y la crema de anfotericina B en ausencia de
este aceite.

Tabla 3. Concentración Mínima Inhibitoria frente a C. albicans
La CMI para la crema sin este aceite
fue de 0.125 µg/ml mientras que para la crema de anfotericina B y aceite
esencial fue de 0.0321 µg/mL, es decir casi 4 veces menor y por lo tanto es más
eficaz5, 34. El aumento de la actividad
antimicótica proporcionado por la presencia del aceite esencial de
B. graveolens podría deberse a sus componentes
terpénicos, los cuales le brindan una actividad antifúngica adicional
posiblemente mediante inhibición en la síntesis de ergosterol, inhibición
enzimática, cambios en la permeabilidad de la membrana y ruptura de ésta induciendo
la muerte del patógeno. Actualmente, la terapia combinada de fármacos especialmente
antifúngicos con terpenos ha revelado efectos prometedores contra patógenos
susceptibles y resistentes. En nuestro estudio, la combinación de anfotericina
B con aceite esencial de B. graveolens en una formulación tópica mostró
una actividad mejorada contra C. albicans, sugiriendo un posible efecto
sinérgico entre los componentes activos de este aceite y el fármaco12, 13.
CONCLUSIONES
La crema de
anfotericina B y aceite esencial de B. graveolens desarrollada en este
estudio presentó características apropiadas de pH, viscosidad y extensibilidad
para la aplicación tópica. Adicionalmente, los estudios de permeación ex vivo y
de eficacia antimicrobiana contra C. albicans, demostraron que la
presencia del aceite esencial de B. graveolens en la formulación mejora
la permeación del fármaco a través de la piel y aumenta la eficacia contra el
patógeno aproximadamente 4 veces al comparar con la formulación en ausencia de
dicho aceite, lo que la convierte en una alternativa prometedora en el
tratamiento de la candidiasis cutánea y motiva a llevar a cabo estudios más
profundos para explorar su uso en la práctica clínica.
Author Contributions: LCE y LS han
conceptualizado la idea, EV ha realizado la extracción del aceite esencial,
OC-SO-LC-TB han realizado las formulaciones y estabilidad física y química. LCE
y LS han realizado los ensayos reológicos y de permeción exvivo. NDG y PCG
han realizado los ensayos de citotoxicidad. LS y LCE han realizado los análisis
estadisticos microbiológicos. LCE, LS y PCG han escrito, analizado y revisado
el documento.
Acknowledgments: Agradecemos la colaboración de la Dra. Lyda Halbaut
de la Universidad de Barcelona por el apoyo en los estudios reológicos. A la
Dra. Ana Calpena de la Universidad de Barcelona por la revisión de los
resultados de permeación y retención exvivo.
Conflicts of
Interest: "The authors
declare no conflict of interest."
REFERENCES
1. Kollipara R, Peranteau AJ, Nawas ZY,
Tong Y, Woc-Colburn L, Yan AC, et al. Emerging infectious diseases with
cutaneous manifestations: Fungal, helminthic, protozoan and ectoparasitic
infections. J Am Acad Dermatol. 2016;75(1):19-30.
2. Havlickova B,
Czaika VA, Friedrich M. Epidemiological trends in skin mycoses worldwide. Wiley-Blackwell.
2008;51(4):2-15.
3. Permana AD,
Paredes AJ, Volpe-Zanutto F, Anjani QK, Utomo E, Donnelly RF. Dissolving
microneedle-mediated dermal delivery of itraconazole nanocrystals for improved
treatment of cutaneous candidiasis. Eur J Pharm Biopharm. 2020;154:50-61.
4. Wall G,
Montelongo-Jauregui D, Vidal Bonifacio B, Lopez-Ribot JL, Uppuluri P. Candida
albicans biofilm growth and dispersal: contributions to pathogenesis. Curr
Opin Microbiol. 2019;52:1-6.
5. Andreu CMF,
Martínez DG, Illnait DM, Pururena LM. Sensibilidad
in vitro de cepas de Candida frente a fluconazol y Anfotericina B. Rev Cub
Med. 2007;59(2).
6. Oliveira
Carvalho V, Okay TS, Melhem MS, Walderez Szeszs M, del Negro GM. The new
mutation L321F in Candida albicans ERG11 gene may be associated with
fluconazole resistance. Rev Iberoam Micol. 2013;30(3):209-12.
7. Yamamoto T,
Umegawa Y, Tsuchikawa H, Hanashima S, Matsumori N, Funahashi K, et al. The
Amphotericin B-Ergosterol Complex Spans a Lipid Bilayer as a Single-Length
Assembly. Biochemistry. 2019;58(51):5188-96.
8. Torrado JJ,
Espada R, Ballesteros MP, Torrado-Santiago S. Amphotericin B formulations and
drug targeting. J Pharm Sci. 2008;97(7):2405-25.
9. Lanternier F,
Lortholary O. Liposomal amphotericin B: what is its role in 2008? Clin Microbiol Infect. 2008;14 Suppl 4:71-83.
10. Lopez-Castillo
C, Rodriguez-Fernandez C, Cordoba M, Torrado JJ. Permeability
Characteristics of a New Antifungal Topical Amphotericin B Formulation with
gamma-Cyclodextrins. Molecules. 2018;23(12).
11. Karande P,
Jain A, Ergun K, Kispersky V, Mitragotri S. Design principles of chemical
penetration enhancers for transdermal drug delivery. Proceedings of the
National Academy of Sciences. 2005;102(13):4688-93.
12. Mendez AHS,
Cornejo CGF, Coral MFC, Arnedo MCA. Chemical Composition, Antimicrobial and
Antioxidant Activities of the Essential Oil of Bursera graveolens
(Burseraceae) From Perú. Indian
J. Pharm. Educ. Res. 2017;51(3s2):s429-s36.
13. Robles
J, Torrenegra R. Triterpenos aislados de corteza de Bursera graveolens
(Burseraceae)
y su actividad biologica. Artigo.
2005;15:283-6.
14. Bakkali F,
Averbeck S, Averbeck D, Idaomar M. Biological effects of essential oils--a
review. Food Chem Toxicol. 2008;46(2):446-75.
15. Chen J, Jiang
QD, Wu YM, Liu P, Yao JH, Lu Q, et al. Potential of Essential Oils as
Penetration Enhancers for Transdermal Administration of Ibuprofen to Treat
Dysmenorrhoea. Molecules. 2015;20(10):18219-36.
16. Carrión-Paladines
V, Fries A, Caballero RE, Pérez Daniëls P, García-Ruiz R. Biodegradation of
Residues from the Palo Santo (Bursera graveolens) Essential Oil Extraction and
Their Potential for Enzyme Production Using Native Xylaria Fungi from Southern
Ecuador. Fermentation. 2019;5(3).
17. Rey-Valeirón
C, Guzmán L, Saa LR, López-Vargas J, Valarezo E. Acaricidal activity of
essential oils of Bursera graveolens (Kunth) Triana & Planch and Schinus
molle L. on unengorged larvae of cattle tick Rhipicephalus (Boophilus)
microplus (Acari:Ixodidae). Journal of Essential Oil Research.
2017;29(4):344-50.
18. Monzotea L,
Hillb GM, Cuellarc A, Scullc R, Setzerb WN. Chemical Composition and
Anti-proliferative Properties of Bursera graveolens Essential Oil. Natural
Product Communications. 2012;7(11):1531-4.
19. Park EK, Song
KW. Rheological evaluation of petroleum jelly as a base material in ointment
and cream formulations, steady shear flow behaviour. Arch Pharm Res. 2010;33(6):141–50.
20. Ayala
Jara CI. Desarrollo y efecto antimicótico in vitro de una crema de Tropaeolum
majus L. (Tropaeolaceae) sobre Trichophyton rubrum (Arthrodermataceae). Arnaldoa.
2018;25(1):105-14.
21. González*
MdR, Yeverino ML, Aguirre D, Esquivel P. Estudio exploratorio de los valores de
pH en cremas. Revista de ciencias Farmacéuticas y Biomedicina. 2018;
Edición especial 2(1):43.
22. Espinoza
LC, Vera-Garcia R, Silva-Abreu M, Domenech O, Badia J, Rodriguez-Lagunas MJ, et
al. Topical Pioglitazone Nanoformulation for the Treatment of
Atopic Dermatitis: Design, Characterization and Efficacy in Hairless Mouse
Model. Pharmaceutics. 2020;12(3).
23. D B, MM A,
Sessa M HL, Guillén C B-MA, R F, AC C-C, et al. Topical Amphotericin B
Semisolid Dosage Form for Cutaneous Leishmaniasis: Physicochemical
Characterization, Ex Vivo Skin Permeation and Biological Activity. Pharmaceutics. 2020;12(2):149.
24. Suñè
JM, M JFY, Fernandez MPG. Extensibilidad en pomadas. Ars Pharmaceutica 1961;4-5(1):241-7
25. Bhandari PN,
Singhal* RS, Kale DD. Effect of succinylation on the rheological profile of
starch pastes. Elsevier. 2002;47:365 -71.
26. Ibánez
S, Suñé JM. Determinación pH y su relación con la piel. Ars
Pharmaceutica. 1969(1):453-67.
27. Gilbert L,
Picard C, Savary G, Grisel M. Rheological and textural characterization of
cosmetic emulsions containing natural and synthetic polymers: relationships
between both data. Colloids
Surf. A: Physicochem. Eng. 2013;421:150-63.
28. Sanchez-Quiles
I, Najera-Perez MD, Espuny-Miro A, Titos-Arcos JC. [Review of the
stabitlity of photosensitive medications]. Farm Hosp. 2011;35(4):204-15.
29. Hagen M, Baker
M. Skin penetration and tissue permeation after topical administration of
diclofenac. Curr Med Res Opin. 2017;33(9):1623-34.
30. Marwah H, Garg
T, Goyal AK, Rath G. Permeation enhancer strategies in transdermal drug
delivery. Drug Deliv. 2016;23(2):564-78.
31. Sosa
L, Calpena AC, Silva-Abreu M, Espinoza LC, Rincon M, Bozal N, et al. Thermoreversible
Gel-Loaded Amphotericin B for the Treatment of Dermal and Vaginal Candidiasis. Pharmaceutics. 2019;11(7).
32. Sosa
L, Clares B, Alvarado HL, Bozal N, Domenech O, Calpena AC. Amphotericin
B releasing topical nanoemulsion for the treatment of candidiasis and
aspergillosis. Nanomedicine. 2017;13(7):2303-12.
33. Yang Z, Teng
Y, Wang H, Hou H. Enhancement of skin permeation of bufalin by limonene via
reservoir type transdermal patch: formulation design and biopharmaceutical
evaluation. Int J Pharm. 2013;447(1-2):231-40.
34. Duarte
I, Herrera ML. Concentración mínima inhibitoria de Anfotericina B contra
Candida albicans. Revista Médica del Hospital Nacional de Niños Dr Carlos Sáenz
Herrera. 1995;30:45-50.
Received: 26 September 2023 / Accepted: 15 April 2023 /
Published:15 December 2023
Citation: Espinoza L C , Correa O, Sosa L , Días-Garrido
N , Ojeda S, Valarezo E, Cartuche L, Bravo T,. Granda P C. Formulación
y caracterización de una crema de anfotericina B y aceite esencial de Bursera
graveolens para el tratamiento local de la candidiasis cutánea. Revis
Bionatura 2023;8 (4) 36. http://dx.doi.org/10.21931/RB/2023.08.04.36
Publisher's Note: Bionatura stays neutral concerning jurisdictional claims in
published maps and institutional affiliations.
Copyright: ©
2023 by the authors. Submitted for possible open-access publication under the
terms and conditions of the Creative Commons Attribution (CC BY) license
(https://creativecommons.org/licenses/by/4.0/).
