2017.02.01.3
Files > Volume 2 > Vol 2 No 1 2017 > Investigaciones
INVESTIGACIÓN
Evaluación de CIMAvaxEGF para el tratamiento del cáncer de pulmón: meta-análisis de ensayos clínicos controlados
Evaluation of CIMAvaxEGF for the treatment of lung cancer: meta-analysis of controlled clinical trials
Carmen Viada1, Javier Quintero2, Javier Ballesteros3, Martha Fors4, Mayteé Robaina5, Bárbara Wilkinson1, Mabel Alvarez1, Aliuska Frías1, Elia Neninger6, Camilo Rodríguez1, Tania Crombet1.
Available from: http://dx.doi.org/10.21931/RB/2017.02.01.3
_______________________________________________________________________________________________________________________
Resumen
CIMAvaxEGF es una vacuna terapéutica contra el cáncer enteramente desarrollada en Cuba y licenciada en el país para su uso en pacientes adultos con cáncer de pulmón de células no pequeñas (CPCNP) en etapas IIIB/IV. El objetivo de este trabajo es determinar la efectividad de la vacuna del CIMAvaxEGF a través de la técnica de meta-análisis combinado. Se efectuó una búsqueda en PubMed de “CIMAvaxEGF”, “vacuna”, se obtuvieron 20 artículos publicados por autores cubanos entre el 1 de enero de 1995 y el 30 de septiembre del 2015, donde se describen los resultados de los estudios clínicos realizados durante el desarrollo de CIMAvaxEGF, principalmente los publicados por investigadores cubanos en revistas científicas internacionales arbitradas. Los artículos describen doce ensayos clínicos realizados en Cuba de 1995–2015 con CIMAvaxEGF; cinco Fase I con 135 pacientes, un Fase II con 80 pacientes, dos Fase III con 520 pacientes, un Fase IV con 513 pacientes, un estudio observacional con 378 pacientes y dos estudios promovidos por el investigador con 35 pacientes. De estos estudios fueron seleccionados por la escala de Jadad los tres ensayos controlados. El meta-análisis consistió en la construcción del grafico de Forest Plot, el análisis de sensibilidad y el análisis acumulado. El meta-análisis arroja resultados favorables a la vacuna CIMAvaxEGF, con heterogeneidad moderada (59,4%). El análisis de sensibilidad revela que el ensayo que más difiere de los demás es el EC056 Fase II. El análisis acumulativo indica que el resultado es conocido después del segundo ensayo.
Palabras Claves: Factor de crecimiento epidérmico, receptor del EGF, cáncer de pulmón de células no pequeñas, tratamiento vacunal, inmunoterapia, vacunas oncológicas.
_______________________________________________________________________________________________________________________
Abstract
CIMAvaxEGF is a therapeutic cancer vaccine developed in Cuba and fully licensed in the country for use in adult patients with lung cancer non-small cell (NSCLC) in stage IIIB / IV. The aims The objective of this work is to determine the effectiveness of the CIMAvaxEGF vaccine through the combined meta-analysis technique. A PubMed search of "CIMAvaxEGF", "vaccine", 20 articles were published by Cuban authors between January 1, 1995 and September 30, 2015, describing the results of the clinical studies performed. During the development of CIMAvaxEGF, mainly those published by Cuban researchers in refereed international scientific journals. Twelve articles describe clinical trials in Cuba from 1995-2015 with CIMAvaxEGF; five Phase I with 135 patients, Phase II with 80 patients, two Phase III with 520 patients, 513 patients with Stage IV, an observational study with 378 patients and two studies sponsored by the investigator with 35 patients. These studies were selected by the Jadad scale the three controlled trials. The meta-analysis consisted of the construction of graph Forest Plot, sensitivity analysis and analysis accumulated. The meta-analysis shows favorable results to CIMAvaxEGF vaccine, with moderate heterogeneity (59.4%). The sensitivity analysis reveals that the test differs from most others is the EC056 Phase II. The cumulative analysis indicates that the result is known after the second trials.
KeyWords: Epidermal growth factor, EGF receptor, of non-small cell lung cancer vaccine therapy, immunotherapy, oncology vaccines.
_______________________________________________________________________________________________________________________
Introducción
En Cuba, el cáncer es la segunda causa principal de muerte y la primera causa de años de vida potencialmente perdidos, lo cual ocasiona un impacto significativo en la esperanza de vida al nacer. El cáncer de pulmón es la enfermedad maligna de mayor incidencia y además la causa principal de muerte por cáncer en el país. En los años 2005–2007, se reportó anualmente un promedio de 4234 nuevos casos de cáncer de pulmón y 4601 muertes por la enfermedad, para una tasa cruda de mortalidad de 54,3 en hombres y 27,3 en mujeres por 100 000 habitantes.
Si persisten las tendencias demográficas actuales y los factores de riesgo, se puede esperar que la incidencia y la mortalidad por cáncer de pulmón aumenten significativamente en los próximos cinco años.1
Considerando que el aumento de la incidencia y la mortalidad por cáncer es un serio problema para la salud pública, el Ministerio de Salud Pública de Cuba ha implementado un Programa Integral de Control del Cáncer (PICC), que opera a todos los niveles del sistema nacional de salud. Este programa constituye un nuevo enfoque terapéutico para la enfermedad, donde la biotecnología sirve de puente entre la investigación en inmunología básica y la salud pública. En Cuba la investigación y el desarrollo de la biotecnología se conciben como un ciclo científico completo (ciclo cerrado), desde el concepto hasta la aplicación clínica y comercialización de los productos. Los ingresos por las ventas del producto se invierten tanto en sostener el uso de las inmunoterapias en el sistema nacional de salud pública, como en la investigación y desarrollo de nuevas modalidades inmunoterapéuticas.2, 3
Aunque las quimioterapias se han convertido en un arsenal indispensable para la reducción de la carga tumoral y el aumento de la supervivencia, su impacto en el cáncer de pulmón solo es medible en meses, con graves reacciones adversas como carga adicional. Por lo general, los pacientes con cáncer de pulmón enfrentan una etapa inicial de diagnóstico y tratamiento oncológico, durante la cual se obtiene la remisión parcial o completa, seguida de una segunda etapa, durante la cual la enfermedad progresa inexorablemente hacia la enfermedad terminal y la muerte. El mecanismo de acción de los productos inmunoterapéuticos, tales como los anticuerpos monoclonales (AcM) y las vacunas terapéuticas, es mucho más selectivo en la eliminación de las células tumorales y puede aumentar la supervivencia de los pacientes proporcionándoles una mejor calidad de vida.4, 5
El receptor del factor de crecimiento epidérmico (REGF) es un oncogén bien conocido. Su sobreactivación puede inducir la transformación de una célula normal en maligna, señalizando la inhibición de la apoptosis, proliferación celular, angiogénesis, metástasis y de procesos proinflamatorios o inmunosupresores.
La vía de señalización y transducción del REGF puede ser interrumpida eficazmente por la privación de EGF, inhibición directa del receptor con AcM específicos, o moléculas de bajo peso molecular que compiten intracelularmente con el adenosín trifosfato (ATP) por el sitio de actividad tirosina quinasa del receptor, con repercusiones negativas sobre la proliferación celular y, por consiguiente, sobre el desarrollo del tumor.6, 7
La inducción de la privación de EGF por la inmunoterapia activa es un concepto emergente desarrollado por investigadores cubanos, que incluye la manipulación de la respuesta inmune del individuo para que genere sus propios anticuerpos efectores (Acs) contra el EGF, reduciendo de esta forma el tamaño del tumor o impidiendo su progresión.8–12

CIMAvaxEGF es una vacuna activa en la que los pacientes son inmunizados con Factor de Crecimiento Epidérmico (EGF), lo que genera anticuerpos dirigidos al propio EGF. El producto también se formula con la proteína externa P64k de Neisseria meningitidis y el ISA 51 de Montanide como coadyuvante para potenciar la respuesta inmune.60 El receptor del factor de crecimiento epidérmico (EGFR) es secuestrado por muchos tipos de cáncer, incluyendo cánceres de pulmón, colon, riñón y cabeza y cuello. Al aumentar los anticuerpos contra EGF, que es el ligando principal de EGFR, se reducen las concentraciones de EGF en la sangre. Así CIMAvaxEGF no apunta directamente a las células cancerosas, pero se espera que trabaje contra estos cánceres negando a los cánceres el estímulo de crecimiento que requieren. Por esta razón, el grupo de Roswell Park piensa que puede resultar más útil como una vacuna preventiva en lugar de como una terapia de cáncer per se.61
CIMAvaxEGF es una vacuna terapéutica contra el cáncer desarrollada totalmente en Cuba. Sus ingredientes farmacéuticos activos (IFA) se producen en el Centro de Ingeniería Genética y Biotecnología (CIGB). La vacuna se formula en el Centro de Inmunología Molecular (CIM) y los ensayos clínicos se realizan en hospitales que reúnen las condiciones profesionales y tecnológicas para cumplir las normas de Buenas Prácticas Clínicas. La prueba de principio (POP, sigla en inglés) del impacto clínico de esta novedosa terapia fue posible por la integración del desarrollo biotecnológico cubano con el sistema de salud pública y la colaboración entre los institutos de investigaciones y los hospitales.13, 14
Desde 1995 CIMAvaxEGF se ha sometido a cinco ensayos clínicos fase I/II y uno fase II. Los resultados de estas investigaciones condujeron a que el Centro para el Control Estatal de la Calidad de los Medicamentos (CECMED) (CECMED), autoridad reguladora cubana, concediera la licencia a esta vacuna terapéutica para su uso en pacientes adultos con cáncer de pulmón de células no pequeñas (CPCNP) en estadios IIIB/IV. Los resultados de las investigaciones también se han publicado en varias revistas científicas nacionales e internacionales.28, 49
El EGFR está sobreexpresado en muchos tumores epiteliales. El EGF es uno de los factores de crecimiento más importantes que estimula el EGFR, de forma parácrina. CIMAvax-EGF es una vacuna terapéutica contra el cáncer destinada a inducir anticuerpos contra el EGF. Está compuesto por EGF recombinante conjugado a P64 de N.Meningitides como portador y Montanide, como adyuvante. Los títulos de anticuerpos contra EGF aumentaron con la vacunación y la concentración de EGF en sueros mostró una reducción rápida después de la inmunización. La respuesta del anticuerpo anti-EGF se correlacionó directamente con la supervivencia global. CIMAVax-EGF fue seguro y los eventos adversos más frecuentes fueron dolor en el sitio de inyección de grado 1-2, fiebre, dolor de cabeza, náuseas, vómitos y escalofríos. La vacuna aumentó significativamente la supervivencia de los pacientes con NSCLC. La concentración de EGF se midió en la línea de base y se encontró que era mucho mayor que en sujetos normales. La alta concentración de EGF predijo mayor beneficio después de la vacunación. La respuesta de anticuerpos frente al EGF es un marcador de supervivencia. La alta concentración de EGF podría ser un marcador predictivo de la eficacia de la vacuna y un biomarcador de pronóstico pobre para los pacientes no vacunados con NSCLC. El valor predictivo y pronóstico de la concentración de EGF se validará prospectivamente.62
La vacunación con CIMAvax-EGF fue segura y prolongó la vida de pacientes con cáncer de pulmón de células no pequeñas, sobre todo en aquellos con altos niveles de EGF en sangre al inicio.58
CIMAvaxEGF es una vacuna del CIM para el tratamiento de cáncer de pulmón. Para su aprobación se hace necesaria una fase de experimentación en la que se evalúan los efectos de los tratamientos usuales. Para ello se hace necesario primeramente un proceso de selección de los ensayos clínicos que se realiza según el criterio PRISMA.15-17
El objetivo de este artículo es revisar las investigaciones clínicas realizadas durante el desarrollo de esta novedosa vacuna terapéutica cubana contra el cáncer, principalmente sobre la base de estudios publicados por investigadores cubanos en revistas científicas internacionales arbitradas.
Materiales y métodos
En Medicina, meta-análisis es el estudio basado en la integración estructurada y sistemática de la información obtenida en diferentes ensayos clínicos, sobre un problema de salud determinado. Consiste en identificar y revisar los estudios controlados sobre un determinado problema, con el fin de dar una estimación cuantitativa sintética de todos los estudios disponibles. Dado que incluye un número mayor de observaciones, un meta-análisis tiene un poder estadístico superior al de los ensayos clínicos que incluye.
Un meta-análisis clínico se basa principalmente en una integración o reciclaje entre la información ya obtenida y poder obtener un análisis mayor.
El primer meta-análisis clínico fue realizado por Karl Pearson en 1904, en un intento de superar el problema del reducido poder estadístico de los estudios con pequeños tamaños muéstrales; si se analizan los resultados de un grupo de estudios similares, se puede alcanzar una valoración más exacta de los efectos.
En Estadística, un meta-análisis se refiere al conjunto de métodos enfocados a contrastar y combinar los resultados de diferentes estudios; con la esperanza de identificar patrones entre los resultados de estudio, las fuentes de desacuerdo entre dichos resultados, u otras relaciones interesantes que pueden salir a la luz en el contexto de múltiples estudios.
En su más simple forma, se lleva a cabo al identificar una medida común del tamaño de efecto; del cual un promedio ponderado podría ser el dato de salida en un meta-análisis. La ponderación podría estar relacionada con tamaños de muestra dentro de los estudios individuales.
El objetivo general de un meta-análisis radica en estimar con mayor fuerza el tamaño real de efecto, en contraste a uno menos preciso derivado en un solo estudio bajo un sencillo conjunto determinado de supuestos y condiciones.
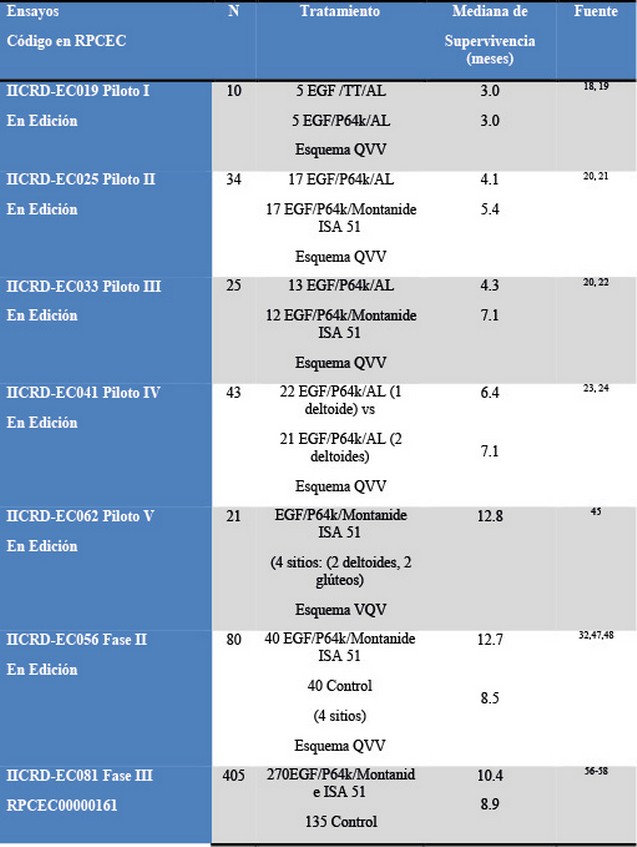
En la Tabla 1 se dispone de 12 ensayos clínicos, de estos se rechazan 5 por ser ensayos piloto, que tienen como objetivo definir las condiciones de experimentación, y 4 por ser no controlados, o sea no tener un brazo de contraste o control. Este proceso es rectorado por los criterios PRISMA que pueden ser consultados en [15], ver Figura 1. Se incluyen finalmente 3 ensayos controlados: EC056, EC081, EC111. En la Tabla 2 se resume el tamaño de cada uno de los ensayos, y la proporción de población dentro del meta-análisis. Al final se obtiene que: el tamaño de la población total en estos tres ensayos es de (13.3%, 67,3%; 19.4%) de 600 pacientes.49-55
Leyenda: RPCEC (Registro Público Cubano de Ensayos Clínicos)
QVV: Quimioterapia-Vacuna-Vacuna
VQV: Vacuna-Quimioterapia-Vacuna
QVV: Quimioterapia-Vacuna-Vacuna
VQV: Vacuna-Quimioterapia-Vacuna
Tabla 1. Ensayos clínicos realizados en Cuba con la vacuna terapéutica anticancerosa de EGF, 1995–2015
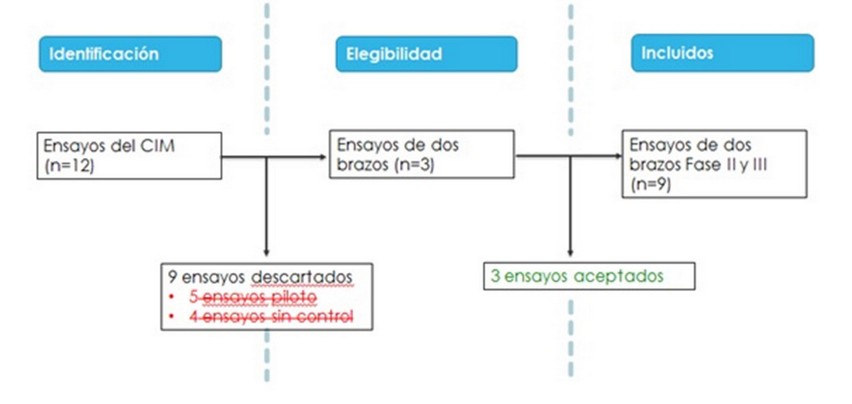
Figura 1. Proceso de selección de los estudios con la vacuna CIMAvaxEGF
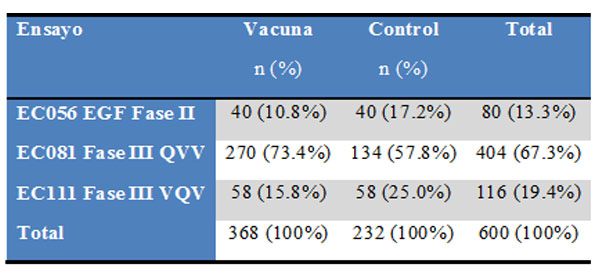
Tabla 2: Población incluida
Se seleccionó para evaluar el tamaño del efecto, el Hazard Ratio (HR), sugerido en para este tipo de datos (tiempo hasta el evento).15 En la Tabla 3 se resumen los tamaños de efecto obtenidos, así como su error estándar, datos estos necesarios para la implementación del meta-análisis.
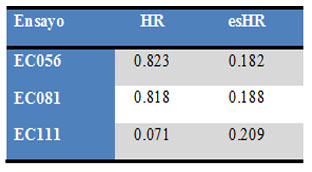
Tabla 3: HR y error estándar
En esta sección se resumirán los resultados obtenidos de la aplicación de los modelos a cada vacuna de forma independiente, y posteriormente se unirán buscando el tamaño de efecto combinado. Para realizar el meta-análisis se utilizó el software Review Manager 5 Versión 5.0.20 y los métodos para analizarlos. Se asume el modelo de efectos fijos, pues se dispone de los datos individuales de cada ensayo.15, 17
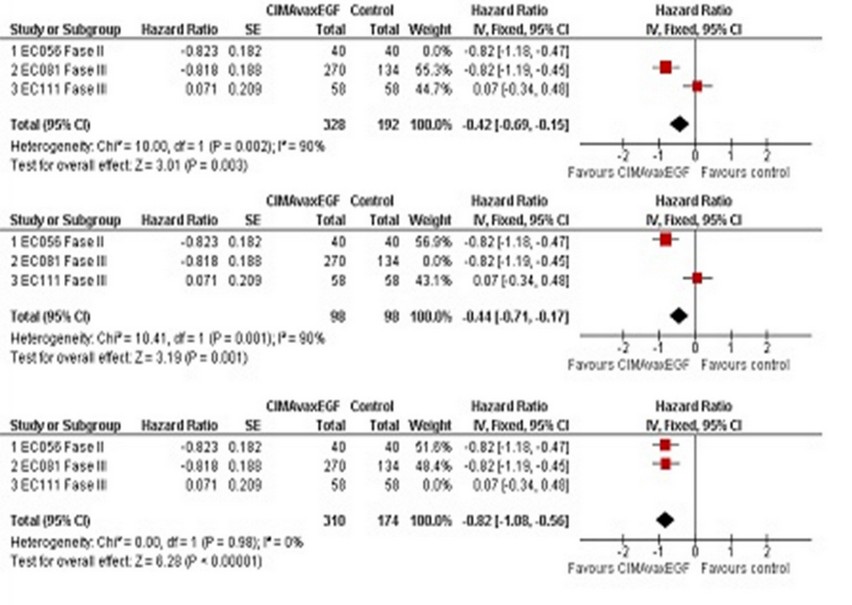
En la Figura 2 se muestran los resultados de HR y su intervalo de confianza del 95%. Hay dos indicadores de que el efecto combinado es favorable a la vacuna: el p-valor, que se encuentra por debajo de 0.05, y el z-valor, que es mayor en módulo que 1.96 que es el valor crítico de admisión, o sea el valor que marca la región donde el efecto no es significativo. Se muestran los resultados del Forest Plot, de la prueba de heterogeneidad el valor de I2 y su intervalo de confianza que corrobora los resultados anteriores.
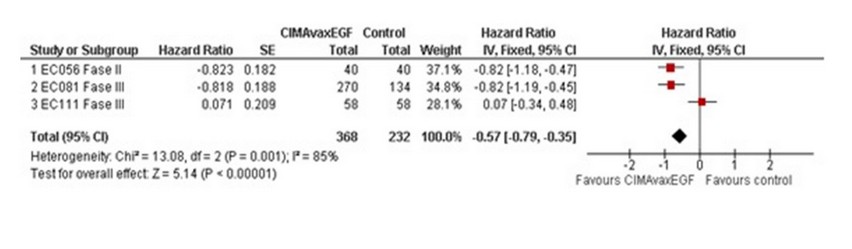
Figura 2: Forest plot para el modelo de efectos fijos
El ensayo de mayor peso 37.1% es el EC056, por la consistencia de los datos. Se chequeó la heterogeneidad según los criterios Cochrane.15 Se puede concluir parcialmente que el efecto es favorable a la vacuna CIMAvaxEGF, pues el diamante (que representa el efecto combinado y sus intervalos de confianza) no atraviesa la hipótesis nula.
En la Figura 3 se muestra el análisis de sensibilidad, necesario para revelar cual es el estudio más discordante. En la misma aparece el HR y su intervalo de confianza al 95% omitiendo cada uno de los ensayos, así como la estimación combinada de todos los estudios a la vez. Se presentan los resultados del Forest Plot que corrobora los resultados anteriores.
Figure 3: Análisis de sensibilidad EGF
En esta salida de Review Manager 5 Versión 5.0.20 es posible observar que el estudio que más difiere de los demás es el EC111, pues cuando es omitido el I2 desciende al 0%.
En la Figura 4 se muestra el análisis acumulativo, necesario para revelar cuál es el estudio más discordante. En la misma aparece el HR y su intervalo de confianza al 95% añadiendo cada uno de los ensayos, así como la estimación combinada de todos los estudios a la vez. Se presentan los resultados del Forest Plot que corrobora los resultados anteriores.
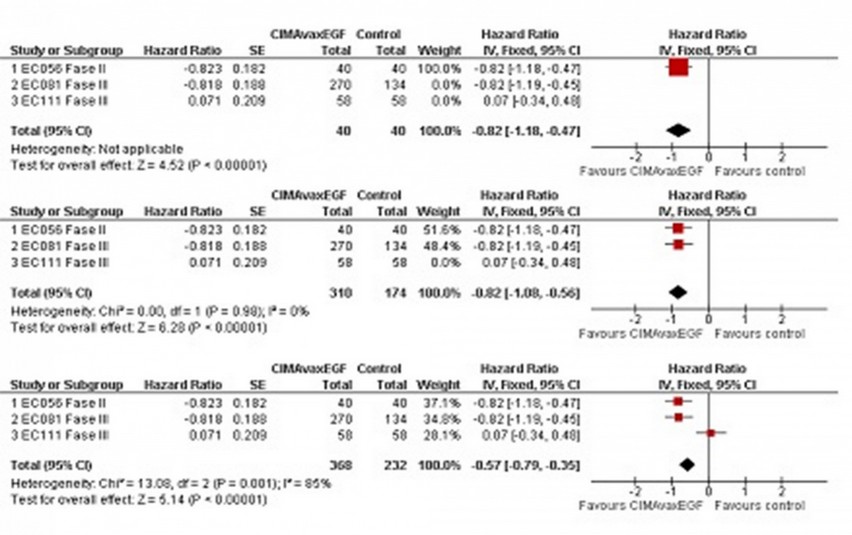
Figure 4: Análisis acumulativo
En esta salida de Review Manager 5 Versión 5.0.20 es posible observar que el estudio que más difiere de los demás es el EC111, pues cuando se añade este ensayo el I2 asciende desde 0%.
Conclusiones
- El meta-análisis combinado arroja resultados favorables a la vacuna CIMAvaxEGF, con un HR de 0.57.
- El análisis de sensibilidad revela que el ensayo que más difiere de los demás es el EC111 Fase III.
- El análisis acumulativo refleja que el estudio que menos aporta al meta-análisis fue el último incluido.
Recomendaciones
- Repetir el meta-análisis incluyendo los nuevos ensayos que se vayan terminando para aumentar poder estadístico al estudio.
- Predecir el tamaño del efecto de los nuevos ensayos a través de la inferencia de los valores de supervivencia.
- Segmentar la población en grupos temporales de supervivencia.
Referencias Bibliográficas
1. Galán Y, Fernández L, Torres P, García M. Trends in Cuba’s Cancer Incidence (1990 to 2003) and Mortality (1990 to 2007). MEDICC Review. 2009;11(3):19–26.
2. Romero T. Changing the Paradigm of Cancer Control in Cuba. MEDICC Review. 2009;11(3):5–7.
3. Lage A. Connecting immunology research to public health: Cuban biotechnology. Nature Immunology. 2008;9(2):109–12.
4. Lage A. Transforming Cancer Indicators Begs Bold New Strategies from Biotechnology. MEDICC Review. 2009;11(3):8–12.
5. Gerard C, Debruyne C. Immunotherapy in the landscape of new targeted treatments for non-small cell lung cancer. Mol Oncol. 2009 Dec;3(5–6):409–24.
6. Toffoli G, De Mattia E, Cecchin E, Biason P, Masier S, Corona G. Pharmacology of epidermal growth factor inhibitors. Int J Biol Markers. 2007 Jan–Mar;22(1 Suppl 4):S24–39.
7. Hirsch FR, Varella-García M, Cappuzzo F. Predictive value of EGFR and HER2 overexpression in advanced non-small-cell lung cancer. Oncogene. 2009 Aug;28 Suppl 1:S32–7.
8. González G, Lage A. Cancer Vaccines for Hormone/Growth Factor Immune Deprivation: A Feasible Approach for Cancer Treatment. Curr Cancer Drug Targets. 2007 May;7(3):229–41.
9. Macías A, Azavedo E, Hägerström T, Klintenberg C, Pérez R, Skoog L. Prognostic significance of the receptor for epidermal growth factor in human mammary carcinoma. Anticancer Res. 1987 May–Jun;7(3 Pt B):459–64.
10. Arteaga CL. ErbB-targeted therapeutic approaches in human cancer. Exp Cell Res. 2003 Mar 10;284(1):122–30.
11. Lage A, Crombet T, González G. Targeting epidermal growth factor receptor signaling: early results and future trends in oncology. Ann Med. 2003;35(5):327–36.
12. Pérez R, Pascual M, Macías A, Lage A. Epidermal growth factor receptors in human breast cancer. Breast Cancer Res Treat. 1984 Sep;4(3):189–93.
13. González G, Sánchez B, Suárez E, Beausoleil I, Perez O, Lastre M, et al. Induction of im-mune recognition of self-epidermal growth factor (EGF): effect on EGF biodistribution and tumor growth. Vac Res. 1996;5(4):233–44.
14. González G, Pardo OL, Sánchez B, García JL, Beausoleil I, Marinello P, et al. Induction of immune recognition of self-epidermal growth factor II: characterization of the antibody immune response and the use of a fusion protein. Vac Res. 1997;6(2):91–100.
15. J. Ballesteros. Revisiones sistemáticas y meta-análisis de ensayos clínicos. UPV/EHU. Material de Conferencia. Habana. 2015.
16. M. Borenstein et al. Introduction to Meta-analysis. Wiley. UK. 2009
17. P. Ellis. The Essential Guide to Effect Sizes. Cambridge University Press. UK. 2010.
18. González G, Crombet T, Catalá M, Mirabal V, Hernández JC, González Y, et al. A novel cancer vaccine composed of human-recombinant epidermal growth factor linked to a carrier protein: report of a pilot clinical trial. Ann Oncol. 1998 Apr;9(4):431–5.
19. Hirsch FR, Herbst RS, Olsen C, Chansky K, Crowley J, Kelly K, et al. Increased EGFR Gene Copy Number Detected by Fluorescent In Situ Hybridization Predicts Outcome in Non–Small-Cell Lung Cancer Patients Treated With Cetuximab and Chemotherapy. J Clin Oncol. 2008 Jul 10;26(20):3351–7.
20. González G, Crombet T, Torres F, Catalá M, Alfonso L, Osorio M, et al. Epidermal growth factor-based cancer vaccine for non-small-cell lung cancer therapy. Ann Oncol. 2003 Mar;14(3):461–6.
21. Ghiringhelli F, Larmonier N, Schmitt E, Parcellier A, Cathelin D, Garrido C, et al. CD4+CD25+ regulatory T cells suppress tumor immunity but are sensitive to cyclophosphamide which allows immunotherapy of established tumors to be curative. Eur J Immunol. 2004 Feb;34(2):336–44.
22. Man S, Bocci G, Francia G, Green SK, Jothy S, Hanahan D, et al. Antitumor effects in mice of low-dose (metronomic) cyclophosphamide administered continuously through the drinking water. Cancer Res. 2002 May 15;62(10):2731–5.
23. González G, Crombet T, Neninger E, Viada C, Lage A. Therapeutic vaccination with epidermal growth factor (EGF) in advanced lung cancer: analysis of pooled data from three clinical trials. Hum Vaccin. 2007 Jan-Feb;3(1):8–13.
24. Crombet T, Neninger E, Catalá M, García B, Leonard I, Martínez L, et al. Treatment of NSCLC Patients with an EGF-Based Cancer Vaccine: report of a Phase I trial. Cancer Biol Ther. 2006 Feb;5(2):130–40.
25. Berd D, Sato T, Maguire HC Jr, Kairys J, Mastrangelo MJ. Immunopharmacologic analysis of an autologous, hapten-modied human melanoma vaccine. J Clin Oncol. 2004 Feb 1;22(3):403–15.
26. Gardiner DF, Huang Y, Basu S, Leung L, Song Y, Chen Z, et al. Multiple-site DNA vaccination enhances immune responses in mice. Vaccine. 2006 Jan 16;24(3):287–92.
27. Aucouturier J, Ascarateil S, Dupuis L. The use of oil adjuvants in therapeutic vaccines. Vaccine. 2006 Apr 12;24 Suppl 2:S2–44–5.
28. Lage A, Pérez R, Fernández LE. Therapeutic cancer vaccines: at midway between immunology and pharmacology. Curr Cancer Drug Targets. 2005 Dec;5(8):611–27.
29. Zinkernagel RM, Hengartner H. Regulation of the immune response by antigen. Science. 2001 Jul 13;293(5528):251–3.
30. Starzl TE, Zinkernagel RM. Antigen localization and migration in immunity and tolerance. N Engl J Med. 1998 Dec 24;339(26):1905–13.
31. Couch M, Saunders JK, O’Malley BW Jr, Pardoll D, Jaffee E. Spatial distribution of tumor vaccine improves efficacy. Laryngoscope. 2003 Aug;113(8):1401–5.
32. Rodríguez PC, González I, González A, Avellanet J, López A, Pérez R, et al. Priming and boosting determinants on the antibody response to an Epidermal Growth Factor-based cancer vaccine. Vaccine. 2008 Aug 26;26(36):4647–54.
33. Hanahan D, Weinberg RA. The Hallmarks of cancer. Cell. 2000 Jan 7;100(1):57–70. Review.
34. Dunn GP, Old LJ, Schreiber RD. The Three Es of Cancer Immunoediting. Annu Rev Immunol. 2004;22:329–60.
35. Kroemer G, Pouyssegur J. Tumor Cell Metabolism: Cancer’s Achilles’ Heel. Cancer Cell. 2008 Jun;13(6):472–82. Review.
36. Mantovani A, Allavena P, Sica A, Balkwill F. Cancer-related inflammation. Nature. 2008 Jul 24;454(7203):436–44. Review.
37. Mantovani A. Inflaming Metastasis. Nature. 2009 Jan 1;457(7225):36–7.
38. Emens LA, Jaffee EM. Leveraging the activity of tumor vaccines with citotoxic chemotherapy. Cancer Res. 2005 Sep 15;65(18):8059–64.
39. Dass S, Vital EM, Emery P. Development of psoriasis after B cell depletion with rituximab. Arthritis Rheum. 2007 Aug;56(8):2715–8.
40. Goetz M, Atreya R, Ghaliba an M, Galle PR, Neurath MF. Exacerbation of ulcerative colitis after rituximab salvage therapy. Inflamm Bowel Dis. 2007 Nov;13(11):1365–8.
41. Terando A, Mulé JJ. On combining antineoplastic drugs with tumor vaccines. Cancer Immunol Immunother. 2003 Nov;52(11):680–5.
42. Ehrke MJ. Immunomodulation in cáncer therapeutics. Int Immunopharmacol. 2003 Aug;3(8):1105–19. Review.
43. Cupps TR, Edgar LC, Fauci AS. Suppression of human B lymphocyte function by cyclophosphamide. J Immunol. 1982 Jun;128(6):2453–7.
44. Sinkovics JG, Horvath JC. Evidence accumulating in support of cancer vaccines combined with chemotherapy: a pragmatic review of past and present efforts. Int J Oncol. 2006 Oct;29(4):765–77.
45. Neninger E, Verdecia BG, Crombet T, Viada C, Pereda S, Leonard I, et al. Combining an EGF-based cancer vaccine with chemotherapy in advanced nonsmall cell lung cancer. J Immunother. 2009 Jan;32(1):92–9.
46. Montero E, Valdés M, Avellanet J, López A, Pérez R, Lage A. Chemotherapy induced transient B-cell depletion boosts antibody-forming cells expansion driven by an epidermal growth factor-based cancer vaccine. Vaccine. 2009 Apr 6;27(16):2230–9.
47. Neninger Vinageras E, de la Torre A, Osorio Rodríguez M, Catalá Ferrer M, Bravo I, Mendoza del Pino M, et al. Phase II randomized controlled trial of an epidermal growth factor vaccine in advanced NSCLC. J Clin Oncol. 2008 Mar 20;26(9):1452–8.
48. García B, Neninger E, de la Torre A, Leonard I, Martínez R, Viada C, et al. Effective Inhibition of the Epidermal Growth Factor/Epidermal Growth Factor Receptor Binding by Anti-Epidermal Growth Factor Antibodies Is Related to Better Survival in Advanced Non Small-Cell Lung Cancer Patients Treated with the Epidermal Growth Factor Cancer Vaccine. Clin Cancer Res. 2008 Feb 1;14(3):840–6.
49. CIMAvax EGF® Conjugado químico de Factor de Crecimiento Epidérmico humano recombinante acoplado a la proteína recombinante rP64K, Número de Registro B- 08- 063- L03- C, Centro de Inmunología Molecular (CIM), Cuba. Centro para el Control de la Calidad de los Medicamentes (CECMED). Havana, Cuba; 2008 June 12.
50. Rodríguez G, González G, Crombet T, Lage A. CIMAvax EGF Development and Manufacturing. Biopharm International. 2008 Oct; Suppl 1:S36–42.
51. Schlom J, Arlen PM, Gulley JL. Cancer Vaccines: Moving Beyond Current Paradigms. Clin Cancer Res. 2007 Jul 1;13(13):3776–82.
52. Hoos A, Parmiani G, Hege K, Sznol M, Loibner H, Eggermont A, et al. A Clinical Development Paradigm for Cancer Vaccines and Related Biologics. J Immunother. 2007 Jan;30(1):1–15.
53. Fine GD. Consequences of delayed treatment effects on analysis of time-to-event endpoints. Drug Inf J. 2007;41(4):535–9.
54. Madan RA, Mohebtash M, Schlom J, Gulley JL. Therapeutic vaccines in metastatic castration-resistant prostate cancer: principles in clinical trial design. Expert Opin Biol Ther. 2009 Oct 27;10(1):1–10.
55. Crombet T, Rodríguez PC, Neninger E, Garcia B, Lage A. CIMAvax EGF (EGF-P64K) vaccine for the treatment of non-small-cell lung cancer. Expert Rev Vaccines. 2015 Oct;14(10):1303-11.
56. Viada C, Dupuy JF, Fors M, Luaces P, González G, Neninger E, et al. CIMAvax®EGF vaccine therapy for non-small cell lung cancer: A weighted log-rank tests-based evaluation. Modern Chemotherapy 2013, 2(3):51-56.
57. Viada C, Dupuy JF, Fors M, Rodríguez PC, González G, et al. Stratified Cox Regression Analysis of Survival under CIMAvax®EGF Vaccine. Journal of Cancer Therapy, 2013, 4, 8-14.
58. Rodríguez PC, Popa X, Martínez O, Mendoza S, Santiesteban E, Crespo T et al. A Phase III Clinical Trial of the Epidermal Growth Factor Vaccine CIMAvax-EGF as Switch Maintenance Therapy in Advanced Non-Small Cell Lung Cancer Patients. Clin Cancer Res 2016 Feb 29. Epub 2016 Feb 29.
59. del Cristo IS, Fors MM, Viada C, Guerra PP, Hernández A, Hernández M. Experiencias de un ensayo clínico en la atención primaria de salud. Revista Bionatura. 2015; 1(1):20-30.
60. Rodríguez, PC; Rodríguez, G; González, G; Lage, A (2010). "Clinical development and perspectives of CIMAvax EGF, Cuban vaccine for non-small-cell lung cancer therapy". MEDICC Review. 12 (1): 17–23. PMID 20387330.
61. Patel, N. (11 May 2015). "Cuba Has a Lung Cancer Vaccine—And America Wants It". Wired. Retrieved 2015-05-13.
62. Crombet T, Neninger E, Gonzalez J, Rodriguez PC, Garcia B, Popa X, Mazorra Z, Viada C, Luaces P, González G, Lage A. EGF-based cancer vaccine: Optimizing predictive and surrogate biomarkers. J Clin Oncol 31, 2013 (suppl; abstr 3013)
Recibido: diciembre 2016
Aprobado; febrero 2017
Aprobado; febrero 2017
Carmen Viada1, Javier Quintero2, Javier Ballesteros3, Martha Fors4, Mayteé Robaina5, Bárbara Wilkinson1, Mabel Alvarez1, Aliuska Frías1, Elia Neninger6, Camilo Rodríguez1, Tania Crombet1.
1Centro de Inmunología Molecular, 2Universidad de La Habana, 3Universidad del País Vasco-España, 4Universidad de las Américas-Ecuador, 5Centro Nacional Coordinador de Ensayos Clínicas, 6Hospital Hermanos Ameijeiras. Cuba, España
Autor de correspondencia: [email protected]