2024..01.01.26
Files > Conference Series > 2024 > Chimboazo ild pagina nueva
Eficacia de Polipodium leucotomus en pacientes pediátricos con Xeroderma Pigmentoso
Efficacy of Polypodium leucotomos in pediatric patients with Xeroderma Pigmentosum
Iris Alvarez - Montiel 1*, Maria Félix Rivera 2
1. Universidad Nacional Autónoma de Honduras (UNAH),. Tegucigalpa, Honduras.
2. Universidad Nacional Autónoma de Honduras (UNAH), Tegucigalpa, Honduras.
[email protected]
[email protected]
* Correspondencia: [email protected]; Tel.: 00 504 94840872
Available from. http://dx.doi.org/10.21931/BJ/2024.01.01.26
RESUMEN
El Xeroderma pigmentoso (XP), es una Geno dermatosis fotosensible a la radiación ultravioleta. Produce daño irreparable al Ácido Desoxirribonucleico (ADN) favoreciendo la carcinogénesis. El Polypodium leucotomos (PL) disminuye la mutación del ADN, mejora la carcinogénesis e inmunosupresión al conservar las células de Langerhans. No existen estudios del uso del PL en pacientes con XP. Nuestro objetivo fue evaluar la eficacia del PL al comparar la incidencia de cáncer y mejorar la inmunosupresión en pacientes pediátricos con XP mediante las diferencias en la medición células de Langerhans (CD1a). Se realizó un estudio prospectivo, cuasi experimental de un brazo, en 8 pacientes pediátricos con diagnóstico clínico de XP en Hospital María Especialidades Pediátricas (HMEP) en Tegucigalpa, Honduras (agosto 2017 - agosto 2018). Se proporcionó PL 7.5 mg/kg en 2 dosis por 1 año y se realizaron 2 mediciones separadas durante este tiempo. Se encontraron diferencias significativas en las mediciones de las células de Langerhans antes (A) y después (B) del uso del PL. La administración oral de PL demostró eficacia en pacientes pediátricos con XP, ya que conserva las células de Langerhans, mejora la inmunosupresión y disminuye la carcinogénesis; por lo que podría considerarse una alternativa terapéutica preventiva y paliativa en los pacientes con XP.
Palabras claves: células de Langerhans, Polypodium leucotomus, Xeroderma Pigmentoso
ABSTRACT
Background: Xeroderma pigmentosum (XP) is a photosensitive genodermatotic to ultraviolet radiation, producing irreparable damage to DNA favoring carcinogenesis. Polypodium leucotomos (PL) decreases DNA mutation and improves carcinogenesis and immunosuppression by preserving Langerhans cells; there are no studies on using PL in patients with XP. Objective: To evaluate the efficacy of PL when comparing the incidence of cancer and improving immunosuppression in pediatric patients with XP through the differences in the measurement of Langerhans cells (CD1a) Methodology: A prospective, quasi-experimental study of one arm was carried out in 8 pediatric patients with a clinical diagnosis of XP at Hospital María Especialidades Pediatricas (HMEP) Tegucigalpa, Honduras (August 2017 - August 2018). PL 7.5 mg/kg was given in 2 doses for 1 year, and 2 separate measurements were made during this time. Results: We found 75% of the patients were women, clinically 62.5% were found in phase III or tumor; the main skin manifestations were hyperpigmentation, hypopigmentation and xerosis in 100% of the patients; photophobia and conjunctivitis in 100% and 87% of the cases. Significant differences were found in Langerhans cell measurements before (A) and after (B) the use of the PL extract, between epidermis A with a p-value of 0.029 and in dermis A and B with a p-value of (0.005 and 0.007), respectively. (p<0.05). Only 2 patients reported abdominal pain at the beginning of the study. Conclusion: Oral administration of PL demonstrated efficacy in pediatric patients with XP, as it preserves Langerhans cells, improves immunosuppression, and decreases carcinogenesis; it can be considered a preventive and palliative therapeutic alternative.
Keywords: Langerhans cells, Polypodium leucotomus, Xeroderma Pigmentosum
INTRODUCCIÓN
El Xeroderma pigmentoso (XP), patología genética de herencia autosómica recesiva con sensibilidad cutánea a la radiación ultravioleta, produce incapacidad de reparar el ADN, incrementando la mutagénesis en la célula y con ello mayor cancerogenicidad.1 Existen diferentes tipos de XP con variación en las manifestaciones clínicas, coincidiendo en desarrollo de cáncer cutaneo2, 3,4. La incidencia de esta enfermedad es uno por millón de habitantes, varía según zona geográfica, étnica y consanguinidad. El tratamiento suele ser conservador, eliminando las lesiones cancerosas y evitando la metástasis. En Honduras, como en la mayoría de los países de América latina existe un subregistro de la incidencia de XP y comúnmente los pacientes proceden de la zona centro oriental del país. La radiación ultravioleta (RUV) induce dos tipos de foto lesiones en ADN, formación de dímeros de ciclobutano-pirimidina y foto productos pirimidina-pirimidona, ocasionando pre-mutagénesis y alteraciones inmunológicas como la depleción de células de Langerhans e interleucinas favoreciendo la no reparación del ADN, inmunosupresión y carcinogénesis.5,6, 7, 8,9 El riesgo de desarrollar cáncer no melanoma es 10,000 veces mayor que la población general, con un riesgo de más de 2000 veces mayor para el melanoma, los carcinomas de células escamosas, los carcinomas de células basales y el melanoma maligno aparecen en la infancia y la mayoría de los pacientes fallecen antes de alcanzar la edad adulta10,11, 12. En el presente estudio se propuso el tratamiento de la planta llamada Polypodium leucotomos conocida en Honduras como "Calaguala", mientras que en México se le conoce como "diente de león" o "uña de león". Este helecho pertenece a la familia Polypodiaceae, género Phlebodium y tiene tres especies: Polypodium decumanum, Leucotomos y Aurem. Tiene rizomas rastreros densos y carnosos y está cubierto de escamas morenas. Son originarias del sur de México centro y sur de América. Las frondas son de color verde oscuro, largas, triangulares y coriáceas, con un pecíolo largo y divididas en 20 a 40 segmentos. Miden alrededor de 20 a 50 cm de alto. 13. Los principales componentes son la calagualina, la polipodina, los ácidos grasos y los taninos. Se ha demostrado científicamente que reduce la incorporación del ácido orótico 6-C y de la L-valina-C-14 U. M y la conversión de la glucosa-C-14 U. M. En tejidos tumorales malignos humanos disminuyó la conversión de glucosa en dióxido carbono y la incorporación de ácido orótico en nucleoproteínas y de valina en proteínas.14 Contiene alta cantidad de polifenoles especialmente p-cumárico, ácido protocatequico, ácido cafeico, ácido vainílico, ácido ferúlico y cinco isómeros del ácido clorogénico.23 El PL inhibe la inmunosupresión y la generación de especies reactivas de oxígeno o radicales libres de oxígeno (ROS) y especies reactivas de nitrógeno, la muerte celular de fibroblastos y queratinocitos, e inhibe la foto descomposición y foto isomerización del ácido t-urocránico15,16,17. Tiene propiedades terapéuticas inmunomoduladores, antioxidantes, antiinflamatorios, anticancerígenos y fotoprotectores; reduce la producción y acumulación de dímeros pirimidina y la mutación del ADN causada por la radiación ultravioleta, lo que reduce la carcinogénesis. Estas propiedades beneficiosas son particularmente importantes para los pacientes con XP, especialmente para reducir la inmunosupresión y la carcinogénesis. Además de su uso en dermatología, como en la dermatitis atópica, vitíligo, psoriasis y otras afecciones, también puede ser utilizado en enfermedades como hepáticas. artritis, el asma, el cáncer y la diabetes. Aunque tiene baja toxicidad, se deben realizar pruebas de función hepática debido a su metabolismo. 18,19,20. En el presente estudio se propuso como objetivo: evaluar la eficacia del PL al comparar la incidencia de cáncer y mejorar la inmunosupresión en pacientes pediátricos con XP mediante las diferencias en la medición células de Langerhans
Tipo de estudio. Se llevó a cabo un ensayo clínico cuasiexperimental de un solo brazo en el Hospital María Especialidades Pediátricas de Tegucigalpa, Honduras. Previo al trabajo de campo, el comité de ética de la Facultad de Ciencias Médicas de la Universidad Nacional Autónoma de Honduras (UNAH) aprobó este trabajo.
Criterios de inclusión. Se incluyeron 12 pacientes con XP, 8 cumplieron los criterios de inclusión los cuales eran niños de 2 a 18 años, con cualquier foto tipo cutáneo (según Fitzpatrick), con más de 10 lesiones no inflamatorias y 2 lesiones cutáneas con signos clínicos y demoscópicas de malignidad.
Criterios de exclusión. Incluyeron a los pacientes mayores de 18 años o menores de 2 años; menos de 5 lesiones no inflamatorias; tratamiento tópico y/o sistémico recibido un mes previo al estudio; o pacientes con una enfermedad subyacente no controlada, como patología gastrointestinal o hipersensibilidad documentada al medicamento utilizado en el estudio. La falta de cumplimiento con el consentimiento informado, los eventos adversos o enfermedades concomitantes graves, el abandono del estudio o la falta de apego terapéutico.
Los padres y los participantes conocieron la información sobre el estudio y consentimiento informado firmado, los protocolos de confiabilidad de sus datos y privacidad de divulgación, y los participantes mayores de cinco años recibieron una explicación detallada del estudio. Por la escasez de participantes, no se realizó cálculo del tamaño de la muestra. Previo al inicio del estudio, a todos se les realizaron pruebas de laboratorio como hemograma, pruebas de función hepática y renal, niveles de vitamina D, histopatología e inmunohistoquímica de CD1a (células de Langerhans).
Administración del tratamiento. Para este estudio, se les brindaron PL a una dosis diaria de 7,5 mg/kg en cápsulas o en forma de suspensión (120mg/5ml) y se les brindó apoyo psicológico a través de terapias individuales y grupales para concientizar a los participantes sobre el apego al tratamiento. Siguieron una dieta rica en antioxidantes como apoyo nutricional. Las evaluaciones demoscópicas (dermatoscopia Dermlite DL 200 Hybrid) y fotográficas se realizaron a las 0, 6, 12 semanas y posteriormente cada 3 meses hasta completar 1 año.
Obtención de muestras de piel. Las muestras de piel para biopsia se tomaron del área expuesta al sol a nivel surco naso geniano derecho (biopsia A) y área no expuesta al sol en la cara anterior de muslo derecho (biopsia B) ambas tomadas previo y posterior al uso de la capsula o suspensión de PL, las biopsias fueron fijadas con formalina buferada al 10% teñidas con hematoxilina- eosina y los bloques fijados en parafina. Los 32 bloques se desparafinaron con solución Trilogy para realizar las tinciones de inmunohistoquímica (CD1a) las cuales fueron revisadas en Hospital Gea González (Ciudad de México) y donde se realizaron cuantificaciones de células de Langerhans (células/mm2) por campos con microscopio electrónico milimétrico y lente de 40X a nivel de epidermis y dermis, etiquetadas como biopsias #1 (A y B) tomadas antes del uso del tratamiento y biopsias #2 (A, B) posterior al uso del tratamiento. La valoración anatomopatológica fue realizada por el mismo personal de dermatopatología de las biopsias 1 y 2 (A, B). No se logró realizar pruebas moleculares genéticas para determinar qué tipo de XP era el más frecuente entre los participantes del ensayo clínico, debido a que en el país no se cuenta con dichos estudios.
Análisis de datos. Una vez recolectados todos los datos, se ingresaron a una base de datos creada en el programa Microsoft Excel 2016, se efectuó la limpieza de la base de datos y se procedió al respectivo análisis en el programa STATA 14.0. realizando análisis univariado para variables cuantitativas. Se obtuvo media, desviación estándar y para variables cualitativas frecuencias y porcentajes. Para el análisis bivariado de variables cuantitativas se evaluó la diferencia de medias, se utilizó Prueba de rangos de Wilcoxon con valor estadísticamente significativo de p< de 0.05 y para variables cualitativas se utilizó Chi cuadrado y test exacto de Fischer con un valor de p < 0.05.
La media de edad de los 8 participantes fue de 9.6 años, con un margen de error de 5.4 años. El 75 % de las participantes eran mujeres y el 25 % eran hombres, y el 12,5 % eran de áreas urbanas y el resto de las áreas rurales. El 12.5% tenía antecedentes de consanguinidad y el 50% tenía antecedentes familiares de XP. La fase III, o tumoral, fue la fase cutánea más predominante clínicamente, con un 62.5%. La fase I, o eritopigmentaria, tuvo un 25.0%, mientras que la fase II, o atrófica telangiectasia, tuvo solo un 12.5% (figura 1). Ninguno presentó afección del Sistema Nervioso Central (SNC), ni tumores sistémicos. Con respecto al cuadro clínico el 100% de los pacientes tenían hiperpigmentación macular cutáneo, hipopigmentación cutánea, xerosis cutánea; en menor porcentaje (1%) ulceras cornales. En relación con los estudios laboratorios se encontraban en limites aceptables, excepto algunos pacientes con evidencia de anemia microcítica hipocrómica (Tabla 1).
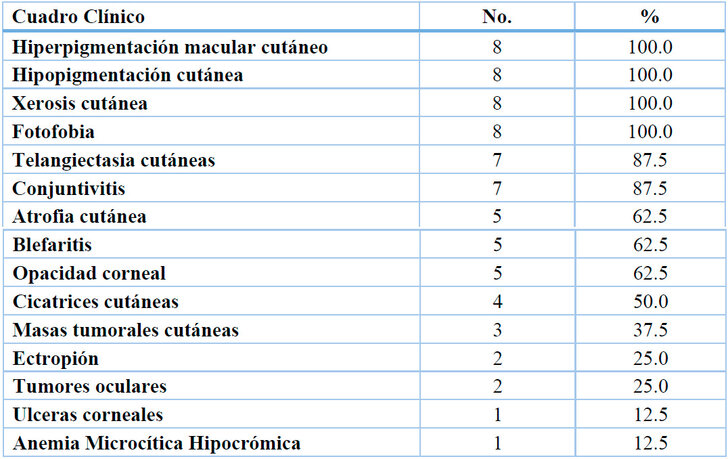
Tabla 1.Cuadro clínico de los pacientes con XP
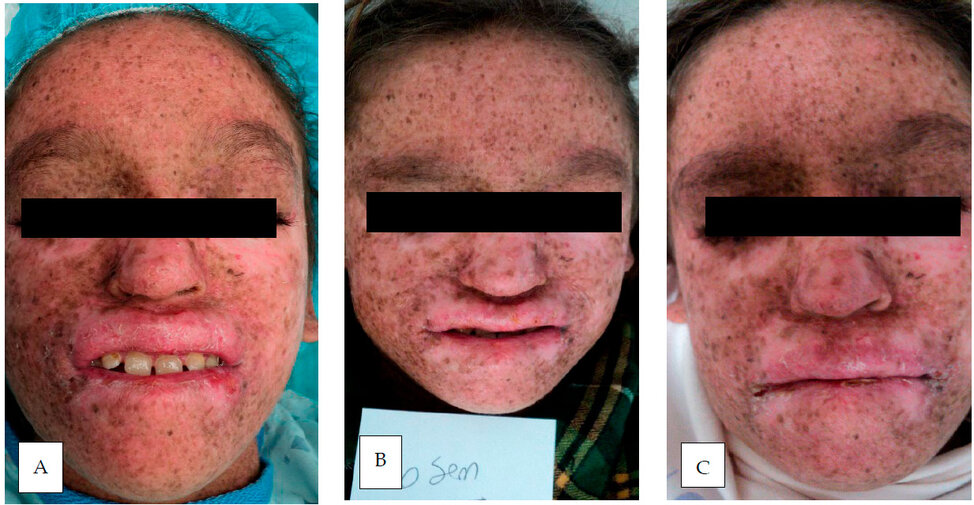
Figura 1: Curso clínico de paciente con XP, (A) inicio, (B) 6 semanas y (C) posterior uso de PL.
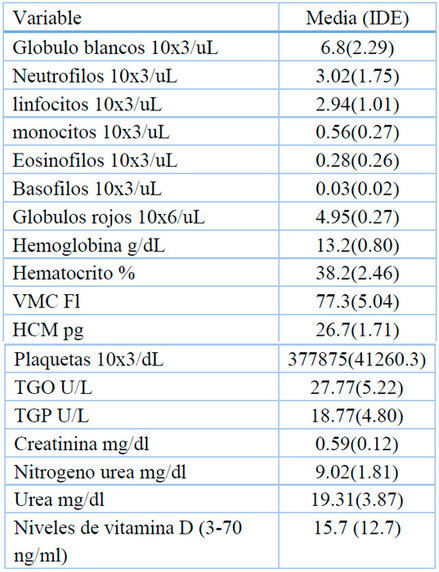
Tabla 2. Estudios de laboratorio en pacientes con XP
Solamente 2 pacientes presentaron molestias gastrointestinales (nauseas) durante el inicio del estudio las cuales fueron transitorias tolerando posteriormente el tratamiento.
Los hallazgos histopatológicos (HE) se basaron de acuerdo al sitio de la toma de la biopsia en área expuesta (A) y no expuesta a sol (B); previas ( biopsia 1) y posterior ( biopsia 2) al uso del PL encontrando cambios en elongación de las redes de las biopsias B del 50.0% al 37.%. La telangiectasia en área expuesta pasó de 87% a 50.0%, presencia de infiltrado por histiciocitos en área expuesta cambio del 100.0% a 57.1% y en área no expuesta de 87.5 a 25%, estos cambios se observaron posterior al uso del PL, sin embargo, las diferencias no fueron estadísticamente significativas con una p mayor de 0.05 según test exacto de Fisher. Tabla 3.
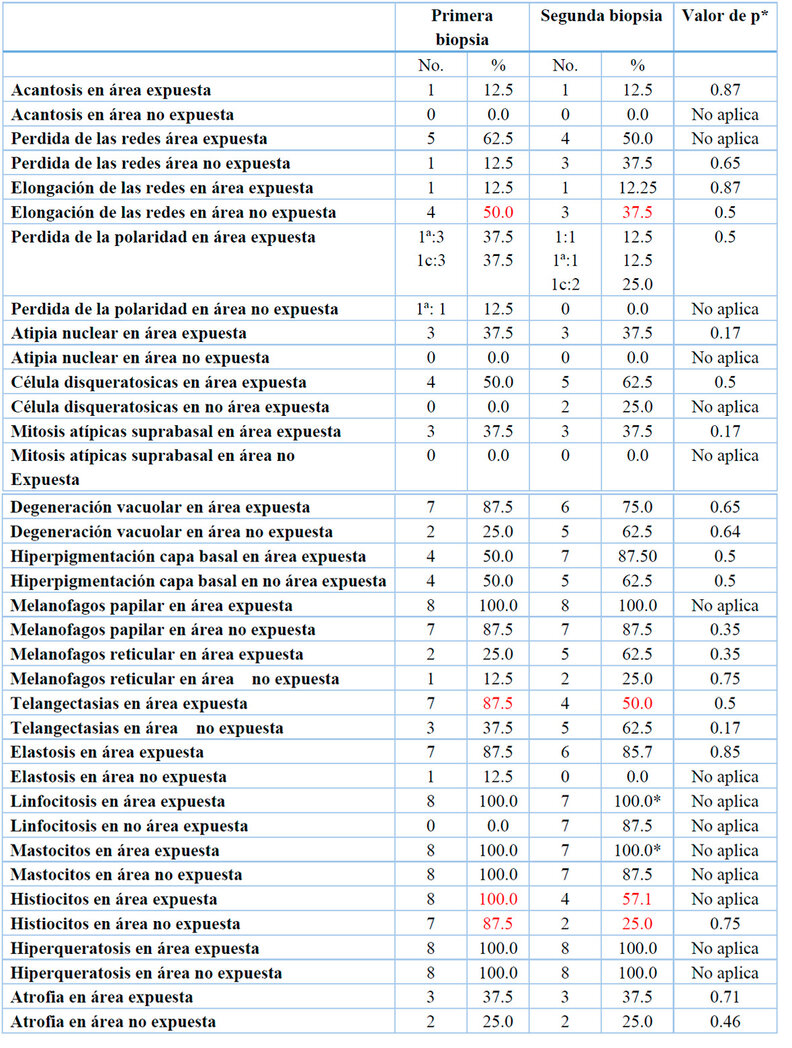
* Perdida de uno de los casos, ** test exacto de Fisher. No aplica cuando hay un valor de cero en al menos una casilla
Tabla 3. Hallazgos de anatomía patología antes y después del PL en pacientes con XP.
Las mediciones de las células de Langerhans previo y posterior al uso del PL, fueron analizadas por la prueba no paramétrica de Wilcoxon encontrando diferencias de medias entre las biopsias primera epidermis A y segunda epidermis A valor p= 0.029; primera dermis A y segunda dermis A, valor p= 0.005, así mismo la primera dermis B y segunda dermis B valor p= 0.007, las diferencias fueron estadísticamente significativas con p<0.05, existiendo entre las biopsias de primera epidermis B y segunda epidermis B valor p = 0.06 lo cual se acercaba a la significancia estadística (Tabla 4).
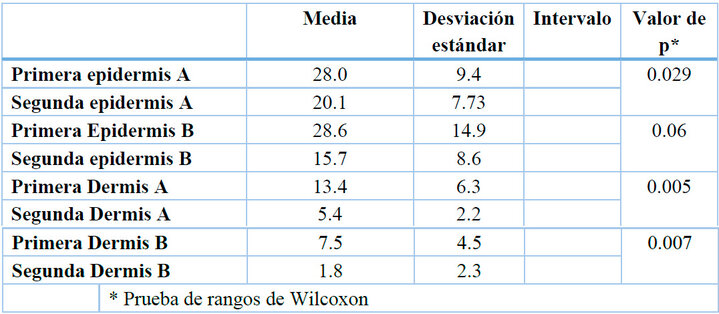
* Prueba de rangos de Wilcoxon
Tabla 4. Valoración del tratamiento a través de Células de Langerhans en pacientes con XP.
En las imágenes de la inmunohistoquímica (figura 2), se observa la preservación de las células de Langerhans (CD1) en la biopsia posterior al uso del PL.
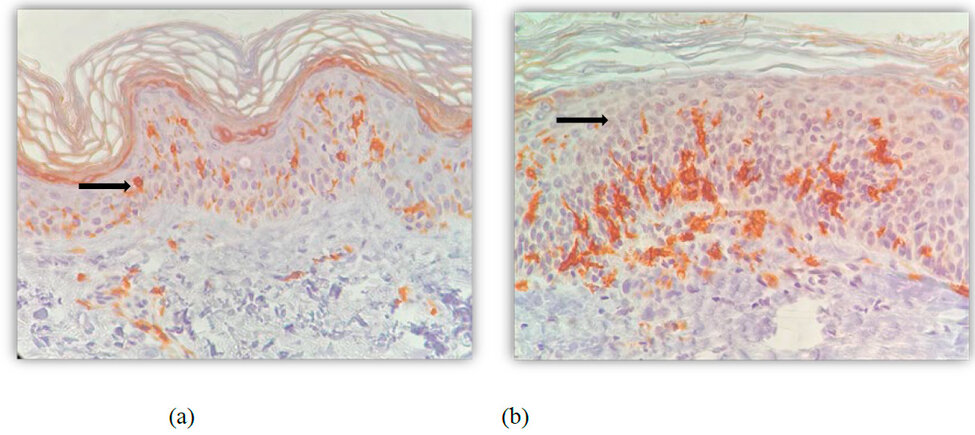
Figura 2: Inmunohistoquímica CD1 tinción para células de Langerhans (señalizadas con flechas negras) (a) previo al uso de PL (40X). (b). Posterior al uso de PL. (40X)
DISCUSIÓN
Según la literatura, la XP es una patología genética que no tiene predilección por sexo; sin embargo, en nuestro estudio, predominó el sexo femenino, por lo que para realizar una correlación entre el sexo y la XP, es necesario aumentar el número de participantes21. En el presente estudio, ninguno de los participantes presentó problemas neurológicos, aunque hay varios tipos de XP que, si lo causan, aproximadamente del 20 al 30% de los pacientes22. La variabilidad de manifestaciones cutáneas depende de la exposición solar, distribución geográfica y tipo de mutación, existiendo tres etapas evolutivas y morfológicas del XP: fase I o eritematoso pigmentaria caracterizada por eritema, edema, vesículas y ampollas, manchas lenticulares de color café. La fase II o atrófica-telangiectasia manifestada por adelgazamiento de la nariz, mutilación de los pabellones auriculares, microstomías, verrugosidades y queratosis actínicas. La fase III o tumoral, sobrevienen epiteliomas basocelulares o espinocelulares, queratoacantomas, sarcomas, melanomas (5%) o incluso diferentes neoplasias benignas.11 nosotros encontramos que el 62.5% de los participantes cursaban la fase tumoral. Las manifestaciones oculares reportados en la literatura son conjuntivitis, neovascularización corneal, sequedad corneal, cicatrización corneal, ectropión, pigmentación de la conjuntiva, cataratas y algunos pacientes pueden desarrollar carcinomas orbitarios.12, 13 nosotros encontramos similares hallazgos con mayor incidencia de fotofobia y conjuntivitis en un 100 % y 87.5% respectivamente.
En estudios realizados por Middelkamp-Hup 14, 16 y reportes del uso dermatológico del PL, evidencia la conservación de células de Langerhans, mejorando la inmunosupresión y carcinogénesis al participar en la inmune vigilancia tumoral. En nuestro estudio valoramos la conservación de las células de Langerhans obteniendo diferencias de medias del CD1a con significancia estadística con valor p < 0.05. Además, se observaron cambios favorables en la histopatología posterior al uso del PL concordando con lo reportado en la literatura del uso benéfico del PL en patología dermatológicas principalmente en la foto daño.
Actualmente no hay reportes de estudios científicos sobre el uso PL en XP, consideramos que podría ser una alternativa terapéutica preventiva y paliativa, aunque en nuestro estudio presentamos limitaciones como el tamaño de la muestra, falta de estudios genéticos moleculares por lo que este ensayo clínico puede ser considerado como un estudio preliminar para ser replicado ampliando el número de participantes.
PL es un producto natural con múltiples propiedades terapéuticas como antioxidante, fotoprotector, inmunomodulador interviniendo en la disminución de la carcinogénesis, la eficacia de esta planta ha sido científicamente demostrado en múltiples patologías dermatológicas especialmente de tipo infamatorias como la psoriasis y dermatitis atópica. El PL al preservar las células de Langerhans, disminuye la carcinogénesis por lo que al ser usado en pacientes con XP se convierte en una alternativa terapéutica con muy escasos efectos secundarios.
.
FINANCIAMIENTO
Se recibió parte de aporte financiero de la Sociedad Hondureña de Dermatología.
RECONOCIMIENTO INSTITUCIONAL: aval institucional y aprobación del comité de ética Facultad de Ciencias Médicas de Universidad Nacional Autónoma de Honduras bajo el registro N° IRB 00003070, con fecha de aprobación del 7 agosto 2017; se obtuvieron los consentimientos informados firmados de todos los participantes del estudio, así como para la publicación de los resultados del mismo. Se realizaron protocolos de confiabilidad de datos y privacidad de divulgación según la declaración de Helsinki.
AGRADECIMIENTO: al Hospital María Especialidades Pediátricas por uso de instalaciones de consulta externa y quirófanos, apoyo financiero en la compra del medicamento DIFUR (Suspensión y cápsulas). Dra. Nelly Janeth Sandoval (dermatopatología, revisión de la histopatología, Hospital Escuela, Tegucigalpa Honduras). Dras. Sonia Toussaint-Caire, Clariza Infante-Fernández (Dermatopatologías, revisión de inmunohistoquímica, Hospital General GEA González, Ciudad de México, México)
CONFLICTO DE INTERESES: "Los autores declaran no tener conflictos de intereses"
"Los financiadores no tuvieron ningún papel en el diseño del estudio; en la recopilación, análisis o interpretación de los datos; en la redacción del manuscrito o en la decisión de publicar los resultados".
1. Martens Marie C, Emmert Steffen and Boeckmann Lars, Xeroderma Pigmentosum: Gene Variants and Splice Variants. Genes (Basel). 2021 Aug; 12(8): 1173
2. Leung Alexander, KC Leung, Barankin Benjamin, Lam Joseph M, Leong Kin F, Lun Hon K. Xeroderma pigmentosum: an updated review. DrugsContext. 2022 April 25; 11:2022-2-5.
3. Dupuy Aurelie, Sarasina Alain. DNA damage and gene therapy of xeroderma pigmentosum, a human DNA repair-deficient disease. MutationResearch, 2015, 776 () 2–8
4. Pinto Christopher, Nayyar Rajest, Asvita Dandamudi, Chirumamilla Avinash, Patel Prachi. Late Presentation of Xeroderma Pigmentosa With Squamous Cell Carcinoma in Septic Shock: Report of a Rare Case. Cureus. 2022 Jun; 14(6): e25967
5. Brambullo Tito, Colonna Michele R, VindigniVincenzo, Piaserico Stefano, Masciopinto Giuseppe, Galeano Mariarosaria, et al. Xeroderma Pigmentosum: A Genetic Condition Skin Cancer Correlated—A Systematic Review. Biomed Res Int. 2022; 2022: 8549532
6. NishigoriChikako, NakanoEiji, Masaki Taro, OnoRyusuke, Takeuchi Seiji, TsujimotoMariko, et al. Characteristics of Xeroderma Pigmentosum in Japan: Lessons From Two Clinical Surveys and Measures for Patient Care. Fotoquímica y Fotobiología, 2019, 95: 140–153
7. Yuan Ling, Cui Dan, Zhao Er-Jiang, Jia Chen-Zhi, Wang Li-Dong, Lu Wei-Quan. XPD Lys751. Gln polymorphism and esophageal cancer risk: a meta-analysis involving 2288 cases and 4096 controls. World J Gastroenterol. 2011 May 14;17(18):2343-8.
8. YousafSajeela, Khan Mohamed I, Michael Shazia, Akhtar Farah, Ali Syeda H, RiazMoeen, et al. XRCC1 and XPD DNA repair gene polymorphisms: a potential risk factor for glaucoma in the Pakistani population. Mol Vis. 2011; 17:1153-63.
9. Bhatia Neal. Polypodium leucotomos: a potential new photoprotective agent. Am J ClinDermatol. 2015; 16(2):73-9.
10. Palomino Olga M. Current knowledge in Polypodium leucotomos effect on skin protection. ArchDermatol Res. 2015; 307(3):199-209.
11. Rodríguez-García R, Aguilar-Ye A, Puig-Sosa PJ, Solis-Daun O, Padilla-Castillo A. Xerodermapigmentoso en dos hermanas. Rev Mex Pediatr 2002; 69(4); 151-154.
12. Black Jennifer O. Xeroderma Pigmentosum. Head and Neck Pathol, 2016, 10:139–144
13. Hernández Cibrián; Sutherland Nelson; Etnobotánica de los Helechos de Honduras. Ceiba, 2007. Volumen 48(1-2):1-10
14. Cambar, Pablo Jose. Algunos estudios farmacológicos de las plantas medicinales en Honduras. Revista medica Hondureña.– 1985, Vol. 53; 190-196
15. Segars, Kelly, McCarver Victoria, Miller Richard A. Dermatologic Applications of Polypodium leucotomos: A Literature Review. J Clin AesthetDermatol. 2021 Feb; 14(2): 50–60
16. Middelkamp-Hup Maritza A, PathakMadhu A, Parrado Concepción, García-Caballero Tomas, Rius-Díaz Francisca, Fitzpatrick Thomas B, González Salvador. Orally administered Polypodium leucotomos extract decreases psoralen-UVA-induced phototoxicity, pigmentation, and damage of human skin. J Am Acad Dermatol. 2004;50(1):41–49.
17. Del Rosso, James. Polypodium Leucotomos Extract (PLE): New Study Gives Evidence-based Insight into “Ain’t Nothing Like the Real Thing”. J Clin AesthetDermatol. 2019 agosto; 12(8): 45–46
18. Middelkamp-Hup Maritza A, Pathak Madhu A, Parrado Concepcion, Goukassian David, Rius-Díaz Francisca, Mihm Martín C, et al. Oral Polypodium leucotomos extract decreases ultraviolet-induced damage of human skin. J Am Acad Dermatol. 2004;51(1):910–918
19. Kohli I Indermeet, Shafi Rubina, IsedehPrescilia, Griffith James, Al-Jamal Mohammed S, Silpa-Archa Narumol. The impact of oral Polypodium leucotomos extract on ultraviolet B response: A human clinical study. J Am Acad Dermatol. 2017;77(1):33–41. e1.
20. Mahamat-Saleh Y, Aune Dagfinn, Schlesinger Sabrina. 25-Hydroxyvitamin D status, vitamin D intake, and skin cancer risk: a systematic review and dose–response meta-analysis of prospective studies Sci Rep. 2020; 10: 13151.
21. Halkud R, Shenoy AM, Naik SM, Chavan P, Sidappa KT, Biswas S. Xeroderma pigmentosum: clinicopathological review of the multiple oculocutaneous malignancies and complications. Indian J Surg Oncol. 2014 Jun;5(2):120-4.
22. Martens, M.C.; Emmert, S.; Boeckmann, L. Xeroderma Pigmentosum: Gene Variants and Splice Variants. Genes 2021, 12, 1173.
23. Rodríguez-Luna A, Zamarrón A, Juarranz Á, González S. Clinical Applications of Polypodium leucotomos (Fernblock®): An Update. Life (Basel). 2023 Jul 5;13(7):1513.
Received: January 9, 2024/ Accepted: March 1, 2024 / Published:15 March 2024
Citation: Alvarez-Montiel, I; Rivera Reyes MF.Eficacia de Polipodium leucotomus en pacientes pediátricos con Xeroderma Pigmentoso. Bionatura Journal 2024; 1 (1) 1.http://dx.doi.org/10.21931/bj/2024.01.01.26
Additional information Correspondence should be addressed to [email protected]
Peer review information. Bionatura Journal thanks anonymous reviewer(s) for their contribution to the peer review of this work using https://reviewerlocator.webofscience.com/
All articles published by Bionatura Journal are made freely and permanently accessible online immediately upon publication, without subscription charges or registration barriers.
Publisher's Note: Bionatura Journal stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2024 by the authors. They were submitted for possible open-access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
