2024..01.01.38
Files > Conference Series > 2024 > Chimboazo ild pagina nueva
Propagación in vitro de Annona deceptrix (westra) H. Rainer (Annonaceae) una especie en peligro de extinción en Ecuador
In vitro propagation of Annona deceptrix (westra) H. Rainer (Annonaceae), an endangered species in Ecuador
María Auxiliadora Nevárez Loor 1*, Fátima Consuelo Macías Ponce 2, José Pico-Mendoza 2
1Programa de Maestría en Biotecnología, Instituto de Posgrado, Universidad Técnica de Manabí, Portoviejo, Ecuador, zip code 130104
2Carrera de Agronomía, Facultad de Ingeniería Agronómica, Universidad Técnica de Manabí. Km. 13.5 vía Portoviejo-Santa Ana. Manabí, Ecuador; [email protected]
* Correspondencia: [email protected]
Available from. http://dx.doi.org/10.21931/BJ/2024.01.01.38
ABSTRACT
This work aims to develop a protocol for the in vitro propagation of Annona deceptrix (westra) H. Rainer. In addition, it measures survival in ex-vitro conditions. Nodal shoot segments were used as explants, disinfected with different NaClO concentrations and exposure times, and then precultured in the Murashige and Skoog (MS) basal culture medium. Woody Plant Medium (WPM) was used for the multiplication and root-ing phase, with different types and concentrations of phytoregulators. In the establishment phase, the ex-plants responded better with the 1% NaClO treatment for 15 minutes, where the highest survival percentage was observed at 72.04%. For the variable number of shoots and stem diameter, the treatment with BAP (1 mgL-1) + (GA3 0.25 gL-1) + (WPM) reached the best average with a value of 2.00 and 2.35, respectively. Mm, respectively. For root induction, the best response was obtained when 3mgL-1 IBA (T3) was added to the culture medium, reaching an average root length of 5.75 cm after 60 days of culture in the medium. The rooted Vitro plants of an approximate height of 5 cm were brought to the mesh house for their acclimatization; in this phase, the survival rate was evaluated during the first week of acclimatization, and the plant's growth fifteen days after sowing in trays containing a peat-based substrate, where T3 had an average survival of 70% and higher plant height at 60 days, indicating that this treatment promoted faster seedling development under conditions ex-vitro.
Keywords: Annona deceptrix , propagation, in vitro rooting, ex-vitro acclimatization, growth regulators.
RESUMEN
El presente trabajo como objetivo desarrollar un protocolo de propagación in vitro de Annona deceptrix (westra) H. Rainer. Además, medir la sobrevivencia en condiciones ex vitro. Como explantes, se usaron segmen-tos nodales de brotes, que fueron desinfectados con diferentes concentraciones de NaClO y tiempo de exposición, luego fueron precultivados en el medio de cultivo basal de Murashige y Skoog (MS). Para la fase de multiplicación y enraizamiento, se utilizó el medio Woody Plant Medium (WPM), con diferentes tipos y con-centraciones de fitorreguladores. En la fase de establecimiento, los explantes tuvieron mejor respuesta con el tratamiento al 1% de NaClO durante 15 minutos, donde se observó el mayor porcentaje de sobrevivencia con el 72,04%. Para la variable número de brotes y diámetro de tallo, el tratamiento con BAP (1 mgL-1) + (GA3 0,25 gL-1) + (WPM) alcanzó el mejor promedio con un valor de 2,00 y 2,35 mm, respectivamente. Para la inducción de raíces, la mejor respuesta se obtuvo cuando se adicionó al medio de cultivo 3mgL-1 IBA (T3) alcanzando una longitud promedio de raíces de 5,75 cm a los 60 días de cultivo en el medio. Las vitroplantas enraizadas de una altura aproximada de 5 cm, fueron llevados a casa malla, para su aclimatación, en esta fase se evaluó la tasa de sobrevivencia durante la primera semana de aclimatación y el crecimiento de la planta a los quince días después de la siembra en bandejas conteniendo un sustrato a base de turba, donde la cual el T3 tuvo promedio de supervivencia del 70% y mayor altura de la planta a los 60 días, lo que indica que este tratamiento promovió un desarrollo más rápido de las plántulas en condiciones ex vitro.
Keywords: Annona deceptrix , propagación, enraizamiento in vitro, aclimatación ex vitro, reguladores de crecimiento.
INTRODUCTION
La Annona deceptrix , conocida como anonilla o guineo de monte, es un árbol endémico de la provincia de Manabí, Ecuador. Su hábitat se encuentra en los bosques tropicales estacionalmente secos (BTES), los cuales cual son reconocidos por su alta diversidad y endemismo, pero también son considerados como los ecosistemas más amenazados a nivel mundia1. La A. deceptrix pertenece a la familia anonáceas, la cual cuenta con alrededor de 25 géneros y 106 especies, de las cuales 19 son endémicas2. Estas especies se distribuyen en una altitud que va desde los 0 a 1000 metros sobre el nivel del mar3.
Según la Lista Roja de Especies Amenazadas de la Unión Internacional para la Conservación de la Naturaleza (UICN), León et al.2 informa que 16 de las 19 especies endémicas están catalogadas como amenazadas, siendo siete de ella de peligro crítico, seis en peligro y cuatro vulnerables. En la actualidad se ha reportado pocos estudios sobre A. deceptrix, pero ha sido evaluada por la UICN en el 2018 como una especie vulnerable. Sus principales amenazas son las actividades antropogénicas, como el cambio de uso de suelo y la defo-restación4, además de su característica intrínseca, como la baja capacidad de germinación en condiciones naturales1,5.
Investigaciones realizadas por Lobo et al.6 han determinado que en Annonas spp, las semillas no poseen la-tencia física que les permita absorber agua, lo cual impide a su germinación. En este sentido, Pico et al.5 en un estudio, aplicaron estrategias para favorecer la germinación de las semillas, donde determinaron que la escarificación mecánica mejora la germinación en un 100%, lo que favorece la supervivencia de esta especie evitando su extinción.
La propagación vegetativa de Annonas spp, a traves de injertos es una técnica que proporciona plantas uni-formes. Pero sin embargo, en algunos casos, los patrones tardan alrededor de un año para alcanzar su desarrollo óptimo, lo que genera problemas de vigor, productividad y riesgo de trasmisión de patógenos 7,(5)5. Para la producción de esta especie de planta, se requiere calidad genética y fitosanitarias con el fin de obtener mejores rendimientos en el campo8. Sin embargo, en la actualidad existen otras herramientas biotecnológicas como el cultivo in vitro de tejidos, que permiten la propagación de plantas de manera más rápida y masiva, libres de patógenos y virus.
En la actualidad, el cultivo in vitro de tejido vegetales se ha convertido en una herramienta para la propaga-ción de plantas de interés, especialmente en peligro de extinción, endémicas, raras, medicinales entre otras9. Esta técnica permite obtener plantas uniformes con alta riqueza genética en un corto periodo de tiempo, lo que la convierte en una herramienta clave para la supervivencia y explotación de estas especies10. Por lo tanto, a través de esta técnica, se planteó desarrollar un protocolo para la multiplicación de A. deceptrix, abarcando las etapas de establecimiento, multiplicación, enraizamiento y aclimatación ex vitro de las plántulas.
MATERIALS AND METHODS
El trabajo de investigación se realizó en el laboratorio de biotecnología de la Facultad de Ingeniería Agronómica de la Universidad Técnica de Manabí, ubicada en la parroquia Lodana del cantón Santa Ana de la pro-vincia de Manabí, Ecuador con coordenadas 01o 09’ 51” S y 80o23’24” O.
Material vegetal
El material vegetal utilizado en la presente investigación se obtuvo de plantas obtenidas de la germinación de frutos maduros, colectados en el bosque protector Cerro Pata de Pájaro, ubicado en el Cantón Pedernales con las coordenadas 00o 01´ 66” de latitud Norte y 79o 58´33” de latitud Oeste. Las plántulas se cultivaron en invernaderos ubicados en la Facultad de Ingeniería Agronómica de la Universidad Técnica Manabí.
Desinfección del material vegetal y establecimiento in vitro
Se utilizaron como explantes, segmentos nodales de A. deceptrix, que contenían dos yemas vegetativas. Los explantes se lavaron con agua destilada estéril y dos gotas de jabón líquido, luego se enjuagaron con agua destilada estéril para eliminar residuos de jabón. En condiciones de cámara de flujo laminar, los explantes se colocaron en alcohol al 70% por 30 segundos, se enjuagaron tres veces y se pasaron a frascos esterilizados que contenían una solución de hipoclorito de sodio en diferentes concentraciones más 2 gotas de Tween 20 x cada 100 mL de solución desinfectante en diferente tiempo de exposición (Tabla 1). Seguido a esto, se pro-cedió a lavar tres veces para eliminar los tejidos afectados por el desinfectante y finalmente se sumergieron en una solución estéril de cisteína 50 ppm (antioxidante), durante 10 minutos antes de sembrar.
Los explantes fueron colocados en medio semisólido previamente esterilizado de Murashige y Skoog (MS) 4,3 gL-1 (Murashige & Skoog 1962), suplementando con 30 g de azúcar + 5 ppm de cisteína, como agente gelificante se utilizó Agar, Plant TC (7,0 gL-1) el pH se ajustó a 5,7 utilizando con HCL o KOH al 0,1 N. El medio estaba contenido en tubos de ensayos estéril con un volumen de 7 mL, posterior a esto se realizó la siembra de los explantes dentro de una cámara de flujo laminar, tener medio asépticos. Los cultivos in vitro se colocaron en un cuarto de incubación, donde las condiciones ambientales fueron: fotoperiodos de 16 horas de luz y temperatura entre 16 a 22ºC.
En la etapa de establecimiento, se procedió a evaluar el porcentaje de explantes contaminados con hongos, bacterias, presencia se oxidación y sobrevivencia, considerando las diferentes concentraciones de hipoclorito de sodio y el tiempo de desinfección, como se observa en la Tabla 1. El ensayo se realizó con 10 unidades experimentales por cada tratamiento, para luego proceder con la fase de multiplicación. Las evaluaciones se realizaron siete días después de la siembra, tomando valoración cada siete días durante veintiún días.
MS: Medio Murashige y Skoog.

Tabla 1: Tratamientos para la fase de establecimiento in vitro en A. deceptrix con diferentes concentraciones de NaClO y tiempos de exposición.
Fase de multiplicación in vitro
Los explantes obtenidos en la fase de establecimiento con cuatro semanas de edad, se transfirieron al medio Woody Plant Medium (WPM) suplementado con vitaminas como tiamina 1mg L-1, inositol 100 mg L-1 y elantioxidante cisteína 50 mg L-1. Además, se adicionaron las diferentes concentraciones de reguladores de crecimiento como se observa en la Tabla 2. El pH del medio se ajustó a 5,7 antes de adicionar el agar. En cada tratamiento se cuantificó el número promedio de brotes, número de hojas, el diámetro (mm) y altura (cm) de la planta se midió con la ayuda de un calibrador.
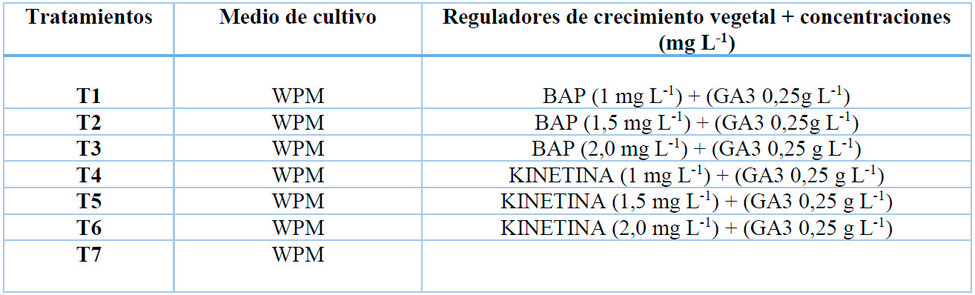
Tabla 2: Tratamientos para la fase de multiplicación in vitro en A. deceptrix, con diferentes tipos y concentraciones de reguladores de crecimiento.
Fase de enraizamiento in vitro
En esta fase se utilizaron los explantes provenientes de la multiplicación. El medio de cultivo que se utilizó para el enraizamiento fue el Woody Plant Medium (WPM) suplementado con diferentes concentraciones de auxinas Tabla 3. Además, se agregó 30 gL-1 de sucrosa + 1mg L-1 de tiamina + inositol 100 mg L-1 + cisteína 50 mg L-1, ajustado a un pH de 5,7 antes de adicionar el agar. Como variables se evaluó la longitud de las raíces (cm) y altura del brote enraizado (cm).
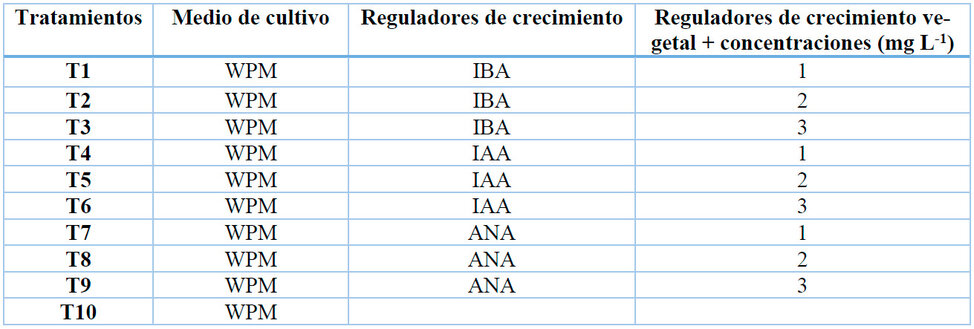
Tabla 3. Tratamientos para la fase de enraizamiento in vitro en A. deceptrix, con diferentes tipos y concentraciones de auxinas.
Análisis estadístico
En todas las fases se usó un Diseño completamente al Azar (DCA), donde se evaluaron tres niveles diferen-tes en cada uno de los tratamientos. Los datos se sometieron análisis de varianza ANOVA y comparación de medias mediante la prueba de Tukey ˂0,05.
Fase ex vitro
Las plántulas enraizadas, se procedió a lavar con agua destilada hasta eliminar por completo los residuos de agar. Luego fueron sembradas en bandejas con turba estéril, donde permanecieron por 60 días en un ambien-te de casa malla donde la radiación solar era baja, para evitar problemas de deshidratación. En esta fase se determinó la tasa de supervivencia y altura de la planta. Las mediciones se realizaron cada semana durante cuatro semanas.
RESULTADOS Y DISCUSIÓN
Fase de establecimiento
El mejor tratamiento en la fase de establecimiento se obtuvo cuando los explantes fueron so-metidos hipoclorito de sodio al 1% durante 15 minutos (T2), alcanzando un 72,04% de sobre-vivencia (figura 1). Estudios reportados por López et al. y Ramírez et al. 11,12 indican que en concentracio-nes de 0 y 0,05% se obtiene baja viabilidad por lo que encontraron altos niveles de contaminación microbiana en los explantes, y a dosis mayor a 2% se reportó un efecto tóxico, mostrando necrosis en los explantes en Annona muricata L, por lo que consideran concentraciones de 0,5 a 1% con tiempos de exposición de 5 a 10 minutos, estos resultados coinciden con los datos obtenidos en esta investigación, donde se demostró que a mayor tiempo de exposición se tuvieron mejores resultados.
La concentración de NaOCl y el tiempo de exposición de la mismas, no tiene impacto significativo en el por-centaje de contaminación (p>0,05). Estudios realizados por Echenique y Mollo13 demuestran que el tiempo de exposición de NaOCl no influye de manera significativa en el porcentaje de contaminación de los seg-mentos nodales de la Annona muricata L, donde obtuvo una tasa de sobrevivencia del 30% utilizando una concentración del 5% y un tiempo de exposición de 10 minutos.
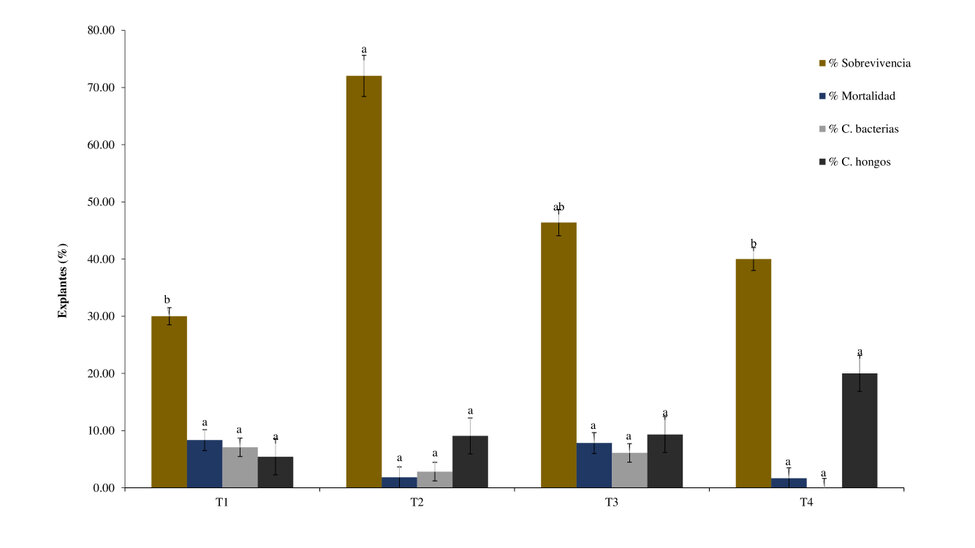
Figura 1: Establecimiento de explantes de A. deceptrix. Los valores corresponden al promedio por cada unidad experimen-tal, las letras son los grupos homogéneos en cada parámetro evaluado de acuerdo al análisis de Tukey p˂0,05.
Fase de multiplicación
Solis et al.14 observaron que el número de brotes es una variable importante en la fase de multiplicación, ya que está relacionado con una buena tasa de multiplicación. Así mismo. En la fase de multiplicación, el trata-miento con BAP (1 mg L-1) + (GA3 0,25g L-1) + WPM (T1) mostró mejor respuesta con un número de 2,00 ± 0,47 por explante, además, se observó mayor diámetro del tallo con un promedio de 2,35 ± 0,34 mm, con respecto a los otros tratamientos (Figura 2). Este resultado se asemeja a lo reportado por Ahmed et al., y Ba et al.15,16 donde indican que BAP fue más eficiente que la Kinetina para la regeneración y el alargamiento de brotes.
Con respecto a las concentraciones de los reguladores de crecimiento, estas no mostraron diferencias signifi-cativas (p>0,05) para el número de hojas por brotes, sin embargo, para las variables número de brotes, altura y diámetro mostraron diferencias significativas entre los tratamientos. Según estudios de Nagori y Purohit, Therezan et al.17,18, se constató que, al iniciar el cultivo de explantes de Annona squamosa en un medio MS que contenía ácido bencenoacético (BA), e incluso después de realizar subcultivos repetidos, así como al aplicar una combinación de ácido giberélico (GA3) junto con BA, no se observó un aumento notable en el crecimiento de los explantes.
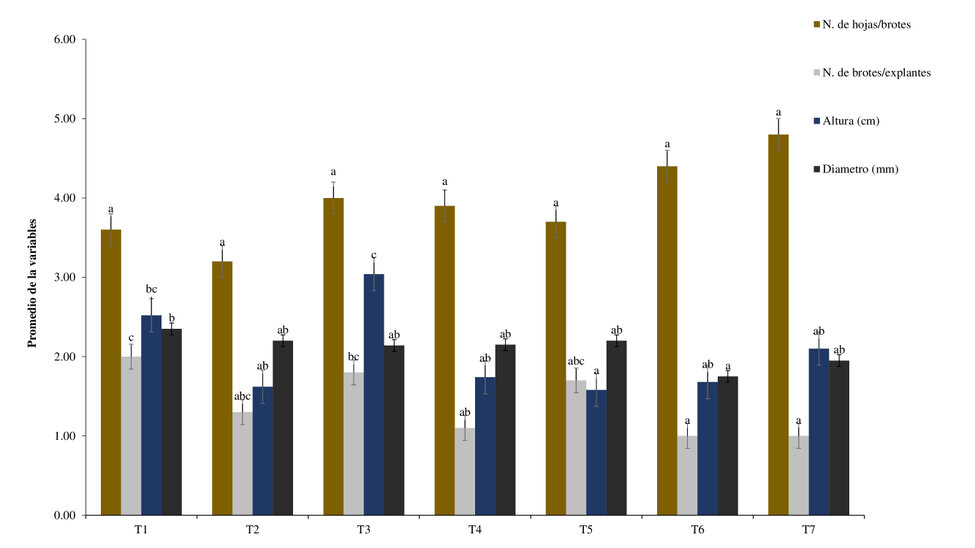
Figura 2: Multiplicación de explantes de A. deceptrix. T1, BAP (1 mgL-1) + (GA3 0,25g L-1); T2, BAP (1,5 mg L-1) + (GA3 0,25g L-1); T3 BAP (2,0 mg L-1) + (GA3 0,25 g L-1); T4, KINETINA (1 mg L-1) + (GA3 0,25 g L-1); T5, KINETINA (1,5 mg L-1) + (GA3 0,25 g L-1l); T6, KINETINA (2,0 mg L-1) + (GA3 0,25 g L-1), T7, sin reguladores de crecimiento. Los valores corres-ponden al promedio de 10 repeticiones por tratamiento ± la desviación estándar y las letras son los grupos homogéneos en cada parámetro evaluado de acuerdo al análisis de Tukey p˂0,05.
Por lo contrario Mollohuanca et al.19 manifiestan que con la aplicación de citoquininas BAP se obtiene altos valores en cuanto al número de brotes en la fase de multiplicación a partir de explantes en condiciones in vitro, además indican que a mayor concentración de BAP disminuye la dominancia apical, además hojas y yemas deformadas, por lo contrario, concentraciones menores de citoquininas favorece la elongación celular y disminuye la división celular18,20.
Fase de enraizamiento
El crecimiento de la raíz es regulado por señales endógenas que mantiene la actividad de los meristemos api-cales de la misma, contribuyendo a la generación de raíces laterales, siendo las auxinas las que juegan un pa-pel importante en esta etapa 21. En la fase de enraizamiento, de todos los tratamientos aplicados, solo los tra-tamientos T3, T4 y T5 tuvieron formación de raíces, sin embargo, el tratamiento T3: 3mgL-1 IBA, tuvo los valores más altos en las variables evaluadas, con una longitud promedio de raíces de 5,75 cm, número pro-medio de raíces secundaria 2,80 y altura promedio de la planta de 2,61 cm (Figura 3); lo que pone en eviden-cia el efecto de la auxina sobre la elongación de las raíces de A. deceptrix.
Sin embargo, IAA en bajas concentraciones logró un efecto en el desarrollo de las raíces, mientras que ANA no tuvo efecto alguno, al contrario de lo reportado por Ramos y Canchignia22 donde determinaron que la aplicación de ANA, presentó mejores resultados en la longitud de las raíces de A. muricata. Autores indican que las plantas pueden obtener IAA a partir de la ẞ- oxidación de IBA dado en los peroxisomas23. Pérez et al.,24 indican que IBA tiene un bajo poder en la liberación de auxínica, pero es excelente en la generación rizógena y en su estudio obtuvieron mejores resultados utilizando 2 mg L-1 de IBA en A. muricata.

Figura 3: Enraizamiento in vitro de A. deceptrix. T3, IBA (3 mg L-1); T4, IAA (1 mg L-1); T5 IAA (2mg L-1); T8, ANA (2 mg L-1). Los valores corresponden al promedio de 10 repeticiones por tratamiento ± la desviación estándar y las letras son los grupos homogéneos en cada parámetro evaluado de acuerdo al análisis de Tukey p˂0,05.
De acuerdo con el análisis estadístico el tipo de auxina influye significativamente (p<0.05) en el desarrollo de las raíces, donde estos resultados se asemejan a lo reportado por Cárdenas et al.25, Castro y Sánchez26, donde también resultaron estadísticamente diferente la aplicación de varias auxinas y el uso de IBA, estimuló el enraizamiento en más del 80% en Solanum dolichosepalum y Eucalyptus pellita.
Fase ex vitro
El enraizamiento es importante para la fase de aclimatación ex vitro, debido a que, la planta requiere las raíces necesarias para un mejor desarrollo en el sustrato, además de poder inducir a la formación de nuevas raíces y pelos absorbentes que extraerá los nutrientes necesarios para el crecimiento 14. En la fase de aclimatación de los explantes de A. deceptrix, se puede observar en la Tabla 1, que el T3 (3mg L-1 IBA) tuvo mayor porcenta-je de sobrevivencia con un 70%, mientras que el T4 (1 mg L-1 IAA) y T5 tuvieron (2 mg L-1 IAA) alcanzaron un 20%.
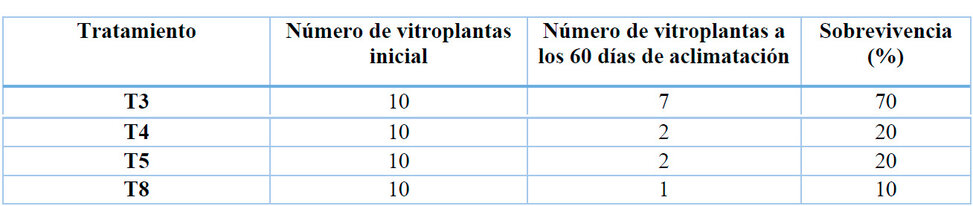
Tabla 4: Porcentaje de sobrevivencia de los brotes de A. deceptrix en condiciones ex vitro.
En la Figura 4, se muestra el crecimiento de la planta en cada uno de los tratamientos que obtuvieron mejores respuestas en la fase de enraizamiento, el T3 (3mg L-1 IBA) tuvo un crecimiento de 2,95 cm a los 60 días de aclimatación ex vitro, seguido del T4 (1 mg L-1 IAA) con un crecimiento de 2,48 cm, lo cual demuestra que las concentraciones y auxinas utilizadas por su efecto auxínico favorece al proceso de rizogénesis. Pedrotti y Voltolini 27, demostraron que la dosis de IBA no afectó la longitud de las raíces de microestacas de manza-nas en condiciones ex vitro. Pero, sin embargo, en la investigación, se observó que si incide el uso de diferen-tes reguladores de crecimiento en la fase ex vitro.
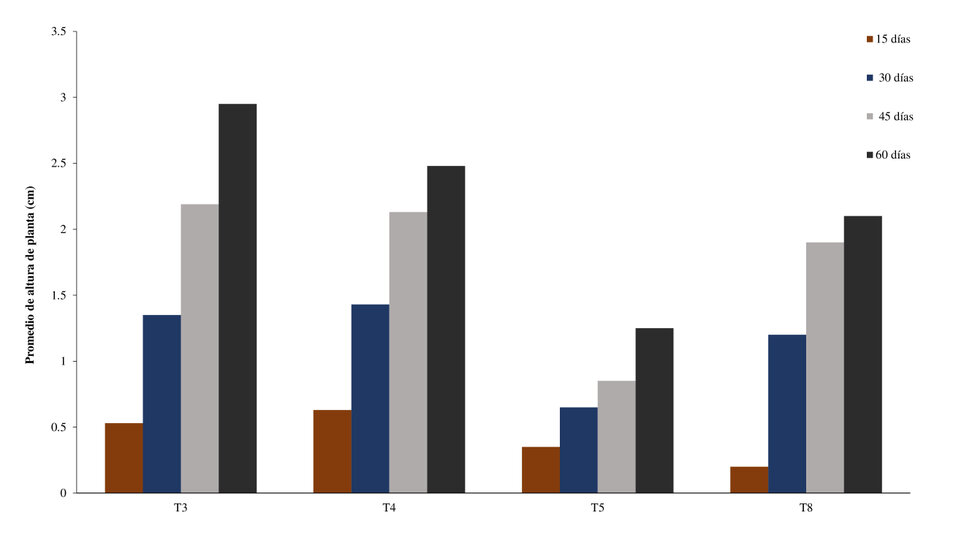
Figura 4: Crecimiento de los brotes de A. deceptrix. en condiciones ex vitro durante los 60 días de muestreo. T3, IBA (3 mg/L); T4, IAA (1 mg/L); T5 IAA (2mg/L); T8, ANA (2 mg/l).

Figura 5: Fases de la propagación in vitro de A. deceptrix; A: Planta madre. B: Desinfección de la materia vegetal. C: Esta-blecimiento in vitro de los explantes. D: multiplicación in vitro. E: enraizamiento in vitro. F: Aclimatización ex vitro de las plántulas obtenidas.
El ácido Indolbutírico (IBA) ayuda a la estimulación del alargamiento celular o su depresión de acuerdo a la concentración en la que se trabaja, además actúa en diferentes actividades de la planta como en la formación de raíces, crecimiento del tallo, abscisión de hojas y frutos, inhibición de las yemas laterales, también, activa las células del cambium en el tejido vascular22.
CONCLUSIONES
Durante la fase de establecimiento, se demostró que el tratamiento más efectivo para la desinfección de los explantes fue la aplicación de NaClO al 1% durante 15 minutos. En la fase de multiplicación, se encontró que el medio con una menor concentración de reguladores de crecimiento, es decir, BAP (1 mg L-1) + GA3 (0,25g L-1) + WPM, resultó con un mayor número de brotes y un diámetro de tallo promedio de 2,00 mm y 2,35 mm, respectivamente. Estos resultados podrían tener implicaciones económicas favorables para la pro-pagación de A. deceptrix. En la fase de enraizamiento, el tratamiento con una concentración de 3 mg L-1 de IBA arroja valores altos en las variables estudiadas. Además, este tratamiento promovió un desarrollo más rápido de las plántulas en condiciones ex vitro, logrando el mayor porcentaje (70%) de plantas adaptadas a condiciones ex vitro.
Contribuciones de los autores
Todos los autores contribuyeron con la ejecución y la redacción de este artículo.
Financiamiento
Este trabajo no fue financiado por ninguna institución
Declaración de la Junta de Revisión Institucional
Trabajo inédito
Agradecimientos
A la Universidad Técnica de Manabí (UTM) y a su Programa de Maestría en Biotecnología del Instituto de Posgrado.
Conflicto de interés
Los autores declaran no tener conflicto de interés.
REFERENCES
1. Espinoza C, De la Cruz M, Luzuriaga L, Escudero A. Bosques tropicales secos de la región Pacífico Ecuatorial: diversidad, estructura, funcionamiento e implicaciones para la conservación. Asoc Españo-la ade Ecol Terr. 2012;21(1):167–79.
2. León S, Valencia R, Pitman N, Endara L, Ulloa C, Navarrete H. Libro rojo de las plantas endémicas del Ecuador [Internet]. 2da ed. Quinto: Publicaciones del Herbario QCA, Pontificia Universidad Ca-tólica del Ecuador; 2019. Available from: https://bioweb.bio/floraweb/librorojo
3. Jimenez A, Tapia M, Cabrera C, Pionce G. Investigaciones de Pregrado sobre la Ecología del Bosque Seco Tropical. Runaiki. Manabí; 2020. 129 p.
4. Erkens R. Annona deceptrix . The IUCN Red List of Threatened Species 2021: e.T42828A176434191. 2021;
5. Pico J, Pinoargote M, Madrid L, Flor J, Álava J, Sancán G, et al. Germination Capacity of Annona deceptrix (Westra) H. Rainer (Annonaceae) an Endemic and Endangered Species in Manabí, Ecuador. Indian J Agric Res. 2020;54(3):329–35.
6. Lobo M, Delgado O, Régulo J, Fernández E, Medina C. Categorización de la germinación y la laten-cia en semillas de chirimoya ( Annona cherimola L .) y guanábana ( Annona muricata L .), como apoyo a programas de conservación de germoplasma. Agron Colomb [Internet]. 2007;25(2):231–44. Availa-ble from: http://www.redalyc.org/articulo.oa?id=180320296005
7. Puc C, Cituk D, Villanieva C, Pinzón L. Compatibilidad de injertación en tres clones de guanábana. Agroproductividad. 2018;11(10):71–4.
8. García L, Álvarez J, Alvarado Y, González M, La O M, Mirabal D, et al. Establecimiento in vitro de segmentos nodales de plantas jóvenes de Annona muricata L. Biotecnol Veg. 2012;12(4):229–34.
9. Shekhawat M, Kannan N, Manokari M, Ravindran C. In vitro regeneration of shoots and ex vitro rooting of an important medicinal plant Passiflora foetida L. through nodal segment cultures. J Genet Eng Biotechnol [Internet]. 2015;13(2):209–14. Available from: http://dx.doi.org/10.1016/j.jgeb.2015.08.002
10. Jiménez A, Zhindón B, Indacochea B, Ramos M. explantation disinfection protocols micropropaga-tion of Cedrela odorata L . UNESUM-Ciencias Rev Científica Multidiscip. 2017;1(2):1–6.
11. Ramírez M, Urdeta A, León de Sierralta S. Establecimiento in vitro de explantes adultos del guaná-bano (Annona muricata L.) tratados con hipoclorito de sodio. Rev la Fac Agron [Internet]. 2002;19(1):48–55. Available from: http://ve.scielo.org/scielo.php?script=sci_arttext&pid=S0378-78182002000100005&lng=es&nrm=iso
12. López P, Iracheta L, Castellanos M, Méndez I, Francisco J, Gutiérrez A, et al. Campo Experimental Rosario Izapa. INIFAP. Carretera Tapachula-Cacahoatan, km 18. Rev Mex Ciencias Agrícolas. 2011;2:645–57.
13. Echenique M, Mollo A. Establecimiento in vitro de segmentos nodales de guanabana (annona murica-ta l.) En la estación experimental sapecho - bolivia. Rev Investig e Innovación Agropecu y Recur Nat [Internet]. 2020;7(1):62–8. Available from: http://www.scielo.org.bo/pdf/riiarn/v7n1/v7n1_a09.pdf
14. Solis L, Olivera S, Rosa R. Propagación in vitro de Carica papaya var. PTM-331 a partir de meriste-mos apicales. Rev Peru Biol. 2011;18(3):343–7.
15. Ahmed A, Al-Olayan E, Aboul M, Al-Khedhairy A. The immune enhancer, thymoquinone, and the hope of utilizing the immune system of Aedes caspius against disease agents. African J Biotechnol. 2010;9(21):3183–95.
16. Ba O, Dieme A, Ndoye AL, Sy MO. In Vitro Clonal Propagation from Juvenile and Different Ex-plant Types of Two Edible Annonaceae Species: Annona muricata L. and Annona squamosa L. Adv Biosci Biotechnol. 2021;12(12):458–80.
17. Nagori R, Purohit SD. In vitro plantlet regeneration in Annona squamosa through direct shoot bud differentiation on hypocotyl segments. Sci Hortic (Amsterdam). 2004;99(1):89–98.
18. Therezan R, Paiva R, Silva L. In vitro culture of Annona emarginata : A rootstock for commercial an-nonaceae species Cultivo in vitro de Annona emarginata : Porta-enxerto para espécies de anónaceas comerciais In vitro culture of Annona emarginata : A rootstock for commercial annonaceae. Plant cell Cult y Micropropag. 2016;12(1):1–6.
19. Mollohuanca C, Mayta L, Bardales R. Growth Regulators (BAP and ANA) for in vitro Propagation of Queñoa (Polylepis rugulosa Bitter). Manglar. 2021;18(2):207–13.
20. Cob J, Ríos D, María A, Cartes P, Sánchez M. Organogénesis directa para la propagación in vitro de Quillaja saponaria Molina en Sudamérica Austral. Rev Mex Ciencias For. 2017;7(34):057–67.
21. Jovanovic M, Lefebvre R, Laporte P, Rizzo S, Frugier F, Brie C, et al. How the Environment Regu-lates Root Architecture in Dicots I . Introduction. Adv Bot Res. 2008;35–74.
22. Ramos R, Canchignia H. Propagación de Guanábana (Annona muricata) utilizando ANA (Ácido Naf-talenacético) y AIB (Ácido Indolbutírico) en el Cantón Quevedo año 2015 [Internet]. Universidad Técnica Estatal de Quevedo; 2016. Available from: chrome-exten-sion://efaidnbmnnnibpcajpcglclefindmkaj/https://repositorio.uteq.edu.ec/bitstream/43000/4314/1/T-UTEQ .0247.pdf
23. Jordán M, Casaretto J. Hormonas y Reguladores del Crecimiento : Auxinas , Giberelinas y Citocininas. In: Fisiología Vegetal [Internet]. Universida. La Serena, Chile; 2006. p. 1–28. Available from: chrome-exten-sion://efaidnbmnnnibpcajpcglclefindmkaj/https://exa.unne.edu.ar/biologia/fisiologia.vegetal/Auxinasgiberelinasycitocininas.pdf
24. Pérez V, Panduro N, Sánchez J, Chuyma M, Villegas P. Indolbutírico en el enraizamiento de estaqui-llas de annona muricata « guanábana » en cámara de subirrigación. Folia Amaz. 2019;28(1):33–41.
25. Cárdenas C, Pacheco J, Vanzela A. Propagación in vitro de Solanum dolichosepalum ( Solanaceae ). 2016;7(2):9–22.
26. Castro D, Sánchez G. Propagación clonal in vitro de eucalyptus pellita f. Muell a partir de árboles plus. Temas Agrar. 2010;15(1):34–43.
27. Pedrotti E, Voltolini J. Enraizamento ex vitro e aclimatização do porta-enxerto de macieira m.9. Rev Bras Frutic Jaboticabal. 2001;23(2):234–9.
Received: October 9th 2023/ Accepted: January 15th 2024 / Published:15 February 2024
Citation: Nevárez- Loor M. A., Macías- Ponce F. C., Pico-Mendoza J. In vitro propagation of Annona deceptrix (westra) H. Rainer (Annonaceae), an endangered species in Ecuador. Bionatura Journal 2024; 1 (1) 38. http://dx.doi.org/10.21931/BJ/2024.01.01.38
Additional information
Correspondence should be addressed to [email protected]
Peer review information. Bionatura Journal thanks anonymous reviewer(s) for their contribution to the peer review of this work using https://reviewerlocator.webofscience.com/
All articles published by Bionatura Journal are made freely and permanently accessible online immediately upon publication, without subscription charges or registration barriers.
Publisher's Note: Bionatura Journal stays neutral concerning jurisdictional claims in published maps and institutional affiliations.
Copyright: © 2024 by the authors. They were submitted for possible open-access publication under the terms and conditions of the Creative Commons Attribution (CC BY) license (https://creativecommons.org/licenses/by/4.0/).
